Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.67 no.3 Sao Paulo 2013
AUTOR CONVIDADO
Câncer de boca baseado em evidências científicas
Oral cancer based on scientific evidences
Celso Augusto Lemos JuniorI; Fábio de Abreu AlvesII; Cassius Carvalho Torres-PereiraIII; Maria Gabriela Haye BiazevicIV; Décio dos Santos Pinto JúniorV; Fábio Daumas NunesVI
I Livre Docente - Professor Associado do Departamento de Estomatologia da Faculdade de Odontologia da Universidade de São Paulo (Fousp) – Brasil
II Doutor - Professor Doutor do Departamento de Estomatologia da Fousp – Brasil
III Doutor - Professor Adjunto da Universidade Federal do Paraná – Brasil
IV Doutora - Professora Doutora do Departamento de Odontologia Social da Fousp – Brasil
V Livre Docente - Professor Associado do Departamento de Estomatologia da Fousp – Brasil
VI Titular - Professor Titular do Departamento de Estomatologia da Fousp – Brasil
RESUMO
Apesar dos inúmeros avanços no conhecimento científico do câncer de boca até o momento, muito ainda há para ser corretamente descoberto e compreendido. Convicções do passado foram substituídas por novas evidências científicas. O câncer de boca acomete cerca de 275.000 pessoas no mundo anualmente sendo mais de 14.100 casos no Brasil, em 90% dos casos é diagnosticado como carcinoma epidermoide. A taxa de mortalidade permanece praticamente a mesma de décadas passadas. Suas características clínicas são bastante conhecidas, mas apesar disso o número de pacientes diagnosticados tardiamente permanece alto. A biologia celular avançou muito, porém ainda carece de um marcador eficiente. A biópsia permanece como o padrão ouro do diagnóstico, apesar das pesquisas realizadas com outras técnicas. O tratamento odontológico de pacientes portadores de neoplasias malignas será cada vez mais comum nos consultórios e o Cirurgião-Dentista deverá estar preparado para diagnosticar e lidar com essas situações.
Descritores: neoplasias bucais; biologia celular; diagnóstico bucal.
ABSTRACT
Although the advances in the oral cancer knowledge, several issues have to be addressed for a better understood of this disease. Convictions of the past have been replaced by new scientific evidences. Oral cancer affects annually more than 275.000 people worldwide and more than 14.100 cases in Brazil, 90% of these are squamous cell carcinoma; the mortality rate remains the same for many decades. Their clinical characteristics are well known, but despite this, the number of patients with late diagnosis remains high. Cell biology had a great advance in the last years and a precise marker is still a dream. Biopsy remains the gold standard for diagnosis of oral cancer in spite of studies with other techniques. The dental treatment of oncologic patients will be more common and the dentist should be prepared to diagnose and manage these patients.
Descriptors: mouth neoplasms; cell biology; diagnosis, oral.
RELEVÂNCIA CLÍNICA
Apesar do câncer de boca ser considerado uma doença rara, é fundamental que o Cirurgião-Dentista esteja apto a orientar, prevenir e diagnosticar as neoplasias orais no momento adequado, sem que haja atrasos desnecessários no encaminhamento para o tratamento oncológico que possam comprometer a morbidade e a mortalidade dos pacientes.
INTRODUÇÃO
O Câncer de Boca acomete no Brasil mais de 14.100 novos pacientes por ano1. O carcinoma epidermoide bucal (CEB) representa mais de 90% dos casos de neoplasias malignas diagnosticadas na boca2,3. Apesar de todo o esforço na prevenção dos profissionais de saúde envolvidos e do governo brasileiro, a taxa de mortalidade permanece a mesma há décadas com uma sobrevida média em torno de 55% após cinco anos4. O grande desafio do Brasil e do mundo é controlar os fatores de risco envolvidos e aumentar a taxas de diagnóstico precoce da doença5. Muito se avançou no conhecimento celular do câncer de boca6, mas muito ainda precisa ser mais bem compreendido. O tratamento odontológico do paciente portador de neoplasia maligna será uma realidade cada vez mais presente para o cirurgião dentista.
Epidemiologia do Câncer de Boca
O Relatório Mundial de Câncer (World Cancer Report), publicado pela IARC (International Association for Research on Cancer), ligada à Organização Mundial da Saúde (OMS) relata que 400.000 novos casos de câncer de cabeça e pescoço ocorrem em todo o mundo a cada ano7. O mesmo documento situa o Brasil como sendo um país de risco intermediário entre mulheres, com aproximadamente 3,0 casos a cada 100.000 pessoas. Porém, entre os homens, trata-se do 2º maior risco de ocorrência, podendo chegar a quase 7,0 casos por 100.000 habitantes1.
O Instituto Nacional do Câncer (Inca) estimou para 2012 a ocorrência de novos casos para todas as regiões do país. Em todas elas, homens tendem a ser mais acometidos do que mulheres de desenvolver câncer de boca. No país como um todo, esperava-se, em 2012, a ocorrência de 13,34 casos a cada 100.000 homens, sendo que as Regiões Sudeste, Sul e Centro-Oeste a com maior expectativa de ocorrência dos casos1.
Dados sobre a mortalidade por câncer de boca no município de São Paulo mostram que para algumas localizações anatômicas, a tendência permaneceu estável entre 2003 e 2009. Isso significa que não houve grandes variações na mortalidade ao longo do tempo, sendo que a localização anatômica de maior ocorrência foi a língua, quase metade dos óbitos ocorridos no período8.
Além do tabagismo e do etilismo, estudos mostram que o consumo pobre de frutas e vegetais também está associado à sua ocorrência9.
Outro aspecto que merece ser destacado é a contribuição da condição socioeconômica no prognóstico da doença. No Município de São Paulo, a mortalidade é maior nas regiões da cidade que apresentam piores indicadores sociais8.
Essas informações devem ser levadas em consideração ao realizar análise do acesso aos serviços de saúde. Em pesquisa realizada para verificar se os Cirurgiões-Dentistas priorizam atendimento de paciente que se queixa de possuir lesão em tecido mole que não regredia, o agendamento da consulta foi marcado com muito mais prontidão, em comparação a pacientes que buscavam consulta com objetivo de realizar uma consulta de rotina. Assim, concluiu-se que a equipe de saúde esteve atenta para a possível necessidade de urgência de avaliação do caso.
Deve-me mencionar também o impacto que a doença e o seu tratamento podem ter na qualidade de vida dos pacientes. Diversas funções do sistema estomatognático são afetadas. Os pacientes sentem dor, possuem problemas de autoestima, já que sua aparência é afetada e diversas atividades da vida diária ficam comprometidas. Além disso, capacidades para engolir, mastigar, falar e sentir o gosto dos alimentos podem ser afetadas. Esses aspectos devem ser considerados antes, durante e após o tratamento, já que muitos pacientes vão conviver com sequelas que poderão afetar a qualidade de vida por longos períodos10.
Prevenção do Câncer de Boca
O câncer da boca poderia ser evitado na maior parte dos casos. A principal estratégia é baseada na prevenção primária, ou seja, no abandono ou na diminuição da exposição aos fatores de risco para a doença. No carcinoma de células escamosas, o principal tipo de neoplasia maligna da boca, a prevenção primária deve ser realizada com cessação ou diminuição do consumo de tabaco e álcool. No caso das lesões labiais, a prevenção primária depende do controle da exposição solar, seja esta de natureza ocupacional ou não5.
Por outro lado, dada a natureza comportamental característica dos fatores de risco envolvidos, obviamente que o controle da exposição ao álcool e cigarros é de natureza bastante complexa e de abordagem multiprofissional. Historicamente, evidências sugerem que apesar do Cirurgião-Dentista estar em posição privilegiada para envolver-se em estratégias individuais e coletivas de cessação do tabagismo e etilismo, sua participação como agente modificador de comportamentos de risco é subestimada e pouco comum11,12.
Na prevenção secundária, aquela cujo objetivo é identificar lesões com potencial de malignização ou lesões malignas em estágio inicial, o Cirurgião-Dentista tem uma contribuição muito relevante pelo seu conhecimento e técnica do exame intrabucal. As lesões mais comuns de câncer bucal são lesões com origem epitelial e, portanto, seriam acessíveis ao exame visual com boa iluminação e secagem adequada da mucosa que caracteriza o exame odontológico de rotina5. O exame preventivo para o câncer da boca, diferentemente do câncer em outras topografias, não requer aparatologia complexa ou técnicas de difícil aplicação rotineira. Sua execução requer um profissional atento, curioso e vigilante em relação aos sinais e sintomas que desviem dos padrões de normalidade da mucosa, que se assemelhem a lesões com potencial de malignização e, principalmente, encontradas em pacientes com exposição importante aos fatores de risco13.
O exame clínico preventivo para o câncer de boca deve ser incorporado como investigação de rotina em toda consulta odontológica. Não há uma recomendação de frequência de sua realização, entretanto, reitera-se que a identificação de histórico de exposição aos fatores de risco deve nortear o planejamento das ações de prevenção primária e secundária4. Os pacientes em geral desconhecem o exame preventivo e desconhecem que o Cirurgião-Dentista possa realizá-lo, porém parecem receptivos à ideia de que o profissional possa conduzir um exame que diminua o risco de ter câncer14.
Um paradoxo observado no câncer bucal é que apesar da suposta facilidade e acessibilidade ao exame clínico, as manifestações da maior parte dos doentes são identificadas em estadiamento avançado, onde o tratamento, o prognóstico e a sobrevida ficam comprometidos. Dados indicam que aproximadamente 50% dos pacientes com câncer bucal apresentam as formas mais avançadas e graves15. As estatísticas relativas ao atraso diagnóstico e estadiamento sofrem poucas variações quando analisadas em diferentes países, desenvolvidos ou em desenvolvimento. Os motivos que levam às formas mais graves de apresentação são variados e envolvem desde aspectos de atraso diagnóstico, atraso de início de tratamento e características do próprio comportamento biológico agressivo da doença16.
Sugere-se, em algumas situações, que os pacientes sejam estimulados à realização de autoexame para identificação de eventuais alterações suspeitas de câncer bucal. O autoexame permitiria que o próprio indivíduo pudesse demandar a realização de exame profissional. Da mesma forma que o exame clínico, o autoexame apresenta como vantagens sua pouca invasividade, suposta facilidade de realização e custo financeiro inexistente. Algumas campanhas recomendam a técnica que é ensinada ao paciente pelo próprio profissional por vezes com apoio de material didático impresso ou audiovisual. Por outro lado, poucos pesquisadores detiveram-se na investigação da eficácia do autoexame como estratégia de impacto nos indicadores epidemiológicos do câncer bucal. Um estudo piloto descreveu que pacientes expostos aos fatores de risco falharam em identificar lesões suspeitas e de que o uso de um material instrucional impresso não foi efetivo no treinamento para esta identificação17. Outros estudos mostraram bom nível de identificação de alterações bucais por meio do autoexame quando a autoavaliação de indivíduos de alto risco ao desenvolvimento da doença era comparada com o diagnóstico de Cirurgião-Dentista treinados18. Há preocupação de que no autoexame o paciente tenha a tendência de sobrevalorizar achados de variação de normalidade da mucosa oral ou lesões traumáticas e benignas. Isto poderia significar, na maior parte das vezes, um resultado falso-positivo que geraria, além de consultas desnecessárias, o impacto emocional negativo da percepção de ser portador de uma doença grave mesmo na sua ausência17. Além disso, o hábito do autoexame está relacionado a melhores indicadores socioeconômicos19. Evidências sugerem, entretanto, que o câncer bucal é mais prevalente em indivíduos com baixa renda e escolaridade sendo estes fatores, por vezes, considerados de risco ao desenvolvimento da malignidade20.
A maior parte da ênfase do currículo odontológico para a o estudo do câncer bucal consiste do treinamento na identificação de lesões com potencial de malignização tais como as leucoplasias e queilite actínica. O treinamento valoriza a prevenção secundária13. Por outro lado, apesar do declínio da prevalência de tabagismo no país21, seria importante que os Cirurgiões-Dentistas participassem mais ativamente da equipe multiprofissional que trata o paciente tabagista. Desta maneira, reorienta-se o eixo da prevenção do câncer para priorizar a prevenção primária, estratégia esta com maior possibilidade de impacto na diminuição dos indicadores de morbidade e mortalidade por câncer da boca.
Características Clínicas
Localização
O CEB pode ocorrer em qualquer área da boca, porém algumas áreas são mais prevalentes como a língua, o assoalho bucal e o lábio, podendo ser acometidos em 50% dos casos. Áreas menos frequentes compreendem a mucosa jugal, região retromolar, gengiva, palato mole e palato duro2,15. Justamente por serem menos frequentes podem acabar sendo tardiamente diagnosticadas.
Sintomas
A principal característica do câncer de boca em seu estágio inicia é a ausência de sintomas dolorosos, porém em estágios mais avançados a dor pode ocorrer em cerca de 40% dos pacientes, em geral somente quando alcançam um tamanho clínico considerável2,22. A dor pode variar de a um leve desconforto a dores excruciantes em casos avançados, especialmente na língua. Outros sintomas comumente encontrados incluem a dor de ouvido, sangramento, mobilidade dos dentes, dificuldade para respirar, dificuldade para engolir, dificuldade para falar, trismo muscular e parestesia3.
Aparência Clínica
A aparência clínica do carcinoma epidermoide em casos avançados é bastante característica facilitando seu diagnóstico, porém em situações iniciais podem ser confundidos com outras lesões benignas levando a diagnósticos incorretos atrasando o início do tratamento3. Apesar das fortes características suspeitas encontradas, a realização da biopsia é fundamental e sempre obrigatória para o diagnóstico definitivo da lesão, sendo tecnicamente fácil de ser realizada após um breve treinamento23. As lesões fundamentais clássicas encontradas são as úlceras e os nódulos firmemente aderidos aos tecidos subjacentes2,3.
Eventualmente os pacientes podem apresentar linfoadenopatia cervical sem nenhum outro sintoma. Em casos extremos o paciente pode apresentar fístulas cutâneas, sangramento, anemia intensa e caquexia3.
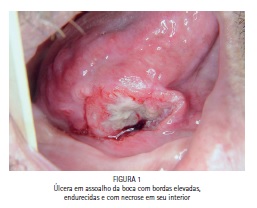
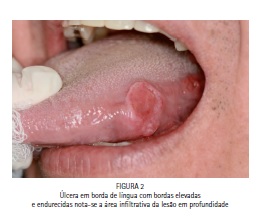
Úlcera
Essa lesão fundamental é a mais comumente encontrada, se apresentando como uma úlcera com assoalho necrótico, margens irregulares e elevadas, quando palpadas apresentam um endurecimento bastante característico, em estágios avançados a dor é irradiante e espontânea (Figuras 01 e 02).
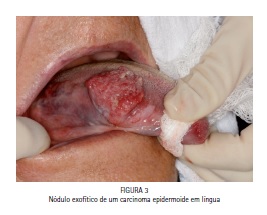
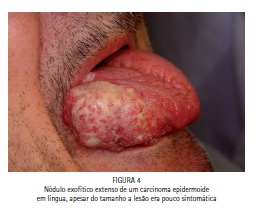
Nódulo
Algumas neoplasias apresentam um padrão de crescimento exofítico, podendo apresentar nódulos, com bordas mal delimitadas e duros a palpação como podem ser vistos nas figuras abaixo (Figuras 03 e 04)
Lesões Não Características e Precoces
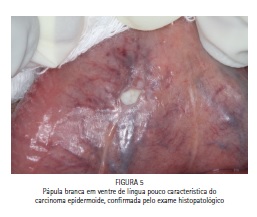
Uma grande dificuldade encontrada é quando a lesão não possui uma característica clínica suspeita, fato esse bastante comum em lesões precoces, podendo levar ao profissional a postergar a realização da biópsia (Figura 05).
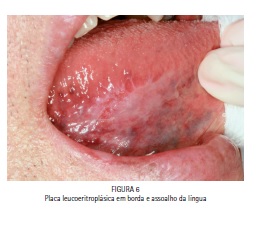
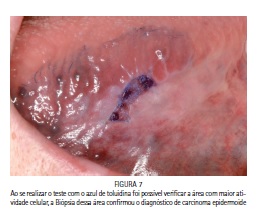
A apresentação clínica de lesões precoces em geral são lesões leucoeritroplásicas (Figuras 06 e 07), que são manchas branco-avermelhadas com superfície delicadamente rugosa, a elasticidade do tecido se altera e a palpação pode-se sentir um discreto endurecimento da área em relação à mucosa normal, no caso apresentado o uso do azul de toluidina foi importante para uma melhor visualização do carcinoma, posteriormente confirmado pela biópsia incisional. Lesões como essa são assintomáticas e podem nunca serm percebidas pelo paciente, por isso a importância do exame profissional buscando discretas alterações de cor na superfície da mucosa.
Uma regra deve ser adotada por todo profissional: "Ao se tratar uma lesão por mais de 15 dias sem sinais de remissão, provavelmente o diagnóstico inicial estava incorreto", por isso não insista, nesses casos a recomendação é realizar uma biópsia ou encaminhar para um estomatologista.
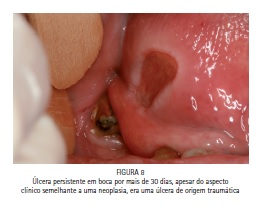
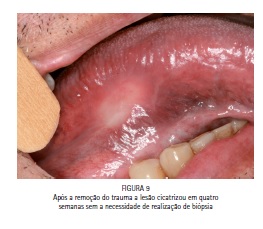
A realização de uma adequada anamnese e exame clínico podem levar também a condutas mais acertadas como no caso abaixo (Figura 08), onde o paciente foi encaminhado para um centro de referência para realização de uma biópsia, pois a úlcera persistia por mais de 30 dias, porém após o exame pode-se contatar que a hipótese clínica era de uma úlcera traumática e não uma úlcera neoplásica, após a extração do terceiro molar fraturado, houve a cicatrização total da lesão em quatro semanas (Figura 09).
Lesões Potencialmente Cancerizáveis
Desde 2005, a OMS recomenda que o melhor termo a ser utilizado para descrever lesões ou condições que possuem uma maior chance de malignização seja o termo lesões potencialmente cancerizáveis(LPC)24. As lesões potencialmente cancerizáveis são as leucoplasias, as eritroplasias, o líquen plano e a queilite actínica. São consideradas condições potencialmente cancerizáveis, a fibrose submucosa, o xeroderma pigmentoso e a anemia de Fanconi25, vamos nos ater apenas as principais lesões potencialmente cancerizáveis.
Leucoplasia
Definida como uma placa branca com risco aumentado de malignização que não pode ser classificada como nenhuma outra lesão branca26, acredita-se que sua prevalência mundial esteja ao redor dos 2%, porém existe diferenças regionais que fazem esse número variar em função do gênero26. A leucoplasia é muito mais comum em fumantes, o álcool é considerado um fator de risco independente e as evidências da participação do HPV são controversas.
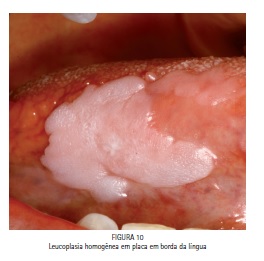
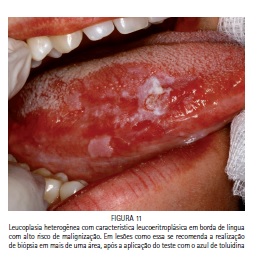
Podem ser divididas em homogêneas(LH) (Figura 10) e não homogêneas (LNH) Figura 11, as LNH também são chamadas de leucoeritroplásicas. A leucoplasia verrucosa é um tipo de leucoplasia não homogênea26. Temos ainda a leucoplasia verrucosa proliferativa(LVP), que é um subtipo da leucoplasia verrucosa, porém com caracterizada por ser multifocal, resistente aos tratamentos propostos e com alta taxa de malignização27.
Acredita-se que sua taxa de malignização esteja ao redor de 1% para todos os tipos de leucoplasias existentes, a presença de displasia epitelial no exame histopatológico é considerado o fator de risco mais importante para avaliar seu potencial de malignização24. Apesar da recomendação de tratamento das leucoplasias não há evidências que sua remoção cirúrgica interfira na ocorrência de lesões malignas24.
Eritroplasia
É definida como uma mancha vermelha que não pode ser diagnosticada como outra lesão com risco aumentado de malignização24, o tabaco e o álcool são considerados importantes fatores de risco, e em geral se apresenta como uma lesão única. Encontramos na literatura uma prevalência variando de 0,02% a 0,83%, de qualquer maneira muito mais rara que a leucoplasia e com risco de malignização muito mais alto.
Líquen Plano
Apesar de bastante controverso é considerado pela maioria dos autores como uma lesão potencialmente cancerizável, com uma taxa anual de malignização por volta de 0,5%25. Essa malignização pode ocorrer em todos os seus tipos clínicos, porém o tipo erosivo parece ser mais relevante. A biópsia é sempre recomendada e apesar de falta de evidências científicas recomenda-se seu acompanhamento pela vida toda24,25.
Diagnóstico
O padrão ouro para se estabelecer o diagnóstico do câncer de boca permanece sendo a biópsia23, apesar de tentativas de se descobrir outros sistemas de diagnóstico como a fluorescência clínica28.
Biologia Celular do Câncer de Boca
O carcinoma epidermoide bucal (CEB) surge como resultado de múltiplos eventos moleculares que se desenvolvem em um indivíduo susceptível, que apesar da comprovada influência de fatores carcinogênicos extrínsecos, como fumo e álcool, o CEB é uma doença em que a predisposição genética (por exemplo, existências de disfunções em genes de reparo) exerce um papel essencial na sua patogênese. Um fator frequentemente citado como relacionado ao câncer de boca é o papilomavirus humano (HPV) de alto risco (como HPV 16, 18 e 31), em associação a outros fatores etiológicos. Embora estudos mostrem uma associação desse vírus com o carcinoma epidermoide de boca, e até com lesões potencialmente malignas, ainda não foi demonstrada realmente a participação desse vírus na carcinogênese de boca, seguindo os postulados de Koch, como por exemplo, uma infecção viral precedendo o carcinoma ou uma associação epidemiológica29.
Dessa maneira, a carcinogênese bucal é um processo composto por várias etapas, sendo modulado por fatores endógenos e ambientais (fatores predisponentes), que podem gerar uma grande variedade de eventos genéticos e epigenéticos, promovendo instabilidade genômica e, consequente, desenvolvimento/progressão tumoral. Outros fatores que contribuem com o câncer são fatores do ambiente tumoral, como células e produtos de secreção, que modificam e são modificados pela células neoplásicas30,31. As alterações genéticas e epigenéticas frequentemente trabalham em conjunto, afetando múltiplas vias celulares ligadas ao processo de carcinogênese e progressão tumoral, tais como as relacionadas à regulação do ciclo celular, reparação de DNA, apoptose, angiogênese e adesão célula-a-célula32.
Muitas são as alterações genéticas que ocorrem no carcinoma epidermoide bucal. Na verdade, instabilidade cromossômica, principalmente perda do braço curto dos cromossomos 3 e 9, tem sido associadas com um aumento na chance de transformação maligna de lesões potencialmente malignas33. A maioria dos estudos com alterações genéticas em cromossomos foram realizados em carcinomas epidermoides da região de cabeça e pescoço, o que inclui sítios como cavidade oral, orofaringe, hipofaringe, nasofaringe, cavidade nasal, seios paranasais, laringe e glândulas salivares. Diferentes estudos relataram perda de material genético nas regiões cromossômicas 1p, 3p, 4p, 5q, 8p, 10p, 11q, 13q e 18q, bem como ganho de material em 1q, 3q, 5p, 7q, 8q, 9q, 11q, 12p, 14q, e 15q. O acúmulo e seleção dessas alterações podem ocorrer ao acaso, mas certamente muitas delas são decorrentes da exposição aos fatores de risco6. Muitas dessas alterações têm sido confirmadas inclusive em linhagens celulares, utilizadas pelos pesquisadores para estudo dessa neoplasia "in vitro"34. O estudo e o entendimento dessas alterações contribuem para a identificação de marcadores de comportamento clínico, ou outros marcadores biológicos de importância para o diagnóstico, tratamento e acompanhamento dos pacientes35.
O termo epigenética refere-se a todas as mudanças hereditárias e reversíveis do genoma que não alteram a sequência de nucleotídeos do DNA. Existem três mecanismos principais de alterações epigenéticas: metilação do DNA, modificações de histonas e ação de RNAs não codificadores31,32,36-38.
Os eventos epigenéticos são importantes na fisiologia de células normais. Com pequenas exceções (células B e T do sistema imune), todos os processos de diferenciação celular são acionados e mantidos através de mecanismos epigenéticos. Sabe-se, por exemplo, que a metilação do DNA desempenha um papel importante no controle da expressão de genes (silenciamento) durante o desenvolvimento embrionário39. Por outro lado, a ativação de genes que controlem o potencial de crescimento de células humanas adultas é de suma importância, de tal forma que, se sem impedimentos, uma única célula pode atingir uma massa de 1 kg (1012 células) em 40 dias por divisão mitótica40. Portanto, os eventos epigenéticos governam uma série de "checagens e balanços", dessa maneira, controlando os vários processos celulares, como diferenciação e proliferação celular, e regulando genes supressores de tumores que devem estar ativos em células normais, mas tornam-se silenciado em cânceres.
O desenvolvimento e progressão de lesões potencialmente malignas e carcinomas na cavidade bucal está associado ao acúmulo de alterações genéticas, incluindo, por exemplo, deleções, amplificações e mutações, que levam tanto a ativação de oncogenes ou a inativação de genes supressores tumorais. Nesse sentido, a exposição celular crônica a carcinógenos pode danificar genes ou até cromossomos, como descrito acima, podendo desencadear uma série de mutações genéticas consecutivas, amplificação de oncogenes (por exemplo, Ciclina D1, EGFR) que promovem a proliferação e sobrevivência celular desregulada bem como a inativação de genes supressores tumorais (por exemplo, p53, p16, PTEN) envolvidos na regulação do ciclo celular. O acúmulo dessas alterações genéticas pode levar ao desenvolvimento de lesões potencialmente malignas (displásicas) e posteriormente o câncer propriamente dito.
No caso do CEB, estima-se que sejam necessárias 6-10 mutações para as células tornarem-se malignas, o que normalmente requer anos de exposição à carcinógenos para ocorrer uma combinação de mutações apropriadas que culminariam na transformação neoplásica. Dessa maneira, a evolução de uma célula normal para uma célula maligna define um período de tempo caracterizado como estágio potencialmente maligno, uma fase precoce do processo de carcinogênese41.
Desse modo, o CEB é resultado do acúmulo de mutações genéticas/epigenéticas, as quais são transmitidas às gerações celulares subsequentes, até o momento em que uma célula mutada torna-se independente, exibindo crescimento autossuficiente e autônomo, não respondendo a sinais proliferativos inibitórios, o que resulta em um tumor apresentando crescimento não controlado. As células neoplásicas, portanto, escapam da morte celular programada e replicam-se infinitamente através do processo de imortalização pelo alongamento de seus telômeros. A esse processo proliferativo desenfreado das células mutadas, dá-se o nome de expansão clonal. Durante a etapa de expansão clonal acontecem inúmeras outras mutações devido à desregulação dos mecanismos de proliferação e diferenciação celulares. Essas mutações adicionais são responsáveis pela heterogeneidade e progressão tumoral. Dessa maneira, a massa neoplásica torna-se heterogênea e individual. Em consequência, essas células neoplásicas adquirem características aberrantes como, por exemplo, intenso potencial de proliferação, invasão e metástase.
Fica evidente que a melhor definição que se pode dar às células tumorais de um CEB, não é a simples ideia de proliferação descontrolada, mas sim sua capacidade de evadir aos processos de morte celular. Este conceito reforça a constatação da alta mortalidade dos pacientes acometidos por esta neoplasia e a dificuldade do controle de crescimento e metástase da mesma pelas atuais modalidades terapêuticas.
Participação do Cirurgião-Dentista no tratamento do câncer de boca
O tratamento do câncer de boca pode envolver cirurgia, radioterapia e quimioterapia. O tamanho e o local do tumor são fatores que devem ser considerados para a definição do tratamento. Importante comentar que a definição do tratamento é realizada por médicos cirurgiões de cabeça e pescoço, radioterapeutas e oncologistas clínicos42.
O Cirurgião-Dentista participa do diagnóstico, sendo o profissional mais indicado para a identificação do câncer de boca, e tem papel fundamental no controle dos efeitos colaterais do tratamento oncológico. Estes efeitos podem comprometer de forma importante o tratamento e a qualidade de vida dos pacientes. A mucosite oral pode estar associada à quimioterapia e radioterapia, e é o efeito mais debilitante durante o tratamento oncológico. Muitas vezes, o tratamento pode ser interrompido devido sua intensidade. A xerostomia, sintoma da boca seca, é outro efeito que compromete a qualidade de vida do paciente. Pacientes xerostômicos estão mais suscetíveis a desenvolver cáries e infecções na boca43.
Cerca de 90% dos pacientes que são atendidos no Departamento de Estomatologia do A.C. Camargo Cancer Center previamente a radioterapia e/ou quimioterapia apresentam algum problema odontológico. Os problemas mais frequentes são doenças da gengiva (gengivite e periodontite), cáries extensas, lesões periapicais (granulomas ou cistos radiculares) e próteses mal adaptadas causando algum tipo de irritação da mucosa bucal. A eliminação de focos de infecção na boca é de suma importância, visto que, estes podem causar a interrupção do tratamento oncológico ou complicações sérias tardiamente, como a osteorradionecrose.
Todos os pacientes que são submetidos à radioterapia para tumores em região de cabeça e pescoço e em grande parte aqueles que recebem tratamento quimioterápico podem desenvolver alterações na cavidade bucal. O atendimento odontológico anteriormente, durante e após estas modalidades de tratamento para o câncer, pode diminuir os efeitos colaterais, amenizar sintomatologias que podem até interromper o tratamento do câncer como é o caso de mucosites intensas.
Atuação do Cirurgião-Dentista previamente e durante a radioterapia e/ou quimioterapia
O atendimento odontológico prévio a radioterapia (região de cabeça e pescoço) deve ser priorizado, todas as extrações dentárias devem ser realizadas anteriormente ao tratamento radioterápico e evitadas após, devido ao risco de desenvolver osteorradionecrose, sendo este o pior efeito colateral. Ressalta-se que as exodontias devem ser realizadas pelo menos 15 dias antes do início da radioterapia. Nesta fase, é necessário um atendimento rápido e eficaz para que o paciente possa iniciar a radioterapia44.
O controle e manutenção dos hábitos de higiene bucal devem ser intensificados durante a radioterapia e/ou quimioterapia, pois agentes microbianos podem colonizar sobre feridas bucais (mucosite) causando problemas sistêmicos. A qualidade da higiene oral do paciente é um fator bem estabelecido. Pacientes com boa condição bucal e que mantêm boa higiene durante o tratamento de câncer tendem a ter menos episódios de mucosite do que pacientes com higiene oral precária. Observa-se ainda que pacientes com mesma idade, tendo o mesmo protocolo de tratamento e características de saúde oral semelhantes não desenvolvem mucosite com a mesma frequência devido à capacidade individual de cada indivíduo absorver e excretar drogas45.
A diminuição do fluxo salivar é outro fator que devemos controlar nesta fase, a saliva age na lubrificação e proteção da mucosa e sua redução também pode tornar a boca um ambiente propício para o desenvolvimento de candidose. Saliva artificial deve ser prescrita quando o paciente queixar de boca seca. Conduto, alguns pacientes preferem ingerir constantemente água à saliva artificial46.
Atuação do Cirurgião-Dentista posteriormente a radioterapia e/ou quimioterapia
O atendimento odontológico pós-radioterapia prioriza a prevenção de cáries, já que a radioterapia afeta o fluxo salivar que expõe o paciente a um maior o número de micro-organismo cariogênicos. A cárie por radiação tem peculiaridades específicas, são geralmente localizadas na região cervical e incisal do dente e possui desenvolvimento rápido47.
Outros problemas incluem dificuldade para falar, alteração dos hábitos alimentares (dificuldade de ingerir alimentos sólidos) e desconforto e dores na boca48. A xerostomia desenvolve agudamente durante o tratamento radioterápico e persiste cronicamente após o tratamento49. A manipulação do paciente xerostômico inclui; estimular o fluxo salivar com gomas de mascar sem adição de açúcar, reduzir a ingestão de alimentos com açúcar e uso de flúor (gel ou solução) na prevenção de cáries e reposição de líquidos.
Outra estratégia é a administração de saliva artificial contendo íons de cálcio, fosfato, sódio, magnésio, e potássio. Visitas periódicas ao Cirurgião-Dentista devem ser estimuladas, pois exodontias devem ser evitadas nesta fase e caso sejam indicadas devem ser realizadas com uso de antibiótico e por Cirurgiões-Dentistas integrados as equipes de tratamento oncológico49-51.
REFERÊNCIAS
1. Inca. Estimativa 2012: incidência de câncer no Brasil. In: Coordenação de Prevenção e Vigilância. – Rio de Janeiro : Inca, editor. Coordenação Geral de Ações Estratégicas. Coordenação de Prevenção e Vigilância.: Instituto Nacional de Câncer José Alencar Gomes da Silva, Coordenação Geral de Ações Estratégicas.; 2011.
2. Scully C. Oral cancer aetiopathogenesis; past, present and future aspects. Med Oral Patol Oral Cir Bucal 2011;16(3):e306-11. [ Links ]
3. Bagan J, Sarrion G, Jimenez Y. Oral cancer: clinical features. Oral Oncol 2010;46(6):414-7. [ Links ]
4. Torres-Pereira CC, Angelim-Dias A, Melo NS, Lemos CA, Jr., Oliveira EM. [Strategies for management of oral cancer in primary and secondary healthcare services]. Cad Saude Publica 2012;28 Suppl:s30-9. [ Links ]
5. Torres-Pereira C. Oral cancer public policies: is there any evidence of impact? Braz Oral Res 2010;24 Suppl 1:37-42. [ Links ]
6. Mascolo M, Siano M, Ilardi G, et al. Epigenetic disregulation in oral cancer. Int J Mol Sci 2012;13(2):2331-53. [ Links ]
7. Boyle P, Levin B, Cancer IAfRo. World cancer report 2008: IARC Press; 2008. [ Links ]
8. Biazevic MG, Castellanos RA, Antunes JL, Michel-Crosato E. Trends in oral cancer mortality in the city of Sao Paulo, Brazil, 1980-2002. Cad Saude Publica 2006;22(10):2105-14. [ Links ]
9. Toporcov TN, Biazevic MG, Rotundo LD, et al. Consumption of animal-derived foods and mouth and oropharyngeal cancer. Rev Panam Salud Publica 2012;32(3):185-91. [ Links ]
10. Biazevic MG, Antunes JL, Togni J, et al. Immediate impact of primary surgery on health-related quality of life of hospitalized patients with oral and oropharyngeal cancer. J Oral Maxillofac Surg 2008;66(7):1343-50. [ Links ]
11. Carr AB, Ebbert J. Interventions for tobacco cessation in the dental setting. Cochrane Database Syst Rev 2012;6:CD005084. [ Links ]
12. Davis JM, Ramseier CA, Mattheos N, et al. Education of tobacco use prevention and cessation for dental professionals-a paradigm shift. Int Dent J 2010;60(1):60-72. [ Links ]
13. Wade J, Smith H, Hankins M, Llewellyn C. Conducting oral examinations for cancer in general practice: what are the barriers? Fam Pract 2010;27(1):77-84. [ Links ]
14. Awojobi O, Scott SE, Newton T. Patients' perceptions of oral cancer screening in dental practice: a cross-sectional study. BMC Oral Health 2012;12:55. [ Links ]
15. Warnakulasuriya S. Global epidemiology of oral and oropharyngeal cancer. Oral Oncol 2009;45(4-5):309-16. [ Links ]
16. van der Waal I. Are we able to reduce the mortality and morbidity of oral cancer; some considerations. Med Oral Patol Oral Cir Bucal 2013;18(1):e33-7. [ Links ]
17. Scott SE, Rizvi K, Grunfeld EA, McGurk M. Pilot study to estimate the accuracy of mouth self-examination in an at-risk group. Head Neck 2010;32(10):1393-401. [ Links ]
18. Elango KJ, Anandkrishnan N, Suresh A, et al. Mouth self-examination to improve oral cancer awareness and early detection in a high-risk population. Oral Oncol 2011;47(7):620-4. [ Links ]
19. Correa MB, Tarquinio SB, Oliveira LJ, et al. Factors associated with prevalence of oral lesions and oral self-examination in young adults from a birth cohort in Southern Brazil. Cad Saude Publica 2013;29(1):155-64. [ Links ]
20. Conway DI, Petticrew M, Marlborough H, et al. Socioeconomic inequalities and oral cancer risk: a systematic review and meta-analysis of case-control studies. Int J Cancer 2008;122(12):2811-9. [ Links ]
21. Wünsch-Filho V, Mirra AP, López RVM, Antunes LF. Tabagismo e câncer no Brasil: evidências e perspectivas. Rev Bras Epidemiol 2010;132. [ Links ]
22. Scully C, Bagan J. Oral squamous cell carcinoma overview. Oral Oncol 2009;45(4-5):301-8. [ Links ]
23. Seoane J, Varela-Centelles P, Esparza-Gomez G, et al. Simulation for training in oral cancer biopsy: a surgical model and feedback from GDPs. Med Oral Patol Oral Cir Bucal 2013;18(2):e246-50. [ Links ]
24. van der Waal I. Potentially malignant disorders of the oral and oropharyngeal mucosa; present concepts of management. Oral Oncol 2010;46(6):423-5. [ Links ]
25. van der Waal I. Potentially malignant disorders of the oral and oropharyngeal mucosa; terminology, classification and present concepts of management. Oral Oncol 2009;45(4-5):317-23. [ Links ]
26. Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med 2007;36(10):575-80. [ Links ]
27. van der Waal I, Reichart PA. Oral proliferative verrucous leukoplakia revisited. Oral Oncol 2008;44(8):719-21. [ Links ]
28. Farah CS, McIntosh L, Georgiou A, McCullough MJ. Efficacy of tissue autofluorescence imaging (VELScope) in the visualization of oral mucosal lesions. Head Neck 2012;34(6):856-62. [ Links ]
29. Syrjanen S, Lodi G, von Bultzingslowen I, et al. Human papillomaviruses in oral carcinoma and oral potentially malignant disorders: a systematic review. Oral Dis 2011;17 Suppl 1:58-72. [ Links ]
30. Li H, Fan X, Houghton J. Tumor microenvironment: the role of the tumor stroma in cancer. J Cell Biochem 2007;101(4):805-15. [ Links ]
31. Rodrigues-Lisoni FC, Peitl P, Jr., Vidotto A, et al. Genomics and proteomics approaches to the study of cancer-stroma interactions. BMC Med Genomics 2010;3:14. [ Links ]
32. Fan CY. Epigenetic alterations in head and neck cancer: prevalence, clinical significance, and implications. Curr Oncol Rep 2004;6(2):152-61. [ Links ]
33. Kim KY, Cha IH. The identification of significant chromosomal regions correlated with oral tongue cancer progression. J Cancer Res Clin Oncol 2012;138(10):1667-77. [ Links ]
34. Martin CL, Reshmi SC, Ried T, et al. Chromosomal imbalances in oral squamous cell carcinoma: examination of 31 cell lines and review of the literature. Oral Oncol 2008;44(4):369-82. [ Links ]
35. Ha PK, Chang SS, Glazer CA, Califano JA, Sidransky D. Molecular techniques and genetic alterations in head and neck cancer. Oral Oncol 2009;45(4-5):335-9. [ Links ]
36. Feinberg AP, Tycko B. The history of cancer epigenetics. Nat Rev Cancer 2004;4(2):143-53. [ Links ]
37. Kanwal R, Gupta S. Epigenetic modifications in cancer. Clin Genet 2012;81(4):303-11. [ Links ]
38. Rountree MR, Bachman KE, Herman JG, Baylin SB. DNA methylation, chromatin inheritance, and cancer. Oncogene 2001;20(24):3156-65. [ Links ]
39. Shaw R. The epigenetics of oral cancer. Int J Oral Maxillofac Surg 2006;35(2):101-8. [ Links ]
40. Momparler RL, Bovenzi V. DNA methylation and cancer. J Cell Physiol 2000;183(2):145-54. [ Links ]
41. Wright JM. A review and update of oral precancerous lesions. Tex Dent J 1998;115(6):15-9. [ Links ]
42. da Silva SD, Ferlito A, Takes RP, et al. Advances and applications of oral cancer basic research. Oral Oncol 2011;47(9):783-91. [ Links ]
43. Alves FA, Coracin FL, Gasparetto PF, Corrêa MEP, Almeida OP. Complicações orais do tratamento quimioterápico antineoplásico. Jornal Brasileiro de Odonto-Psicologia e Odontologia para Pacientes Especiais 2003;1:337-40. [ Links ]
44. Koga DH, Salvajoli JV, Alves FA. Dental extractions and radiotherapy in head and neck oncology: review of the literature. Oral Dis 2008;14(1):40-4. [ Links ]
45. Sonis ST. Mucositis as a biological process: a new hypothesis for the development of chemotherapy- induced stomatotoxicity. Oral Oncol 1998;34(1):39-43. [ Links ]
46. Rankin KV. Oral health in cancer therapy part II: Management of xerostomia and pain in cancer patients. Tex Dent J 2010;127(5):460-1. [ Links ]
47. Silva AR, Alves FA, Antunes A, Goes MF, Lopes MA. Patterns of demineralization and dentin reactions in radiation-related caries. Caries Res 2009;43(1):43-9. [ Links ]
48. Davies AN, Broadley K, Beighton D. Salivary gland hypofunction in patients with advanced cancer. Oral Oncol 2002;38(7):680-5. [ Links ]
49. Antonadou D, Pepelassi M, Synodinou M, Puglisi M, Throuvalas N. Prophylactic use of amifostine to prevent radiochemotherapy-induced mucositis and xerostomia in head-and-neck cancer. Int J Radiat Oncol Biol Phys 2002;52(3):739-47. [ Links ]
50. Abdelghany A, Nolan A, Freeman R. Treating patients with dry mouth: general dental practitioners' knowledge, attitudes and clinical management. Br Dent J 2011;211(10):E21. [ Links ]
51. Hancock PJ, Epstein JB, Sadler GR. Oral and dental management related to radiation therapy for head and neck cancer. J Can Dent Assoc 2003;69(9):585-90. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Celso Augusto Lemos Junior
Departamento de Estomatologia
Av. Professor Lineu Prestes, 2227
Cidade Universitária – São Paulo - SP
05508-001
Brasil
e-mail: calemosj@usp.br













