Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.69 no.3 Sao Paulo Jul./Set. 2015
Revisão de literatura (Autor convidado)
A terapia fotodinâmica como benefício complementar na clínica odontológica
Photodynamic therapy as a complementary benefit in the dental clinic
Carlos de Paula EduardoI; Marina Stella Bello-SilvaII; Karen Müller RamalhoIII; Ester Mi Ryoung LeeIV; Ana Cecília Correa AranhaV
I Professor titular sênior do Departamento de Dentística da Faculdade de Odontologia da Universidade de São Paulo (Fousp), coordenador do Laboratório Especial de Lasers em Odontologia (Lelo-Fousp)
II Colaboradora do Lelo-Fousp
III Professora do programa de pós-graduação em Odontologia da Universidade Ibirapuera (Unib)
IV Aluna de mestrado do curso de pós-graduação em Dentística (área de concentração em Laser) da Fousp
V Professora associada do Departamento de Dentística da Fousp, vice-coordenadora do Lelo-Fousp
RESUMO
Um dos grandes desafios do Cirurgião-Dentista é o controle microbiológico nas patologias dentárias. Independentemente da especialidade, a redução microbiana para o sucesso do tratamento é necessária. A terapia fotodinâmica vem sendo utilizada como coadjuvante ao tratamento tradicional, reduzindo significativamente a quantidade de microrganismos nos sítios-alvo e contribuindo para a solução de casos, principalmente na presença de infecções resistentes. Esta revisão de literatura tem como objetivo apresentar estudos laboratoriais e clínicos relacionados à terapia fotodinâmica em Periodontia, Endodontia e Estomatologia. Apesar da variedade de protocolos utilizados nas recentes pesquisas, a terapia fotodinâmica mostra-se promissora como coadjuvante ao tratamento convencional. Além disso, apresenta grande utilidade, fácil acessibilidade e baixo custo para o Cirurgião-Dentista frente a processos infecciosos em Odontologia.
Descritores: endodontia; lasers; medicina bucal; herpes labial; periodontia
ABSTRACT
One of the great challenges of the dentist is the microbiological control in dental pathologies. Regardless of specialty, microbial reduction for successful treatment is necessary. Photodynamic therapy has been used as an adjunct to traditional treatment, significantly reducing the amount of microorganisms in the target sites and contributing to the solution of cases, especially in the presence of resistant infections. This literature review aims to present laboratory and clinical studies related to photodynamic therapy in Periodontics, endodontics and Stomatology. Despite the variety of protocols used in recent research, photodynamic therapy is potentially used as an adjunct to conventional treatment. In addition, it is useful, easy to apply and with low cost to the dentist.
Descriptors: lasers; endodontics; periodontics; oral medicine; herpes labialis
RELEVÂNCIA CLÍNICA
A Terapia Fotodinâmica (PDT) antimicrobiana não é considerada uma substituta aos fármacos antimicrobianos ou de qualquer tratamento convencional, mas sim uma importante modalidade de tratamento complementar de infecções bucais localizadas, principalmente em casos de microrganismos resistentes. A sensibilidade de bactérias, vírus e fungos à PDT sugere sua aplicabilidade em infecções localizadas de pouca profundidade e de microbiota conhecida. Baixo custo, mínimos efeitos colaterais e redução da probabilidade de recorrência são as principais vantagens da terapia, além de simplicidade técnica e ausência de risco de resistência microbiana.
INTRODUÇÃO
Os lasers vêm sendo cada vez mais utilizados pelo Cirurgião-Dentista na rotina clínica do consultório. Os lasers de alta potência são utilizados com finalidade cirúrgica, e podem remover tecido duro como osso, esmalte e dentina, além de vaporizar o tecido mole, realizando incisões, gengivectomia etc. Estes lasers atuam pelo aumento de temperatura e, por este motivo, possuem um importante efeito antimicrobiano associado à sua ação cirúrgica.
Em contrapartida, os lasers de baixa potência atuam com efeito terapêutico, ou seja, promove reparação tecidual, modulação da inflamação e analgesia. Por não provocarem aumento de temperatura no tecido, não possuem efeito antimicrobiano associado. Estes lasers, porém, podem apresentar índice de redução microbiana na faixa dos 99-100% quando utilizados em associação com agentes fotossensibilizadores. A associação de uma fonte de luz com um agente fotossensibilizador para morte microbiana é chamada de terapia fotodinâmica (PDT, do inglês, Photodynamic Therapy).
A PDT apresenta aplicações em diversas áreas da saúde. Na Odontologia, a grande maioria das patologias está relacionada a bactérias, fungos e vírus, e a PDT apresenta-se promissora com diversas aplicações e inúmeras vantagens, dentre elas o custo, a ausência de efeitos colaterais e a impossibilidade de resistência adquirida por bactérias. No mercado mundial e brasileiro já existem diversas empresas que produzem equipamentos de laser em baixa potência, com custos acessíveis. Existem, ainda, sistemas de fibras ópticas voltadas exclusivamente para aplicação da PDT em canais radiculares e bolsas periodontais, além de fotossensibilizadores apropriados e indicados para tal.
O objetivo desta revisão de literatura é elucidar e discutir o uso da PDT em diversas áreas da odontologia, visando guiar o clínico durante a sua aplicação, apresentando casos clínicos com o objetivo de ilustrar os protocolos de PDT existentes.
MATERIAIS E MÉTODOS
Estudos in vitro, in vivo e clínicos relacionados à terapia fotodinâmica na Odontologia foram buscados nas bases ISI, EMBASE, LILACS, SCOPUS E PUBMED. Não houve restrição quanto ao período de publicação. Foram utilizados para busca os termos "Photodynamic Therapy, Antimicrobial Photodynamic Therapy, Photodynamic Antimicrobial Chemotherapy, Photosensitization, Photoinactivation, PDT e Terapia Fotodinâmica".
REVISÃO DE LITERATURA
Mecanismo de ação
O mecanismo de fotossensibilização da PDT consiste na interação da luz com o fotossensibilizador e o oxigênio, gerando radicais livres que induzem severos danos às células microbianas, levando à sua morte. A luz é responsável por excitar o agente fotossensibilizador (FS), que interage com moléculas vizinhas através de dois mecanismos.1 O fotossensibilizador no estado excitado pode agir removendo um átomo de hidrogênio de uma molécula do substrato biológico (fosfolipídeos, colesterol, proteínas entre outros)1 ou transferindo elétrons, gerando íons radicais que tendem a reagir com o oxigênio no estado fundamental. São formados produtos oxidados responsáveis pela cadeia de radicais livres, como radical superóxido (O2-), peróxido de hidrogênio (H2O2), e radical hidroxila (OH), que são capazes de oxidar uma grande variedade de biomoléculas. O fotossensibilizador no estado excitado pode, ainda, transferir energia ao oxigênio molecular no estado fundamental, produzindo oxigênio singleto (1O2). Este é o mecanismo dominante na PDT.2 O oxigênio singleto é uma forma altamente reativa de oxigênio e é considerado o principal mediador do dano fotoquímico causado aos microrganismos por muitos fotossensibilizadores. O oxigênio singleto possui tempo de vida em água de aproximadamente 4 μs e em sistemas biológicos esse tempo é extremamente baixo, inferior a 0,04 μs. Em função disso, seu raio de ação é extremamente reduzido (<0,02μm), atuando apenas onde é produzido, fato muito importante para TFD que se baseia no efeito fotodinâmico localizado.
Fontes de luz
Para que a PDT seja efetiva, é imprescindível que a fonte de luz interaja com o FS. Assim, a escolha da fonte de luz depende do FS que será utilizado, e vice-versa. Existem inúmeros agentes FS descritos na literatura para este fim. O mais estudado deles é o azul de metileno. Por este motivo, a luz mais utilizada para interagir com este FS é a luz vermelha visível, que pode ser emitida pelo laser de baixa potência vermelho ou também por diodos emissores de luz (LEDs) vermelhos.
Apesar de frequentemente confundidos, os lasers são fontes de luz diferentes dos LEDs. Os lasers possuem características específicas, como monocromaticidade (fótons com o mesmo comprimento de onda), colimação (fótons emitidos na mesma direção) e coerência (fótons emitidos em sincronismo no tempo e espaço). Já os LEDs apresentam somente monocromaticidade, ou seja, o LED vermelho emite fótons na faixa do vermelho somente. Para que a PDT ocorra, os fótons na faixa do vermelho visível devem interagir com o azul de metileno. Portanto, ambas as fontes de luz, tanto lasers vermelhos quanto LEDs vermelhos, podem ser utilizadas. As diferenças entre eles recaem sobre a ação mais localizada e em profundidade dos lasers quando comparados aos LEDs, que apresentam ação mais superficial e em maior área. Com os equipamentos atualmente disponíveis, a PDT realizada em superfície, como para tratamento do herpes, por exemplo, pode utilizar ambas as fontes de luz. Já a irradiação que necessita de maior profundidade deve ser realizada com o laser vermelho, como aquela para reduzir microrganismos numa bolsa periodontal sem o uso de fibra ótica, por exemplo. O importante é que os parâmetros de irradiação sejam meticulosamente respeitados, como energia, potência, tempo de irradiação e comprimento de onda da fonte de luz.
Agentes Fotossensibilizadores
A literatura apresenta inúmeros FS atuando de maneira eficaz na PDT. Os corantes fenotiazínicos são os mais comumente utilizados em Odontologia. FS dessa classe apresentam fototoxicidade tanto ao núcleo quando às membranas celulares.3 O mais conhecido deles é o Azul de Metileno (AM), cuja máxima absorção ocorre em 664 nm, ou seja, a PDT com o AM deve utilizar fontes de luz emitindo fótons na faixa do vermelho visível, como os lasers vermelhos de baixa potência e os LEDs vermelhos.
A característica hidrofílica do AM, seu baixo peso molecular e sua carga positiva permitem sua passagem através dos microrganismos, inclusive através dos canais compostos pela proteína porina nas membranas externas de bactérias gram-negativas.4 Seu caráter catiônico permite que este interaja com grupos aniônicos presentes na superfície das células microbianas. Para que este processo ocorra de forma efetiva, o clínico deve aguardar alguns minutos para realizar a irradiação após a inserção do FS. Esse tempo é chamado "Tempo Pré-Irradiação". Ele garantirá que o FS alcançou seu alvo e que as espécies reativas de oxigênio serão liberadas no sítio desejado.2 O tempo pré-irradiação pode variar. Em casos onde não haja fluidos ou exsudatos, três minutos são suficientes.5 Infecções periodontais ou fúngicas necessitam de tempo pré-irradiação de 5 e 30 minutos, respectivamente.6,7
Outro fator importante com relação ao FS é a sua concentração. O mercado odontológico comercializa duas concentrações de azul de metileno, 0,005% e 0,01%. A primeira é indicada em casos onde não haja exsudato, sangue, fluido gengival, saliva ou qualquer outro tipo de diluente ou conteúdo proteico, como canais radiculares e superfície dental (após o preparo protético ou cavitário). Na presença destas substâncias, opta-se pelo AM a 0,01%, mais concentrado, portanto.
Terapia fotodinâmica em Endodontia
grande desafio no tratamento endodôntico é a máxima eliminação de bactérias previamente à obturação. Estudos mostram que o sucesso do tratamento endodôntico está diretamente relacionado à porcentagem da eliminação de bactérias durante o tratamento.8 Canais radiculares infectados apresentam uma complexa flora microbiana distribuída na extensão dos canais radiculares principais e secundários. Essas coleções ou agregados densos microbianos (biofilme) se aderem às paredes dos canais e são capazes de penetrar a dentina através dos túbulos dentinários. O insucesso do tratamento endodôntico ocorre, na maioria das vezes, por falhas causadas devido à anatomia de difícil acesso ou presença de canais secundários, onde a descontaminação torna-se mais restrita.
O número de estudos avaliando a PDT na eliminação de bactérias relacionadas a infecções endodônticas vem aumento consideravelmente nos últimos anos. Os índices de descontaminação alcançados com a PDT atingem os 97-100%8, e são equivalentes àqueles conseguidos com os lasers de alta potência. O efeito antimicrobiano da PDT em patógenos endodônticos (P. gingivalis, P. intermedia, F. nucleatum, P. micros, P. endodontalis) foi observado tanto in vitro8,9 quanto in vivo10,5. A PDT se mostrou efetiva também na redução de E. faecalis presentes em canais contaminados in vitro8,11. Este é um resultado muito importante, visto que essa bactéria está relacionada às infecções endodônticas persistentes e refratárias.
Estudos clínicos observam a importância da PDT como coadjuvante ao tratamento endondôntico tradicional em casos de lesão periapical, resistência antibiótica e cirurgia parendodôntica.5,12 Os estudos utilizaram uma fibra ótica como modo de entrega da luz laser. A fibra atua com movimentos helicoidais nos canais ou no interior da retrocavidade, favorecendo a distribuição homogênea da luz e garantindo uma melhor fotorreação.10,13,14
A análise dos estudos mostra que os parâmetros do laser em baixa intensidade utilizados assim como as concentrações dos corantes variam muito nos trabalhos publicados. Pode-se notar uma tendência de energias mais altas parecerem mais efetivas, ao passo que a concentração de corante parece não ter essa relação. Também se pode concluir que a PDT utilizada em todas as sessões do tratamento endodôntico apresenta vantagens, uma vez que influencia diretamente e recolonização bacteriana.
Caso clínico - Endodontia
A paciente S.P., 64 anos, compareceu para atendimento apresentando fístula na região periapical do dente 47 e sondagem periodontal de >10 mm. O tratamento periodontal e o tratamento endodôntico foram realizados tradicionalmente, e a PDT foi conduzida para favorecer a redução dos microrganismos na região. Foi realizado tratamento endodôntico tradicional, com preparo químico-cirúrgico usando limas R25 (Reciproc, VDW) e NaOCl a 2,5% associado ao Endo-PTC. Após o preparo apical com lima manual tipo K #35, os canais receberam EDTA-T como irrigação final para aumentar a permeabilidade dentinária e preparar os canais para receber a PDT. Os canais foram secos com papel absorvente estéril e uma agulha gengival montada em um tubete de azul de metileno a 0,005% foi utilizada para preencher os canais com o FS. Um cone de papel estéril foi introduzido em cada canal, favorecendo o acesso do FS à região apical e minimizando bolhas. Após três minutos de tempo pré-irradiação os cones foram removidos, e iniciou-se a irradiação de cada canal com o laser de baixa potência vermelho acoplado à fibra ótica (DMC, São Carlos, Brasil). Foram feitos movimentos helicoidais no sentido apico-cervical incessantemente, durante todo período de irradiação. Cada canal recebeu 9 J de energia, entregues com potência de 100 mW durante 90 segundos de irradiação por canal. Após a irradiação os canais foram irrigados com EDTA-T para a remoção de resquícios de AM, e receberam medicação a base de hidróxido de cálcio por 15 dias. Após esse período a paciente retornou para ser realizada nova PDT e, finalmente, a obturação dos canais com guta-percha e cimento AH Plus (Dentsply).
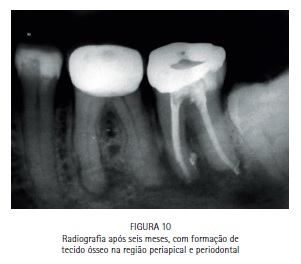
A bolsa periodontal e a fístula foram irrigadas com azul de metileno a 0,01%, (Chimiolux®, DMC, São Carlos, SP. Brasil) valendo- se de uma ponta de irrigação com ponta romba, de maneira a evitar a injeção do FS nos tecidos. Durante o tempo pré-irradiação de cinco minutos a bolsa e a fístula foram constantemente irrigadas. Após os cinco minutos, a bolsa periodontal vestibular, a bolsa periodontal lingual e a fístula foram admitidas como sendo três sítios distintos. Cada um dos sítios recebeu irradiação com laser de baixa potência vermelho acoplado à fibra ótica (DMC, São Carlos, SP. Brazil). Na bolsa periodontal foram feitos movimentos pendulares no sentido mesio-distal, percorrendo toda a superfície radicular incessantemente, durante todo período de irradiação. Na fístula, a fibra foi introduzida até o limite interno e novamente tracionada, incessantemente, percorrendo toda a sua extensão diversas vezes durante o tempo de irradiação. Cada sitio recebeu 9 J de energia, entregues com potência de 100 mW durante 90 segundos de irradiação, totalizando 27 J de energia e 270 segundos de irradiação. A paciente retornou para o controle de seis meses, e a radiografia periapical indicou formação óssea periapical e periodontal. (Figuras 1, 2, 3, 4, 5, 6, 7, 8, 9 e 10)
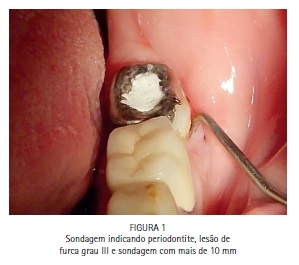
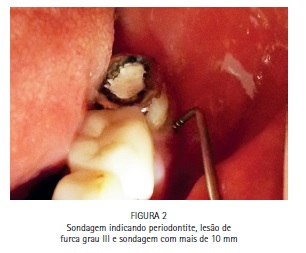
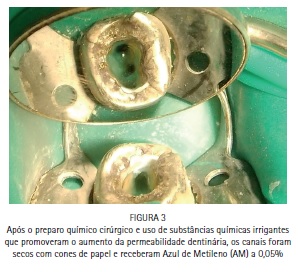
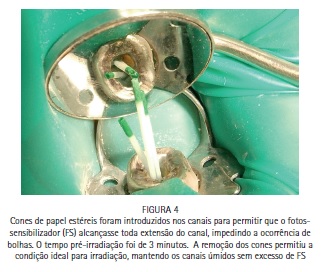
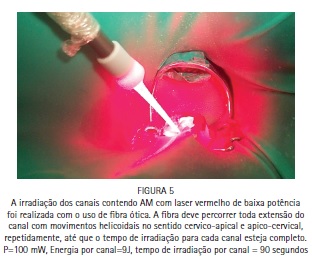

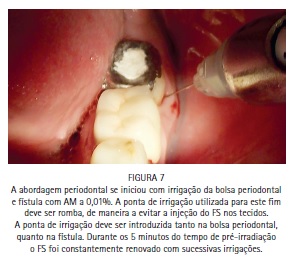
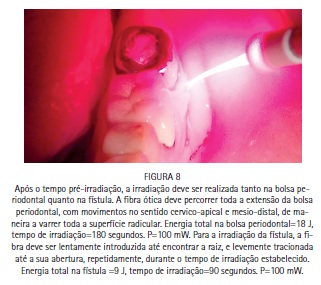
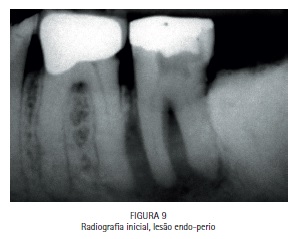
Caso clínico - Endodontia
A presença de microrganismos no sulco gengival é o fator determinante para o desenvolvimento da doença periodontal e sua progressão pode levar a sequelas irreversíveis, como a perda do elemento dental. A PDT tem sido apontada como um importante coadjuvante no tratamento periodontal, principalmente devido à sua eficiência contra microrganismos resistentes aos antimicrobianos tradicionais.14 A realização da terapia tradicional na Periodontia pode ser limitada pela presença de microrganismos resistentes, ou ainda, por áreas de difícil acesso. Nesse caso, o prognóstico desfavorável e a redução nos índices de sucesso após o tratamento periodontal tradicional apontam a PDT como um importante coadjuvante a ser integrado ao tratamento, visando à obtenção de prognósticos melhores e mais previsíveis.
O laser de alta potência como coadjuvante indispensável ao tratamento periodontal tradicional já é consagrado em diversos países. No Brasil, seu uso vem ganhando espaço nos últimos anos pela presença de equipamentos com custo mais acessível no mercado. Essa tecnologia deve em breve ter seus benefícios estendidos à população.
Existe uma infinidade de estudos in vitro demonstrando a capacidade da terapia fotodinâmica de reduzir patógenos relacionados ao desenvolvimento da doença periodontal, como P. gingivalis, A. actinomycetemcomitans, F. nucleatum, P. intermedia e S. sanguis. Estes estudos foram conduzidos em diferentes condições experimentais, tanto em culturas de bactérias provenientes ou não de pacientes periodontais, quanto em biofilme. Os índices de redução microbiana proporcionados pela terapia fotodinâmica variam entre 91,1% e 100%.16,17
Apesar dos inúmeros estudos que comprovam a ação antimicrobiana da PDT, a literatura apresenta parâmetros extremamente distintos com relação aos agentes FS, concentração, tempo pré-irradação e parâmetros de irradiação entre as diversas metodologias adotadas. Alguns estudos, ainda, omitem completamente os parâmetros de irradiação, impedindo conclusões objetivas. Essa diversidade leva à obtenção de resultados conflitantes, e esse fato acaba por prejudicar o estabelecimento de protocolos padronizados para o uso da PDT.
Estudos in vivo avaliaram a eficiência da PDT em doenças periodontais induzidas em animais, e observaram redução da perda óssea e dos sinais de inflamação periodontal, como eritema gengival e sangramento à sondagem. Os estudos foram realizados em animais saudáveis,18 diabéticos, ou ainda, imunossuprimidos19. Os resultados promissores encontrados nos estudos em animais encorajaram a realização de estudos clínicos, e dessa maneira, foi possível estreitar a distância entre o desenvolvimento tecnológico em nível laboratorial e a utilização dessa tecnologia na clínica, visando converter os resultados laboratoriais em benefícios aos pacientes.
Estudos clínicos relatando a utilização da PDT como coadjuvantes no tratamento periodontal foram realizados tanto em casos de periodontite crônica20,21,22,23 e periodontite agressiva24, quanto durante a fase de manutenção e acompanhamento do tratamento periodontal25, e obtiveram redução da profundidade de clínica de sondagem, do sangramento à sondagem, do fluxo do fluído gengival e dos níveis de citocinas no fluido crevicular gengival. Os resultados clínicos indicam que a PDT é um tratamento seguro a ser adotado como coadjuvante ao tratamento periodontal tradicional, favorecendo a redução dos sinais da inflamação e promovendo a redução de periodonto patógenos sem causar danos ao tecido periodontal.
As vantagens da terapia fotodinâmica incluem a sua utilização tópica, no sítio ativo da doença periodontal, sem qualquer efeito sobre os demais microrganismos que compõe a microflora bucal, além do benefício de não apresentar os efeitos colaterais presentes na administração de medicamentos sistêmicos antimicrobianos.26 Ainda, a realização sucessiva da PDT em microrganismos sabidamente resistentes aos antimicrobianos tradicionais mostrou não induzir a seleção de cepas resistentes.27 Este fato, isoladamente, já seria suficiente para justificar a utilização da PDT em pacientes portadores de doença periodontal em larga escala, visto que a ocorrência de cepas resistentes aos antimicrobianos tradicionais tem aumentado progressivamente.
Com base nos resultados observados em estudos clínicos e laboratoriais, e considerando a acessibilidade a técnica relacionada ao baixo custo dos equipamentos de laser de baixa potência na faixa do vermelho visível e dos agentes fotossensibilizadores, a PDT é considerada um coadjuvante fundamental a ser integrado ao tratamento periodontal tradicional27, seja no atendimento privado em consultório odontológico, seja na promoção da saúde bucal através do atendimento público à população brasileira.
Terapia fotodinâmica em Estomatologia
A Estomatologia é a especialidade odontológica que previne, diagnostica e trata as enfermidades relacionadas com a cavidade oral e todo aparelho estomatognático, como lesões ulcerativas e vesico-bolhosas, doenças viróticas, úlceras causadas por tumores, lesões brancas, processos proliferativos, alterações vasculares, alterações em glândulas salivares, crescimentos teciduais de origem traumática, tumores benignos dos tecidos moles, câncer bucal, entre outros. Entre os tratamentos convencionais para certas patologias como o câncer bucal ou lesões infecciosas como o herpes e a candidose, destacam-se as cirurgias, radioterapia, quimioterapia e drogas sistêmicas. Estes tratamentos apresentam efeitos benéficos, porém, oferecem efeitos colaterais como menor resistência a infecções, perda de apetite, náusea, vômito e emagrecimento. Diante dos efeitos colaterais e da eficiência limitada das terapias tradicionais, terapias alternativas estão sendo constantemente desenvolvidas, dentre elas destaca-se a PDT. Na medicina essa terapia já vem sendo frequentemente utilizada no tratamento de lesões neoplásicas. A PDT pode ser dividida em terapia antimicrobiana e terapia anti-neoplásica, ambas aplicáveis na Estomatologia devido ao seu baixo custo, mínimos efeitos colaterais, ausência de ação sistêmica, baixa toxicidade do corante utilizado e redução da probabilidade de recorrência das lesões intraorais.28 A simplicidade da técnica e a ausência de riscos são características que tornam a técnica uma alternativa viável para aplicação clínica na Estomatologia.
A PDT antimicrobiana utilizada no controle microbiológico de fungos e vírus apresenta vantagens como morte microbiana mais rápida, prevenção de nova resistência a antifúngicos e antivirais, inexistência de interações medicamentosas indesejáveis e baixo custo.29 O herpes simples (HSV) é geralmente tratado com medicamentos sistêmicos (vidarabina ou acyclovir, valacyclovir, pencyclovir e foscarnet), entretanto, nenhum tratamento mostrou ser completamente eficaz na eliminação dos sintomas provocados pelo vírus. Deste modo, outras terapias vêm sendo sugeridas pela literatura, entre elas, a fototerapia, que utiliza o laser de baixa potência e suas propriedades biomoduladoras, analgésicas e anti-inflamatórias.30 A associação do laser de baixa a corantes também pode ser utilizada, somando- se aos fatores benéficos da laserterapia o efeito antimicrobiano da PDT. Fatores importantes devem ser considerados na aplicação da PDT no tratamento das lesões de herpes labial como o estágio da mesma. Caso a lesão se encontre na fase de vesícula, deve-se drenar as vesículas previamente à irradiação. Entre as substâncias empregadas no procedimento da PDT para inativação do vírus HSV, pode-se citar as proflavinas, porfirinas, derivados da hematoporfirina e o ácido aminolevulinico (5-ALA).31 No entanto, as propriedades antivirais do AM são conhecidas há mais de setenta anos. Alguns estudos têm claramente demonstrado o efeito do AM contra o vírus.32,33
Em infecções fúngicas (candidose) na cavidade oral, destaca-se o fungo Candida sp., principalmente a espécie C. albicans. A candidose oral é um problema comum que se instala como uma infecção crônica sem evoluir para grave envolvimento sistêmico, a menos que o indivíduo seja imunodeprimido. Os tratamentos convencionais para a candidose incluem os derivados poliênicos como a nistatina, que apresenta comprovada eficácia contra C. albicans. A droga está disponível na forma de suspensão para bochechos, mas apresenta sabor desagradável, que pode causar náusea e vômito. A anfotericina B, de uso parenteral, é reservada para casos sistêmicos graves e possui efeitos colaterais como febre, calafrios, náusea, diminuição da função renal com elevação da concentração de ureia e creatinina e redução dos níveis de potássio. O uso de derivados azólicos, como o cetoconazol, o itraconazol e o fluconazol, também é indicado para quadros graves de candidose com envolvimento sistêmico, apresentando efeitos adversos como náusea e prurido e, menos frequentemente, podem ocorrer problemas gastrintestinais e disfunção hepática.34 A PDT se mostrou tão eficiente quanto a nistatina no tratamento de estomatite protética.7 Este estudo clínico utilizou derivados da hematoporfirina como FS associados ao LED azul, valendo-se de um tempo pré-irradiação de 30 minutos. A curcumina associada ao LED azul também mostrou resultados promissores nos estudos em animais.35 A literatura indica que a PDT atua tanto na redução microbiana, quanto na redução da virulência e da patogenicidade das espécies de Candida.36
Na literatura, a utilização da PDT em outros tipos de patologia também é descrito com resultados interessantes, como queilite actínica, líquen plano e sarcoma de Kaposi. As vantagens da PDT na aplicada na Estomatologia são: possibilidade de tratamento simultâneo de lesões múltiplas e incipientes, ausência de efeitos colaterais, tempo de cura relativamente curto, resposta satisfatória em pacientes imunocomprometidos, boa tolerância do paciente ao tratamento, inibição da resistência adquirida de microrganismos além da possibilidade de repetição do tratamento sem acúmulo de toxicidade.37
Caso clínico – Estomatologia
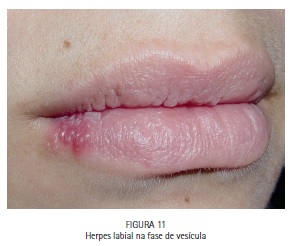
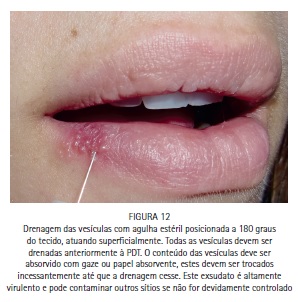
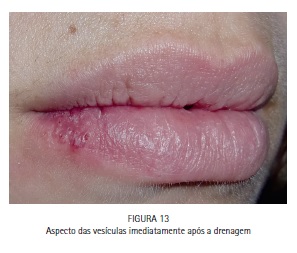
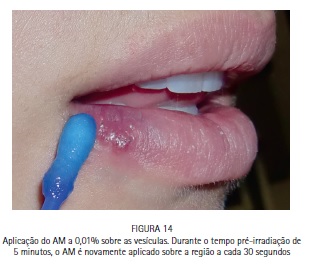
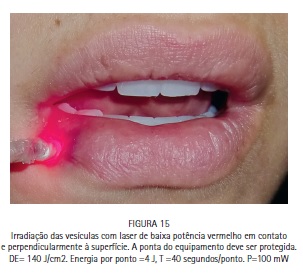
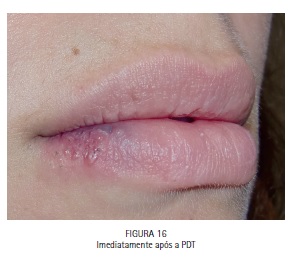
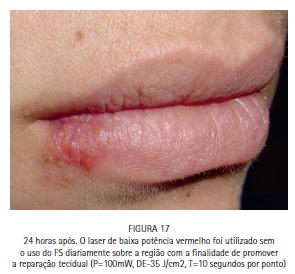
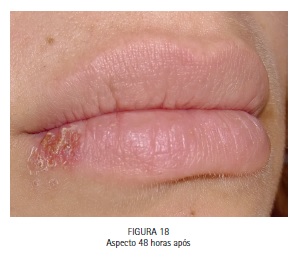
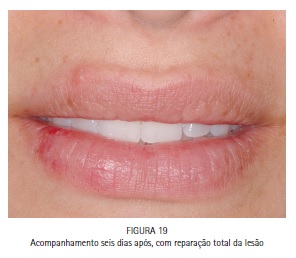
A paciente M.S., 30 anos, compareceu à clínica odontológica apresentando vesículas no lábio inferior direito referentes à infecção recorrente por HSV-1 (herpes labial). Foi feita a drenagem das vesículas com agulha estéril, utilizando o bisel da agulha superficialmente. A região foi comprimida com papel absorvente por 5 minutos, até que a drenagem cessasse. O azul de metileno a 0,01% (Chimiolux®, DMC, São Carlos, SP. Brasil) foi aplicado sobre as vesículas drenadas, e o tempo pré-irradiação de 5 minutos foi aguardado. Durante este tempo o FS foi reaplicado a cada 30 segundos. Após os 5 minutos, foi realizada a irradiação das vesículas com laser de baixa potência na faixa do vermelho visível (690 nm, DMC, São Carlos, SP. Brasil), com a ponteira posicionada perpendicularmente e em contato à superfície. Foram feitos 6 pontos de irradiação, de maneira a abranger toda a área da lesão, com pontos adjacentes, porém sem sobreposição entre eles. Foi utilizada potência máxima do equipamento de 100 mW, densidade de energia de 140 J/cm2, tempo de irradiação de 40 segundos por ponto, 4 J de energia por ponto. Após a PDT as lesões entraram em fase de crosta, e foi realizada laserterapia diária com o mesmo laser de baixa potência na faixa do vermelho visível sem a associação com o azul de metileno, desta vez para promover o reparo tecidual somente. As irradiações foram realizadas com 100 mW, 35 J/cm2, 10 segundos por ponto. Após 6 dias houve reparo completo das lesões. (Figuras 11, 12, 13, 14, 15, 16, 17, 18 e 19)
DISCUSSÃO E CONCLUSÃO
Na Odontologia, o insucesso do tratamento está frequentemente relacionado à ocorrência de infecções e dificuldades no controle microbiológico. Por este motivo, a PDT pode ser indicada para todas as especialidades odontológicas. A literatura descreve suas vantagens como: vasta aplicabilidade; fácil acessibilidade, baixo custo, boa tolerância, ausência de efeitos colaterais e impossibilidade de resistência microbiana adquirida frente aos fotossensibilizadores (Garcez et al., 2007; 2008)29.
Um dos principais problemas com as drogas antimicrobianas convencionais é seu único sítio e modo de ação.2 Após determinada exposição, a maioria dos microrganismos começa a desenvolver mecanismos de resistência para um único ponto de ataque. Ao contrário, os fotossensibilizadores agem via produção de oxigênio singleto ou espécies reativas de oxigênio, os quais não apresentam uma especificidade de ação celular, reagindo rapidamente com uma variedade de substratos, incluindo colesterol, acilas insaturadas das camadas lipídicas das membranas, resíduos de aminoácidos, bem como bases de ácidos nucléicos do DNA, particularmente a guanina e timina.2 Devido a essa inespecificidade de ação, o microrganismo não é capaz de desenvolver resistência.
Esta revisão de literatura abordou os resultados promissores da terapia fotodinâmica aplicada à Endodontia, periodontia e estomatologia em estudos in vitro, in vivo e casos clínicos. Particularidades da aplicação da terapia em cada especialidade foram discutidos, e permitem concluir que a PDT pode ser efetiva no controle de bactérias, fungos e vírus e, na maioria dos casos, é recomendada como coadjuvante ao tratamento convencional. Existem outras aplicações descritas na literatura que não foram abordadas nesta revisão, como o uso da PDT para redução microbiana em preparo cavitário após remoção de cárie, para tratamento de periimplantite e alveolite. Os estudos mostram redução microbiana efetiva em todas estas indicações, comprovando o amplo espectro de ação da PDT, mesmo valendo-se do mesmo fotossensibilizador (azul de metileno) e mesma fonte de luz (laser de baixa potência na faixa do vermelho visível).
No entanto, vale ressaltar que, aparentemente, cada microrganismo responde de forma diferente aos fotossensibilizadores. Assim, a terapia torna-se específica para cada aplicação, por exemplo: o tipo do fotossensibilizador, sua concentração, o tempo pré-irradiação, o tipo de luz utilizada na fotossensibilização, o comprimento de onda, a energia, a potência, o modo de entrega da luz etc. Dessa forma, para o melhor resultado deve ser usado o protocolo específico em cada aplicação. As pesquisas vêm aos poucos desenvolvendo esses protocolos, de forma a tornar sua utilização mais fácil para o clínico no consultório. A técnica também vem sendo constantemente aprimorada, como por exemplo, nos estudos visando a melhor forma de veiculação dos fotossensibilizadores, nos quais diferentes meios de diluição vêm sendo testados assim como de veiculação através da nanotecnologia.
Através dos estudos descritos na revisão de literatura, pode-se considerar a terapia fotodinâmica como uma terapia coadjuvante promissora para ser aplicada à Odontologia, altamente especializada e qualificada, sendo os custos de sua utilização aplicáveis à realidade brasileira, seja em atendimento particular, seja em atendimento público.
Perspectivas
Apesar da infinidade de aplicações da PDT na Odontologia, esta ainda é desconhecida pela maioria dos Cirurgiões-Dentistas. Como a PDT tem como principal objetivo o controle microbiológico, essa terapia se encaixa perfeitamente nos objetivos do tratamento odontológico. Os resultados encontrados nas pesquisas e casos clínicos publicados mostram-se promissores. Atualmente, já existem no mercado brasileiro empresas com registros na Anvisa e Ministério da Saúde que disponibilizam os equipamentos e fibras ópticas a preços acessíveis a realidade brasileira, assim como a veiculação dos fotossensibilizadores. Dessa forma, a PDT está aos poucos sendo introduzida no dia a dia clínico na Odontologia, o que demostra a inserção e sedimentação dos lasers e de novas tecnologias na Odontologia moderna.
AGRADECIMENTOS
Os autores gostariam de agradecer ao Laboratório Especial de Laser em Odontologia (LELO) do Departamento de Dentística da Faculdade de Odontologia da USP, assim como o Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelas bolsas concedidas (mestrado processo nº. 134268/2015-6 e Produtividade em Pesquisa processo nº. 306857/2013-8).
REFERÊNCIAS
1. Foote CS. Definition of type I and type II photosensitized oxidation. Photochem Photobiol 1991; 54(5): 659-663. [ Links ]
2. Bagnato VS. Novas técnicas óticas para as áreas da saúde. Física ELd, editor. São Paulo, 2008.
3. Harris F, Chatfield LK, Phoenix DA. Phenothiazinium based photosensitisers – photodynamic agensts with multiplicity of cellular targets and clinical applications. Curr Drug Targets 2005; 6(5): 615-627.
4. Usacheva MN, Teichert MC, Biel MA. The interaction of lipopolysacharides with phenothiazine dyes. Lasers Surg Med 2003; 33(5): 311-319.
5. Garcez AS, Nunez SC, Hamblin MR, Ribeiro MS. Antimicrobial effects of photodynamic therapy on patients with necrotic pulps and periapical lesion. JOE 2008; 34(2): 138-142.
6. Ribeiro MS, Groth EB, Yamada AM, Garcez AS, Suzuki LC, Prates RA, Nunez SC. Terapia fotodinâmica antimicrobiana. Aplicações na Odontologia. Cap 07; Livro Virtual C, editor. São Paulo 2005.
7. Mima EG, Vergani CE, Machado AL, Massucato EMS, Colombo AL, Bagnato VS et al. Comparison of Photodynamic Therapy versus conventional antifungal therapy for the treatment of denture stomatitis: a randomized clinical trial. Clin Microbiol Infect 2012; 18: E380–E388
8. Soukos, NS, Chen PSY, Morris JT, Ruggiero K, Abernethy AD, Som S, Foschi F, Doucette S, Bammann LL, Fontana CR, Doukas AG, Stashenko PP. Photodynamic therapy for endodontic disinfection. JOE 2006; 32(10): 979-984.
9. Flimpe JL, Fontana CR, Foshi F, Riggiero K, Song X, Pagonis TC, Tanner ACR, Kent R, Doukas AG, Stashenko PP, Soukos NS. Photodynamic treatment o endodontic polymicrobial infection in vitro. JOE 2008; 34(6): 728-734.
10. Bonsor SJ, Nichol R, Reid MS, Pearson GJ. An alternative regimen for root canal disinfection. British Dental J 2006; 201(2): 101-105.
11. Yildirim C, Karaarslan ES, Ozsevik S, Zer Y, Sari T, Usumez A. Antimicrobial efficiency of photodynamic therapy with different irradiation durations. Eur J Dent 2013;7:469-73.
12. Garcez AS, Nuñez SC, Hamblim MR, Suzuki H, Ribeiro MS. Photodynamic Therapy Associated with Conventional Endodontic Treatment in Patients with Antibiotic-resistant Microflora: A Preliminary Report. Journal of Endodontics 2010 Sept: 36, (9): 1463–1466
13. Garcez AS, Neto JGA, Sellera DP, FregnaniE, Effects of Antimicrobial Photodynamic Therapy and Surgical Endodontic Treatment on the bacterial load reduction and periapical lesion healing. Three years follow up, Photodiagnosis and Photodynamic Therapy 2015, http://dx.doi.org/10.1016/j.pdpdt.2015.06.002
14. Garcez AS, Fregnani E et al. Lasers Med Sci 2013 28:79–85
15. Maisch T. Anti-microbial photodynamic therapy: useful in the future? Lasers Med Sci 2007;22(2):83-91.
16. Chan Y, Lai CH. Bactericidal effects of different laser wavelengths on periodontopathic germs in photodynamic therapy. Lasers Med Sci 2003; 18:51-55.
17. Alvarenga LH, Prates RA, Yoshimurad TM, Katoe IT, Suzuki LC, Ribeiro MS, et al. Dental Aggregatibacter actinomycetemcomitansbiofilm can be inactivated by methyleneblue-mediated photodynamic therapy Photodiagnosis and Photodynamic Therapy 2015; 12:131-135.
18. de Almeida JM, Theodoro LH, Bosco AF, Nagata MJ, Oshiiwa M, Garcia VG. In vivo effect of photodynamic therapy on periodontal bone loss in dental furcations. J Periodontol 2008a; 79:1081-1088.
19. Fernandes LA, de Almeida JM, Theodoro LH, Bosco AF, Nagata MJ, Martins TM, Okamoto T, Garcia VG. Treatment of experimental periodontal disease by photodynamic therapy in immunosuppressed rats. J Clin Periodontol. 2009;36(3):219-228.
20. Braun A, Dehn C, Krause F, Jepsen S. Short-term clinical effects of adjunctive antimicrobial photodynamic therapy in periodontal treatment: a randomized clinical trial. J Clin Periodontol 2008; 35(10): 877-884.
21. Christodoulides N, Nikolidakis D, Chondros P, Becker J, Schwarz F, Rössler R, et al. Photodynamic therapy as an adjunct to non-surgical periodontal treatment: a randomized, controlled clinical trial. J Periodontol. 2008;79(9):1638-1644.
22. Betsy J, Prasanth CS, Baiju KV, Prasanthila J, Subhash N. Efficacy of antimicrobial photodynamic therapy in the management of chronic periodontitis: a randomized controlled clinical trial. J Clin Periodontol 2014;41: 573–581. doi: 10.1111/jcpe.12249.
23. Alwaeli HA, Al-Khateeb SN, Al-Sadi A. Long-term clinical effect of adjunctive antimicrobial photodynamic therapy in periodontal treatment: a randomized clinical trial Lasers Med Sci 2015;30:801-807
24. de Oliveira RR, Schwartz-Filho HO, Novaes AB, Garlet GP, de Souza RF, Taba M, Scombatti de Souza SL, Ribeiro FJ. Antimicrobial photodynamic therapy in the non-surgical treatment of aggressive periodontitis: cytokine profile in gingival crevicular fluid, preliminary results. J Periodontol 2009;80(1):98-105.
25. Kolbe MF, Ribeiro FV, Luchesi VH, Casarin RC, Sallum EA, Nociti Jr. FH, et al. Photodynamic Therapy During Supportive Periodontal Care: Clinical, Microbiologic, Immunoinflammatory, and Patient-Centered Performance in a Split-Mouth Randomized Clinical Trial. J Periodontol 2014;85:e277-e286
26. Jori G. Photodynamic therapy of microbial infections: state of the art and perspectives. J Environ Pathol Toxicol Oncol. 2006;25(1-2):505-519.
27. Lauro FM, Pretto P, Covolo L, Jori G, Bertoloni G. Photoinactivation of bacterial strains involved in periodontal diseases sensitized by porphycene-polylysine conjugates. Photochem Photobiol Sci 2002;1:468-470.
28. Garcez, A.S. et al. Terapia fotodinâmica em odontologia: laser de baixa potência para redução microbiana. Rev Assoc Paul Cir Dent 2003; 57(3):223-225.
29. Zanin, ICJ; Gonçalves, RB. Novas perspectivas do uso do laser terapêutico: ação antimicrobiana da terapia fotodinâmica. In: BRUGNERA JÚNIOR, A. et al. Atlas de laserterapia aplicada à clínica odontológica. São Paulo: Santos, 2003.
30. Eduardo, F.P., Mehnert, D.U., Monezi, T.A., Zezell, D.M., Schubert, M.M., Eduardo, C.P., and Marques, M.M. Cultured epithelial cells response to phototherapy with low intensity laser. Lasers Surg Med.2007 Apr; 39(4), 365-372.
31. Ichimura, H., Yamaguchi, S., Kojima, A., Tanaka, T., Niiya, K., Takemori, M., et al.. Eradication and reinfection of human papillomavirus after photodynamic therapy for cervical intraepithelial neoplasia. Int J Clin Oncol 2003;8(5):322-325.
32. Schagen FH, Moor AC, Cheong SC, Cramer SJ, van Ormondt H, van der Eb AJ, et al. Photodynamic treatment of adenoviral vectors with visible light: an easy and convenient method for viral inactivation. Gene Ther 1999;6(5):873-881.
33. Marotti J, Sperandio FF, Fregnani ER, Aranha ACC, de Freitas PM, Eduardo CP. High-Intensity Laser and Photodynamic Therapy as a Treatment for Recurrent Herpes Labialis. Photomedicine and Laser Surgery 2010; 28: 3
34. Andrade, E.D. Protocolos indicados na Prática Odontológica. In: Terapêutica medicamentosa em odontologia. Artes Médicas. São Paulo, 1999.
35. Dovigo LN et al. Curcumin-mediated photodynamic inactivation of Candida albicans in a murine model of oral candidiasis. Medical Mycology 2013 April: 51, 243–251
36. Kato IT, Prates RA, Sabino CP, Fuchs BB, Tegos GP, Mylonakis E, Hamblin MR, Ribeiro MS. Antimicrobial Photodynamic Inactivation Inhibits Candida albicans Virulence Factors and Reduces In Vivo Pathogenicity. Antimicrobial Agents and Chemotherapy 2013 Jan: 57; 1 p. 445–451
37. Sierón, A. et al. Photodynamic therapy (PDT) using topically applied - aminolevulinic acid (ALA) for the treatment of oral leukoplakia. J. Oral Pathol. Med 2003; 32 (6):p. 330-336.
 Endereço para correspondência:
Endereço para correspondência:
Marina Stella Bello-Silva
Av. Prof. Lineu Prestes, 2777
Butantã - São Paulo – SP
05508-000
Brasil
e-mail: marinastella@hotmail.com
Recebido: jul/2015
Aceito: ago/2015













