Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.69 no.4 Sao Paulo Out./Dez. 2015
Artigo Original
Estabilidade do ácido peracético no processo de desinfecção prévia à lavagem
Peracetic acid stability in disinfection process prior to wash
Ana Carolina do NascimentoI; Albano Porto da Cunha JuniorII; Célia Regina Gonçalves e SilvaIII; Mariella Vieria Pereira LeãoIV; Silvana Soléo Ferreira dos SantosV
I Graduação em Ciências Biológicas pela Universidade de Taubaté (Unitau)
II Mestrado - Doutorando em Odontologia pela Unitau - Professor do curso de Odontologia da Universidade do Vale do Paraíba (Univap)
III Doutorado - Professora assistente III da Unitau
IV Doutorado - Professora assistente III da Unitau
V Doutorado - Professora assistente III da Unitau
RESUMO
Objetivo: Avaliar a efetividade antimicrobiana e a estabilidade de formulações de ácido peracético com (Apc) e sem inibidor (Aps) de corrosão. Materiais e Métodos: Corpos de prova em aço inoxidável foram contaminados com Staphylococcus aureus, Escherichia coli, Candida albicans, sangue e saliva e imersos em ácido peracético (Aps e Apc) por dez, quinze e trinta minutos. Após estes períodos, Apc e Aps foram neutralizados, agitados durante um minuto e a suspenção obtida foi semeada (ágar sangue), incubada (24h/37 °C) e as unidades formadoras de colônia (UFC) contadas. Este procedimento foi realizado seis vezes ao dia por 18 dias não consecutivos por um período de trinta dias. Corpos de prova contaminados e não submetidos à desinfecção foram utilizados como grupo controle. Resultados: Houve redução significativa das médias diárias de crescimento dos microrganismos para os dois grupos teste (Aps e Apc) quando comparados ao grupo controle (p= 0,0000) sem diferença estatística significativa entre eles (p= 0,7517). Conclusão: As duas soluções de ácido peracético mostraram-se eficientes no processo de desinfecção, sendo a solução sem inibidor de corrosão estável por um período maior.
Descritores: ácido peracético; reatividade-estabilidade; desinfecção; oxidação
ABSTRACT
Objective: To evaluate the stability of formulations of peracetic acid with (Apc) and without inhibitor (Aps) of corrosion in the disinfection process prior to washing. Materials and Methods: Specimens of stainless steel were contaminated with Staphylococcus aureus, Escherichia coli, Candida albicans, blood and saliva and immersed in peracetic acid (Aps and Apc) for ten, fifteen and thirty minutes. After these periods, Aps and Apc were neutralized, stirred and the suspension obtained was seeded (blood agar) incubated (24h/37°C) and colony forming units counted. This procedure was carried out six times a day for 18 consecutive days for a period of thirty days. Contaminated specimens and not disinfected were used as control group. Results: There was significant reduction in the daily growth average of microorganisms for the two test groups (Aps and Apc) when compared to control group (p = 0.0000) with no significant statistical difference between them (p = 0.7517). Conclusion: The two solutions of peracetic acid were effective in the disinfection process, with the solution without corrosion inhibitor stable for a longer period.
Descriptors: peracetic acid; reactivity-stability; disinfection; oxidation
RELEVÂNCIA CLÍNICA
A desinfecção pré-lavagem ou terminal deve ser realizada logo após o uso do instrumental, sendo uma conduta em biossegurança para minimizar o risco de contaminação do operador. Com a proibição do uso do glutaraldeído para este fim, o mesmo tem sido substituído pelo ácido peracético, considerado mundialmente como um dos mais rápidos e potentes agentes microbicidas. Por apresentar um potencial corrosivo aos instrumentais odontológicos, algumas marcas são comercializadas adicionadas de inibidores de corrosão. Assim, a efetividade antimicrobiana e estabilidade física de uma solução de ácido peracético adicionada de inibidor de corrosão foi comparada a outra sem a sua adição.
INTRODUÇÃO
A contaminação de instrumentais pelo contato com sangue e secreções durante os procedimentos médico-odontológicos é inevitável e tem relação direta com a infecção cruzada.1,2,3
Previamente a lavagem, uma desinfecção do instrumental contaminado faz-se necessária para a redução da carga microbiana e consequente redução do risco de infecção ocupacional no seu preparo para o processo de esterilização.3,4,5
Com a restrição do uso do glutaraldeído como substância desinfetante, encontrar outro produto com esta finalidade tornou- se preponderante.6 Além disto, frente as desvantagens do uso hipoclorito de sódio como agente desinfetante houve um aumento no interesse do ácido peracético7 sendo utilizado na Endodontia8, para desinfecção de moldes9, entre outros10.
O ácido peracético (acetil hidroperóxido ou ácido peroxiacético) é um líquido incolor, com pH ácido, alto teor oxidante, não corante, odor avinagrado, corrosivo para metais e que em baixas concentrações tem ação efetiva contra todos os microrganismos e esporos bacterianos e é estável em ampla faixa de temperatura (0 a 40°C) e pequenas variações de pH.11
A atividade desinfetante do ácido peracético é baseada na oxidação dos constituintes celulares, ou seja, na liberação de oxigênio ativo que interage com ligações de enxofre nas proteínas, enzimas e outros metabólitos dos microrganismos. Também interrompe a função osmótica, o transporte por lipoproteínas da membrana citoplasmática e causa deslocamento ou ruptura da parede celular, desta forma, facilitando sua ação contra microrganismos Gram-negativos. A sua ação na desnaturação de proteínas ajuda a explicar suas características esporicida e ovicida. Age também sobre as bases da molécula de DNA, além de inativar a catalase, uma enzima que neutraliza a ação dos radicais livres de hidroxila.12
As principais vantagens do ácido peracético são a biodegrabilidade, atoxicidade e a ação efetiva em matéria orgânica. Além disto, após o uso há uma rápida decomposição transformando- se em ácido acético, água e oxigênio. Para o descarte apenas a sua diluição em água e o lançamento em rede de esgoto é necessária, não necessitando cuidados especiais.6
Frente à necessidade de definir parâmetros para a utilização correta de formulações comerciais do ácido peracético, o objetivo deste trabalho foi avaliar a efetividade antimicrobiana e estabilidade física do ácido peracético, adicionado ou não de agente inibidor de corrosão, no processo de desinfecção prévia à lavagem de instrumentais.
MATERIAIS E MÉTODOS
Foram utilizados corpos-de-prova (CP) de aço inoxidável, com cinco centímetros de comprimento e dois milímetros de diâmetro. Todos os CP foram esmerilhados mecanicamente com auxílio de lixadeira (DPU 10, Panambra industrial e técnica S/A, São Paulo, SP, Brasil) para adquirir ranhuras e tiveram as bordas arredondadas.
O sangue utilizado na pesquisa foi obtido de uma mesma bolsa de sangue proveniente de um hemonúcleo, a qual não havia sido utilizada para transfusão por apresentar anticorpos clinicamente significativos contra antígenos eritrocitários (CEP Unitau nº 038/11).
Para cada dia do experimento foram coletados aproximadamente 5mL de saliva, do pesquisador, em coletor universal esterilizado descartável (J Prolab, São José dos Pinhais, PR, Brasil) e, de culturas de 24h de Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC 25922) e Candida albicans (ATCC 18804), foram preparadas suspensões em solução salina (NaCl 0,9%) esterilizada com turvação compatível ao padrão 0,5 da escala de McFarland (aproximadamente 1,5 x 108 células por mililitro) para as bactérias e 106 células por mililitro para as leveduras (contagem em câmara de Newbauer).
Em um Becker esterilizado foram adicionados 4 mL de cada suspensão microbiana, 2 mL de saliva e 0,4 mL de sangue, obtendo-se assim uma suspensão rica em amostra biológica contaminante. A cada experimento, catorze CP esterilizados foram imersos na suspensão contaminante recém-preparada por trinta minutos (Figura 1).

Em uma vasilha plástica (Plasvale, Gaspar, SC) com tampa e capacidade para 250 mL foi colocada uma solução de ácido peracético 0,25% (Proxitane alfa®, Thech Desinfecção Ltda., SP) e, em outra vasilha de mesma marca e capacidade, uma solução de ácido peracético 0,25% (Proxitane alfa®) adicionada de inibidor de corrosão (Benzotriazol 0,07g, molibdato de sódio 0,042g, fosfato dissódico 1,05g, ácido 1-hidroxietilideno 1,1 difosfônico 0,238g), para que os CP fossem submetidos ao processo de desinfecção.
Após o período de contaminação, dois CP foram transferidos com auxílio de pinça estéril para o tubo controle (contendo 8 mL de água destilada esterilizada), seis CP para a solução de ácido peracético sem adição de agente antioxidante e seis CP para a solução de ácido peracético com adição de agente antioxidante (grupos testes).
Da suspensão obtida no grupo controle, 100μL foram semeados, em duplicata, em Ágar BHI (Brain Infusion Heart, Difco, Detroit, EUA), Ágar manitol salgado (Oxoid Hampshire, England), Ágar MacConkey (Oxoid) e Ágar Sabouraud (Oxoid) adicionado de 0,1mg/mL de cloranfenicol (Quemicetina Succinato/ Carlo Erba®, Milano, MI, Itália), para contagem total dos microrganismos e das espécies contaminantes (S. aureus, E. coli e C. albicans).
Para os grupos testes, depois de cada período experimental de desinfecção (dez, 15 e trinta minutos), dois CP foram retirados de cada produto e transferidos com auxílio de pinça esterilizada para tubos de ensaio contendo pérolas de vidro (n=20) e 8mL de água destilada esterilizada adicionada de solução neutralizante específica (Tiossulfato de sódio - Na2S2O3, VETEC, em concentração de 2g/L)e submetidos a agitação (Vortex, Phoenix, Araraquara, SP, Brasil) por um minuto. Das suspensões obtidas, 100μL foram semeados, em duplicata, em Ágar BHI (Difco) para contagem total dos microrganismos.
Todas as placas foram incubadas por 48h a 37°C para contagem de unidades formadoras de colônia (UFC) por placa e cálculo de UFC por mililitro.
Todos os procedimentos da análise microbiológica foram repetidos seis vezes por dia, três a quatro vezes por semana, por 18 dias não consecutivos com as mesmas soluções desinfetantes.
O pH e concentração das soluções desinfetantes foram verificados com fitas indicadoras (Macherey-Nagel, Düren, Alemanha e Merckoquant 100-500, Merck, respectivamente) no início e final do experimento de cada dia. A temperatura de armazenagem do produto durante o período experimental e as temperaturas iniciais, máxima e final a cada dia do experimento foi verificada utilizando um termômetro analógico de ambiente com escala de -30 a +50°C (Incoterm, Porto Alegre, RS).
Para análise da variação da temperatura ambiente foi utilizada a análise de variância (ANOVA) seguida pelo teste t de Student. O teste não paramétrico de Wilcoxon foi utilizado para verificar a redução de microrganismos pelo ácido peracético (controle da acidez), considerando os tempos de exposição e o número de repetições do experimento em um mesmo dia. O teste de Mann-Whitney foi utilizado para analisar a ação do ácido peracético quando comparado o log de UFC/mL do controle com a média do log de UFC/mL, após exposição ao produto, em cada dia do experimento, independente do tempo de exposição, entre os dias do experimento. O teste de Kruskall-Wallis comparou cada tempo de exposição entre os dias do experimento. Todos os dados foram analisados considerando-se o nível de significância de 5% (p ≤ 0,05).
RESULTADOS
O mesmo volume de ácido peracético da marca Proxitane alfa®, sem adição de agente antioxidante (Aps) ou com adição de agente antioxidante (Apc) foi utilizado para desinfecção por 18 dias não consecutivos por um período de trinta dias. Ambos apresentaram concentração de 500 mg/L de ácido peracético durante todo o período experimental. Aps apresentou pH 2,0 nos dois primeiros dias e do terceiro dia até o final do experimento manteve o pH em 2,5. Já Apc manteve pH 3,0 durante todo o período experimental.
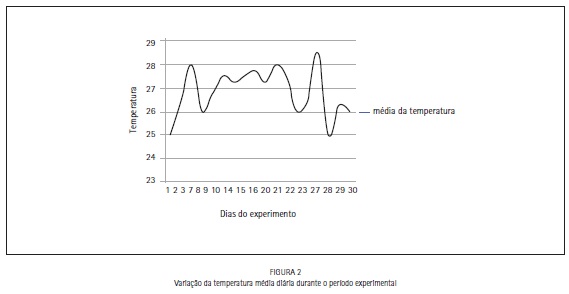
A média diária da temperatura ambiente é apresentada na Figura 2.
O logarítimo de unidades formadoras de colônia por mililitro (log de UFC/mL) para a contagem total de microrganismos, após contaminação dos corpos-de-prova, variou entre 3,38 e 4,05 (media de 3,7 e desvio padrão de 0,22). A contagem total de microrganismos (log de UFC/mL) após exposição ao Aps e Apc para cada repetição diária e tempo de exposição são apresentados nas Tabela 1 e 2 respectivamente.
Houve redução significativa de microrganismos quando comparado o log de UFC/mL do grupo controle com as médias diárias de crescimento após exposição ao Aps (p=0,0000) e ao Apc (p=0,0000). Quando comparada as médias (log de UFC/mL) diárias de crescimento depois da exposição ao ácido peracético, não houve diferença estatística significativa entre Aps e Apc (teste de Mann-Whitney, p= 0,7517).
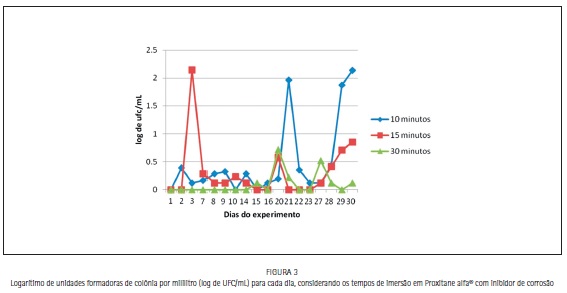
O teste de Kruskall-Wallis comparou cada tempo de exposição entre os dias do experimento. Não foram encontradas diferenças significativas para cada tempo, ou seja, para dez minutos (p= 0,132), quinze minutos (p=0,552) e trinta minutos (p= 0,132) e entre os tempos de exposição de exposição (test t de Student, p= 0,1424, Figura 3).
DISCUSSÃO
Desde o ano de 2006, a Anvisa13 preconiza, para a área odontológica, o uso do ácido peracético no processo de desinfecção após a limpeza do material. Embora seja sabido que a limpeza (lavagem com água, detergente e escova ou em lavadora ultrassônica) reduz aproximadamente 105 unidades formadoras de colônia (ufc) do contingente microbiano presente nos artigos e superfícies6, ainda há o risco de contaminação, do profissional ou de sua equipe, no processamento dos instrumentais. Pensando em minimizar este risco, é recomendável que seja realizada uma desinfecção prévia à lavagem.
De acordo com a Secretaria de Saúde do Estado de São Paulo6 a solução de ácido peracético, em uso, tem validade de até 28 dias e sua concentração deve ser monitorada com fita teste específica, diariamente ou semanalmente, porém esta recomendação aplica-se somente ao material que já passou pelo processo de limpeza. Assim este trabalho se propôs a analisar parâmetros que validem o tempo que o ácido peracético, na concentração de 0,25%, pode permanecer em uso para descontaminação prévia a lavagem, em formulação com e sem agente antioxidante.
A formulação adicionada de agente antioxidante também foi avaliada nesta pesquisa, apesar de o ácido peracético não ser corrosivo para aço inoxidável das séries 304 e 3166, porque alguns instrumentais fabricados em aço inoxidável para a Odontologia contêm pouca quantidade de cromo (elemento que confere a inoxidabilidade) e é mais susceptível ao processo de corrosão.14
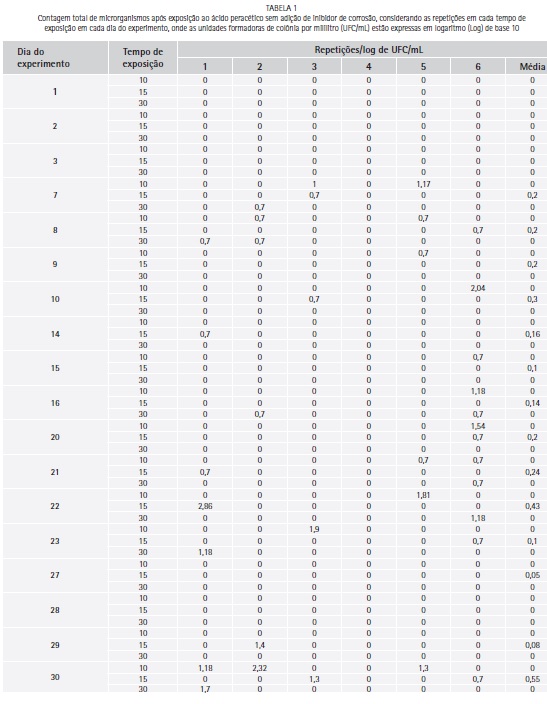
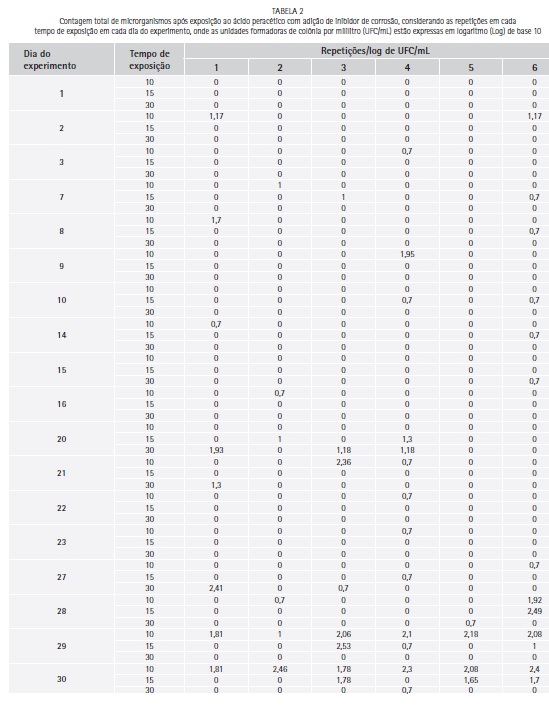
Durante todo o período experimental foi detectada uma concentração de 500 mg/L de ácido peracético no produto Proxitane alfa® na sua forma original ou quando adicionado de agente inibidor de corrosão, se mantendo dentro da faixa preconizada pela Secretaria da saúde - SP (300 a 700 mg/L) e semelhante aos resultados encontrados por Costa (2015)15 onde, o Proxitane alfa® em sua formulação original apresentou concentração de 500 mg/L no primeiro dia de experimento e de 400 mg/L nos demais dias (onze não consecutivos). Este fato foi importante, pois não houve uma diferença significativa na redução microbiana entre a formulação original e o produto adicionado de inibidor de corrosão em cada tempo ou mesmo entre os variados tempos de exposição, podendo o mesmo ser utilizado para a desinfecção prévia à lavagem pelo menor tempo avaliado (10 minutos).16,17,18
Outro fator diz respeito às variações de pH de 2 a 3 encontrados neste trabalho, favorável para o processo de desinfecção considerando que nesta faixa de pH há uma maior efetividade do produto pois o mesmo não sofre dissociação. 12
A temperatura ambiente durante o período experimental variou entre 24 e 30ºC. Como a concentração inicial do Proxitane alfa® é de 2500 mg/L (0,25%) a ocorrência da perda de concentração com a variação de temperatura não pôde ser avaliada acima de 500 mg/L, pois o indicador utilizado neste experimento mensura variações entre 100 e 500 mg/L, entretanto esta variação é possível, pois de acordo com Kunigk et al. (2001)19 o aumento da temperatura causa decomposição mais rápida da solução de ácido peracético.
No presente trabalho, o limite definido para considerar a eficácia desinfetante dos produtos foi uma redução mínima de 80% dos microrganismos. Sendo assim, o Proxitane alfa® em sua formulação original, com base nos resultados do presente trabalho, pode ser utilizado no processo de desinfecção por 22 dias (13 não consecutivos) e o produto adicionado de inibidor de corrosão por 20 dias (11 não consecutivos). Para uma redução acima de 90%, ou seja, um padrão mais rigoroso de controle, o Proxitane alfa® em sua formulação original pode ser utilizado no processo de desinfecção por 21 dias (12 não consecutivos) e o produto adicionado de inibidor de corrosão por 16 dias (dez não consecutivos).
CONCLUSÃO
A partir dos resultados do presente trabalho foi possível concluir que o Proxitane alfa® em sua formulação original demonstrou estabilidade superior ao produto adicionado de agente inibidor de corrosão no processo de desinfecção prévia a lavagem.
APLICAÇÃO CLÍNICA
A desinfecção de instrumentais é rotina no consultório odontológico, sendo o ácido peracético utilizado para este fim. O artigo demonstra a sua eficácia na desinfecção de instrumentais sem prejuízo da vida útil por conta da corrosão.
REFERÊNCIAS
1. RUTALA, W. A.; WEBER, D. J. Disinfection and sterilization in health care facilities: what clinicians need to know. Clin Infect Dis, 2004;39(5): 702-9, Sep 1. [ Links ]
2. Disinfection and sterilization: an overview. Am J Infect Control, 2013b;41(5) Suppl: S2-5.
3. SCHNEIDER, P. M. New technologies and trends in sterilization and disinfection. Am J Infect Control, 2013;41(5) Suppl: S81-6, May.
4. Current principles and practices; new research; and new technologies in disinfection, sterilization, and antisepsis. Am J Infect Control, 2013a;41(5) Suppl: S1, May.
5. SEAVEY, R. High-level disinfection, sterilization, and antisepsis: current issues in reprocessing medical and surgical instruments. Am J Infect Control, 2013;41(5) Suppl: S111-7, May.
6. São Paulo (Cidade). Secretaria da Saúde. Uso do ácido peracético na prática clínica em saúde bucal, no âmbito da Secretaria Municipal da Saúde de São Paulo – SMS-SP/ Secretaria da Saúde, Coordenação da Atenção Básica, Área Técnica de Saúde Bucal;. - São Paulo: SMS, 2011. 14p.
7. VANDEKINDEREN, I. et al. Optimization and evaluation of a decontamination step with peroxyacetic acid for fresh-cut produce. Food Microbiology, 2009;26(8): 882-888.
8. GUERREIRO-TANOMARU, J. M. et al. Antibacterial effectiveness of peracetic acid and conventional endodontic irrigants. Braz Dent J, 2011;22(4): 285-7.
9. GUIRALDO, R. D. et al. Surface detail reproduction and dimensional accuracy of stone models: influence of disinfectant solutions and alginate impression materials. Braz Dent J, 2012;23(4): 417-21.
10. WEBER, D. J.; RUTALA, W. A. Self-disinfecting surfaces: review of current methodologies and future prospects. Am J Infect Control, 2013;41(5) Suppl: S31-5, May.
11. SVDIZINSKI, A. E. et al. Eficácia do ácido peracético no controle de staphylococcus aureus meticilina resistente. Cienc Cuid Saúde. 2007, 6 (3): 312-318.
12. KITIS, M. Disinfection of wastewater with peracetic acid: A review. Enviroment. Int. 2004;30: 47-55.
13. Solvay Chemicals, INC. Proxitane 5. Safety Data Sheet. North American version. Página consultada em 11 de dezembro de 2014, http://www.solvaychemicals.us/SiteCollection- Documents/sds/P16906-USA.pdf/citation_internet.
14. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Serviços Odontológicos: Prevenção e Controle de Riscos / Ministério da Saúde, Agência Nacional de Vigilância Sanitária. – Brasília: Ministério da Saúde, 2006. Disponível em: http://www. anvisa.gov.br/servicosaude/manuais/manual_odonto.pdf
15. Solvay Chemicals, INC. Proxitane 5. Safety Data Sheet. North American version. Página consultada em 11 de dezembro de 2014, http://www.solvaychemicals.us/SiteCollection- Documents/sds/P16906-USA.pdf/citation_internet
16. COSTA, S. A. S. et al. Stability of antimicrobial activity of peracetic acid solutions used in the final disinfection process. Braz Oral Res [online]. 2015;29(1):1-6.
17. Brasil. Agência Nacional de Vigilância Sanitária. Segurança do paciente em serviços de saúde: limpeza e desinfecção de superfícies/Agência Nacional de Vigilância Sanitária – Brasília: Anvisa, 2010. 116 p. Disponível em: http://portal.anvisa.gov.br/wps/wcm/co nnect/4ec6a200474592fa9b32df3fbc4c6735/Manual+Limpeza+e+Desinfeccao+WEB. pdf?MOD=AJPERES
18. BLOCK, C. The effect of Perasafe® and sodium dichloroisocyanurate (NaDCC) against spores of Clostridium difficile and Bacillus atrophaeus on stainless steel and polyvinyl chloride surfaces. Journal of Hospital Infection, 2004;57(2): 144-148, 2004.
19. CHASSOT, A. L. C.; POISL, M. I. P.; SAMUEL, S. M. W. In vivo and in vitro evaluation of the efficacy of a peracetic acid- based disinfectant for decontamination of acrylic resins. Brazilian Dental Journal, 2006;17(2): 117-121, 2006.
20. KUNIGK, L. et al. The influence of temperature on the decomposition kinetics of peracetic acid in solutions. Braz. J. Chem. Eng. 2001;18(2): 217-220.
 Endereço para correspondência:
Endereço para correspondência:
Albano Porto da Cunha Junior
Av. Ademar de Barros, 1567
Jardim Maringá - São José dos Campos – SP
12245-010
Brasil
e-mail: jralcunha@gmail.com
Recebido: jun/2015
Aceito: jul/2015