Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.70 no.2 Sao Paulo Abr./Jun. 2016
Artigo original (convidado)
Uma nova perspectiva sobre a biologia da osseointegração
A new perspective in the biology of osseointegration
Vanessa Cristina MendesI; John E. DaviesII
I Doutora - Professora assistente da Faculdade de Odontologia, Universidade de Toronto
II Doutor - Professor Titular do Departamento de Biomateriais da Faculdade de Odontologia, Universidade de Toronto
RESUMO
O termo osseointegração refere-se à ancoragem de um implante no tecido ósseo, de forma que esse implante possa suportar carga funcional. O processo de osseointegração envolve vários mecanismos biológicos e o entendimento desses mecanismos e do papel da superfície dos implantes nesse processo, auxiliará o clínico de duas maneiras importantes: 1) na escolha dos implantes mais apropriados para os seus pacientes; e 2) no reconhecimento de problemas que possam surgir após a colocação de um implante. Nesse artigo, abordaremos uma nova perspectiva sobre a osseointegração, baseada em um trabalho recente que demonstrou que a reparação peri-implantar pode ser considerada um processo de restauração da homeostasia óssea. Esse processo representa um fenômeno universal, com vários exemplos nas ciências naturais e biológicas. O crescimento exponencial da ancoragem do implante no tecido ósseo através do tempo leva a um novo equilíbrio que pode ser representado por uma simples equação, onde dois parâmetros são importantes: 1) o valor máximo da ancoragem entre o implante e osso (novo equilíbrio tecidual) e 2) o período através do qual esse equilíbrio é adquirido. Portanto, em condições experimentais, é importante monitorar o processo de reparo por um longo período de tempo para que esse novo equilibrio seja obtido. Esse período de tempo necessário para que a hemostasia seja adquirida é descrito por um parâmetro matemático chamado "Tau", que surge como uma maneira única de quantificar e comparar a performance do processo de osseointegração dos implantes. Essa nova perspectiva sobre a osseointegração será discutida em detalhes nesse artigo.
Descritores: osseointegração; implantes dentários; implantação dentária endo-óssea; homeostase.
ABSTRACT
Osseointegration refers to the anchorage of an implant in bone, to a degree that can withstand functional loading. Osseointegration comprises several distinct biological mechanisms. An understanding these phenomena, and the role of implant surface topography in this process, will assist the clinician in two important ways: 1) It will inform their choice of the most appropriate implant designs for their patients, and 2) It will facilitate their recognition of problems that may arise after implant placement. We describe herein a new perspective on osseointegration. It is based on recent work that has demonstrated that peri-implant healing may be regarded as a restoration of bony homeostasis. Restoration of homeostasis is a universal phenomenon of which there are a multitude of examples in the natural and biological worlds. Applied to bone healing, the exponential rise in bone anchorage with time reaches the new equilibrium. This can be modeled using a simple equation where two important parameters emerge: 1) The ultimate value of implant/bone anchorage, which represents the new tissue equilibrium and 2) The rate at which this equilibrium is reached. Thus, experimentally, it is important to monitor healing over a relatively long time so that the new bony equilibrium, can be achieved. However, the rate at which homeostasis is reached, described by a single mathematical parameter "tau", emerges as a unique means by which the osseointegration performance of implants can be quantified and compared. This new perspective on osseointegration will be discussed in more details herein.
Descriptors: eointegration; dental implants; dental implantation, endosseous; homeostasis.
RELEVÂNCIA CLÍNICA
A relevância clínica desse artigo fundamenta-se no entendimento dos mecanismos biológicos da osseointegração dos implante dentários e de como esse conhecimento poderá auxiliar o clínico na escolha de implantes mais apropriados para os seus pacientes, assim como no reconhecimento de problemas que possam surgir após a colocação de um implante.
INTRODUÇÃO
Osseointegração: processo de reparo ou rejeição?
Osseointegração é um termo que pode ser utilizado para descrever a ancoragem de um implante endósseo, suficiente para suportar cargas funcionais. A osseointegração de um implante é vital para o seu sucesso clínico, portanto, para que seja possível dissecar os mecanismos da osseointegração, é fundamental que se entenda o processo natural de osteogênese (formação óssea) durante os períodos de regeneração e remodelação óssea.
Como os implantes são inseridos no tecido ósseo, uma das abordagens para explicar o fenômeno da osseointegração considera esse processo como sendo parte do mecanismo relacionado à reparação de injúrias ósseas. De fato, vários autores estabeleceram semelhanças entre o processo de reparação peri-implantar endo-ósseo e o processo de reparo de fraturas.1 Essa abordagem tem a vantagem de ser fundamentada em um modelo geral de reparação tecidual, que engloba alguns processos fundamentais comuns ao reparo da maioria dos tecidos, como por exemplo, a resolução do coágulo sanguíneo no local da injúria, a necessidade da formação de novos vasos sanguíneos (angiogênese), e a importância das células perivasculares como fonte de células-tronco mesenquimais presentes nos tecidos. Essa abordagem, que considera os aspectos fundamentais, ou comuns, do processo de reparo de feridas, nos levou recentemente a elaborar uma nova perspectiva para entender o processo de reparo de forma geral, e a osseointegração de forma particular. Essa nova proposta está fundamentada na restauração da homeostasia tecidual e será abordada nesse artigo.
Recentemente, no entanto, foi proposta na literatura outra abordagem, radicalmente diferente da descrita acima, que surgiu da ideia de que a osseointegração é o resultado de uma resposta imunológica contra o implante.2 Existem fatores importantes que são comuns a essas duas abordagens (processo de reparo vs. reação imunológica contra o implante), como por exemplo, as interações iniciais do sangue com a superfície do implante. No entanto, essas duas linhas de pensamento são divergentes quando se considera a inevitável resposta inflamatória aguda. A inflamação aguda, causada pelo trauma cirúrgico ao tecido, provoca uma intrincada resposta imune adaptativa que poderá resultar em uma rápida resolução da lesão, mesmo na presença de infecção. No entanto, a inflamação aguda também poderá transicionar para uma resposta crônica, caracterizada pelo recrutamento de células gigantes de corpo estranho.3 Essa sequela crônica pode ser exemplificada pela presença de um espinho encravado em tecido mole e encapsulado por tecido fibroso, o qual em algum momento, poderá ser expulso do organismo como corpo estranho. O "encapsulamento" de um implante pelo tecido ósseo foi sugerido como sendo outro exemplo de sequestro pelo tecido conjuntivo4, no entanto, é importante considerar que a presença de células gigantes de corpo estranho nesse ambiente seria um indicador claro da rejeição do implante pelo organismo. Portanto, o seguinte questionamento é inevitável: a integração de um implante endo-ósseo seria o resultado de uma resposta reparativa do organismo, que resultaria no restabelecimento da homeostasia, ou seria uma tentativa do organismo de sequestrar, ou rejeitar um corpo estranho? O enorme sucesso clínico dos implantes dentários endo-ósseos indica que a primeira opção seria uma suposição mais razoável, além dessa também estar contida no conceito de Raghavendra, frequentemente citato na literatura para ilustrar a transição entre a estabilidade primária e secundária de um implante dentário durante o processo de osseointegração. 5
Duas lições importantes sobre o processo de remodelação óssea
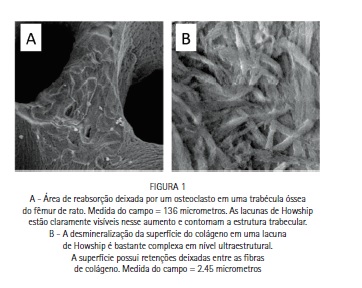
Existem dois conceitos críticos que surgiram a partir do nosso entendimento sobre o fenômeno natural de remodelação óssea, e que também são relevantes para o entendimento da osseointegração. O primeiro conceito está relacionado à topografia da superfície do tecido ósseo remanescente após reabsorção por um osteoclasto. Essa topografia é tridimensional e complexa em três escalas distintas: 1) sub-micrométrica (em inglês: "sub-micron scale"), representada pela superfície óssea exposta após desmineralização das fibras de colágeno orientadas em vários planos; 2) micrométrica (em inglês: "micron scale"), representada por lacunas individuais de Howship; e 3) a escala micrométrica grosseira (em inglês: "coarse-micron scale"), representada pela profundidade de reabsorção da superfície óssea por grupos de osteoclastos e também pela complexidade tridimensional dessa superfície (Figura 1).6
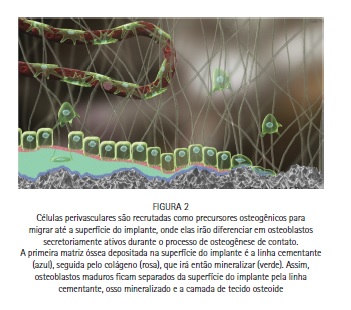
O segundo conceito refere-se às células osteogênicas que irão se diferenciar em osteoblastos e secretar matriz óssea sobre a superfície do implante durante o processo de osteogênese por contato. Essas células osteogênicas são derivadas de células perivasculares (em inglês: "perivascular cells" or "pericytes"), localizadas ao redor das paredes dos vasos sanguíneos presentes na área de remodelação óssea, ou na região peri-implantar durante o processo de reparo. Crisan et al. (2008)7 demonstraram que as células perivasculares representam uma fonte ubíqua de células mesenquimais progenitoras em todos os órgãos do organismo. Sabemos que essas células migram através da região peri-implantar para povoar a superfície do implante, sobre a qual elas irão diferenciar e elaborar uma nova matriz óssea (Figura 2). De forma semelhante, células perivasculares migram da parede dos vasos sanguíneos contidos nos canais Haversianos para a superfície do túnel de reabsorção óssea, com objetivo de produzir [novo] tecido ósseo lamelar durante o processo natural de remodelação.
Um pequeno resumo sobre os mecanismos de reparação peri-implantar
As várias definições publicadas para "osseointegração" atestam para o fato de que um único termo não consegue abranger a cascata de eventos biológicos que resulta na ancoragem de um implante inanimado (normalmente metálico) no tecido ósseo vivo. O processo de osseointegração pode ser subdividido em três fases distintas, mas que se sobrepõem em algum momento: 1) osteocondução, 2) formação óssea e 3) remodelação óssea.8,9
Osteocondução
O processo de osteocondução foi definido como sendo o recrutamento e a migração de células osteogênicas para a superfície de um implante.8 Como mencionado acima, esse mesmo fenômeno ocorre durante o processo natural de remodelação óssea, quando uma população de células perivasculares [osteogênicas] migra dos vasos sanguíneos neoformados para a superfície óssea deixada pelos osteoclastos. A diferença entre remodelação óssea e reparação peri-implantar é a presença do coágulo sanguíneo. Dessa forma, em ambos os casos, a angiogênese precede a osteogênese, uma vez que sem angiogênese, as células osteogênicas não seriam levadas para os sítios de reparo ou remodelação. À medida que as células perivasculares [osteogênicas] migram para a superfície do implante durante o processo de osteocondução, elas se diferenciam para tornarem-se secretoriamente ativas e depositar matriz óssea diretamente sobre a superfície do implante. É importante ressaltar que são necessários vários dias até que as células osteogênicas atinjam a superfície do implante, e durante esse processo, essa superfície sofre várias modificações em nível molecular, através da adsorção de proteínas do soro sanguíneo e da atividade de uma infinidade de células do sangue. Dessa forma, a composição química da superfície do implante torna-se radicalmente diferente daquela de quando o implante foi empacotado, esterilizado e recebido pelo clínico antes da cirurgia.
Formação e adesão óssea
O tecido ósseo é composto por uma matriz extracelular mineralizada de colágeno e contém osteócitos em sua estrutura. No entanto, os osteoblastos, antes de sua completa diferenciação, elaboram uma matriz extracelular mineralizada que não contém colágeno. Essa matriz foi chamada de "linha cementante" (em inglês: "cement line") por von Ebner em 1875. A linha cementante (mineralizada e sem colágeno) ocupa a interface que está constantemente sendo criada entre o osso "antigo" (reabsorvido) e o tecido ósseo neoformado, no processo natural de remodelação óssea que ocorre durante a vida de um individuo. As células osteogênicas que formam a linha cementante inicialmente secretam proteínas não colagenosas no espaço extracelular. Essas proteínas, antes de serem mineralizadas, espalham-se por irregularidades e retenções presentes na superfície sobre a qual elas foram depositadas8 [de forma semelhante, na odontologia, ao vazamento de gesso (antes da presa) em um molde de alginato]. As fibras colágenas ficam aderidas à essa linha cementante que forma uma interface entre o osso "antigo" e o osso neoformado, como von Ebner havia suposto. A mesma condição ocorre na superfície de um implante que apresenta retenções em sua topografia, e uma vez mineralizada, a linha cementante ficará fortemente aderida a essa superfície. Esse fenômeno é conhecido como adesão óssea, ou em inglês: "bone bonding".10,11
No entanto, é importante destacar que essa interface "verdadeira", que ocorre entre a linha cementante e o tecido ósseo reabsorvido (no processo de remodelação óssea) ou a superfície do implante, acontece em uma escala nanométrica e não é suficiente para aguentar carga funcional. De fato, as linhas cementantes do tecido ósseo foram consideradas interfaces "fracas"12 e a resistência à carga biomecânica têm sido atribuída à estrutura tridimensional complexa do colágeno mineralizado, tanto em escala micrométrica quanto em relação à arquitetura do tecido ósseo.13,14
Ancoragem óssea
Enquanto a osseointegração pode ser descrita como sendo a ancoragem funcional de um implante no tecido ósseo, precisamos definir o termo "ancoragem". Funcionalmente, ancoragem representa a resistência de um implante endo-ósseo contra remoção. Pode-se imaginar que espaços vazios de qualquer tamanho e forma na superfície do implante, que permitam a deposição de tecido ósseo em seu interior, irão oferecer algum tipo de resistência à remoção do implante (utilizando-se força de tração ou de tensão). Se, de forma hipotética, um implante possuir grandes poros em sua superfície, que possibilitariam o crescimento ósseo em seu interior, a resistência contra a remoção desse implante (ancoragem) seria maior do que a resistência contra a remoção de um implante sem os mesmos poros. Para que esse primeiro implante seja removido, o tecido ósseo tenderá a fraturar próximo a um plano localizado na região mais externa desses poros, ao invés de separar na interface direta osso/ implante. Isso acontece sem que o tecido ósseo precise estar aderido ("bonded") à superfície do implante. Nesse contexto, podemos ressaltar a observação de Brånemark, em 1983, que menciona: "Esforços para remover os implantes levaram a fraturas no tecido ósseo dos maxilares, per se, e não na interface".15
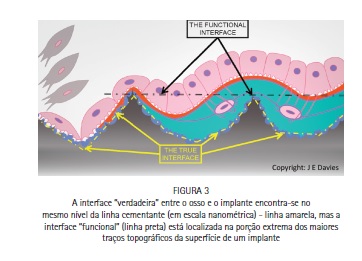
Portanto, "ancoragem" pode ser diferenciada de "adesão" ("bonding"), uma vez que adesão refere-se à interface direta entre o tecido ósseo e a superfície do implante (em escala nanométrica). Em resumo, a adesão óssea ("bone bonding") ocorre apenas na interface "verdadeira" do osso com a superfície do implante, enquanto a ancoragem óssea, sob carga funcional, é determinada pelas características topográficas da superfície do implante em maior escala (micrométrica e supra-micrométrica), as quais delimitam a interface "funcional" (Figura 3).
O papel do desenho da superfície do implante
Durante as últimas três décadas, ficou claro que o desenho da superfície do implante pode provocar um grande impacto no processo de reparação peri-implantar e na ancoragem óssea funcional. Sabemos que esse desenho, representado por características topográficas em escala nano ou micrométrica, possui um papel significante nos estágios iniciais da reparação peri-implantar. O trabalho de Buser et al.16 trouxe uma contribuição significativa à literatura e os autores concluíram que "Superfícies de implantes rugosas geralmente demonstraram um aumento na deposição óssea em comparação com superfícies polidas ou menos complexas". No entanto, é importante ressaltar também o trabalho de Wong et al.17 que demonstrou "que medidas percentuais da cobertura de implantes são indicadores menos sensíveis relacionados à osseointegração do que os testes mecânicos." Dessa forma, a utilização de um teste funcional para a avaliação da osseointegração de um implante endo-ósseo é considerada mais importante do que a quantidade limitada de dados que se pode obter medindo o contato entre o tecido ósseo e o implante (em inglês: "bone/implant contact" – BIC) em cortes histológicos. Essa foi uma conclusão importante do trabalho desses autores, pois está relacionada de uma forma muito próxima com a realidade clínica, onde apenas métodos físicos (análise da frequência de ressonância, torque reverso, ou manipulação digital) podem ser empregados para a avaliação da osseointegração.
Essa ênfase inicial na rugosidade das superfícies de implante resultou na publicação de vários estudos que caracterizaram as superfícies através de métodos que geram parâmetros matemáticos comparativos de rugosidade. Apesar de se entender facilmente a influência da rugosidade da superfície de um implante na força necessária para rompê-lo do tecido ósseo18, esses parâmetros de rugosidade não oferecem qualquer esclarecimento sobre os mecanismos biológicos relacionados à ancoragem óssea. No entanto, o desenho da topografia da superfície de um implante tem uma importância clara e presente, pois quase todos os fabricantes, e muitos outros que utilizam implantes metálicos, modificam suas superfícies com a intenção de acelerar a reparação peri-implantar e melhorar a ancoragem óssea.
Restauração da homeostasia
A nossa nova abordagem considera o processo de reparação peri-implantar endo-ósseo como sendo o restabelecimento de um novo equilíbrio tecidual, ou homeostasia. A literatura confirma que existe uma grande quantidade de informação disponível no campo das ciências naturais relacionada à restauração da homeostasia. Alguns exemplos podem ser tão variados como a restauração dos estoques de peixes em locais onde a pesca foi proibida19, ou a recuperação da massa óssea de astronautas após o retorno às condições gravitacionais da Terra.20
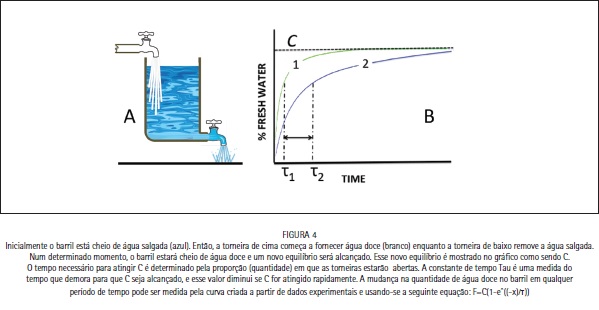
Esses exemplos de restauração da homeostasia podem ser modelados matematicamente através de uma abordagem comum, e são descritos pelas curvas assintóticas que se aproximam das isotermas de Langmuir.21 No entanto, detalhes matemáticos não são importantes aqui, pois gostaríamos apenas de ilustrar um princípio geral (veja as funções relevantes na legenda da Figura 4). Então, em essência, um aumento na medida de uma variável levará a um crescimento exponencial até que um platô, ou limite, seja atingido. Uma analogia para ilustrar esse conceito poderia ser feita com a utilização de um barril cheio de água salgada, como mostrado na Figura 4A. A homeostasia seria uma condição em que ambas as torneiras estariam simultaneamente fornecendo água salgada e esvaziando o barril na mesma proporção. Agora, imagine que a torneira que fornecia a água salgada, passe então a fornecer água doce. Após certo período de tempo, o barril estará recebendo apenas água doce e um novo equilíbrio será alcançado quando as duas torneiras estiverem simultaneamente fornecendo água doce e esvaziando o barril na mesma proporção. A mudança (aumento) na quantidade de água doce dentro do barril, através do tempo, é representada pelas curvas no gráfico da Figura 4B. No entanto, a taxa de fornecimento de água doce para que o platô da curva seja atingido, irá depender inteiramente da proporção (quantidade) que as torneiras estiverem abertas – o tempo poderá ser longo ou curto. Além disso, a quantidade de tempo que leva para que ocorra essa mudança de água salgada para a água doce, chamada de constante do tempo – que convencionalmente recebe a letra grega Tau "τ" – é definida como sendo o tempo necessário para que o valor medido aumente até atingir 63.2% do [platô] máximo. Dessa forma, "τ" irá depender da quantidade em que as torneiras estiverem abertas (assumindo-se que ambas as torneiras estejam abertas ou fechadas na mesma proporção). Essa mesma constante de tempo é utilizada em muitos outros fenômenos biológicos e os exemplos variam desde a farmacocinética, onde "τ" representa a taxa média de retenção de uma droga22, até a neurociência, onde "τ" é a constante que representa o aumento do potencial de ação de um neurônio.23
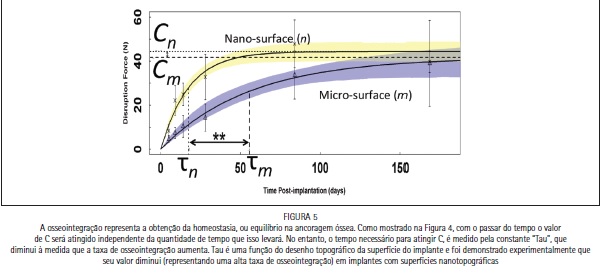
Demonstramos recentemente que essa mesma relação pode ser aplicada à osseointegração.24 Como mencionado acima, não existem dúvidas de que a osseointegração representa a restauração da homeostasia, ou em outras palavras, à medida em que a reparação óssea progride, o equilíbrio é alcançado. Investigamos o desenvolvimento desse equilíbrio através de testes mecânicos para avaliar a ancoragem de implantes no tecido ósseo em função do tempo. O aumento da ancoragem através do tempo seguiu uma curva exponencial e alcançou um platô (Figura 5), da mesma forma que foi descrito na Figura 4. Espera-se que a altura desse platô ("C" – força necessária para romper o modelo) seja modificada pelo tipo de tecido ósseo e sua microarquitetura, e dessa forma, irá variar em implantes testados em osso imaturo de animais, ou em osso lamelar humano – ou até mesmo entre o osso lamelar e trabecular. No entanto, o que surgiu desse trabalho experimental foi que a constante de tempo "τ" não depende da metodologia do teste, mas do desenho da topografia da superfície do implante. Mais especificamente, quando comparamos um implante contendo uma topografia de superfície nanotexturizada com outro que possui uma topografia de superfície microtexturizada, "τnano" foi significantemente menor do que "τmicro" (veja τn and τm na Figura 5), indicando que a superfície com nanotopografia provocou um aumento significante na taxa de osseointegração em comparação com a superfície microtopográfica. O mais importante, no entanto, e que está de acordo com dados clínicos publicados, é que com o passar do tempo, ambas as superfícies adquirem o mesmo equilíbrio e platô.
Dois parâmetros críticos: "C" e "τ" surgem através dessa nova abordagem experimental e do preparo das curvas assintóticas (utilizando a equação descrita na Figura 4). Ao mesmo tempo em que um valor alto de "C" representa uma ancoragem robusta entre o implante e o tecido ósseo, quanto mais baixo o valor de "τ", mais rápido essa ancoragem será obtida. Assim, enquanto esses dois parâmetros são importantes, o valor de Tau é o que representa a taxa de osseointegração de um implante. Considerando que esse parâmetro, calculado a partir de dados experimentais, fornece informação imediata sobre o potencial de osseointegração da superfície de um implante, e considerando também que "τ" é uma função do desenho da superfície do implante, o Tau surge como o primeiro parâmetro matemático que poderá ser utilizado para comprar o potencial de osseointegração de superfícies de implantes com diferentes desenhos topográficos.
CONCLUSÃO
De forma geral, atualmente já se conhece bastante sobre a biologia básica relacionada à osseointegração. Esse entendimento surgiu quase que inteiramente a partir do conhecimento sobre o processo de remodelação óssea natural e sobre a complexidade da interface formada entre o osso remanescente (reabsolvido por osteoclastos) e o osso neoformado. Esse conhecimento fundamenta o entendimento sobre a importância do desenho topográfico da superfície de implante no processo de osseointegração e, em particular, como a osseointegração pode ocorrer em todos os tipos de tecido ósseo, uma vez utilizada a superfície de implante mais apropriada para cada caso.
Os aspectos mais importantes da osseointegração acontecem antes da formação óssea, ou em escalas métricas inacessíveis até mesmo às técnicas radiográficas mais modernas. Dessa forma, o entendimento da biologia óssea básica da osseointegração fornece não apenas a oportunidade para uma análise racional sobre a escolha de desenhos específicos de superfícies de implantes mais adequadas para os pacientes, mas também nos permite começar a entender os problemas que possam surgir após a colocação de um implante no tecido ósseo.
REFERÊNCIAS
1. Kuzyk PRT, Schemitsch EH, Davies JE. A biodegradable scaffold for the treatment of a diaphyseal bone defect of the tibia. J Orthop Res. 2010;28(4):474–80.
2. Trindade R, Albrektsson T, Wennerberg A. Current concepts for the biological basis of dental implants: foreign body equilibrium and osseointegration dynamics. Oral Maxillofac Surg Clin North Am. 2015;27(2):175–83.
3. McNally AK, Anderson JM. Macrophage fusion and multinucleated giant cells of inflammation. Adv Exp Med Biol. 2011;713:97–111.
4. Donath K, Laall M, Giinzl H-J The histopathology of different foreign-body reactions in oral soft tissue and bone tissue. Virchows Archiv: Pathol Anat 1992;420:131-137.
5. Raghavendra S, Wood MC, Taylor TD. Early wound healing around endosseous implants: a review of the literature. Int J Oral Maxillofac Implants. 2005;20(3):425–31.
6. Davies JE. Basic biology of osseontegration. In: Tamimi D, editor(s). Specialty imaging: Dental implants. 1st ed. (US): Amirsys Inc. 2014:2-9.
7. Crisan M, Yap S, Casteilla L, Chen C-W, Corselli M, Park TS, et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell Stem Cell. 2008;3(3):301–13.
8. Davies JE. Mechanisms of endosseous integration. Int J Prosthodont 1998;11(5):391–401.
9. Davies JE. Understanding peri-implant endosseous healing. J Dent Educ. 2003;67(8):932–49.
10. Davies JE. Bone bonding at natural and biomaterial surfaces. Biomaterials. 2007;28(34):5058–67.
11. Mendes VC, Moineddin R, Davies JE. The effect of discrete calcium phosphate nanocrystals on bone-bonding to titanium surfaces. Biomaterials. 2007;28(32):4748–55.
12. Brunski JB. In vivo bone response to biomechanical loading at the bone/dental-implant interface. advances in dental research. SAGE Publications. 1999;13(1):99–119.
13. Tai K, Dao M, Suresh S, Palazoglu A, Ortiz C. Nanoscale heterogeneity promotes energy dissipation in bone. Nat Mater. 2007;6(6):454–62.
14. Lakes R. Materials with structural hierarchy. Nature. 1993;361(6):511–5.
15. Brånemark PI. Osseointegration and its experimental background. J Prosthet Dent. 1983;50(3):399–410.
16. Buser D, Schenk RK, Steinemann S, Fiorellini JP, Fox CH, Stich H. Influence of surface characteristics on bone integration of titanium implants. A histomorphometric study in miniature pigs. J Biomed Mater Res.1991;25(7):889–902.
17. Wong M, Eulenberger J, Schenk R, Hunziker E. Effect of surface topology on the osseointegration of implant materials in trabecular bone. J Biomed Mater Res. 1995 Dec;29(12):1567–75.
18. Gotfredsen K, Berglundh T, Lindhe J. Anchorage of titanium implants with different surface characteristics: an experimental study in rabbits. Clin Implant Dent Relat Res. 2000;2(3):120–8.
19. McClanahan TR, Graham NAJ, Calnan JM, MacNeil MA. Toward pristine biomass: reef fish recovery in coral reef marine protected areas in Kenya. Ecological Applications. 2007;17(4):1055–67.
20. Sibonga JD, Evans HJ, Sung HG, Spector ER, Lang TF, Oganov VS, et al. Recovery of spaceflight-induced bone loss: Bone mineral density after long-duration missions as fitted with an exponential function. Bone. 2007;41(6):973–8.
21. Langmuir I. The constitution and fundamental properties of solids and liquids. Part I. Solids. J Am Chem Soc. 1916;38(11):2221–95.
22. Cheng HY, Jusko WJ. Mean residence time concepts for pharmacokinetic systems with nonlinear drug elimination described by the Michaelis-Menten equation. Pharm Res. 1988;5(3):156–64.
23. Rall W. Time constants and electrotonic length of membrane cylinders and neurons. Biophys J. 1969;9(12):1483–508.
24. Liddell R, Ajami E, Davies JE. Tau "τ": A new parameter to assess the osseointegration potential of an implant surface. 2016; In press.
 Endereço para correspondência:
Endereço para correspondência:
Vanessa C. Mendes - Faculdade de Odontologia
Universidade de Toronto
University of Toronto
170 College Street (Mining Building), room 330
Toronto, Ontario
M5S 3E3
e-mail: vanessa.mendes@dentistry.utoronto.ca
Recebido: mar/2016
Aceito: abr/2016













