Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RPG. Revista de Pós-Graduação
versão impressa ISSN 0104-5695
RPG, Rev. pós-grad. vol.17 no.3 São Paulo Jul./Set. 2010
ARTIGOS ORIGINAIS ORIGINAL ARTICLES
Avaliação da capacidade de descontaminação da terapia fotodinâmica no pós-operatório imediato de implantes: estudo piloto
Efficiency of photodynamic therapy in the immediate postoperative of dental implants: pilot study
João Eduardo Miranda FrancoI; Silvana CaiII; Luiz Antonio Pugliesi Alves de LimaIII; Alyne Simões GonçalvesIV; Tomie Nakakuki de CamposV
IMestrando em Prótese Dentária pela Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP
IIProfessora Doutora do Departamento de Microbiologia do Instituto de Ciências Biomédicas da Universidade de São Paulo (ICB-USP) – São Paulo/SP
IIIProfessor Associado do Departamento de Estomatologia da Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP
IVProfessora Doutora do Departamento de Materiais Dentários da Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP
VProfessora Titular do Departamento de Prótese Dentária da Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP
RESUMO
Em todo ato cirúrgico para instalação de implantes dentários ocorre uma contaminação inerente ao procedimento que pode prejudicar a cicatrização. Este projeto foi proposto para encontrar uma forma de reduzir a microbiota da área peri-implantar com a terapia fotodinâmica (PDT, do inglês photodynamic therapy). Após triagem (critérios de inclusão: normorreativos, com espaço intercalar superior, sem histórico de doença periodontal grave), cinco pacientes foram selecionados e reabilitados com implantes Standard Plus da Straumann®. Ao término da cirurgia, uma primeira coleta microbiológica peri-implantar foi efetuada (controle). Aplicou-se o corante azul de metileno a 0,005% por 5 minutos. Em seguida, a área peri-implantar foi irradiada com laser diodo de baixa potência (AsGaAl, 660 nm, 40mW), por 2 minutos, totalizando 120 J/cm2 de densidade de energia, dividida em 4 pontos (2 na vestibular e 2 na palatina). Ao término da PDT, outra coleta microbiológica foi realizada (teste). Todo o material coletado passou pelo seguinte processo: diluições seriadas; semeadura em meios de cultura; incubação em meio anaeróbio por sete dias e contagem do número de unidades formadoras de colônias totais (UFC). O teste estatístico de Wilcoxon mostrou haver diferença significante (p < 0,001) na redução bacteriana para as UFC, tendo como mediana dessa redução 93,67%. Os resultados permitem afirmar que a PDT é um método eficaz de descontaminação da área cirúrgica no pós-operatório imediato de implantes dentários.
Descritores: Implante dentário. Microbiologia. Descontaminação. Terapia a laser de baixa intensidade. Terapia fotodinâmica.
ABSTRACT
In most of the dental surgical procedures to insert an implant fixture, there is an inherent contamination related, which may impair the healing process. This project has the goal to propose a way to reduce the microbial peri-implant area through photodynamic therapy (PDT). After the selection of patients (criteria: normoreactive patients, presenting intercalate superior space, with no history or signs of advanced aggressive periodontitis), five patients were selected and rehabilitated via Standard Plus implants (Straumann®). After the surgery, the first microbial peri-implant samples were collected (control), then methylene blue (0,005%) was applied for 5 minutes followed by diode laser light (GaAlAs, 660 nm, 40 mW) for 2 minutes, totalizing 120 J/cm2 of energy density, divided in 4 points (2 at the vestibular and 2 at the palatal). By the end of the PDT, another microbial collection was carried out (test). After dilutions, the culture media were incubated in an anaerobiosis atmosphere for a week, and then the counting of total colony-forming units (CFU) was performed. The Wilcoxon signed-rank test showed a significant difference (p < 0,001) in the bacterial reduction for CFU, with average of 93,67%. The results allow us to declare that PDT is an effective method of decontamination of the surgical area for the immediate postoperative of dental implants.
Descriptors: Dental implantation. Microbiology. Decontamination. Laser therapy, low-level. Photochemotherapy.
Introdução
A busca por tratamento mais rápido e confortável para os pacientes levou à criação do protocolo de implantes não submersos, o que evita uma segunda intervenção cirúrgica (reabertura dos implantes), acelerando a instalação da prótese provisória. Nessa técnica, o processo de osseointegração e a cicatrização peri-implantar ocorrem ao mesmo tempo. A penetração dos implantes não submersos através da mucosa oral, situada em ambiente oral com microbiota diversificada e outros possíveis contaminantes, cria um problema muito delicado. Portanto, as condições dos tecidos moles são fundamentais durante o período de cicatrização do implante e da manutenção a longo prazo30-31.
Imediatamente após a cirurgia de instalação do implante não submerso, forma-se um coágulo que ocupa o espaço entre a mucosa e o implante, e entre a mucosa e o processo alveolar, infiltrado por numerosos granulócitos e neutrófilos. Um selamento da mucosa inicial é estabelecido durante essa fase pelo agrupamento de leucócitos em uma densa rede de fibrina5,17.
Alguns autores11,15 mostraram que a colonização por micro-organismos no sulco peri-implantar ocorre muito precocemente, logo após a cirurgia de instalação dos implantes não submersos.
Essa colonização inicial segue um modelo, com a adesão de colônias primárias, formando a película adquirida. Em seguida, os colonizadores secundários fixam-se através da adesão interbacteriana15 que, juntos, criam um biofilme. Esse, por sua vez, promove uma proteção para as bactérias contra agentes antimicrobianos, dificultando sua remoção com a higienização oral15.
O quadro é mais desfavorável para pacientes parcialmente edentados, nos quais, mesmo em condição clinicamente saudável, os tecidos peri-implantares podem apresentar bactérias periodontopatogênicas12. Dentre elas, citam-se: Porphyromonas gingivalis, Prevotella intermédia, Bacteroides forsythus, Peptostreptococcus micros, Campylobacter rectus, Fusobacterium nucleatum, Treponema denticola (anaeróbios estritos), Actinobacillus actinomycetemcomitans (anaeróbio facultativo)12. Isso ocorre porque os dentes funcionam como um reservatório de bactérias que, por sua vez, colonizam o sulco peri-implantar, exigindo um ótimo controle de higienização7,9,11-12.
Contudo, na maioria dos casos, durante o processo inicial de osseointegração, a higienização não é realizada adequadamente por receio do paciente de traumatizar a área cirúrgica15. Assim, são favorecidos a colonização e o crescimento microbiano15, especialmente de Gram-negativos, devido ao aumento do exsudato gengival, à presença de sangue e a uma menor tensão de oxigênio no ambiente12. Portanto, o controle de placa é fundamental na manutenção e estabelecimento da barreira tecidual dos implantes14.
Visando minimizar a contaminação, são realizados controles pré e pós-operatórios, por meio do uso profilático de antimicrobiano (antibiótico de amplo espectro)12 e enxaguatórios bucais. Porém, a utilização de desinfectantes antibacterianos e de antibióticos sistêmicos, que podem aumentar a resistência bacteriana23, consegue a remoção completa das bactérias da região peri-implantar15.
Segundo Furst et al.15, a clorexidina, utilizada como enxaguatório bucal antes da cirurgia e durante a primeira semana pós-cirurgia, é ineficiente na prevenção do estabelecimento de uma microbiota potencialmente patogênica ao redor tanto dos dentes quanto dos implantes.
O laser de baixa potência, quando associado a um fotossensibilizador, ativa o mesmo, que passa a absorver os fótons, convertendo-se em um estado excitado. É possível que a energia transferida para as moléculas vizinhas resulte na formação de moléculas reativas, como o oxigênio singleto, os íons superóxidos, as hidroxilas e outros radicais livres, que podem danificar ou matar as células bacterianas33, além de neutralizar os fatores de virulência presentes após a morte bacteriana6. Esse processo é conhecido como terapia fotodinâmica ou PDT (photodynamic therapy).
A terapia apresenta como vantagens ser um método não invasivo que não apresenta evidência de promover resistência bacteriana, que tem baixo custo quando comparado ao laser de alta potência, sem efeitos colaterais, além de agir seletivamente na área de aplicação6,16,23,28.
Objetivo
Avaliar o efeito da terapia fotodinâmica sobre a microbiota do sulco peri-implantar no pós-cirúrgico imediato de implantes, a fim de reduzi-la e, assim, favorecer o sucesso da reabilitação oral por implantes osseointegrados.
Material e métodos
Após a aprovação do Comitê de Ética em Pesquisa, iniciou-se a seleção dos sujeitos de pesquisa junto ao Departamento de Prótese da Faculdade de Odontologia da Universidade de São Paulo (FOUSP). Os critérios de inclusão e exclusão estão discriminados na Tabela 1.
Participaram da pesquisa 5 pacientes, 2 homens e 3 mulheres, com idade média de 43,8 anos. Todos foram submetidos à cirurgia para instalação de implante de um estágio cirúrgico (Standard Plus da Straumann® Dental Implant System).
Foi administrado amoxicilina 500 mg, de 8 em 8 horas, por 7 dias, medicação iniciada um dia antes da cirurgia, e paracetamol 750 mg de 8 em 8 horas durante 5 dias, iniciada depois da cirurgia. Todas as cirurgias de instalação dos implantes foram realizadas pelo mesmo cirurgião sob anestesia infiltrativa com cloridrato de bupivacaína 0,5% e adrenalina 1:200.000 (sal anestésico do grupo amida com vaso constritor). Uma assepsia extraoral foi feita com uma solução de Clorexidine a 2% e intraoral de 0,12% como bochecho.
A instalação dos implantes ocorreu de acordo com o protocolo do fabricante, a uma distância de pelo menos 1,5 mm de osso ao redor do implante e 1,5 mm das raízes dos dentes vizinhos, com a linha rugosa/lisa do implante colocada ao nível da crista óssea. Os tecidos foram reposicionados e suturados de modo que o parafuso de cobertura ficasse completamente exposto.
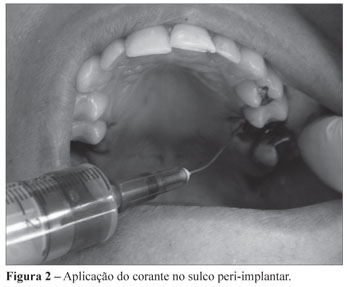
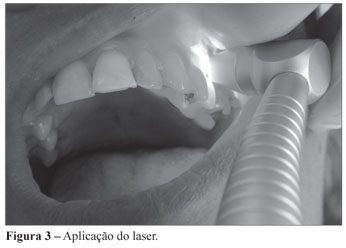
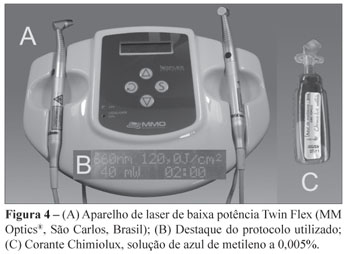
Decorrido período pós-cirúrgico de 30 minutos, foi realizada uma coleta no sulco peri-implantar, em isolamento relativo, pela inserção de 4 cones de papel estéril por 20 segundos (Figura 1). Quando removidos, os cones foram imediatamente transferidos para frascos, contendo 2 mL de meio de transporte VMGA III (Viability Medium Goteborg Anaerobically). Em seguida, foi feita a aplicação da PDT. Sob isolamento relativo, o sulco peri-implantar foi irrigado com 1 mL de solução de azul de metileno a 0,005% por 5 minutos (Figura 2) e aplicações pontuais, com laser de baixa potência (Figura 3) de comprimento de onda de 660 nm, através de irradiação contínua de 120 J/cm2 de densidade de energia dividida em 4 pontos de 30 J/cm2 por implante (dois na vestibular e dois na palatina), 30 segundos por ponto, numa potência de 40 mW (Figura 4).
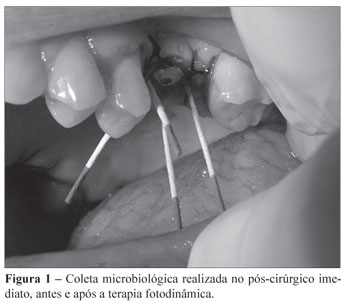
Uma nova coleta, com os mesmos procedimentos acima citados, foi realizada após aplicação da terapia (Figura 1).
Alíquotas de 100 mL de cada amostra foram diluídas a 1/100, 1/1.000, 1/10.000 e 1/100.000, em água peptonada e, posteriormente, semeadas 250 µL de volumes das amostras sem diluição e de cada uma das diluições citadas, em triplicata, em placas de Petri contendo meio ágar Brucella acrescido de 5% de sangue desfibrilado de carneiro, hemina e menadione.
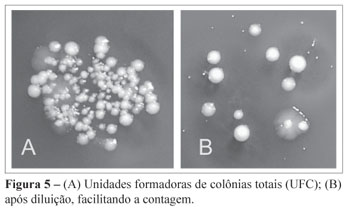
Na sequência, as placas foram incubadas em atmosfera de anaerobiose durante sete dias. Após essa etapa, as placas foram analisadas em microscópio estereoscópico para contagem das unidades formadoras de colônias totais (UFC) (Figura 5).
Realizou-se a análise estatística com os testes de Kolmogorov-Smirnov e Wilcoxon, com um nível de significância de 5% (p=0,05).
Resultados
O Gráfico 1 mostra a quantidade de UFC (antes e após a terapia) no pós-operatório imediato.
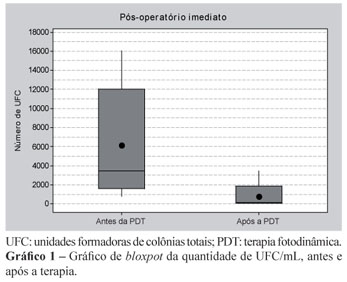
A terapia fotodinâmica promoveu uma redução estatisticamente significante, com nível de significância (p) de 0,003.
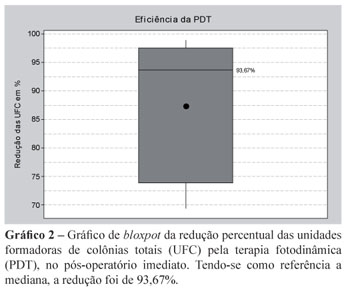
De forma percentual, o Gráfico 2 apresenta a eficiência da PDT sobre as UFC no pós-operatório imediato.
Discussão
Para o controle bacteriano pós-operatório, um dos métodos atualmente utilizados é o uso de solução de gluconato de clorexidina a 0,12%. Trata-se de uma solução antisséptica com ação bactericida e bacteriostática que combate principalmente bactérias Gram-positivas, sendo pouco eficaz contra Gram-negativas16,27 e contra o biofilme oral29. Seu uso contínuo ou em concentrações mais elevadas pode promover aumento da resistência bacteriana27, uma preocupação constante com o uso regular de agentes antimicrobianos locais, além dos efeitos colaterais locais, como perda de paladar e manchamento dos dentes1,22.
Estudos in vitro e em animais têm demonstrado o efeito tóxico da clorexidina, que impede o crescimento de fibroblastos sobre a superfície radicular2, alterando acentuadamente a viabilidade, o crescimento e a síntese proteica das células do tecido gengival e do ligamento peridontal24; e, quando em contato direto com o tecido ósseo, leva a uma necrose superficial, o que retarda a reparação da ferida4.
Atualmente, buscam-se meios de descontaminação alternativos e a PDT desponta como uma das terapias de grande destaque na literatura com resultados animadores3,8,13,16,20,23,25,26,28,32.
Muitos autores relatam que a presença de sangue e fluidos gengivais prejudica a atuação da PDT por oferecer "proteção" às bactérias contra a terapia, impedindo a penetração do corante e/ou refletindo o laser21. Todavia, neste estudo, a abundância de sangue no pós-cirúrgico imediato não impediu a descontaminação, que apresentou redução de 93,67% das UFC.
Outros pontos de extrema importância relacionados à PDT se devem ao fato de ser um procedimento seguro para o paciente e atuar sobre as bactérias sem prejudicar ou reduzir a viabilidade celular do hospedeiro19; e a luz não absorvida pelas bactérias pode ser espalhada e absorvida por cromóforos do tecido peri-implantar adjacente, promovendo efeito analgésico; modulação da inflamação, diminuindo os sinais inflamatórios e do sangramento a sondagem, acelerando o processo de reparação do tecido gengival e ósseo, e aumentando a vascularização3,10,18,25-26.
Portanto, é necessário que pesquisas futuras busquem avaliar essas condições clinicamente, analisando a ação da PDT sobre os tecidos peri-implantares tanto moles (gengiva e periósteo) quanto duros (osso), em busca de melhores resultados e protocolos para reabilitação oral e manutenção da saúde.
Conclusão
Os resultados permitem afirmar que a PDT é um método eficaz de descontaminação da área cirúrgica no pós-operatório imediato de implantes dentários.
Agradecimentos
Apoio financeiro: FAPESP, processo 2009/51317-9.
Referências bibliográficas
1. Addy M, Moran J, Newcombe R, Warren P. The comparative tea staining potential of phenolic, chlorhexidine and anti-adhesive mouthrinses. J Clin Periodontol. 1995;22(12):923-8. [ Links ]
2. Alleyn CD, ONeal RB, Strong SL, Scheidt MJ, Van Dyke TE, McPherson JC. The effect of chlorhexidine treatment of root surfaces on the attachment of human gingival fibroblasts in vitro. J Periodontol. 1991;62(7):434-8. [ Links ]
3. Andersen R, Loebel N, Hammond D, Wilson M. Treatment of periodontal disease by photodisinfection compared to scaling and root planing. J Clin Dent. 2007;18(2):34-8. [ Links ]
4. Bassetti C, Kallenberger A. Influence of chlorhexidine rinsing on the healing of oral mucosa and osseous lesions. J Clin Periodontol. 1980;7(6):443-56. [ Links ]
5. Berglundh T, Abrahamsson I, Welander M, Lang NP, Lindhe J. Morphogenesis of the peri-implant mucosa: an experimental study in dogs. Clin Oral Implants Res. 2007;18(1):1-8. [ Links ]
6. Bhatti M, MacRobert A, Meghji S, Henderson B, Wilson M. Effect of dosimetric and physiological factors on the lethal photosensitization of Porphyromonas gingivalis in vitro. Photochem Photobiol. 1997;65(6):1026-31. [ Links ]
7. Botero JE, Gonzalez AM, Mercado RA, Olave G, Contreras A. Subgingival microbiota in peri-implant mucosa lesions and adjacent teeth in partially edentulous patients. J Periodontol. 2005;76(9):1490-5. [ Links ]
8. Chan Y, Lai CH. Bactericidal effects of different laser wavelengths on periodontopathic germs in photodynamic therapy. Lasers Med Sci. 2003;18(1):51-5. [ Links ]
9. Covani U, Marconcini S, Crespi R, Barone A. Bacterial plaque colonization around dental implant surfaces. Implant Dent. 2006;15(3):298-304. [ Links ]
10. De Almeida JM, Theodoro LH, Bosco AF, Nagata MJ, Oshiiwa M, Garcia VG. Influence of photodynamic therapy on the development of ligature-induced periodontitis in rats. J Periodontol. 2007;78(3):566-75. [ Links ]
11. De Boever AL, De Boever JA. Early colonization of non-submerged dental implants in patients with a history of advanced aggressive periodontitis. Clin Oral Implants Res. 2006;17(1):8-17. [ Links ]
12. De Lorenzo JL, Simionato MRL, De Lorenzo A. Infecção: principal causa de insucessos em implantes dentários. Rev ABO Nac. 1997;5(5):321-4. [ Links ]
13. Dortbudak O, Haas R, Bernhart T, Mailath-Pokorny G. Lethal photosensitization for decontamination of implant surfaces in the treatment of peri-implantitis. Clin Oral Implants Res. 2001;12(2):104-8. [ Links ]
14. Ericsson I, Persson LG, Berglundh T, Marinello CP, Lindhe J, Klinge B. Different types of inflammatory reactions in peri-implant soft tissues. J Clin Periodontol. 1995;22(3):255-61. [ Links ]
15. Furst MM, Salvi GE, Lang NP, Persson GR. Bacterial colonization immediately after installation on oral titanium implants. Clin Oral Implants Res. 2007;18(4):501-8. [ Links ]
16. Hayek RR, Araujo NS, Gioso MA, Ferreira J, Baptista-Sobrinho CA, Yamada AM, et al. Comparative study between the effects of photodynamic therapy and conventional therapy on microbial reduction in ligature-induced peri-implantitis in dogs. J Periodontol. 2005;76(8):1275-81. [ Links ]
17. Hermann JS, Cochran DL, Nummikoski PV, Buser D. Crestal bone changes around titanium implants. A radiographic evaluation of unloaded nonsubmerged and submerged implants in the canine mandible. J Periodontol. 1997;68(11):1117-30. [ Links ]
18. Garcia VG, de Lima MA, Okamoto T, Milanezi LA, Junior EC, Fernandes LA, de Almeida JM, Theodoro LH. Effect of photodynamic therapy on the healing of cutaneous third-degree-burn: histological study in rats. Lasers Med Sci. 2010;25(2):221-8. [ Links ]
19. Luan XL, Qin YL, Bi LJ, Hu CY, Zhang ZG, Lin J, et al. Histological evaluation of the safety of toluidine blue-mediated photosensitization to periodontal tissues in mice. Lasers Med Sci. 2009;24(2):162-6. [ Links ]
20. Marotti J, Tortamano-Neto P, Cai S, Ribeiro MS, Franco JEM, Campos TN. Descontaminação da superfície de implantes dentários por meio da terapia fotodinâmica. In: 26a Reunião Anual da SBPqO, 2009, Águas de Lindóia. Brazilian Oral Research (Proceedings of the 26th SBPqO Annual Meeting). São Paulo: SDO, 2009. v. 23. p.179. [ Links ]
21. Matevski D, Weersink R, Tenenbaum HC, Wilson B, Ellen RP, Lepine G. Lethal photosensitization of periodontal pathogens by a red-filtered Xenon lamp in vitro. J Periodontal Res. 2003;38(4):428-35. [ Links ]
22. Mendieta C, Vallcorba N, Binney A, Addy M. Comparison of 2 chlorhexidine mouthwashes on plaque regrowth in vivo and dietary staining in vitro. J Clin Periodontol. 1994;21(4):296-300. [ Links ]
23. Pfitzner A, Sigusch BW, Albrecht V, Glockmann E. Killing of periodontopathogenic bacteria by photodynamic therapy. J Periodontol. 2004;75(10):1343-9. [ Links ]
24. Pucher JJ, Daniel JC. The effects of chlorhexidine digluconate on human fibroblasts in vitro. J Periodontol. 1992;63(6):526-32. [ Links ]
25. Shibli JA, Martins MC, Ribeiro FS, Garcia VG, Nociti FH, Jr., Marcantonio E, Jr. Lethal photosensitization and guided bone regeneration in treatment of peri-implantitis: an experimental study in dogs. Clin Oral Implants Res. 2006;17(3):273-81. [ Links ]
26. Sigusch BW, Pfitzner A, Albrecht V, Glockmann E. Efficacy of photodynamic therapy on inflammatory signs and two selected periodontopathogenic species in a beagle dog model. J Periodontol. 2005;76(7):1100-5. [ Links ]
27. Thomas L, Maillard JY, Lambert RJ, Russell AD. Development of resistance to chlorhexidine diacetate in Pseudomonas aeruginosa and the effect of a "residual" concentration. J Hosp Infect. 2000;46(4):297-303. [ Links ]
28. Usacheva MN, Teichert MC, Biel MA. Comparison of the methylene blue and toluidine blue photobactericidal efficacy against gram-positive and gram-negative microorganisms. Lasers Surg Med. 2001;29(2):165-73. [ Links ]
29. Vitkov L, Hermann A, Krautgartner WD, Herrmann M, Fuchs K, Klappacher M, et al. Chlorhexidine-induced ultrastructural alterations in oral biofilm. Microsc Res Tech. 2005;68(2):85-9. [ Links ]
30. Weber HP, Buser D, Donath K, Fiorellini JP, Doppalapudi V, Paquette DW, et al. Comparison of healed tissues adjacent to submerged and non-submerged unloaded titanium dental implants. A histometric study in beagle dogs. Clin Oral Implants Res. 1996;7(1):11-9. [ Links ]
31. Weber HP, Cochran DL. The soft tissue response to osseointegrated dental implants. J Prosthet Dent. 1998;79(1):79-89. [ Links ]
32. Yilmaz S, Kuru B, Kuru L, Noyan U, Argun D, Kadir T. Effect of gallium arsenide diode laser on human periodontal disease: a microbiological and clinical study. Lasers Surg Med. 2002;30(1):60-6. [ Links ]
33. Zanin ICJ, Brugnera Junior A, Gonçalves RB. Aplicação da terapia fotodinâmica na descontaminação bacteriana. Rev Assoc Paul Cir Dent. 2002;56(Supl):7-11. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
João Eduardo Miranda Franco
Rua das Hortênsias, 212, apto 103
CEP 04051-000 – Mirandópolis/SP
Tel.: (11) 8576-3157
E-mail: joaofranco@usp.br
Estudo realizado na Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP.
Recebido: 04/08/10
Aceito: 20/09/10













