Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RFO UPF
versão impressa ISSN 1413-4012
RFO UPF vol.15 no.3 Passo Fundo Set./Dez. 2010
Potencial erosivo e cariogênico de anti-histamínicos de uso infantil
Erosive and cariogenic potential of pediatric anti-histaminic medicines
Rayanne Izabel Maciel de SousaI; Mariana da Costa OliveiraI; Marayza Alves ClementinoI; Alessandro Leite CavalcantiI; Fernando Fernandes VieiraII
IUniversidade Estadual da Paraíba, Centro de Ciências Biológicas e da Saúde, Departamento de Odontologia, Campina Grande, Paraíba, Brasil
IIUniversidade Estadual da Paraíba, Centro de Ciências Tecnológicas, Departamento de Química, Campina Grande, Paraíba, Brasil
RESUMO
OBJETIVO: Avaliar in vitro o pH endógeno, a acidez total titulável (ATT), o teor de sólidos solúveis totais (SST) e os açúcares totais de anti-histamínicos de uso infantil apresentados sob a forma de xarope.
MATERIAIS E MÉTODO: Cinco medicamentos foram avaliados por meio de um experimento aleatório com análise em triplicata. A avaliação do pH foi feita por potenciometria e a capacidade tampão foi realizada por meio da diluição de cada uma das substâncias. Incrementos de 0,1 N KOH foram adicionados até que se atingisse a neutralidade. As leituras do ºBrix foram feitas por refratometria usando o refratômetro de Abbé.
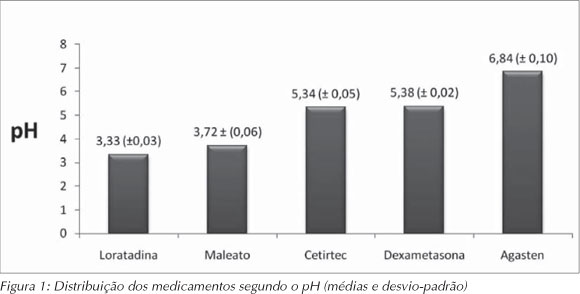
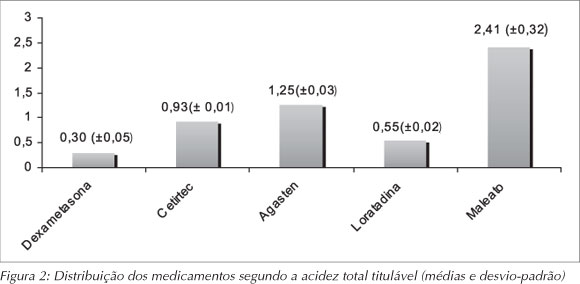
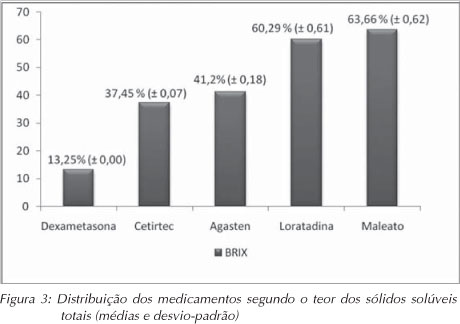
RESULTADOS: As médias do pH variaram de 3,33 (loratadina) a 6,84 (agasten) e quatro medicamentos mostraram pH abaixo do valor crítico de 5,5. As médias da ATT variaram de 0,30 para a dexametasona a 2,41 para o maleato de dexclofeniramina. A dexametasona apresentou o menor valor de SST (13,25%) e o maleato de dexclorfeniramina, o maior valor de SST (63,66%). No tocante aos açúcares totais, o percentual variou de 24,80% (loratadina) a 49,34% (maleato de dexclorfeniramina).
CONCLUSÃO: Os anti-histamínicos analisados têm um alto potencial erosivo e cariogênico, visto que possuem um baixo pH e elevado teor de sólidos solúveis totais.
Palavras-chave: Administração oral. Preparações farmacêuticas. Edulcorantes. Cárie dentária. Erosão dentária.
ABSTRACT
OBJECTIVE: To evaluate in vitro the endogenous pH, titratable acidity, total soluble solids content (TSSC) and total sugars of pediatric anti-histaminic medicines presented as syrups.
METHODS: Five medicines were evaluated by a random experiment with 3 repetitions for each sample. pH analysis was performed by potentiometry and buffering capacity was assessed by dilution of each medicine. Increments of 0.1 N KOH were titrated until neutrality was reached. TSSC readings were performed by Brix refractometry using the Abbé refractometer.
RESULTS: pH values ranged from 3.33 (loratadina) to 6.84 (agasten) and four medicines showed pH below the critical value of 5.5. The titratable acidity values ranged from 0.30 (dexametasona) to 2.41 (maleato de desclofeniramina). Dexametasona presented the lowest TSSC content (13.25%) and maleato de dexclorfeniramina presented the highest TSSC content (63.66%). Regarding to total sugars values ranged from 24.80% (loratadina) to 49.34% (maleato de dexclorfeniramina).
CONCLUSION: The anti-histaminic medicines evaluated have a high erosive and cariogenic potential, as they present low pH and a high total soluble solids content.
Key words: Oral administration. Pharmaceutical preparations. Sweetening agents. Dental caries. Tooth erosion.
Introdução
O uso de medicamentos faz parte do cotidiano de muitas crianças que sofrem com problemas crônicos, como alergias respiratórias, asma brônquica, convulsões, ou doenças agudas recorrentes, como amigdalite, otite, rinite alérgica e sinusite. A maior parte das drogas desenvolvidas para a pediatria tem em sua composição algum tipo de açúcar para "mascaramento" do seu sabor1.
Dentre os açúcares comumente utilizados pode-se destacar a sacarose2; motivo pelo qual se constitui em uma preocupação para uma adequada saúde bucal, tendo em vista o aumento da prevalência da doença cárie, a qual está relacionada com a ingestão frequente de medicamentos líquidos infantis3. Tal condição decorre, provavelmente, da capacidade da sacarose de promover grande atividade acidogênica, com consequente queda do pH do biofilme dental, uma vez que este açúcar funciona como substrato para fermentação da microbiota bucal4. Além disso, medicamentos que têm alto percentual de sacarose, baixo pH endógeno e alta acidez titulável apresentam tanto potencial cariogênico quanto erosivo, visto que promovem rápida queda do pH bucal, que permanece baixo por períodos mais prolongados de tempo1,5.
A escala oBrix (oBr) é uma escala numérica que mede a quantidade de sólidos solúveis em uma solução de sacarose. Em muitos casos, todo o soluto dissolvido é o açúcar6. Uma solução de 20 Bx tem 20 g do açúcar da sacarose por 100 g de líquido. Pesquisa prévia demonstrou uma variabilidade de 11,21% a 62,46% na quantidade de sacarose em diferentes medicamentos7; enquanto outro estudo revelou um percentual de sacarose ainda maior em medicamentos infantis, atingindo até 80,0%8.
A posologia das medicações também tem influência na sua cariogenicidade. Quanto maior o número de ingestões diárias, maior o número de desafios cariogênicos, pois a cárie dentária é uma doença infecciosa multifatorial, dieta-dependente, atribuída primariamente à presença de bactérias orais e açúcares fermentáveis1,9. Em acréscimo, certos medicamentos, como os anti-histamínicos, têm como efeito colateral a diminuição do fluxo salivar, aumentando, assim, a suscetibilidade à doença cárie10,11.
Com base no exposto, o presente estudo verificou o potencial erosivo e cariogênico de anti-histamínicos líquidos de uso infantil.
Materiais e método
O estudo caracteriza-se como sendo experimental in vitro. A amostra foi composta por cinco diferentes anti-histamínicos apresentados sob a forma de xaropes para uso infantil (Tab. 1). As análises das propriedades físico-químicas dos fármacos foram feitas em triplicata.
Determinação do pH endógeno
A verificação dos valores de pH foi feita utilizando-se pH-metro digital Q400-A (Quimis Aparelhos Científicos Ltda., Diadema, SP). Após a calibração do aparelho, foram transferidos 10 mL de cada medicamento para um copo de polietileno, sendo realizada a imersão do eletrodo, seguida da leitura e do registro em ficha específica.
Determinação da acidez total titulável
A mensuração da acidez total titulável (ATT) foi feita utilizando-se o método adotado pela Association of Official Analytical Chemists12. Foram pipetados 10 mL de cada amostra e transferidos para um erlenmeyer de 250 mL. Em seguida, procedeu-se à titulação com hidróxido de potássio (KOH) a 0,1N até que a substância atingisse um valor entre 8,2 e 8,4 - ponto de viragem da fenolftaleína.
Ao atingir esse valor, observou-se o volume de KOH gasto e, então, calculou-se o percentual de acidez da substância por meio da fórmula abaixo, que expressa o resultado em percentagem de ácido cítrico correspondente13.

onde: V = volume de KOH; Nap = concentração normal da base de KOH; meq-g = miliequivalente por grama de ácido cítrico; amostra = volume do medicamento.
Teor de sólidos solúveis totais (ºBrix)
As leituras do grau ºBrix foram feitas por refratometria, utilizando-se o refratômetro de Abbé (PZO-RL1R, Varsóvia, Polônia), corrigido para 20 ºC, após a abertura das embalagens. O aparelho foi calibrado à temperatura ambiente com água deionizada (índice de refração = 1,3330 e 0 ºBrix a 20 ºC) e procedeu-se às leituras das amostras13.
Análise do teor de açúcares totais
A determinação da quantidade de sacarose presente foi realizada pelo método Lane-Enyon (Fehling), no qual os açúcares com grupamento livre, quando aquecidos em solução alcalina, transformam-se em enedióis, que são substâncias que sofrem ação de agentes oxidantes. O ponto final da reação é indicado pelo azul de metileno, que é reduzido a sua forma incolor por pequeno excesso de açúcar redutor12.
Os dados foram organizados no programa Microsoft Excel 2007 e apresentados por meio de estatística descritiva (médias e desvio-padrão).
Resultados
Em relação ao pH endógeno, evidenciou-se que quatro deles possuem pH inferior a 5,5, sendo o menor pH registrado para a loratadina (3,3) e o maior, para o Agasten (6,8), conforme demonstrado na Figura 1.
Quanto à acidez total titulável, os valores variaram de 1,6 a 12,5 mL de solução de NaOH 0,1 N, indicando que alguns dos medicamentos podem levar mais tempo para ser neutralizados em razão da quantidade de solução necessária. As médias da porcentagem de ácido cítrico variaram entre 0,30 (± 0,05) para a dexametasona e 2,41 (± 0,32) para o maleato de dexclofeniramina.
Os teores de sólidos solúveis totais (ºBx) variaram de 13,25% (dexametasona) a 63,66% (maleato de dexclofeniramina), conforme demonstrado na Figura 3.
No tocante aos açúcares totais, somente foi possível determinar o teor de dois medicamentos, o maleato de dexclorfeniramina (49,34 ± 3,65) e a loratadina (24,80 ± 3,87).
Discussão
Algumas doenças ou medicamentos podem aumentar o risco de estabelecimento ou a severidade da cárie dentária. O paciente acometido por uma enfermidade vive uma situação extraordinária, na qual fatores cariogênicos podem prevalecer1. No entanto, o risco maior pode estar relacionado ao tratamento da doença, em razão da presença da sacarose e da acidez provocada pelo baixo pH endógeno em algumas formulações infantis, o que contribui para agravar o potencial cariogênico e erosivo desses medicamentos10,14-16.
Vale ressaltar que o risco do desenvolvimento da doença cárie associado ao uso de medicamentos torna-se ainda maior quando nenhuma medida efetiva de higiene bucal é realizada a fim de eliminar os resíduos dessas substâncias da cavidade bucal das crianças17.
Deve-se ainda considerar que a maior parte desses medicamentos é administrada à noite ou durante o sono, período em que há uma redução fisiológica do fluxo salivar e diminuição dos reflexos de deglutição e movimentos musculares, ocasionando um tempo prolongado de permanência desses medicamentos na cavidade bucal17.
O uso frequente e contínuo de medicamentos também é um fator que pode contribuir para o seu potencial cariogênico e erosivo. Assim, o presente estudo selecionou para avaliação in vitro anti-histamínicos líquidos de uso infantil, uma vez que pacientes que apresentam patologias benignas recorrentes, como alergias respiratórias, além de doenças crônicas, como asma e bronquite, fazem uso constante desses medicamentos; por consequência, aumenta o risco de desenvolvimento de cárie e erosão dentária. Embora os processos de erosão e cárie sejam diferentes, as duas condições podem ocorrer simultaneamente e ser deletérias para os tecidos duros dentais18.
A determinação do pH é aplicada a preparações farmacêuticas veiculadas apenas em água ou em associação a outros líquidos miscíveis com a água. Portanto, aplica-se, entre outras, às formas farmacêuticas líquidas de uso oral, tais como xaropes3. O pH das medicações líquidas, frequentemente, está relacionado com as exigências das substâncias ativas, não só no que se refere à estabilidade, pois pode ocorrer decomposição química em função do pH inadequado, comprometendo, assim, a ação farmacológica19.
Todos os medicamentos avaliados neste estudo mostraram pH inferior a 7,0, fator que pode favorecer a erosão dentária13,15,20. Apenas o agasten encontrou-se dentro da faixa de pH de estabilidade recomendada na literatura, ressaltando-se ainda que os valores encontrados neste medicamento não contribuem para a desmineralização do esmalte3. Outros estudos realizados com medicamentos infantis também verificaram uma média de pH endógeno abaixo do pH crítico1,3,7,13.
Medicamentos pediátricos podem conter vários tipos de ácidos que contribuem para os baixos valores de pH. De acordo com os rótulos, os produtos avaliados (loratadina, maleato de dexclorfeniramina e dexametasona) apresentaram o ácido cítrico em sua composição. Tem sido referido que este ácido pode produzir altos níveis de erosão, possivelmente em virtude de suas fortes propriedades quelantes21. Essa ação quelante sobre o cálcio do esmalte permanece ativa mesmo que ocorra elevação do pH na superfície dentária22.
Além desses fatores químicos, outras condições podem ter um impacto sobre a erosão dentária in vivo, como os fatores comportamentais (hábitos de consumo, estilo de vida, consumo excessivo de ácidos) e biológicos (capacidade tampão, a composição da saliva, formação de película adquirida, anatomia do dente e dos tecidos moles)21.
No tocante aos experimentos realizados até o momento, foi possível obter por esse método apenas o teor de açúcares totais de dois medicamentos, o maleato e a loratadina. Quanto aos outros medicamentos testados, supõe-se que não são sensíveis a esse teste. Serão realizados novos testes para se confirmar essa hipótese.
A análise dos teores de sólidos solúveis totais (ºBx) revelou que quatro medicamentos apresentaram elevado ºBx, superior aos 30,0%. Como, em muitos casos, todo o soluto dissolvido é o açúcar6; verifica-se que esses fármacos possuem elevado potencial cariogênico. A quantidade de açúcar presente no Agasten, maleato de dexclofeniramina e loratadina foi superior a 40%, de acordo com o ºBx.
Visando confirmar essa condição, analisou-se a presença de açúcar. Todavia, apenas em dois medicamentos foi possível determinar os açúcares totais, com os valores variando de 24,80% para a loratadina a 49,34% para o maleato de dexclorfeniramina. Uma das possíveis hipóteses para a não obtenção do percentual de sacarose dos demais medicamentos é que os princípios ativos dos fármacos estejam interferindo na redução dos açúcares. Todavia, é lícito destacar que os valores obtidos podem ser considerados elevados.
Pesquisa anterior constatou que a sacarose estava presente em dois terços dos medicamentos analisados1; embora existam medicamentos com açúcares alternativos em substituição à sacarose23; como a sacarina sódica, ciclamato de sódio, aspartame e o xilitol9.
A justificativa para presença da sacarose na maior parte das preparações farmacêuticas deve-se ao fato de este açúcar ter um baixo custo, não deixar gosto residual e, ainda, agir como conservante e antioxidante, além de melhorar a viscosidade dos medicamentos líquidos24.
Diversas recomendações têm sido feitas no intuito de minimizar a interferência da terapia medicamentosa no desafio cariogênico. Foi sugerido que todos os medicamentos pediátricos deveriam ser produzidos pelos laboratórios na forma livre de açúcar além da forma açucarada17,25 e que os medicamentos sugar free deveriam ser utilizados sempre que possível26.
É necessário que exista uma maior interação entre médicos, odontólogos e farmacêuticos, a fim de reduzir o número de prescrições de medicamentos açucarados ou que haja a substituição destes por medicamentos com açúcares alternativos em substituição à sacarose, assim como orientar os pais quanto à ingestão das medicações no horário das refeições e à escovação com dentifrício após a administração.
Conclusão
Os anti-histamínicos analisados têm um alto potencial erosivo e cariogênico, visto que possuem um baixo pH e elevado teor de sólidos solúveis totais.
Referências
1. Marquezan M, Marquezan M, Pozzobon RT, Oliveira MDM. Medicamentos utilizados por pacientes odontopediátricos e seu potencial cariogênico. RPG Rev Pós Grad 2007; 13(4):334-9. [ Links ]
2. Neiva A, Silva VS, Maia LC, Soares EL, Trugo LC. Análise in vitro da concentração de sacarose e pH de antibacterianos de uso pediátrico. Pesq Bras Odontopediatr Clín Integr 2001; 1(1):9-16. [ Links ]
3. Santinho AJP, Waldow C, Santos SB. Estudo sobre a correlação do potencial cariogênico e do pH de xaropes pediátricos. Rev Bras Farm 2008; 89(2):88-90. [ Links ]
4. Neves BG, Pierro VSS, Maia LC. Percepções e atitudes de responsáveis por crianças frente ao uso de medicamentos infantis e sua relação com cárie e erosão dentária. Ciênc Saúde Coletiva 2007; 12(5):1295-300. [ Links ]
5. Costa CC, Almeida ICS, Costa Filho LC. Erosive effect of an antihistamine-containing syrup on primary enamel and its reduction by fluoride dentifrice. Int J Paediatr Dent 2006; 16(3):174-80. [ Links ]
6. Ball DW. Concentration scales for sugar solutions. J Chem Educ 2006; 83(10): 1489-91. [ Links ]
7. Costa CC, Almeida ICS, Raymundo MS, Fett R. Análise do pH endógeno, da acidez e da concentração de sacarose de medicamentos pediátricos. Rev Odonto Ciênc 2004; 19(44):164-9. [ Links ]
8. Newbrum E. Substrato: dieta e cárie. In: ______. Cariologia. São Paulo: Santos; 1988. p. 86-121. [ Links ]
9. Pereira AFF, Silva TC, Caldana ML, Machado MAAM, Buzalaf MAR. Revisão de literatura: utilização do xilitol para a prevenção de otite média aguda. Arq Int Otorrinolaringol 2009; 13(1):87-92. [ Links ]
10. Durward C, Thou T. Dental caries and sugar containing liquid medicines for children in New Zealand. N Z Dent J 1997; 93:124-9. [ Links ]
11. Feldens CA. Cárie oclusal: diagnóstico, prevenção e tratamento. J Bras Odontopediatr Odontol Bebê 1998; 1:56-61. [ Links ]
12. Association of Official Analytical Chemists. Official methods of analysis. 14. ed. Arlington (Virginia): Association of Official Analytical Chemists; 1984. [ Links ]
13. Cavalcanti AL, Fernandes LV, Barbosa AS, Vieira FF. pH, titratable acidity and total soluble solid content of pediatric antitussive medicines. Acta Stomatol Croat 2008; 42(2):164-70. [ Links ]
14. Rekola M. In vivo acid production from medicines in syrup form. Caries Res 1989; 23:412-6. [ Links ]
15. Moss SJ. Dental erosion. Int Dent J 1998; 48:529-39. [ Links ]
16. Dugmore CR, Rock WP. A multifactorial analysis of factors association with dental erosion. Br Dent J 2004; 196(5):283-6. [ Links ]
17. Bigeard L. The role of medication and sugars in pediatric dental patients. Dent Clin North Am 2000 44:443-56. [ Links ]
18. Tahmassebi JF, Duggal MS, Malikkotru G, Curzon MEJ. Soft drinks and dental health: a review of the current literature. J Dent 2006 34(1):2-11. [ Links ]
19. Ferreira AO, Souza GF. Preparações orais líquidas. São Paulo: Pharmabooks; 2005. [ Links ]
20. Nunn JH, Ng SK, Sharkey I, Coulthard M. The dental implications of chronic use of acidic medicines in medically compromised children. Pharm World Sci 2001 23(3):118-9. [ Links ]
21. Lussi A, Jaeggi T. Chemical factors. In: Lussi A. Dental Erosion. Monogr Oral Sci. Basel: Karger, 2006; Chapter 7, p. 77-87. [ Links ]
22. Järvinen VK, Rytömaa II, Heinonen OP. Risk factors in dental erosion. J Dent Res 1991; 70(6):942-7. [ Links ]
23. Bezerra ACB, Toledo OA. Nutrição, dieta e cárie. In: Krieger L. ABOPREV. Promoção de Saúde Bucal. 2. ed. São Paulo: Artes Médicas; 1997. p. 43-67. [ Links ]
24. Silva SMB, Santos CF. Medicamentos pediátricos e risco de cárie: uma revisão. Rev Fac Odontol Bauru 1994; 2:15-21. [ Links ]
25. Hunter ML, Lewis R, Hunter B. Consumer demand in the purchase and prescription of sugar-free medicines. Int J Paediatr Dent 2000; 10(2):140-4. [ Links ]
26. Geddes DA. Teeth for the future. Acta Paediatr Scand 1991; 373 (Suppl):53-7. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Alessandro Leite Cavalcanti
Universidade Estadual da Paraíba
Departamento de Odontologia
Avenida das Baraúnas, S/N - Bodocongó
58109-000 Campina Grande - PB
Fone ( )
E-mail: dralessandro@ibest.com.br
Recebido: 11.02.2010
Aceito: 18.08.2010













