Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Arquivos em Odontologia
versão impressa ISSN 1516-0939
Arq. Odontol. vol.47 no.3 Belo Horizonte Jul./Set. 2011
Avaliação anti-microbiológica do ácido peracético como desinfetante para moldes odontológicos
Anti-microbial evaluation of peracetic acid as a disinfectant for dental impressions
Dimitri Ribas FonsecaI; Paulo Badaró de SouzaII; Vitor César DumontIII; Paula Cristina Pelli PaivaIII; Patrícia Furtado GonçalvesIII; Maria Helena SantosIII
I Programa de Pós-Graduação em Odontologia, Faculdade de Ciências Biológicas e da Saúde (FCBS), Universidade Federal dos Vales do Jequitinhonha e Mucuri (UFVJM), Diamantina, MG, Brasil
II Cirurgião-Dentista
III Curso de Odontologia, Faculdade de Ciências Biológicas e da Saúde (FCBS), Universidade Federal dos Vales do Jequitinhonha e Mucuri (UFVJM), Diamantina, MG, Brasil
Contato: dimitri.ribas@gmail.com, p_badaro@hotmail.com, vitorcdumont@gmail.com, paulacpp@ig.com.br, patriciafu@yahoo.com, mariahelena.santos@gmail.com
RESUMO
Objetivo: Esse estudo piloto avaliou a atividade desinfetante do ácido peracético a 0,2% em corpos de prova de hidrocolóide irreversível. Materiais e Métodos: Sua ação antimicrobiana foi investigada comparativamente à solução de glutaraldeído 2%, à solução de hipoclorito de sódio 2,5% e ao digluconato de clorexidina agregado à fórmula de um hidrocolóide irreversível. Foram selecionadas cepas de quatro microrganismos, Escherichia coli, Staphylococcus aureus, Bacillus proteus e Candida albicans para inoculação nos meios de cultura. As amostras de hidrocolóide irreversível foram divididas aleatoriamente em cinco grupos: G1 - com 8 corpos de prova de hidrocolóide irreversível sem tratamento desinfetante, representando o grupo controle; G2 - com 8 amostras de hidrocolóide irreversível desinfetadas por imersão em solução de Hipoclorito de Sódio a 2,5%; G3 - com 8 amostras do hidrocolóide irreversível com desinfecção por imersão em solução de Glutaraldeído a 2%; G4 - com 8 corpos de prova de hidrocolóide irreversível desinfetadas por imersão em solução de ácido peracético 0,2% e G5 - com 8 corpos de prova de hidrocolóide irreversível com clorexidina na composição. Placas de petri contendo os fragmentos de hidrocolóide irreversível e a replicação dos microrganismos foram incubadas por 24 h. a 37°C. Após este período, foram mensurados os halos de inibição do crescimento microbiano que variaram de 0 a 50 milímetros (mm). Resultados: A análise descritiva mostrou atividade antimicrobiana do ácido peracético para todas as cepas. A análise intergrupo, feita aos pares com o grupo teste G4, pelo teste Mann-Whitney (p<0,05), não mostrou significância estatística. Na avaliação da magnitude de efeito de Cohen, pode-se perceber a semelhança de comportamento dos desinfetantes ácido peracético, glutaraldeído e hipoclorito de sódio; e uma diferença do ácido peracético para os grupos controle G1 e com clorexidina G5. Conclusão: Todas as cepas de microrganismos foram sensíveis ao ácido peracético ao hipoclorito de sódio e ao glutaraldeído.
Descritores: Ácido peracético. Desinfecção. Moldes para moldagem odontológica.
ABSTRACT
Aim: This pilot study aimed to evaluate the disinfectant activity of peracetic acid at 0.2% in specimens of irreversible hydrocolloid. Materials and Methods: This peracetic acid's antimicrobial activity was investigated by comparing a 2% glutaraldehyde solution, a 2.5% sodium hypochlorite solution and a chlorhexidine gluconate added to the formula of an irreversible hydrocolloid. Four strains of microorganisms were selected: Escherichia coli, Staphylococcus aureus, Bacillus proteus, and Candida albicans for inoculation in culture mediums. Irreversible hydrocolloid samples were randomly divided into five groups: G1 - with 8 samples of irreversible hydrocolloid without treatment disinfectant, representing the control group; G2 - with 8 samples of irreversible hydrocolloid disinfected by immersion in 2.5% sodium hypochlorite solution; G3 - with 8 samples of irreversible hydrocolloid disinfected by immersion in a 2% glutaraldehyde solution; G4 - with 8 samples of irreversible hydrocolloid disinfected by immersion in peracetic acid at 0.2%; G5 - with 8 samples of irreversible hydrocolloid with chlorhexidine gluconate added to the formula. Petri dishes containing fragments of irreversible hydrocolloid and seeded microorganisms were incubated for 24 h at 37°C. The inhibition of microbial growth ranged from 0 to 50 mm. Results: The descriptive analysis showed antimicrobial activity of peracetic acid for all tested microorganisms. Intergroup analysis, performed in pairs with test group G4, by means of the Mann-Whitney test (p <0.05), showed no statistical significance. In assessing the magnitude of the Cohen effect, one can observe a similar behavior for the peracetic acid disinfectant, glutaraldehyde, and sodium hypochlorite, as well as a difference in the peracetic acid for the control groups G1 and G5 with chlorhexidine gluconate. Conclusion: All strains were susceptible to peracetic acid, sodium hypochlorite, as well as Glutaraldehyde.
Uniterms: Peracetic acid. Disinfection. Dental impression materials.
INTRODUÇÃO
Moldes odontológicos representam uma potencial fonte de infecção cruzada. Expostos aos fluidos bucais eles podem contaminar os modelos de gesso e consequentemente, todos os profissionais que irão manipulá-lo1,2. O processo mais estudado de desinfecção de moldes é a imersão ou spray de soluções germicidas como o hipoclorito de sódio a 2,5% e o glutaraldeído a 2%. Estes desinfetantes com alta capacidade de eliminação de patógenos são aplicados nas áreas médica e odontológica, para desinfecção de artigos termossensíveis críticos e semi-críticos3.
O constante risco de infecção cruzada durante as técnicas de moldagens e modelagens odontológicas incentivaram recentemente, a incorporação de agentes desinfetantes na fórmula de alguns materiais de moldagem. O digluconato de clorexidina foi selecionado, por sua ótima estabilidade química, como antimicrobiano agregado à fórmula de hidrocolóides irreversíveis4.
Apesar da grande utilização destes três desinfetantes, outro agente antibacteriano, o ácido peracético (APA), vem apresentando em estudos recentes, eficácia semelhante aos anteriores, com vantagens bioquímicas que permitiram sua eleição para desinfecção de alto nível na área médica5,6. As características do ácido peracético como pH favorável, boa capacidade antimicrobiana e baixa toxicidade, sugerem propriedades para a desinfecção de moldes na rotina odontológica7.
Deste modo, o propósito deste estudo piloto foi avaliar in-vitro a atividade antimicrobiana do ácido peracético na concentração de 0,2% atuando em corpos de prova de hidrocolóide irreversível. A inibição de crescimento microbiológico foi comparada entre este e as soluções de hipoclorito de sódio a 2,5%, de glutaraldeído a 2% e ainda com a clorexidina contida na fórmula de uma marca comercial de hidrocolóide. Os patógenos selecionados para o teste foram as cepas de Escherichia coli (E. coli - ATCC 25922), Staphylococcus aureus (S. aureus - ATCC 29313), Bacillus proteus (B. proteus - ATCC7002) e Candida albicans (C. albicans - isolada pelo laboratório setorial de microbiologia da Faculdade de Ciências Biológicas e da Saúde da Universidade Federal dos Vales do Jequitinhonha e Mucuri FCBS/UFVJM).
MATERIAIS E MÉTODOS
Este estudo piloto, foi conduzido no laboratório setorial de microbiologia e no centro de avaliação e desenvolvimento de biomateriais BioMat - FCBS/UFVJM. Foram cultivadas quatro cepas de microrganismos infectantes para seres humanos, Escherichia coli8 (E. coli), Staphylococcus aureus9 (S. aureus), Bacillus proteus10 (B. proteus) e Candida albicans11 (C. albicans). Após a incubação em caldo nutriente ou em caldo Brain Heart Infusion, Difco (BHI) a 37ºC por 24 horas1 estes inóculos foram classificados por um técnico capacitado e reservados. Foi adotado o nível 0,5 de turvação da escala de McFarland12 para comparação, padronizando o nível de concentração de microrganismos na ordem de 3x108 UFC/ml.
Corpos de prova de hidrocolóide irreversível foram obtidos a partir de uma matriz de poliestireno com oito poços cilíndricos de 6x4mm, adaptada para o experimento. Foram utilizadas duas marcas comerciais: um hidrocolóide irreversível comum (HI), Jeltrate Dustless (Dentsply, São Paulo, Brasil) e um hidrocolóide irreversível com digluconato de clorexidina na composição (HIC), Avagel (Dentsply, São Paulo, Brasil). Todas as orientações do fabricante, quanto à proporção água/pó, tempo de espatulação e tempo de presa foram respeitadas.
Estes corpos de prova foram imediatamente distribuídos, aleatoriamente, em cinco grupos experimentais (n=8). O Grupo 1 (G1), com 8 corpos de prova de hidrocolóide HI, sem nenhum tratamento desinfetante, representando o grupo controle. O Grupo 2 (G2) apresentando 8 amostras de hidrocolóide HI desinfetadas por imersão em solução de Hipoclorito de Sódio a 2,5% (Cloro Rio, Rioquímica Farmacêutica LTDA, Rio de Janeiro, Brasil). O Grupo 3 (G3) correspondeu a 8 amostras do hidrocolóide HI com desinfecção por imersão em solução de Glutaraldeído a 2% (CicloFarma Indústria Farmacêutica, São Paulo, Brasil). O Grupo 4 (G4) representando o grupo teste, também foi constituído por 8 corpos de prova de HI, mas com imersão em solução desinfetante de ácido peracético 0,2% (Neopharma Farmácia de manipulação, Belo Horizonte, Brasil). Durante o tratamento por imersão foi respeitado o tempo de 10 minutos para cada banho e mantido o volume de 20 ml para cada solução. O Grupo 5 (G5) foi composto por oito amostras de hidrocolóide irreversível com digluconato de clorexidina na composição HIC, sem tratamento adicional.
Placas de petri contendo meio de cultura agaragar previamente preparadas receberam a replicação das culturas de microrganismos. Totalizaram 8 placas de petri sendo 2 com E. coli, 2 com S. aureus, 2 com B. proteus e 2 com C. albicans. Cada placa de petri recebeu então cinco cilindros distintos, sendo um de cada grupo experimental.
Este conjunto de oito placas de petri, contendo os fragmentos de hidrocolóide irreversível de cada grupo da pesquisa posicionados em meio de cultura contaminado pelos inóculos, foi submetido à incubação durante 24 h à temperatura constante de 37ºC. Após este período, as placas foram avaliadas por um examinador que mensurou com o auxílio de um paquímetro, os halos presentes de inibição do crescimento dos microrganismos a partir do centro de cada cilindro de hidrocolóide. Os valores obtidos em milímetros foram organizados para avaliação descritiva e estatística. Inicialmente foram submetidos ao teste de normalidade o que resultou em amostragem não normal. Aplicou-se o teste de Mann-Whitney considerando p<0,05 para uma comparação aos pares entre o grupo do ácido peracético e os demais grupos, utilizando-se do pacote estatístico SPSS 15.0 (Statistical Package for the Social Sciences 15.0 for Windows). Ainda para a avaliação intergrupo comparativa para o grupo G4, foi eleita a avaliação da Magnitude do efeito de Cohen13.
RESULTADOS
Os valores absolutos das mensurações dos halos de inibição variaram de 0 a 50 milímetros (mm) e encontram-se dispostos na Tabela 1. Foram observados halos menores para o grupo controle G1 e para o grupo G5 que também não recebeu tratamento desinfetante adicional, mas apresentava moldes com o hidrocolóide HIC contendo clorexidina em sua composição. Ainda na avaliação descritiva o grupo de estudo G4 apresentou valores máximos de halos de inibição (50 mm) em três culturas diferentes, assim como os grupos G2 e G3.
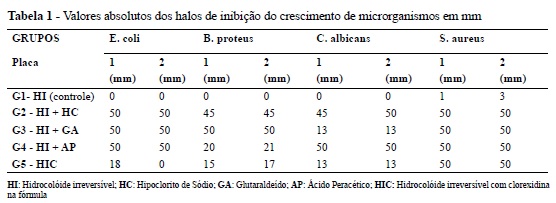
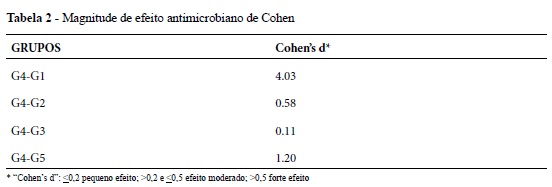
O teste de Mann-Whitney não evidenciou significância estatística em nenhuma das comparações feitas aos pares com o grupo de estudo G4. Deste modo, na intenção de analisar melhor os valores das médias, não paramétricas e ainda sem significância para p< a 0,05, estes valores do grupo G4 foram comparadas aos pares com as médias dos grupos G1, G2, G3 e G5 e submetidos ao teste de avaliação da magnitude de efeito16. A Tabela 2 apresenta o resultado desta análise.
DISCUSSÃO
Moldes odontológicos são obtidos em diversas etapas do tratamento odontológico e carregam microrganismos que potencializam a infecção cruzada1. São considerados artigos semicríticos, por entrarem em contato com a mucosa do paciente e devem ser submetidos à desinfecção de alto nível ou esterilização3.
As cepas de microrganismos selecionadas para este estudo são relacionadas a infecções transitórias oportunistas e frequentemente isoladas no meio bucal ou no trato gastrointestinal8-11. Estudos que investigaram a contaminação do sistema de canais radiculares14,15 e em superfície de próteses totais16 também utilizaram ou isolaram cepas semelhantes às utilizadas neste experimento.
O APA avaliado neste trabalho é um desinfetante investigado nos últimos anos, comercialmente disponível, que compreende a uma mistura quaternária em equilíbrio contendo ácido acético, peróxido de hidrogênio, ácido peracético e água. Tem forte propriedade oxidante e é ativo contra bactérias entéricas e, em menor grau contra os vírus, esporos bacterianos e algumas formas de protozoários17,18. Apresenta mais de uma via de síntese, mas é dependente da ação do peróxido de hidrogênio sobre a acetilcaprolactama, sobre o ácido acético ou sobre anidridos acéticos19. Consequente destas diferentes vias, alguns de seus componentes podem apresentar-se com concentrações variadas ou até mesmo ausentar-se. Isto também define propriedades distintas como o potencial de oxidação.
Por não fixar proteínas como o glutaraldeído, APA é sugestivamente mais apropriado à prevenção de infecções priônicas como as encefalopatias espongiformes transmissíveis, principalmente quando associado ao Cobre iônico20. Por ser eficaz em baixas concentrações apresenta vantagem sobre o hipoclorito de sódio por ser menos corrosivo para metais e indicado para controle de patógenos em alimentos e água para consumo humano21,22. Há protocolos de uso para o ácido peracético com diferentes concentrações, associados a equipamentos de perfusão e com acréscimo de calor durante a ação do químico23. Na odontologia o ácido peracético foi recentemente relacionado ao potencial de limpeza da smear layer dentinária com ação comparada ao EDTA24.
No protocolo de desinfecção de moldes deste estudo piloto, optou-se pela imersão dos corpos de provas em soluções desinfetantes25,26. Apesar desta desinfecção também poder ser realizada com borrifação das soluções27,28, não encontrou-se na literatura atual evidências para escolha da segunda.
Neste estudo, todas as cepas avaliadas foram susceptíveis à ação do ácido peracético. O protocolo de utilização do mesmo resultou em uma ação antimicrobiana semelhante ao hipoclorito de sódio e ao glutaraldeído. As proximidades dos valores dos halos de inibição mensurados são importantes principalmente quando valorizadas as evidências na eficácia da ação desinfetante do hipoclorito de sódio em ambientes hospitalares e ambulatoriais29,30. Esta eficácia corrobora a investigação de uma bactéria com nomenclatura validada no Brasil de Mycobacterium massiliense BRA100, responsável por milhares de infecções oportunistas, sendo considerada resistente a altas concentrações de glutaraldeído, foi sensível à ação do ácido peracético a 0,2%31.
A formação de halos de inibição com magnitude de 50 milímetros evidencia o potencial de dissociação da solução de APA. Mas estudos que avaliem a penetração do ácido peracético nos moldes odontológicos são necessários para se estimar o alcance de sua ação antimicrobiana.
Na intenção de analisar melhor os valores das médias, não paramétricas e ainda sem significância para p< 0,05, aplicou-se o teste de magnitude do efeito de Cohen13. Este teste proposto em 1992 quantifica o efeito da diferença entre dois grupos numa relação entre a variação das médias e de seus desvios padrões. São propostos três escores para avaliação dos efeitos entre grupos: "Cohen's d": d<0,2 para pequena magnitude, 0,2>d<0,5 para moderada magnitude ou d>0,5 para grande magnitude de efeito entre os dois grupos avaliados. Deste modo, pode-se perceber uma semelhança de comportamento dos desinfetantes ácido peracético, glutaraldeído e hipoclorito de sódio; e uma diferença do ácido peracético para os grupos controle G1 e com Clorexidina G5.
A Agência Nacional de Vigilância Sanitária (ANVISA) aprovou o ácido peracético como desinfetante de alto nível a partir de 199332 e corrobora os pareceres da Food and Drug Administration (FDA) publicados em 198833. Ambas admitem a utilização do mesmo como esterilizante, desinfetante de superfícies fixas, desinfetante para artigo semicrítico e para indústria alimentícia. A desinfecção de moldes adotada no presente estudo configura a utilização em artigo semicrítico3.
A clorexidina também é considerada um desinfetante eficaz. Sua utilização como composto integrante da formulação de hidrocolóide irreversível deve-se à sua estabilidade química e pH favoráveis34. Neste trabalho foram observados baixos valores de inibição do crescimento bacteriano para o grupo da clorexidina. Houve semelhança deste grupo comparando a ação antibacteriana com o grupo controle. É possível que a menor presença de umidade na superfície dos corpos de prova do G5 possa ter inibido uma maior dissociação no agar-agar e conseqüentemente menores halos de inibição.
Avaliando as limitações deste estudo, acredita-se que uma amostragem maior é necessária para uma avaliação quantitativa adequada. O ácido peracético apresenta-se comercialmente com variações do potencial oxidante, com associações de diferentes concentrações entre peróxidos e ácidos, que necessitam serem investigadas de forma consistente e detalhada. Este estudo piloto encoraja a continuidade da investigação do ácido peracético em suas diferentes apresentações como alternativa para desinfecção de moldes odontológicos.
CONCLUSÃO
Os resultados deste estudo piloto sugerem a eficácia anti-microbiana do ácido peracético na concentração de 0,2% nesta metodologia proposta. Houve inibição do crescimento das cepas de microrganismos selecionadas. Assim como para a solução de glutaraldeído a 2% e de hipoclorito de sódio a 2,5%. Mais estudos são necessários para evidenciar a proposta de utilização deste agente desinfetante.
AGRADECIMENTOS
Este trabalho teve o apoio FAPEMIG.
REFERÊNCIAS
1. Egusa H, Watamoto T, Matsumoto T, Abe K, Kobayashi M, Akashi Y, et al. Clinical evaluation of the efficacy of removing microorganisms to disinfect patient-derived dental impressions. Int J Prosthodont. 2008; 21:531-8. [ Links ]
2. Dwairi A, Nawaf Z. Infection control procedures in commercial dental laboratories in Jordan. J Dent Educ. 2007; 71:1223-7.
3. Chassot AL, Poisl MI, Samuel SM. In vivo and in vitro evaluation of the efficacy of a peracetic acid-based disinfectant for decontamination of acrylic resins. Braz Dent J. 2006; 17:117-21.
4. Casemiro LA, Pires-de-Souza FC, Panzeri H, Martins CH, Ito IY. In vitro antimicrobial activity of irreversible hydrocolloid impressions against 12 oral microorganisms. Braz Oral Res. 2007; 21:323-9.
5. Ceretta R, Paula MM, Angioletto E, Méier MM, Mitellstädt FG, Pich CT, et al. Evaluation of the effectiveness of peracetic acid in the sterilization of dental equipment. Indian J Med Microbiol. 2008; 26:117-22.
6. Kunigk L, Almeida MCB. Action of peracetic acid on Escherichia coli and Staphylococcus aureus in suspension or settled on stainless steel surfaces. Braz J Microbiol. 2001; 32:38-41.
7. Sagripanti JL, Bonifacino A. Cytotoxicity of liquid disinfectants. Surg Infect. 2000; 1:3-14.
8. Telli M, Guiral E, Martínez JA, Almela M, Bosch J, Vila J, et al. Prevalence of enterotoxins among Escherichia coli isolates causing bacteraemia. FEMS Microbiol Lett. 2010; 306:117-21.
9. Schwarzkopf R, Takemoto RC, Immerman I, Slover JD, Bosco JA. Prevalence of Staphylococcus aureus colonization in orthopaedic surgeons and their patients: a prospective cohort controlled study. J Bone Joint Surg Am. 2010; 92:1815-9.
10. Machado AP, Pimenta AT, Contijo PP, Geocze S, Fischman O. Microbiologic profile of flexible endoscope disinfection in two Brazilian hospitals. Arq Gastroenterol. 2006; 43:255-8.
11. Cuesta AI, Jewtuchowicz V, Brusca MI, Nastri ML, Rosa AC. Prevalence of Staphylococcus spp and Candida spp in the oral cavity and periodontal pockets of periodontal disease patients. Acta Odontol Latinoam. 2010; 23:20-6.
12. Lennette EH, Balows A, Hausler WJ, Shadomy HJ. Manual of clinical microbiology. Washington: American Society for Microbiology; 1985.
13. Cohen J. Quantitative methods in Psychology. Psychol Bull. 1992; 112:155-59.
14. Chandra A. Discuss the factors that affect the outcome of endodontic treatment. Aust Endod J. 2009; 35:98-107.
15. Gurgel-Filho ED, Vivacqua-Gomes N, Gomes BP, Ferraz CC, Zaia AA, Souza-Filho FJ. In vitro evaluation of the effectiveness of the chemomechanical preparation against Enterococcus faecalis after single- or multiplevisit root canal treatment. Braz Oral Res. 2007; 21:308-13.
16. Ferreira MA, Pereira-Cenci T, Rodrigues de Vasconcelos LM, Rodrigues-Garcia RC, Del Bel Cury AA. Efficacy of denture cleansers on denture liners contaminated with Candida species. Clin Oral Investig. 2009; 13:237-42.
17. Stampi S, De Luca G, Onorato M, Ambrogiani E, Zanetti F. Peracetic acid as an alternative wastewater disinfectant to chlorine dioxide. J Appl Microbiol. 2002; 93:721-31.
18. Zanetti F, De Luca G, Sacchetti R, Stampi S. Disinfection efficiency of peracetic acid: inactivation of coliphages and bacterial indicators in a municipal wastewater plant. Environ Technol. 2007; 28:1265-71.
19. Kitis M. Disinfection of wastewater with peracetic acid: a review. Environ Int. 2004; 30:47-55.
20. Lehmann S, Pastore M, Rogez-Kreuz C, Richard M, Belondrade M, Rauwel G, et al. New hospital disinfection processes for both conventional and prion infectious agents compatible with thermosensitive medical equipment. J Hosp Infect. 2009; 72:342-50.
21. De Luca G, Sacchetti R, Zanetti F, Leoni E. Comparative study on the efficiency of peracetic acid and chlorine dioxide at low doses in the disinfection of urban wastewaters. Ann Agric Environ Med. 2008; 15:217-24.
22. Vandekinderen F, Devlieghere B, De Meulenaer P, Ragaert J, Van Camp I. Optimization and evaluation of a decontamination step with peroxyacetic acid for fresh-cut produce. Food Microbiol. 2009; 26:882–8.
23. Food and Drug Administration [Internet]. Washington: USA. [cited 2010 jan 31]. Available from: http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/ReprocessingofSingle-UseDevices/ucm133514.htm
24. De Deus G, Souza EM, Marins JR, Reis C, Paciornik S, Zehnder M. Smear layer dissolution by peracetic acid of low concentration. Int Endod J. 2011; 44:485-90.
25. Rentzia A, Coleman DC, O'Donnell MJ, Dowling AH, O'Sullivan M. Disinfection procedures: their efficacy and effect on dimensional accuracy and surface quality of an irreversible hydrocolloid impression material. J Dent. 2011; 39:133-40.
26. Lu JX, Zhang FM, Chen YM, Qian M. The effect of disinfection on dimension stability of impressions. Shanghai Kou Qiang Yi Xue. 2004; 13:290-2.
27. Ghahramanloo A, Sadeghian A, Sohrabi K, Bidi A. A microbiologic investigation following the disinfection of irreversible hydrocolloid materials using the spray method. J Calif Dent Assoc. 2009; 37:471-7.
28. King BB, Norling BK, Seals R. Gypsum compatibility of antimicrobial alginates after spray disinfection. J Prosthodont. 1994; 3:219- 27.
29. Fukuzaki S. Mechanisms of actions of sodium hypochlorite in cleaning and disinfection processes. Biocontrol Sci. 2006; 11:147-57.
30. Vitali M, Protano C, Agolini G. Advantages of sodium hypochlorite or sodium dichloroisocyanurate disinfection for teats and bottles in newborn infants' feeding. Public Health Nurs. 2008; 25:103-5.
31. Lorena NS, Pitombo MB, Côrtes PB, Maya MC, da Silva MG, Carvalho AC, et.al. Mycobacterium massiliense BRA100 strain recovered from postsurgical infections: resistance to high concentrations of glutaraldehyde and alternative solutions for high level disinfection. Acta Cir Bras. 2010; 25:455-9.
32. Brasil. Ministério da Saúde. Portaria nº 122, de 29 de novembro de 1993. Brasília: Ministério da Saúde; 1993. [acesso em 2011 maio 24]. Disponível em: http://bvsms.saude.gov.br/bvs/ saudelegis/svs1/1993/prt0122_29_11_1993.html
33. Federal Register. General hospital and personal use devices: proposed classification of liquid chemical sterilizants and general purpose disinfectants. Proposed by Food and Drug Administration. 1998; 63:59917-21.
34. Flanagan DA, Palenik CJ, Setcos JC, Miller CH. Antimicrobial activities of dental impression materials. Dent Mater. 1998;14:399-404.
 Autor correspondente:
Autor correspondente:
Dimitri Ribas Fonseca
Secretaria do PPGOdonto/DO/UFVJM – Campus I
Rua da Glória, 187
CEP: 39100-000, Diamantina – MG – Brasil
E-mail: dimitri.ribas@gmail.com
Recebido em 31/01/2011 – Aceito em 26/05/2011













