Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Odontologia Clínico-Científica (Online)
versão On-line ISSN 1677-3888
Odontol. Clín.-Cient. (Online) vol.10 no.4 Recife Out./Dez. 2011
ARTIGO ORIGINAL / ORIGINAL ARTICLE
Avaliação microbiológica do processo de esterilização de artigos odontológicos segundo embalagens primárias e secundárias
Microbiological evaluation of dental articles' sterilization according primary and secondary packaging
Camilla Aparecida Silva de Oliveira I; Sidinei Miguel Costa I; Keli Bahia Felicíssimo Zocratto II; Kelly Moreira Grillo Ribeiro Branco III
I Alunos do Curso de Odontologia do Centro Universitário Newton Paiva
II Professora do curso de Odontologia do Centro Universitário Newton Paiva
III Coordenadora do Curso de Ciências Biológicas do Centro Universitário Newton Paiva
RESUMO
O empacotamento é uma das etapas para a preparação do artigo para a esterilização. A associação de embalagens primárias e secundárias nessa etapa tem sido descrita na literatura como uma benfeitoria para manutenção da esterilidade do material até o momento de sua utilização. Este estudo teve como objetivo avaliar os benefícios da utilização de uma embalagem secundária (embalagem plástica tipo ziploc) em relação à proteção do material estéril, armazenado em um período de sete dias, na central de material e esterilização. Foram utilizados 132 bastões de vidro como amostras, divididos em três grupos: grupo Controle (12 bastões de vidro esterilizados sem o invólucro primário e secundário); grupo A (60 bastões de vidro envolvidos em SMS) e grupo B (60 bastões de vidro envolvidos em SMS que receberam uma embalagem secundária - tipo zip loc - após a esterilização). Todas as amostras foram submetidas à análise microbiológica. Realizou-se análise descritiva e comparativa dos resultados. O grupo A apresentou um maior crescimento de colônias filamentosas e cremosas. Dessa forma, conclui-se que a embalagem secundária funcionou como uma proteção à passagem de partículas com microorganismos transportados pelo ar, pela umidade ou pela poeira, reduzindo a quantidade de contaminação.
Descritores: Esterilização; Microbiologia; Embalagem.
ABSTRACT
The packaging is one of the steps for preparing the article for sterilization. The association of primary and secondary packaging at this stage has been reported as a boon to maintain the sterility of the material until the time of use. This study aimed to evaluate the benefits of using a secondary packaging (ziplock type plastic bag) with respect to protection of the sterile material, stored in a period of seven days in the center of material and sterilization. We used 132 sticks of glass as samples, divided into three groups: control group (12 sterilized glass rods without the wrapper primary and secondary), group A (60 glass rods involved in SMS), group B (60 glass rods involved HSE received a secondary packaging, zip-loc after sterilization). All samples were submitted to microbiological analysis. We conducted descriptive and comparative analysis of results. Group A showed a higher growth of filamentous colonies and creamy. Thus, we conclude that the secondary packaging functioned as a protection to the passage of airborne microorganisms' particles, by moisture or dust, reducing the amount of contamination.
Keywords: Sterilization; Microbiology; Packaging.
INTRODUÇÃO
O reprocessamento dos artigos odonto-médicos hospitalares possuem etapas obrigatórias interdependentes, como: recepção, descontaminação, lavagem, secagem, separação, empacotamento, distribuição dos pacotes no interior do aparelho esterilizador, armazenamento e distribuição das embalagens estéreis. Todas essas etapas devem ser realizadas de forma adequada, para que seja mantida a esterilidade do material até o momento da sua utilização 1-4.
O empacotamento é a etapa de preparação do artigo para a esterilização. Todo artigo a ser esterilizado, armazenado e transportado deve ser envolvido em uma embalagem compatível com o processo de esterilização. O ato de embalar o material significa acondicionar, empacotar, proteger o conteúdo 2-4.
Uma embalagem ideal para o processo de esterilização deve ter as seguintes características:
• permitir a esterilização do material e ser compatível com o processo de esterilização;
• manter a esterilidade do material até a abertura dos pacotes, mantendo a integridade do material durante o transporte e o manuseio;
• promover uma barreira que impeça a entrada de microorganismos do meio ambiente para o interior da embalagem;
• não liberar substâncias químicas que coloquem em risco a saúde ou que leve à alteração do material estéril;
• conter indicadores para mostrar que o produto foi realmente esterilizado;
• possibilitar a abertura do pacote de forma fácil e asséptica e ter um indicador de que o pacote foi aberto, não permitindo sua reutilização;
• ter a gramatura e a massa dos pacotes uniformes, sem apresentar partes transparentes e áreas heterogêneas;
• resistir à umidade, impedindo que pequenas gotículas de água possam entrar no pacote;
• ser flexível, facilitando o seu manuseio; e
• ter um baixo custo1-11.
O uso da dupla embalagem é recomendado pela norma ISO 11607-2:2006, que aconselha a existência de um sistema de embalagens, em que se associa uma barreira estéril com um invólucro de proteção. O sistema de barreira estéril consiste no empacotamento interno dos artigos com embalagens ideais. Estas irão prevenir a entrada de microorganismos e permitir a apresentação asséptica do produto em ponto de uso. O invólucro de proteção foi acrescentado para proteger e prevenir danos ao sistema estéril. Essa embalagem funciona como uma barreira de proteção contra a poeira e previne os danos durante o transporte12.
De acordo com o sistema de embalagens, os invólucros podem ser classificados como: embalagens primárias e embalagens secundárias4,9,12-14. As embalagens primárias têm como objetivo vedar o artigo para evitar a recontaminação do material após ser esterilizado, pois, ao saírem da autoclave, esses materiais entram em contato direto com o meio ambiente, são transportados, manipulados e, na maioria das vezes, armazenados por um determinado período de tempo4,9,13,14.
No mercado, existem diversos tipos de embalagens primárias próprias para o processo de esterilização, que variam de acordo com o processo a ser empregado. Atualmente, a forma de esterilização mais segura e utilizada na odontologia é a de vapor saturado sob pressão, por meio de autoclaves. Para essa forma de esterilização, é recomendado que seja utilizado papel grau cirúrgico, spunbonded/meltblown/ spunbonded(SMS), papel crepado, tecido não tecido (TNT), tecido de algodão duplo, vidro e nylon, cassetes, caixas metálicas perfuradas, havendo, ainda, relatos na literatura do uso de papel Kraft e tecido tipo brim 3,4,8,11.
Cabe a cada serviço de saúde definir a embalagem a ser utilizada na Central de Material e Esterilização e o tempo de validade da esterilização. O tempo de validade varia de acordo com as condições em que esse material é armazenado, transportado, manuseado e, ainda, com o tipo de embalagem utilizada. Com tantas variáveis a serem avaliadas, torna-se difícil determinar uma única validade de acordo com os tipos de embalagem. Porém, existem tabelas de recomendações sobre a validade da esterilização divulgada pelo Centro de Controle de doenças ou pelo Ministério da Saúde que são baseadas em estudos científicos que podem nortear as instituições a estabelecer o seu tempo de validade de acordo com invólucros 5,15-19.
Com a presença de diversas variáveis envolvidas na permanência da esterilidade do material até o momento do uso, recomenda-se o uso de embalagens secundárias. Estas são utilizadas para garantir a proteção contra a umidade e a poeira e aumentar o período de validade, principalmente em locais onde os parâmetros ideais, como o armazenamento em armários fechados, não são utilizados. Quando essas embalagens são adicionadas aos invólucros que foram esterilizados por meio físico, o prazo de armazenamento passa de uma semana para trinta dias. Essas embalagens devem ser aplicadas no material após o processo de esterilização com a embalagem primária e o resfriamento desse material9,15,18.
Nesse sentido, o objetivo desse estudo é avaliar os benefícios da utilização de uma embalagem secundária (embalagem plástica tipo ziploc) em relação à proteção do material estéril, armazenados em um período de sete dias na área de estocagem da Central de Material e Esterilização.
MATERIAL E MÉTODOS
O presente estudo foi realizado na Central de Material e Esterilização (CME) do curso de odontologia de uma faculdade no município de Belo Horizonte - MG, no ano de 2010. Foram utilizados 132 bastões de vidro como amostras. Esses bastões foram divididos em três grupos: grupo controle (12 bastões de vidro esterilizados sem o invólucro primário e secundário); grupo A (60 bastões de vidro envolvidos em SMS - Reg. MS. 80.063.160.006); grupo B (60 bastões de vidro envolvidos em SMS que receberam uma embalagem secundária - tipo zip loc com tamanho de 8,5 cm X 14 cmX 0,08 mm - após a esterilização).
O empacotamento desses bastões de vidro foi realizado na área de preparo e acondicionamento, seguindo a técnica do envelope14. Todas as amostras foram processadas em uma autoclave pré-vácuo, tipo pulsante (BAWMER®), a uma temperatura de 134°C, pelo tempo de esterilização de 15 minutos. Foram submetidas ao primeiro ciclo completo da autoclave que teve uma duração de aproximadamente uma hora. Como controle do processo de esterilização, foi realizado o teste Bowie & Dick (DIATEST®), utilizando um ciclo próprio, prévio ao ciclo de processamento das amostras. Também foi empregado, na parte externa de todos os invólucros, um indicador químico, do tipo fita adesiva termo-sensível (CIEX®). O indicador biológico padronizado com esporos de Bacillus stearothermophylus (EZ TEST®) também foi empregado nesse ciclo de esterilização, e seu resultado serviu como o controle negativo desse estudo.
Após a realização do ciclo de esterilização, as amostras foram resfriadas por 30 minutos. Todas as amostras foram retiradas do rack da autoclave e armazenadas em dois armários da área de estocagem da CME. O grupo B recebeu a embalagem secundária antes de seu armazenamento. Esses armários possuem 6 divisórias cada que foram previamente limpas pela fricção de água e sabão, álcool 70% e posterior borrifo de ácido peracético. Cada divisória recebeu uma amostra do grupo controle e cinco amostras do grupo A e B. As amostras permaneceram armazenadas nos armários, durante sete dias. Durante esses sete dias de armazenamento, realizou-se a medição da temperatura e umidade do ar, utilizando-se um higrotermômetro (MINIPA® /NP 241).
Transcorridos os sete dias de armazenamento, todas as amostras foram recolhidas e levadas para o laboratório de microbiologia. Usou-se ágar nutriente e ágar sabouraud como meios para semeadura que se deu em uma capela de fluxo laminar. Em seguida, as placas com os meios de cultura foram incubadas e, após esse período, realizou-se a leitura e o registro das culturas, levando em consideração se as colônias presentes eram cremosas ou filamentosas e o número de unidades formadoras de colônias (UFC). As placas que tiveram crescimento cremoso foram submetidas ao teste de Gram e analisadas no microscópico óptico com aumento de 1.000 vezes.
Na análise estatística dos dados, realizou-se análise descritiva por meio da distribuição das frequências e análise comparativa de grupos pelo teste do qui-quadrado a um nível de significância de 5%.
RESULTADOS E DISCUSSÃO
A manutenção da esterilidade dos artigos odonto-médico hospitalares depende de múltiplos fatores do processo de esterilização, que vai desde o preparo e acondicionamento até o armazenamento e manuseio desses invólucros. Para garantir a eficácia do método de esterilização, indicadores físico, químico e biológico são utilizados para monitorar o ciclo de esterilização. No presente estudo, todos os indicadores adotados durante o ciclo de esterilização atestaram a eficácia desse processo. O controle biológico serviu como controle negativo desse estudo sem apresentar qualquer tipo de crescimento microbiano após sua incubação por 48 horas 1-4.
Após o ciclo de esterilização dos materiais, outros fatores devem ser observados, pois podem contribuir para a recontaminação dos produtos. Dentre esses fatores, destaca- se o tipo de invólucro utilizado, as condições de armazenagem e a manipulação8,16,17,19. As amostras do presente estudo foram armazenadas nos armários da CME. Esses armários não apresentaram umidade, encontrando-se devidamente limpos e fechados. Suas portas só eram abertas, quando se fazia necessário o manuseio desses materiais. Essas condições coincidem com as condições ideais de um local de armazenagem, o qual, segundo a literatura, deve ser fechado, limpo, livre de poeira, umidade e insetos, com uma distância mínima de 20cm do teto e 5cm da parede 3,17. A não esterilidade desse ambiente pôde ser confirmada pelo crescimento microbiano nos controles positivos do presente estudo, em que se observou o crescimento de colônias filamentosas (UFC=11) e cremosas (UFC=4), resultado esse que é corroborado por outro estudo13.
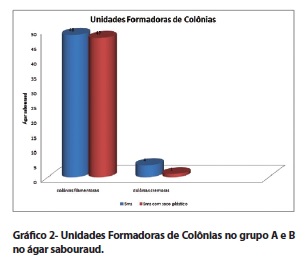
O Grupo A apresentou crescimento microbiano em 33 (55%) amostras no ágar nutriente (AN). Das amostras contaminadas, 22 (66,6%) apresentaram crescimento de colônias filamentosas e 12 (36,4%) apresentaram colônias cremosas. O total de unidades formadoras de colônias nesse meio de cultura foi de 124 colônias filamentosas e 21 colônias cremosas (gráfico 1). No ágar Sabouraud (AS), 29 (48,3%) amostras apresentaram crescimento microbiano, sendo que 26 (89,6%) apresentaram colônias filamentosas e 3 (10,4%) colônias cremosas. O total de unidades formadoras de colônias nesse meio de cultura foi de 48 colônias filamentosas e 4 colônias cremosas (gráfico 2).
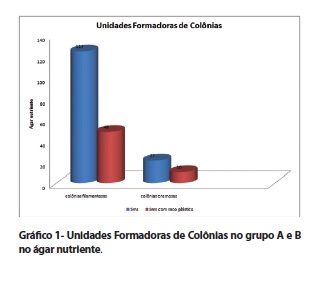
Em ambos os meios de cultura utilizados, no grupo A, houve um maior crescimento de colônias filamentosas. Na análise comparativa dos grupos, houve significância estatística (p<0,05) quando avaliado o número de amostras com crescimento filamentoso. O crescimento de fungos é comum em ambientes sem ventilação, com umidade e temperaturas inadequadas e sem medidas higiênicas preventivas ou de manutenção. A presença desses microorganismos resulta, geralmente, da falta de adequação do espaço físico à sua função20. Os armários nos quais as amostras desse trabalho foram armazenadas receberam medidas higiênicas preventivas, embora, durante os 7 dias de armazenamento, nenhum tipo de limpeza de manutenção foi realizada. O recomendável é que se realize a limpeza com água e sabão nos armários, diariamente e com álcool 70% semanalmente, procedimento o qual não foi realizado no presente estudo e pode ter contribuído para a propagação de microorganismos nas amostras21. A limpeza mecânica das superfícies é de grande importância, pois tem a capacidade de reduzir a carga microbiana a níveis considerados toleráveis e remover a sujidade. Aspectos técnicos devem ser respeitados durante a limpeza, que deve ser realizada de cima para baixo, de dentro para fora e sem movimentos de fricção de vaivém22.
A temperatura também é um importante fator, que contribui para o crescimento desses microorganismos. Durante os sete dias de armazenamento das amostras desse estudo, a área de estocagem apresentou temperaturas entre 26° a 29° C, o que pode ter contribuído para o crescimento microbiano nessas amostras. Temperaturas elevadas como as que foram encontradas nesse estudo podem aumentar o número de unidades formadoras de colônias, como descrito em outra pesquisa23. O ideal é que a temperatura da área de estocagem permaneça entre 18° a 22°C 2,24-25, informação que contradiz com o que foi observado nesse estudo. Já a umidade relativa do ar encontrada na presente pesquisa se manteve entre 56 a 65%. Existe controvérsia na literatura relacionada a essa medida; para alguns autores, o ideal é que a umidade relativa desse ambiente esteja entre 35 a 70% 2,24-25, o que estaria em consenso com os valores encontrados no presente trabalho. No entanto, outros autores relatam que o ideal é que a umidade relativa do ar esteja entre 30 a 60%, pois medidas elevadas poderiam contribuir para a contaminação dos materiais armazenados na CME (26). Dessa maneira, as temperaturas encontradas no presente estudo estariam acima do ideal, o que provavelmente tenha contribuído para a contaminação das amostras.
O grupo B apresentou crescimento microbiano no AN em 28 (46,6%) amostras, sendo que 20 (71,4%) dessas amostras contaminadas apresentaram crescimento filamentoso e 8 (28,6%) apresentaram crescimento cremoso. O total de unidades formadoras de colônias nesse grupo foram 48 colônias filamentosas e 10 colônias cremosas (gráfico 1). No AS, 26 (43,3%) amostras apresentaram crescimento de microorganismos, sendo que 25 (96,15%) delas apresentaram colônias filamentosas e 1 (3,9%) apresentou colônias cremosas. O número de UFC nesse meio foi de 48 colônias filamentosas e 10 colônias cremosas (gráfico 2).
Em ambos os grupos do presente estudo, houve crescimento de colônias cremosas, no entanto, ao se realizar o teste do qui-quadrado, percebeu-se que houve maior crescimento de colônias cremosas no grupo A com significância estatística (p<0,01). Por meio do teste do gram e da análise microscópica, identificou-se a presença de bactérias do tipo bacilos gram positivos, cocos gram positivos e estafilococos. Microorganismos, como os estafilococos, principalmente Stapylococcus aureus, são transmitidos e locomovidos pelo ar, quando aderidos nas partículas de poeira. Esses microorganismos podem ser expelidos durante a conversação, tosse ou espirro, formando, então, um aerosol bacteriano com partículas de tamanhos variados. Essas partículas permanecem em suspensão por até 16 horas, caindo posteriormente, ao piso e juntando-se à poeira, sendo mais tarde ressuspensas pela corrente de ar ou pelo trânsito de pessoas. Dessa forma, acredita-se que esses agentes microbianos podem penetrar nos materiais envolvidos pelas embalagens, principalmente se essas estiverem em ambientes úmidos27. Por isso, a central de esterilização é um ambiente que sempre deve estar limpo, seco, livre de poeira e com uma circulação restrita aos funcionários do setor. De preferência, os armários desse ambiente também devem ser fechados e de fácil limpeza. Embora muitas centrais sigam a exigência de se utilizarem armários fechados, as suas portas são abertas frequentemente para a remoção de material estéril, o que pode favorecer a contaminação microbiana dos invólucros que ali estão armazenados17,24. No presente estudo, as portas dos armários eram fechadas, mas a abertura destas acontecia quando era necessário se manusearem os materiais. Nesse caso, a utilização de uma cobertura de plástico como uma embalagem secundária (Grupo B) recebeu uma quantidade de contaminação menor quando comparado ao grupo que utilizou apenas a embalagem primária (Grupo A), comprovando a sua efetividade, mencionada pela literatura9,15,18. O manuseio de materiais estéreis antes do momento da sua utilização pode ser considerado uma fonte contaminante. A principal via de transmissão de microorganismos são as mãos, pois a pele é um reservatório, que abriga diversos microorganismos, como os estafilococos e os micrococos, e os agentes transitórios, como fungos e bactérias aeróbias, formadoras de esporos. As bactérias e os fungos podem ser transmitidos de uma superfície para outra por meio do contato direto, indireto ou por superfícies contaminadas1,28-30. O ideal é que todos os profissionais que atuam na manipulação de material estéril ou contaminado realizem a higienização das mãos com água e sabão quando elas estiverem visivelmente sujas e com preparação alcoólica quando as mãos não estiverem aparentemente sujas30. A lavagem das mãos é uma conduta simples, barata e eficaz na prevenção das infecções e diminui a possibilidade da recontaminação dos artigos. Entretanto, na maioria das vezes, essa prática é negligenciada, por isso o recomendável é que exista uma pia ou dispersadores de álcool gel próximos à porta da entrada da área de armazenamento e distribuição, para que os funcionários higienizem as mãos antes de entrarem nesse ambiente. O fácil acesso aos suprimentos necessários para realizar a higienização das mãos é essencial à adesão dos profissionais a essa prática2,25,26,30. No presente estudo, houve maior contaminação por bactérias nas amostras que não estavam envolvidas no invólucro secundário (grupo A). Essa contaminação provavelmente se deu porque as pessoas que manusearam esses materiais colocaram suas mãos diretamente sobre os invólucros primários que estavam sem nenhuma proteção secundária. A utilização de embalagens secundárias contribui para reduzir a contaminação, fato que pode ser confirmado pelos resultados encontrados no grupo B do presente estudo, em que houve uma menor contaminação quando comparado ao grupo A.
A literatura relata que a embalagem secundária funciona como uma proteção à passagem de microorganismos transportados pelo ar, pela umidade ou pela poeira, reduzindo a quantidade de contaminação 9,12. Essa afirmação condiz com os resultados deste presente estudo: a menor quantidade de crescimento nas amostras oriundas do grupo B sugere que a embalagem secundária realmente funcionou como uma barreira de proteção tanto para a contaminação de fungos quanto para a contaminação de bactérias.
Os tipos de invólucros utilizados também são importantes para a manutenção da esterilidade do material durante o seu período de armazenamento. Eles devem apresentar as características ideais, como as embalagens de SMS, que têm uma barreira microbiana, por serem repelentes, não liberaram partículas e têm múltiplas fibras e camadas, que formam um caminho tortuoso. No entanto, a manutenção da esterilidade não está relacionada, apenas, às características dessa embalagem. Esse tecido pode sofrer danificações pelos próprios artigos embalados nesses invólucros, por meio da fricção e do deslizamento, facilitando, assim, a recontaminação6. O método de esterilização e as condições de manuseio e armazenamento também podem contribuir para recontaminar o material, variando eles de uma unidade de serviço para a outra, impedindo, então, que se estabeleça um prazo genérico de esterilização. Cabe a cada serviço estipular o seu prazo de validade, embasado nas condições do local de serviço8,11,17. No presente estudo, avaliaram-se as amostras no prazo de validade de sete dias, o qual está estipulado no manual de biossegurança da instituição de ensino onde este estudo foi realizado. É preciso que se realizem outros estudos, analisando-se todas as condições de armazenagem da CME, buscando identificar quais fatores podem estar contribuindo para a recontaminação desse material nesse período de armazenamento.
CONCLUSÃO
A embalagem secundária funcionou como uma proteção à passagem de partículas com microorganismos transportados pelo ar, pela umidade ou pela poeira, reduzindo a quantidade de contaminação. Essa embalagem serviu como uma proteção durante o manuseio desses materiais, já que o grupo B apresentou uma menor contaminação bacteriana do que o grupo A.
REFERÊNCIAS
1. Santos IBC, Oliveira TL, Nogueira MJF. A embalagem para esterilização sob a ótica assistencial do enfermeiro. Rev.SOBECC 2002; 7(1):7-20. [ Links ]
2. Possari JP. Centro de Material e Esterilização: planejamento e gestão. 3. ed. São Paulo: Iátria, 2007.
3. Serratine ACP, Rocha MJC. Avaliação da esterilização realizada por meio de estufas (forno de pasteur) em consultórios odontológicos da grande Florianópolis. Rev. Alcance 1998; 5(4):53-58.
4. Costa, EAM. Estudo de custo-benefício de embalagens para esterilização. Rev. SOBECC 2004;9(4):38-43.
5. Schwartz R, Davis R. Safe storage times for sterile dental packs. Oral Surg. Oral Med. Oral Pathol 1990; 70(3): 297-300.
6. Goveia VR. Embalagens para esterilização: tecidos e não tecidos. Rev. SOBECC 1997; 2(4):10-2.
7. Pinter MG, Gabrielloni MC. Validação de embalagens de algodão duplo e papel grau cirúrgico – relato de experiência. Acta Paul. Enf. 2000; 12(especial):94-95.
8. Brito MFP, Galvão CM, Françolin L, Rotta CSG. Validação do processo de esterilização de artigos médico-hospitalares, segundo diferentes embalagens. Rev. Bras. Enferm.2002; 55(4):414-419.
9. Huys JO. Sterilization of Medical Supplies by Steam. 2.ed. Renkum, The Netherlands: Heart Consultancy. 2004.
10. Rodrigues E, Levin AS, Sinto SI, Mendes CF, Barbosa B, Graziano KU. Evaluation of the use and re-use of cotton fabrics as medical and hospital wraps. Braz. J. Microbiol 2006; 37:113-116.
11. Brasil, Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Serviços odontológicos: prevenção e controle de riscos. Brasília, 152p, 2006.
12. Pereira R. Embalagens de esterilização – o que você precisa saber sobre: normas técnicas. In: CONGRESSO PAN-AMERICANO DE ESTERILIZAÇÃO – SIMPÓSIO INTERNACIONAL DE ESTERILIZAÇÃO E CONTROLE DE INFECÇÃO HOSPITALAR – SOBBEC, V, 2008, São Paulo. Palestra. Disponibilidade e acesso: <http:// www.wfhss.com/html/conf/br_sobecc_conf20080724_lectures_ pt.htm>.
13. Webster J, Radke E, George N, Faoagali J, Harris M. Barrier properties and cost implications of a single versus a double wrap for storing sterile instrument packs. Am. J. Infect .Control 2005;33(6):348-352.
14. Kavanagh CMG. Elaboração de manual de procedimentos em central de materiais e esterilização. Ed. São Paulo: Atheneu; 2007.
15. Standard PG, Mackel DC, Mallison GF. Microbial penetration of muslin - and paper- wrapped sterile packs stored on open shelves and in closed cabinets. Apol. Microbiol.1971; 22(3):432-437.
16- Butt WE, Bradley, DV, Mayhew RB, Schwartz RS. Evaluation of the shelf life of sterile instrument packs. Oral Surg. Oral Med. Oral Pathol 1991;72(6):650-654.
17- Padoveze MC, Nakamura, MHY, Blanco VLO, Calusni ALR, Ceribelli MIPF. Recontaminação microbiana em artigos processados por autoclave e embalados em tecido e papel grau cirúrgico. Rev. SOBECC 2001;6(3):24-27.
18- Bhumisrikaul W, Bhumisrikaul P, Pongchaires P. Long-term storage of small surgical instruments in autoclaved packages. Asian J. Surg. 2003;26(4): 202-204.
19- Joan LSP, Norhashimawati, Khor S. Time versus event-related sterility: Linen & Pouch packaging remain sterile over a year of storage and handling. Nurs. J. Singapore 2010; 37(1):34-42.
20- Rosa H, Lemos JA, Costa CR, Silva MRR, Fernandes OFL. Ocorrência de fungos filamentosos em acervo da faculdade de medicina da universidade federal de Goiás. Rev. patol. trop. 2008; 37(1):65-69.
21- Santos JM, Gomes FVL. Rotina de limpeza do ambiente hospitalar. Goiânia, 53p. 2005. Disponibilidade e acesso: <www.santacasago.org.br/.../ccih_rotinas_de_limpeza_do_ ambiente_hospitalar.pdf >
22- Andrade D, Ferrazere MVG, Santos LS, Moraes M, FREIRE E, Ito IY. Uso de sabões e detergentes em serviços de saúde: novos contextos, outros olhares? Rev. Panam. Infectol. 2006; 8(4):33-37.
23-Filho TRM, Groppo FC, Pacheco ABND, Motta RHL. Influência da climatização da clínica odontológica sobre o número de microorganismos dispersos no ar. Revista Lecta 2002; 20(2):171-176.
24- Guadagnin, SVT, Primo, MGB, Tipple AFV, Souza ACS. Centro de Material e Esterilização: padrões arquitetônicos e o processamento de artigos. Rev. Eletrônica de Enfermagem 2005; 7(3): 285-293.
25- Souza NC. Uma aplicação do custeio baseado em atividades na central de materiais esterilizados de hospitais. Rev. Multiface 2007; 1(2):56-66.
26- Rodrigues AB. Central de Material Esterilizado: rotinas técnicas. Belo Horizonte: Health, 1995.
27- Abrahão AR, Lélis MAS, Possas OS, Castro RAP. Análise da contaminação de soluções parenterais pela exposição ao ar. Acta. Paul. Enf. 1989; 2(4):128-133.
28- Custódio J, Alves JF, Silva F M, Dolinger EJO, Santos, JGS; Brito DD. Avaliação microbiológica das mãos de profissionais da saúde de um hospital particular de Itumbiara. Rev. Cien. Med.2009;18(1):7-11.
29- Oliveira DGM, Souza PR, Watanable E, Andrade D. Avaliação da higiene das mãos na perspectiva microbiológica. Rev. Panaman. Infectol. 2010; 12(3):28-32.
30- Brasil, Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Higienização das mãos. Brasília: 2010.
 Endereço para correspondência:
Endereço para correspondência:
Keli Bahia Felicíssimo Zocratto
Rua Tenente Anastácio de Moura, 740/202
Belo Horizonte/MG CEP: 30240390
E-mail: kelibahia.prof@newtonpaiva.br
Recebido para publicação: 02/06/11
Aceito para publicação: 22/06/11













