Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista de Cirurgia e Traumatologia Buco-maxilo-facial
versão On-line ISSN 1808-5210
Rev. cir. traumatol. buco-maxilo-fac. vol.11 no.3 Camaragibe Jul./Set. 2011
Reconstrução de bossa frontal com implante de polimetilmetacrilato: relato de dois casos
Reconstruction of frontal vault with a polymethylmethacrylate implant: a report of two cases
Arlei CerqueiraI; Fernando Bastos Pereira JúniorII;Marília Spínola AzevêdoIII; Thaise Gomes FerreiraIII
I Doutor em Cirurgia e Traumatologia Buco-Maxilo-Facial. Assistente do Serviço de Cirurgia e Traumatologia Buco-Maxilo-Facial do Hospital Geral Roberto Santos / Escola Bahiana de Medicina e Saúde Pública.
II Doutor em Cirurgia e Traumatologia Buco-Maxilo-Facial. Coordenador do Serviço de Cirurgia e Traumatologia Buco-Maxilo-Facial do Hospital Geral Roberto Santos / Escola Bahiana de Medicina e Saúde Pública.
III Cirurgiã-dentista graduada pela Escola Bahiana de Medicina e Saúde Pública.
RESUMO
A eleição de um substituto ósseo e a reconstrução de defeitos extensos ainda são um desafio para a cirurgia reparadora. Para a reconstrução craniana, existem dois grupos principais de materiais utilizados, o enxerto ósseo autógeno e os materiais aloplásticos, como o titânio, polietileno de alta densidade (Medpor) e o polimetilmetacrilato (PMMA). A confecção da prótese de PMMA pode ser executada no período pré-operatório, utilizando-se biomodelos de prototipagem rápida ou durante o procedimento cirúrgico, aplicando-se diretamente sobre os tecidos. O objetivo do presente trabalho é apresentar a utilização do PMMA na reconstrução craniofacial, por meio de dois casos clínicos, solucionados com técnicas distintas. No primeiro caso, realizou-se a excisão de tumor em seio frontal, e o contorno foi restabelecido por meio da técnica direta; no segundo, foi feita a reconstrução de sequela de traumatismo cranioencefálico, utilizando-se a técnica indireta e biomodelo. Benefícios foram observados por meio da utilização de biomodelos de prototipagem rápida, no que tange à redução da morbidade e o tempo cirúrgico bem como a melhoria na qualidade da prótese confeccionada.
Descritores: Cirurgia bucal; Polimetil Metacrilato; Modelos anatômicos; Diagnóstico por computador.
ABSTRACT
The choice of a replacement for bone and the reconstruction of large defects is still a challenge for maxillofacial surgery. For cranial reconstruction, two main groups of materials have been used, namely autogenous bone grafts and alloplastic materials, such as titanium, high-density polyethylene (Medpor) and polymethylmethacrylate (PMMA). The confection of a PMMA prosthesis can be done preoperatively, using biomodels of rapid prototyping or during the operative procedure, when it is molded directly onto the tissues. The aim of this study is to report the use of PMMA in craniofacial reconstruction in two clinical cases, successfully treated with different techniques. In the first case an excision of the tumor was performed on a frontal sinus, with the contour being restored using the direct technique; in the second case the reconstruction of a sequela of a traumatic cranial injury was done using the indirect technique and a biomodel. Benefits were observed with use of biomodels permitting rapid prototyping, such as a decrease in morbidity and operative time, as well as the improved quality of the prothesis.
Keywords: Surgery, Oral; Polymethyl Methacrylate; Models, anatomic; Diagnosis, Computer- Assisted.
INTRODUÇÃO
Nos dias atuais, as causas das fraturas faciais podem variar de acordo com a área geográfica, condição econômica e cultural estudada1. Na maioria dos grandes centros, os principais agentes etiológicos encontram-se entre acidentes automobilísticos e agressões físicas1,2,3. O aumento da violência e a imprudência no trânsito são fatores importantes, que contribuem para a elevação do número de casos de fraturas faciais4.
Em nossa rotina, muitas fraturas, sobretudo aquelas provenientes de traumas de alto impacto, como acidentes automobilísticos ou ferimentos por arma de fogo, provocam sequelas de difícil resolução. Nesses casos, a abordagem tardia das fraturas (devido a períodos prolongados em unidades de terapia intensiva), a perda de substância e remodelação dos ossos fraturados tornam quase impossível uma redução satisfatória dos segmentos.
A cranioplastia, no tratamento de sequelas cranianas, tem como objetivo a reabilitação morfológica e funcional do crânio. Essa técnica é indicada para defeitos ósseos causados por tumores, traumatismos, infecções da região craniana ou descompressão cerebral5,6. O tratamento de sequelas ósseas é um verdadeiro desafio aos profissionais que militam na cirurgia maxilofacial, muitas vezes aceitando resultados pobres como definitivos.
Tecnologias recentemente incorporadas, como a prototipagem rápida, permitem a simulação de procedimentos e a confecção de órteses e próteses personalizadas, reduzindo a morbidade e melhorando os resultados obtidos. Mesmo com esse recurso, a eleição de um material substitutivo para grandes defeitos pode gerar considerável controvérsia6,7,8.
A seleção de um material de reconstrução deve considerar amplas propriedades como biocompatibilidade, radiopacidade, custo, osteocondutividade, risco de infecção, simplicidade no preparo e na aplicação6,9,10.
Podem-se identificar dois grupos principais de materiais utilizados para a reconstrução maxilofacial, os enxertos ósseos (autógenos, alógenos ou xenógenos)3,6 e os materiais aloplásticos, com a grande vantagem de reduzir a morbidade do tratamento, ter grande disponibilidade e permitir a confecção de peças personalizadas11,12.
Dentre os materiais aloplásticos, podemos citar o titânio, o polietileno poroso, a hidroxiapatita e o polimetilmetacrilato - PMMA. O PMMA na cranioplastia tem como vantagens o baixo custo, mínima reação inflamatória, fácil disponibilidade e excelente adaptação ao contorno do defeito craniano9,12-15. Como desvantagens, apresenta alta adesão bacteriana, sendo pouco tolerante à infecção e relativamente pobre em osteocondutividade12,14.
O objetivo do presente trabalho é apresentar a utilização do PMMA na reconstrução craniofacial, por meio de dois casos clínicos com técnicas distintas, tecendo considerações quanto às complicações.
RELATO DE CASO
Caso 1
Paciente do gênero masculino, 36 anos, foi encaminhado ao Serviço de Cirurgia e Traumatologia Buco-Maxilo-Facial para excisão de lesão em seio frontal, com rompimento da tábua vestibular, provocando abaulamento da região frontal (Fig. 1). Esse paciente havia se submetido à biópsia incisional prévia num serviço de cirurgia de cabeça e pescoço que revelou tratar-se de tecido fibromuscular e adiposo, isento de atipias.
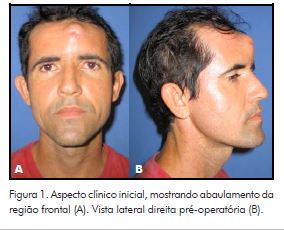
Para o referido paciente, foi programada excisão do tumor por acesso coronal e reconstrução imediata com PMMA por meio da técnica direta. Após anestesia geral, a enucleação do tumor transcorreu sem dificuldades e optou-se pela remoção do periósteo aderido à lesão devido à manipulação prévia, durante a biópsia incisional.
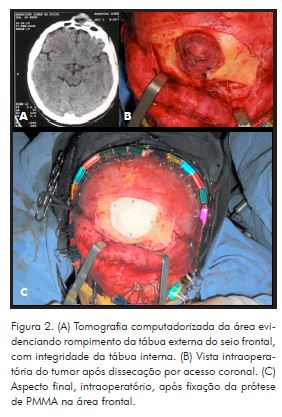
A reconstrução do defeito ósseo remanescente foi realizada pelo preenchimento do seio frontal com gaze úmida e pela adição de cimento de PMMA manipulado diretamente sobre o defeito, com acabamento manual, e, após a polimerização do material, a gaze utilizada para tamponamento do seio frontal foi removida, e a prótese, fixada com parafusos do sistema 1,5mm (Fig. 2). A sutura foi realizada no plano cutâneo utilizando-se fio de nylon por meio da técnica contínua festonada. No período pós-operatório, o paciente foi mantido com antibióticos de rotina para a profilaxia de infecções do trato respiratório superior, cefalotina e cefalexina, bem como anti-inflamatórios esteroidais e analgésico comum.
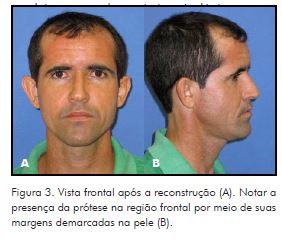
A recuperação do paciente transcorreu sem complicações, e os resultados foram considerados satisfatórios (Fig. 3), no entanto o laudo anatomopatológico foi diferente daquele obtido inicialmente. Com o novo diagnóstico de carcinoma escamocelular moderadamente diferenciado, esse paciente foi encaminhado ao oncologista que estabeleceu como conduta acompanhamento imaginológico.
Caso 2
Paciente do gênero feminino, 19 anos, foi vítima de acidente automobilístico grave, com traumatismo cranioencefálico (TCE) e perda de massa encefálica, evoluindo com infecção recorrente e sequelas neuromotoras.
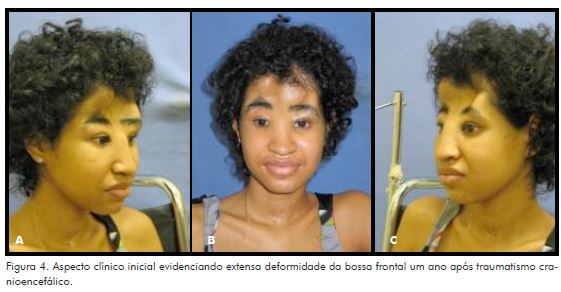
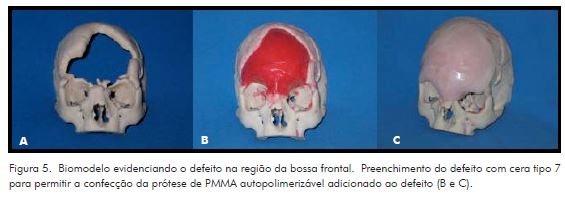
Após um ano do acidente, mediante alta neurológica, a referida paciente foi encaminhada ao Serviço de Cirurgia Buco-Maxilo-Facial para reconstrução da bossa frontal. Nessa época, apresentava-se lúcida e orientada, com sequelas na fala e paraplegia. Ao exame regional, observou-se extensa deformidade da bossa frontal com depleção, caracterizada pela ausência completa de remanescentes ósseos e telecanto traumático (Fig. 4).
Considerando a complexidade do caso, o planejamento incluiu a confecção de biomodelo de prototipagem rápida, obtido por sinterização seletiva a laser, disponibilizado pelo Centro de Pesquisas Renato Archer do Ministério da Ciência e Tecnologia, e prótese personalizada de PMMA. Para a confecção da prótese, foi realizado o preenchimento do defeito com cera odontológica tipo sete e adicionado cimento de polimetilmetacrilato autopolimerizável de uso odontológico. Após acabamento em laboratório de prótese dentária, a peça foi esterilizada em óxido de etileno (Fig. 5).
O procedimento cirúrgico contou com a participação de médico neurocirurgião para a separação das meninges e foi finalizado pela equipe de cirurgia buco-maxilo-facial. Por meio de acesso coronal, foram necessárias cerca de três horas até a finalização do procedimento. Após a dissecção das meninges, coube à equipe de bucomaxilofacial expor os limites ósseos e adaptar a prótese, com especial atenção ao dorso nasal e teto orbital. Sendo impossível a separação da fibrose encefálica das estruturas orbitais, foi necessário remover a extensão da prótese que compunha o teto orbital. Devido à perda de massa encefálica, os tecidos cranianos mantiveram certa distância até a prótese, caracterizando a manutenção de espaço morto. Ao final do procedimento, optou-se pelo não preenchimento desse espaço subjacente à peça protética, e não foi instalado dreno ativo com vácuo, para que se formasse coágulo subjacente à peça (Fig. 6).
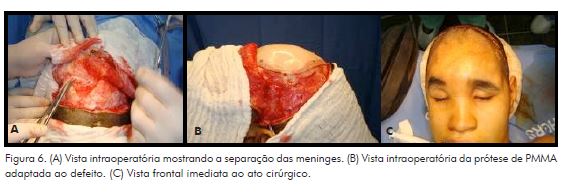
No primeiro dia pós-operatório (DPO), a paciente evoluiu com enfisema dos tecidos subcutâneos da fronte, regular estado geral e períodos de sonolência e letargia. Diante do quadro, foi solicitada tomografia computadorizada de controle em que foi possível observar a presença de ar adjacente ao espaço morto sob a prótese, caracterizando pneumoencéfalo. A conduta estabelecida pela neurocirurgia consistiu em antibioticoterapia com Ceftriaxona associado à Oxacilina e o acompanhamento do quadro.
Nos dias seguintes, a paciente fez episódios de febre e continuou com prostração e letargia. Foi submetida à instalação de derivação ventricular peritoneal e o líquor avaliado diariamente, até que, no 12º DPO, o líquor apresentou-se turvo. .Nessa época, a medicação foi substituída por Imipenem e solicitado cultura do líquor. Nova tomografia de controle evidenciou dilatação ventricular e edema periventricular, culminando com o diagnóstico de ventriculite, quando se passou a utilizar Aztreonam associado à Linezolida. A cultura evidenciou a presença de Pseudomonas aeruginosa multirresistente, e a prótese foi, então, removida no 15º DPO. Após a remoção da prótese e diante do resultado da cultura, foi instituído o tratamento com Polimixina B associado à Amicacina e a Fluconazol.
A despeito das terapêuticas instituídas, a paciente cursou com taquicardia e taquipneia, distúrbio de sódio, depressão do estado neurológico e sinais de descerebração que culminaram com o óbito no terceiro mês pós-operatório.
DISCUSSÃO
No cotidiano da cirurgia maxilofacial, inúmeras são as causas de defeitos ósseos com necessidade de reconstrução. Atrofia dos maxilares secundária a perdas dentais, ressecção de tumores e sequela de fraturas faciais podem requisitar técnicas complexas de reconstrução, com a utilização de enxertos autógenos ou biomateriais. A decisão pelo material substituto irá variar de acordo com os objetivos específicos da reconstrução, se estética, funcionais ou ambas, ou ainda, de acordo com a disponibilidade de recursos. Nos casos selecionados, optamos pelo cimento de PMMA devido à facilidade de manipulação, sobretudo pela formação odontológica da equipe cirúrgica, disponibilidade do material e baixo custo.
Para o tratamento dos defeitos apresentados foi utilizada a técnica da cranioplastia, que está indicada para o restabelecimento da estética e proteção do tecido neural5,6,7,10,12,16. O padrão ouro para esse tipo de defeito são os enxertos ósseos autógenos, no entanto, a alta morbidade e a incidência de reabsorção, com comprometimento do resultado estético, tornam mandatória a busca por materiais alternativos9. Para Gonzalez (2003), atualmente, os materiais aloplásticos têm se tornado mais populares e são usados mais frequentemente que os enxertos autógenos. Entre as desvantagens da reconstrução de grandes defeitos com enxertos autógenos, podemos citar a necessidade de maior quantidade de tecido, prolongando o tempo cirúrgico e a dificuldade em adaptação ao contorno do defeito11.
Considerando os materiais aloplásticos, o titânio é altamente biocompatível, sem risco de hipersensibilidade ou reações alérgicas, apresenta grande resistência à corrosão, promove o rápido restabelecimento do contorno externo do crânio, no entanto apresenta custo elevado quando comparado ao PMMA10,14. Também pode ser citado o polietileno de alta densidade (Medpor), que não induz reação de corpo estranho, altamente estável e flexível, permitindo rápido crescimento de tecido fibroso ao seu redor, porém apresenta custo elevado em relação ao PMMA9,15,17. Uma outra possibilidade, o cimento de hidroxiapatita é um material bioativo, com capacidade de permitir a osteocondução e com potencial de integrar-se ao tecido onde foi implantado, já que é quimicamente similar ao osso, comprovando a sua biocompatibilidade10,14,18. Facilmente disponível, por ser aloplástico, pode ser modelada durante a cirurgia e não sofre reabsorção9,14. Entretanto, apresenta custo relativamente elevado e fragilidade, até que sua superfície seja depositada por tecido ósseo, contrastando com PMMA, que tem alta resistência à fratura e menor custo10,12.
O uso do PMMA na cranioplastia tem como vantagens a facilidade de manipulação, podendo ser impregnado com antibióticos, como gentamicina ou tobramicina; é impermeável, não biodegradável, desenvolve uma cápsula fibrosa, tem significada tolerância corpórea, todavia não é capaz de se incorporar ao tecido14,15. Testes de compressão e torção demonstraram que o PMMA é mais forte do que o osso do crânio9,18. Gonzalez et al., 2003 e Cheng et al., 2008 o consideram o melhor material aloplástico para cranioplastia em adultos. No entanto, por ser um material inerte e fixo que não se adapta às mudanças do esqueleto craniofacial, não está indicado para a reconstrução do esqueleto de crianças ou de jovens em crescimento9.
No presente trabalho, foram utilizadas duas técnicas para a reconstrução da bossa frontal. No primeiro caso, foi instalado prótese de PMMA, que foi confeccionada no transoperatório, enquanto, no segundo caso, foi utilizado biomodelo de prototipagem rápida e prótese prévia, tendo como vantagens melhor estética, redução do tempo operatório, menor perda de sangue e risco de infecção. Esses benefícios também foram observados por Chiarini (2004) e Lee (2009). Para defeitos grandes, é difícil restabelecer o contorno, quando o PMMA é moldado durante a cirurgia, mais uma razão para a utilização no segundo caso da prótese pré-fabricada5.
O PMMA tem odor forte quando está sendo manipulado, o que pode causar reações alérgicas no sistema respiratório, por meio de seus vapores tóxicos e dermatite de contato após a manipulação14,15. Esses achados reforçam a utilização de biomodelo e a pré-fabricação da prótese, conforme adotadas no segundo caso. O PMMA é composto de pequenas unidades repetidas da molécula de metacrilato de metila20. Hipersensibilidade ao acrílico tem sido descrita como reação de contato local, com poucos relatos identificando algum sintoma sistêmico significante21.
O PMMA é resultado de uma reação exotérmica, na qual a temperatura pode chegar a mais de 80ºC. Apesar de o líquido de monômero ser extremamente alergênico e citotóxico, a mistura e o processo de polimerização inicial ocorrem fora do local de implantação da prótese, havendo, dessa forma, um mínimo contato de monômeros livres com o tecido14. Lins et al. (2008) realizaram estudo em ratos para analisar histologicamente o processo de reparação óssea no osso frontal frente à adição de PMMA. Não foram evidenciados sinais de inflamação e necrose óssea. No grupo em que foi colocado o PMMA, observou-se a biocompatibilidade do material por meio da formação de cápsula fibrosa.
A utilização da técnica direta apresenta algumas desvantagens em relação à confecção prévia da prótese. Na técnica direta, faz-se necessário o controle da temperatura com irrigação de solução salina no material durante a cirurgia, já que o processo de polimerização ocorre por meio de reação exotérmica, com liberação de monômeros livres, maior tempo cirúrgico devido à dificuldade de adaptação ao defeito e, por último, impossibilidade de polimento. No primeiro caso relatado, na foto final, é possível observar a presença da prótese na região frontal, por meio de suas margens demarcadas na pele.
O risco de infecção depois da cranioplastia na área frontal é maior do que em outras áreas, pois está adjacente à cavidade nasal e aos seios paranasais5,18. No segundo caso relatado, a paciente evoluiu com quadro de pneumoencéfalo, seguido de meningite, culminando com a necessidade de remoção do implante. Nessa cirurgia, foi observada a presença de espaço morto entre o implante e a fibrose que revestia o defeito da bossa frontal, com o acúmulo de líquido escurecido. Inicialmente, foi uma das justificativas apontadas pela equipe para as complicações apresentadas pela paciente.
No que tange ao manejo do espaço morto intracraniano, Netscher et al. (1992) relataram a transferência de retalho de tecido mole, como gordura, para obliteração do espaço morto. Lee et al. (1995) relataram oito casos de cranioplastia sem obliteração do espaço morto. Dentre esses, dois apresentaram infecções 15 meses após o procedimento cirúrgico que foram justificadas por exacerbação de infecção crônica pré-existente, e, no outro caso, a falência do material de fixação levou à exposição deste e contaminação do referido espaço. Porém, essas infecções não causaram alterações sistêmicas. Diante desses resultados, esses autores não recomendam a obliteração de espaço morto com tecidos autógenos, uma vez que aumenta a morbidade do procedimento, e seus benefícios não foram comprovados.
Para o caso apresentado, é possível inferir que o óbito foi alcançado pela agressividade da infecção hospitalar, a despeito das medidas adotadas, como a remoção da prótese, a drenagem peritoneal e o uso de antimicrobianos de última geração. Isso demonstra a importância de um atendimento multidisciplinar em que as especialidades requisitadas possam prestar atendimento, respeitando sua competência legal.
CONSIDERAÇÕES FINAIS
O Cimento de PMMA apresenta características físicas e biológicas que permitem sua utilização em cranioplastias.
A importante redução na morbidade e tempo cirúrgico bem como a melhor adaptação ao defeito nos permitem indicar a técnica indireta, utilizando-se biomodelos de prototipagem rápida.
REFERÊNCIAS
1. Brasileiro BF, Passeri LA. Epidemiological analysis of maxillofacial fractures in Brazil: A 5-year prospective study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 102:28-34. [ Links ]
2. Oliveira C, Santos J, Brasileiro B, Santos TS. Epidemiologia dos traumatismos buco-maxilo-faciais por agressões em Aracaju/SE. Rev. Cir. Traumatol. Buco-Maxilo-Fac 2008; 8(3): 57-68.
3. Zanetti LSS, Garcia IRJ, Marano RR, Sampaio LM, Raña H. Reconstrução frontal e supra-orbitária utilizando crista ilíaca. Rev. Cir. Traumatol. Buco-Maxillo-Facial., Camaragibe 2008; 8(4): 41-46. Netscher DT, Stal S, Shenaq S. Management of residual cranial vault deformities. Clinics in Plastic Surgery 1992; 19(1): 301-313.
4. Krause RGS, Silva AN, Schneider LE, Aguiar RC, Smidt R. Etiologia e incidência das fraturas faciais: estudo prospectivo de 108 pacientes. R. Ci. méd. biol. 2004; 3(2): 188-193.
5. Netscher DT, Stal S, Shenaq S. Management of residual cranial vault deformities. Clinics in Plastic Surgery 1992; 19(1): 301-313.
6. Chiarini L, et al. Cranioplasty using acrylic material: a new technical procedure. Journal of cranio-maxillofacial surgery 2004; 32: 5-9.
7. Lee C, Antonyshyn OM, Forrest CR. Cranioplasty: indications, technique, and early results of autogenous split skull cranial vault reconstruction. Journal of Cranio Maxillofacial Surgery 1995; 2:133-142.
8. Meurer E, Oliveira MG, Meurer MI, Silva JVL, Bárbara AS, Heitz C. Biomodelos de prototipagem rápida em CTBMF. Revista Brasileira de Cirurgia e Periodontia 2003; 1(3): 172-180.
9. Gosain AK. Biomaterials in Facial Reconstruction. Operative Techniques in Plastic and Reconstructive Surgery 2003; 9(1): 23-30.
10. Marchac D, Greensmith A. Long-term experience with methylmethacrylate cranioplasty in craniofacial surgery. Journal of Plastic, Reconstructive and Aesthetic Surgery 2007; 61: 744-752.
11. Eppley BL. Craniofacial reconstruction with Computer-Generated HTR Patient-Matched Implants: Use in Primary Bony Tumor Excision. The Journal of Craniofacial Surgery 2002; 13(5): 650-657.
12. Itokawa H, Hiraide T, Moriya M, Fujimoto M, Nagashima G, Suzuki R, et al. A 12 month in vivo study on the response of bone to a hydroxyapatite-polymethymethacrilate cranioplasty composite. Biomaterials 2007; 4922-4927.
13. Sherburn EW, Silbergeld DL. A new method of acrylic cranioplasty. Surg Neurol 1996; 46: 292-294.
14. Eppley, BL. Alloplastic Cranioplasty. Operative Tecniques in Plastic and Reconstructive Surgery 2003; 9(1): 16-22.
15. Lins L, Azevedo RA, Gomes L, Santos MT, Bragança RJF. Efeito do cimento cirúrgico composto por metacrilatos na reparação óssea de ratos. Revista Brasileira de Cirurgia e Traumatologia Buco-Maxilo-Facial 2008; 5(1): 44-50.
16. Lee SC, Wu CT, Lee ST, Chen PJ. Cranioplasty using polymethyl methacrylate prostheses. Journal of Clinical Neuroscience 2009; 16: 56-63.
17. Duman H, Deveci M, Uygur F, Sengezer M. Reconstruction of contour and anterior wall defects of frontal bone with a porous polyethylene implant. Journal of cranio-maxillofacial surgery 1999; 27: 298 - 301.
18. Gonzalez AM, Jackson IT, Miyawaki T, Barakat K, Dinick V. Clinical outcome in cranioplasty: critical review in long-term follow-up. The Journal of Craniofacial Surgery 2003; 14(2): 144-153.
19. Cheng YK, Weng HH, Yang JT, Lee MH, Wang TC, Chang CN. Factors affecting graft infection after cranioplasty. Journal of Clinical Neuroscience 2008; 15: 1115-1119.
20. Rawls HR. Polímeros Odontológicos. In: Anusavice KJ. Phillips Materiais Dentários. 11. edição. Rio de Janeiro: Elsevier; 2005. p. 135-159.
21. Meel BL. Fatal systemic allergic reaction following acrylic cranioplasty: a case report. Journal of Clinical Forensic Medicine 2004; 11: 205-207.
 Endereço para correspondência:
Endereço para correspondência:
Prof. Dr. Arlei Cerqueira
Escola Bahiana de Medicina e Saúde Pública – Curso de Odontologia
Av. Silveira Martins, 3386 – Cabula
Salvador – BA
CEP. 41.150-100
e-mail: arlei@bmf.odo.br













