Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RSBO (Online)
versão On-line ISSN 1984-5685
RSBO (Online) vol.8 no.1 Joinville Jan. 2011
ARTIGO ORIGINAL DE PESQUISA ORIGINAL RESEARCH ARTICLE
Avaliação ultraestrutural comparativa de biomaterial particulado de origem ovina
Comparative ultrastructure evaluation of particle biomaterial of ovine origin
João César Zielak; Patrícia Locatelli; Sônia Pozzan; Allan Fernando Giovanini; Tatiana Miranda Deliberador; Cícero de Andrade Urban; Flares Baratto-Filho
Faculdade de Odontologia, Universidade Positivo – Curitiba – PR – Brasil
RESUMO
INTRODUÇÃO: Os biomateriais de enxerto ósseo xenogênicos têm sido alvo de grande interesse científico. A fácil aplicação clínica e o baixo custo atraem profissionais e pacientes. Como alternativa ao biomaterial bovino é possível desenvolver o ovino.
OBJETIVO: Comparar por microscopia eletrônica de varredura a ultraestrutura de biomaterial particulado de origem ovina com ossos equino e bovino disponíveis comercialmente, além de osso humano proveniente de um banco de tecidos musculoesqueléticos.
MATERIAL E MÉTODOS: Osso mandibular de ovelha, oriundo de criadouro local, submetido à moagem e a protocolo químico e físico para esterilização foi comparado com variadas partículas de biomateriais. Avaliaram-se as imagens obtidas quanto à quantidade e área de porosidades (c2), rugosidade visual da superfície e relação Ca/P.
RESULTADOS: Não houve diferenças significativas entre as imagens das amostras, mesmo assim porosidades e rugosidades mais expressivas foram observadas nas partículas de osso bovino.
CONCLUSÃO: Em relação à porosidade, o osso ovino experimental apresentou características mais semelhantes às do osso humano do que os ossos equino e bovino. Quanto à rugosidade visual, o osso equino foi o que mais se aproximou do humano, seguido pelo osso ovino e pelo bovino. No que diz respeito à relação Ca/P, o osso ovino evidenciou o menor valor e mais distante do osso humano; depois vieram o equino e o bovino.
Palavras-chave: enxerto ósseo; experimental; ultraestrutura.
ABSTRACT
INTRODUCTION: Xenogenic bone grafting biomaterials have been vastly studied. Easy clinical use and low cost have attracted professionals and patients. Alternatively to bovine biomaterial, ovine biomaterial can be developed.
OBJECTIVE: To compare by scanning electron microscopy the ultrastructure of a particle ovine biomaterial to equine and bovine commercially available biomaterials, besides to human bone from a tissue bank.
MATERIAL AND METHODS: Ovine mandibular bone, from a local sheep farm, was ground and submitted to a chemical and physical sterilization protocol to be compared to different biomaterial particles. Images were obtained and evaluated according to the quantity and area values of porosities (c2), visual surface roughness, and Ca/P ratio.
RESULTS: There was no statistical difference among the sample images; however, the bovine particles presented marked porosities and roughness.
CONCLUSION: In relation to porosity, experimental ovine bone presented closer characteristics to human bone than equine and bovine. Regarding to surface roughness, equine bone was the most similar to human bone, followed by ovine and bovine. Concerning to Ca/P ratio, ovine bone presented the lowest and most distant value from human bone, followed by equine and bovine.
Keywords: bone grafting; experimental; ultrastructure.
Introdução
Em Odontologia, caso aconteça perda óssea grande, os enxertos tornam-se indispensáveis para correção estética e funcional. Costa e Veinstein [4] relatam a divisão clássica dos enxertos: 1) autógenos ou autoenxertos, quando o tecido é transferido de uma região (sítio doador) para outra (sítio receptor) no mesmo indivíduo, não provocando reação imune; 2) alogênicos, homógenos ou homoenxertos, tecidos enxertados entre indivíduos da mesma espécie com genes não idênticos, como o osso fresco, congelado, liofilizado (FDBA), desmineralizado e liofilizado (DFDBA); 3) aloplásticos, corpo estranho, inerte, produzido de modo sintético, utilizado para implantação nos tecidos, como fosfato de cálcio, hidroxiapatita, biocerâmicas, além de outros tipos; e 4) xenoenxertos, heteroenxertos ou heterólogos, realizados entre indivíduos de espécies diferentes, como, por exemplo, de origem animal, como é o caso do osso bovino, mais comum, ou osso de outro animal de criadouros, como o osso equino. Em cada tipo de enxerto há diferentes materiais empregados, aqui genericamente chamados de biomateriais de enxerto.
Os materiais não autógenos da classificação anterior têm suscitado grande interesse por parte de profissionais, uma vez que o procedimento cirúrgico é mais rápido, pois o material a ser enxertado se encontra preparado, necessitando apenas do sítio receptor, o que diminui os riscos em virtude da não existência da ferida doadora, característica muito vantajosa para o paciente [5, 14].
Os critérios de seleção de um biomaterial e as técnicas de processamento dele devem ser eficientes e seguros. Entendendo a natureza do processamento, particularmente a influência das várias técnicas de preservação biológicas e biomecânicas e/ou processos de incorporação e associação entre materiais, seleciona-se cada biomaterial de acordo com o objetivo da reconstrução cirúrgica. Hoje em dia a disponibilidade de diferentes biomateriais aumentou, e a agilidade na conquista de técnicas de tratamento oportunizou formas inovadoras de superação dos inúmeros desafios reconstrutivos, além de oferecer de maneira satisfatória a muitas pessoas uma alternativa a mais no tratamento [15].
O uso do osso bovino como fonte de matéria-prima na produção de biomaterial de enxerto vem sendo estudado há tempos [20]. Após a coleta, faz-se o processamento do osso para remover restos celulares, lipídios e proteínas. É possível que essas substâncias, de grande potencial para a ativação do sistema imune do receptor, interfiram na biocompatibilidade do enxerto. O tratamento do osso com peróxidos na descelularização da matriz ajuda a manter o complexo colágeno-apatita e produz uma resistência mecânica mais alta do biomaterial obtido [24].
A superfície de um material mostra-se capaz de influenciar a colonização celular. Marins et al. [9] caracterizaram as partículas de um biomaterial bovino orgânico por microscopia eletrônica de varredura e avaliaram sua aplicação in vivo (em ratos) por microscopia de luz. Os resultados demonstraram que o material estudado, com sua microarquitetura preservada, é vagarosamente absorvido e pode servir como espaço para preenchimento das células, permitindo a angiogênese, a migração celular, a adesão e a neoformação óssea nas bordas da lesão na qual foi enxertado.
Assim como os bovinos, outros animais criados de modo regular em grande escala são fonte na produção de biomateriais de enxerto. Ao comparar, por exemplo, o rebanho bovino com o ovino, alguns fatores são levados em consideração: ambos podem ser alimentados apenas com capim, uma vez que são ruminantes; os ovinos adaptam-se melhor às condições climáticas e requerem espaço físico menor de pastagens; além disso, o início da reprodução e do abate deles fica entre 6 e 9 meses [13], enquanto os bovinos em geral precisam completar 24 meses para o abate [23]; o período de gestação de ovinos é de somente cinco meses, já o dos bovinos é o dobro [13, 17].
A possibilidade da transmissão de doenças torna-se outro fator relevante e que causa apreensão quando se fala em biomateriais de origem animal. Entre as mais temidas no que se refere aos bovinos ou ovinos, estão as encefalopatias espongiformes transmissíveis (EETs), que podem ser ocasionadas pelo acúmulo de glicoproteínas modificadas nos tecidos nervosos dos indivíduos. As glicoproteínas modificadas pertencem a uma classe de substâncias chamada príons. Como se sabe, as EETs em humanos têm o mesmo agente causador das encefalopatias bovinas e ovinas [25], no entanto, apesar de resistentes, existem métodos para neutralizar os príons [12].
Como os relatos de estudos com biomaterial de origem ovina são escassos, o objetivo deste trabalho foi comparar, por microscopia eletrônica de varredura (MEV), a ultraestrutura de biomaterial experimental particulado de origem ovina com ossos equino e bovino disponíveis comercialmente e com partículas de osso humano proveniente de um banco de tecidos musculoesqueléticos.
Material e métodos
Retirou-se o biomaterial ovino de osso mandibular de ovelha (Suffolk) com 6 meses de idade, oriunda do criadouro Cabanha Kulik, localizado no bairro Barreirinha, Curitiba, Paraná. O animal foi abatido para fins alimentícios por funcionário do estabelecimento, e a cabeça, descartada. O mesmo funcionário levou a cabeça ao congelador (-12°C). Depois, em laboratório, a mandíbula foi separada e teve sua superfície limpa por meio da remoção de tecidos moles residuais (periósteo e inserções musculares) por raspagem com faca e bisturi (Duflex, Curitiba, Paraná, Brasil). Em seguida, a mandíbula foi lavada em água corrente e dividida em fragmentos de aproximadamente 2,0 x 1,0 x 0,5 cm. Submeteu-se uma parte dos fragmentos aos seguintes processamentos: 1) imersão em hipoclorito de sódio a 2% a 20ºC por 12 horas, 2) lavagem em água corrente (2 minutos), 3) imersão em solução de metabissulfito de sódio a 2% por 3 minutos para a inativação do hipoclorito, 4) nova lavagem em água corrente (2 minutos), 5) secagem por calor seco a 20ºC por 2 horas, 6) moagem dos fragmentos em moedor de osso elétrico (Kopp, Curitiba, Paraná, Brasil) e 7) calor úmido (autoclave) por 20 minutos a uma temperatura de 135ºC. Da mesma forma, moeu-se um pequeno fragmento ósseo não contaminado, dispensado de procedimento cirúrgico e proveniente do banco de tecidos musculoesqueléticos do Hospital de Clínicas da Universidade Federal do Paraná.
A seguir, algumas partículas de ossos ovino e humano foram armazenadas em desecadora com sílica, montadas em suporte para MEV e metalizadas (Baltec, Balzers, Alemanha). Outros fragmentos de biomateriais disponíveis no mercado também foram metalizados e montados em suporte: osso equino (BGS-05 Esponjoso, Bio-gen, Bioteck, Chieri, Torento, Itália) e bovino (Genox Inorg Esponjoso, Baumer, Mogi-Mirim, São Paulo, Brasil). Levaram-se os suportes ao microscópio eletrônico para avaliação morfológica ultraestrutural e química da superfície (espectroscopia de energia dispersiva de elétrons) (SEM-EDS, JSM 6360-LV, Jeol, Japão). As imagens obtidas foram analisadas e comparadas com auxílio de um programa de análise de imagens (Image Tool 3.00, Centro de Ciências da Saúde da Universidade do Texas, EUA).
Resultados
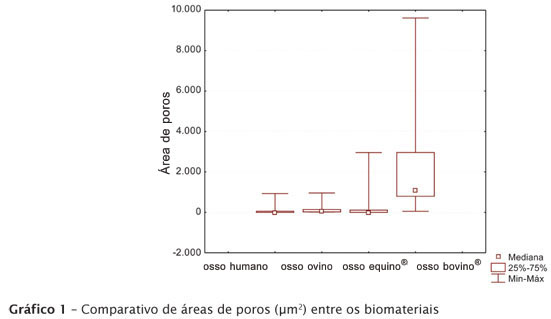
Por intermédio da análise das imagens de MEV observaram-se o aspecto visual da rugosidade superficial e a porosidade das partículas em aumento de 30, 150, 1.500 e 10.000 vezes (figura 1).

A quantidade de poros e as suas áreas foram mensuradas. A análise estatística (χ2) dos dados demonstrou discrepâncias significativas entre o osso ovino experimental e os demais disponíveis comercialmente (equino e bovino), mas não houve diferença expressiva em relação ao osso humano (tabela I e gráfico 1).
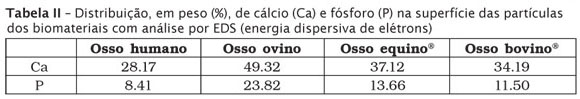
Na tabela II consta a relação Ca/P nos biomateriais averiguados, os quais evidenciaram valores de 3,3 para o osso humano, 2,0 para o ovino, 2,7 para o equino e 2,9 para o espécime bovino.
Discussão
A escolha por uma fonte de matéria-prima para a produção de um determinado produto deve levar em conta vários fatores, entre eles custos, rendimento e sobretudo sustentabilidade. Dos modelos animais de criação extensiva já inseridos na sociedade, os ovinos parecem estar à frente dos bovinos, pois um rebanho de ovelhas e carneiros pode levar, no uso de um mesmo espaço, à maior produção de massa e em menor tempo do que um rebanho de bois. Desse modo, imagina-se também que, para uma mesma produção de massa, um espaço menor seja necessário para a criação de ovinos e, portanto, há menos desmatamentos, um dos maiores causadores de devastação ambiental nos dias de hoje [16, 21].
Apesar de o objetivo do presente trabalho não passar pela caracterização dos príons nas partículas avaliadas, o protocolo apresentado considerou a regulamentação vigente, visando à biossegurança na produção de biomateriais xenogênicos: uso de animais livres de príons (o Brasil tem baixo risco de contaminação nos rebanhos); utilização do osso como matéria-prima, um tecido de baixa infecção de príons; e processamento capaz de inativar os príons [3]. Portanto, propôs-se uma associação de técnicas químicas e físicas para inativação dos príons, de acordo com orientações indicadas por organismos internacionais [12], com desinfecção por oxidação em hipoclorito de sódio, mais aplicação de calor úmido (autoclave).
Ogurtan et al. [11] relataram a superioridade do osso bovino particulado aplicado em defeitos experimentais in vivo. Nesta investigação não se avaliou o tamanho das partículas produzidas pelo moedor elétrico. Na clínica também há outros tipos de moedores disponíveis: pilão manual e catraca. Uma característica interessante do moedor elétrico é fazer partículas em lascas (chips), com uma pequena espessura (0,5-1 mm, segundo o fabricante), que ocupam uma área relativamente grande. Apesar da variação da área, o moedor elétrico produz fragmentos de aspecto mais regular do que as partículas de moedor do tipo catraca ou pilão manual, com frequência empregados nas técnicas cirúrgicas [10]. Acerca das partículas dos biomateriais comerciais da presente pesquisa, de acordo com os fabricantes ambas tinham entre 0,5 e 1 mm de tamanho.
Em aspectos gerais, a ultraestrutura do osso bovino comercial demonstrou as características mais distintas em relação às dos outros materiais: grande porosidade e estrutura de aspecto semelhante a inúmeros agregados de pequenas unidades, provavelmente cristais de hidroxiapatita, ou seja, a parte inorgânica do osso bovino que permaneceu após a ação do bioprocesso a que o espécime foi submetido (figura 1).
Por outro lado, quanto ao aspecto visual da rugosidade de superfície (figura 1), o osso equino foi o que mais se aproximou do humano. Conforme o fabricante, o processamento a que esse osso se sujeitou é enzimático e ocorre a 37ºC, favorecendo a manutenção de uma superfície mais semelhante à situação in vivo. No entanto Śmieszek-Wilczewska et al. [22] asseguram que o bioprocesso de obtenção do osso equino atinge a temperatura de 125ºC. No geral, ainda no tocante à rugosidade superficial visualmente observada, distanciando-se da similaridade com o osso humano, após o osso equino veio o osso ovino experimental, seguido pelo bovino.
A análise quantitativa revelou porosidades de tamanhos e quantidades irregulares (tabela I e gráfico 1), demonstrando maior variação nas partículas de osso bovino. A presença de poros nos materiais pode ser importante, pois, de acordo com o já exposto, a colonização celular do tecido ósseo é facilitada com a existência de poros. Estes devem ter tamanhos que variam de 50 a 100 micrômetros para que ocorram boa vascularização e colonização celular, de maneira a diminuir riscos de infecção [26]. Leonel et al. [7] descreveram a importância de poros na superfície dos biomateriais, por ser uma condição fundamental para a estabilização e a incorporação destes pelos tecidos vivos. A existência de porosidade nos materiais de enxerto, seu diâmetro, a conformação e a presença de intercomunicações são características essenciais que auxiliam a migração celular para o interior de tais implantes, permitindo ou não a neoformação óssea. O osso bovino do presente trabalho apresentou porosidades com áreas bem superiores a 100 micrômetros quadrados, enquanto os demais biomateriais (ossos equino, ovino experimental e humano) demonstraram porosidades menores e de tamanhos parecidos (gráfico 1).
Como o tamanho dos poros pode influenciar a vascularização do enxerto, entende-se que, quanto maior a porosidade do biomaterial, maior a possibilidade de absorção das partículas do biomaterial e por conseguinte maior substituição por novo tecido ósseo, como foi o caso do osso bovino desta pesquisa. Ainda em outro estudo sobre o osso de boi usado no presente trabalho, nota-se que a temperatura de desproteinização utilizada no processo (até 1.000ºC) é capaz de modificar também a resposta biológica e que esse processamento favorece o reparo ósseo [14]. Por outro lado, um grande aumento da temperatura gera modificações permanentes na estrutura e na cristalinidade da matriz óssea, tornando-a rica em compostos insolúveis [8], o que pode reduzir sua absorção no local de enxerto e consequente substituição óssea, além de contribuir potencialmente para uma neoformação óssea com menor resistência mecânica, graças à presença de partículas envolvidas por tecido conjuntivo, inertes e que não participam do remodelamento tecidual, particularidade importantíssima à renovação do osso [19].
No que diz respeito à relação Ca/P de um biomaterial, sabe-se que pode influenciar a qualidade do reparo. Tal relação está diretamente ligada à solubilidade em meio fisiológico e, quanto menor, maior a biodegradação. Por exemplo, partículas de biomateriais como as de trifosfato de cálcio (TCP) têm 1,50 e de hidroxiapatita pura (HAp) 1,67 [27]. Mesmo com as maiores quantidades de cálcio e fosfato (tabela II), o osso ovino experimental apresentou a menor relação Ca/P. Isso pode refletir em maior grau de biodegração do que os outros biomateriais da amostra. Ainda assim, um longo caminho de investigações deve ser percorrido a fim de se observar a legitimidade do bioprocesso aqui exposto. O estudo da microarquitetura de um determinado biomaterial precisa passar por avaliações funcionais, com o intuito de conhecer outras características relevantes à colonização celular. Pesquisas in vitro, por exemplo, que comprovem a eficácia na inativação dos príons e a cultura celular na presença do biomaterial ovino são perspectivas futuras. Já se tem conhecimento de que o oxigênio livre gerado na decomposição de peróxidos [18], as variações de temperatura e pressão [1] e a radiação [2] dos processos físicos e químicos [6] de esterilização alteram morfologicamente várias biomoléculas, tais como proteínas, lipídios, aminoácidos, carboidratos e ácidos nucleicos, o que em retorno influencia o comportamento das células e dos tecidos expostos aos biomateriais. Por isso, são também importantes ensaios experimentais in vivo que forneçam dados relevantes de biocompatibilidade e da reação do tecido ósseo na aplicação clínica do biomaterial ovino experimental.
Conclusão
De acordo com as limitações desta pesquisa, conclui-se que:
- no que tange à porosidade (quantidade e área), o osso ovino experimental demonstrou características mais semelhantes às do osso humano do que os ossos equino e bovino;
- quanto à rugosidade visual, o osso equino foi o que mais se aproximou do humano, seguido pelo osso ovino e pelo bovino;
- no que diz respeito à relação Ca/P, o osso ovino evidenciou o valor menor e mais distante do osso humano, depois vieram o osso equino e o bovino.
Referências
1. Actis AB, Obwegeser JA, Rupérez C. Influence of different sterilization procedures and partial demineralization of screws made of bone on their mechanical properties. J Biomater Appl. 2004 Jan;18(3):193-207. [ Links ]
2. Andriano KP, Chandrashekar B, McEnery K, Dunn RL, Moyer K, Balliu CM et al. Preliminary in vivo studies on the osteogenic potential of bone morphogenetic proteins delivered from an absorbable puttylike polymer matrix. J Biomed Mater Res. 2000;53(1):36-43. [ Links ]
3. Castro-Silva II, Zambuzzi WF, Granjeiro JM. Panorama atual do uso de xenoenxertos na prática odontológica. J Biomater Esthet. 2009;4(3):70-5. [ Links ]
4. Costa OR, Veinstein FJ. Injertos oseos em regeneración periodontal. Rev Asoc Odontol Argent. 1994;82:117-25. [ Links ]
5. Cruz GA, Sallum EA, Toledo S. Estudo da morfologia de diferentes substitutos ossos por microscopia eletrônica de varredura. Rev Period. 2005;19(3):21-8. [ Links ]
6. Haje DP, Thomazini JA, Volpon JB. Efeitos do processamento químico, da esterilização em óxido de etileno e da usinagem em parafusos de osso bovino: estudo com microscopia eletrônica de varredura. Rev Bras Ortop. 2007;42(4):120-4. [ Links ]
7. Leonel ECF, Mangilli PD, Ramalho LTO, Andrade Sobrinho J. A importância da porosidade interna do polímero de mamona durante a neoformação óssea – estudo em ratos. Ciênc Odontol Bras. 2003,6(3):19-25. [ Links ]
8. Luna-Zaragoza D, Romero-Guzmán ET, Reyes-Gutiérrez LR. Surface and physicochemical characterization of phosphates vivianite, Fe2(PO4)3 and hydroxyapatite, Ca5(PO4)3OH. J Min Mat Charact Engin. 2009;8(8):591-609. [ Links ]
9. Marins LV, Cestari TM, Sottovia AD, Ganjeiro JM, Taga R. Radiographic and histological study of perennial bone defect repair in rat calvaria after treatment with blocks of porous bovine organic graft material. J Appl Oral Sci. 2004;12(1):62-9. [ Links ]
10. Matocano LGG, Saraiva MS. Obtenção de enxerto ósseo da região retromolar para reconstrução de maxila atrófica. Rev Dental Press Period Implantol. 2008;2(1):78-91. [ Links ]
11. Ogurtan Z, Hatipoglu F, Ceylan C. Comparative evaluation of demineralized and mineralized xenogenic bovine bone powder and chips on the healing of circumscribed radial bone defects in the dog. Firat Univ Vet J Health Sci. 2007;21(6):269-76. [ Links ]
12. OIE – Organización Mundial de Sanidad Animal. Encefalopatía espongiforme bovina. 2002. Available from: URL: http://www.oie.int/esp/maladies/fiches/e_B115.htm. [ Links ]
13. Oliveira NM, Osório JC, Monteiro EM. Produção de carne em ovinos de cinco genótipos: 1. Crescimento e desenvolvimento. Ciênc Rural [serial online]. 1996;26(3):467-70. [ Links ]
14. Oliveira RC, Sicca CM, Silva TL, Cestari TM, Kina JR, Oliveira DT et al. Avaliação histológica e bioquímica da resposta celular ao enxerto de osso cortical bovino previamente submetido a altas temperaturas. Efeito da temperatura no preparo de enxerto xenógeno. Rev Bras Ortop. 2003;38(9):551-61. [ Links ]
15. Rabiee SM, Mortazavi SMJ, Moztarzadeh F, Sharifi D, Fakhrejahani F, Khafaf A et al. Association of a synthetic bone graft and bone marrow cells as a composite biomaterial. Biot Bio Eng. 2009;14(1):1-5. [ Links ]
16. Rivero S, Almeida O, Ávila S, Oliveira W. Pecuária e desmatamento: uma análise das principais causas diretas do desmatamento na Amazônia. Nova Econ. 2009;19(1):41-66. [ Links ]
17. Rocha JCMC, Tonhati H, Alencar MM, Lobo RB. Componentes de variância para o período de gestação em bovinos de corte. Arq Bras Med Vet Zootec. 2005;57(6):784-91. [ Links ]
18. Ronsein GE, Miyamoto S, Bechara E, Mascio P, Martinez GR. Oxidação de proteínas por oxigênio singlete: mecanismos de dano, estratégias para detecção e implicações biológicas. Quím Nova. 2006;29(3):563-8. [ Links ]
19. Rumpel E, Wolf E, Kauschke E, Bienengräber V, Bayerlein T, Gedrange T et al. The biodegradation of hydroxyapatite bone graft substitutes in vivo. Folia Morphol. 2006;65(1):43-8. [ Links ]
20. Sakurai O, Fujii H, Nobuhara K, Miyamoto T, Tanaka J, Sakabe Y et al. The experimental and clinical studies of deproteinized calf bone transplantation. Kobe J Med Sci. 1965;11(Suppl):14-5. [ Links ]
21. Sassioto MCP, Inouye CM, Aydos RD, Figueiredo AS, Pontes ERJC, Takita LC. Estudo do reparo ósseo com matriz óssea bovina desvitalizada e calcitonina em ratos. Acta Cir Bras. 2004;19(5):495-503. [ Links ]
22. Śmieszek-Wilczewska J, Koszowski R, Pająk J. Comparison of postoperation bone defects healing of alveolar processes of maxilla and mandible with the use of Bio-Gen and Bio-Oss. J Clin Exp Dent. 2010;2(2):62-8. [ Links ]
23. Soutello RVG, Fernandes JOM, Braz MA, Mangold MA, Pereira RC. Idade ao abate de bovinos em frigorífico no município de Andradina-SP. Ciên Agr Saúde. 2003;3(1):11-8. [ Links ]
24. Takamori ER, Figueira EA, Taga R, Sogayar MC, Granjeiro JM. Evaluation of the cytocompatibility of mixed bovine bone. J Braz Dent. 2007;18(3):179-84. [ Links ]
25. Thuring CMA, Erkens JHF, Jacobs JG, Bossers A, Van Keulen LJM, Garssen GJ et al. Discrimination between scrapie and bovine spongiform encephalopathy in sheep by molecular size, immunoreactivity, and glycoprofile of prion protein. J Clin Microbiol. 2004;42(3):972-80. [ Links ]
26. Turrer CL, Ferreira FPM. Biomateriais em cirurgia craniomaxilofacial: princípios básicos e aplicações – revisão de literatura. Rev Bras Cir Plást. 2008;23(3):234-9. [ Links ]
27. Wang H, Lee JK, Moursi A, Lannutti JJ. Ca/P ratio effects on the degradation of hydroxyapatite in vitro. J Biomed Mater Res. 2003;67(A):599-608. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
João César Zielak
Rua Professor Pedro Viriato Parigot de Souza, n.º 5.300 – Campo Comprido
CEP 81280-330 – Curitiba – PR
E-mail: jzielak2@gmail.com
Recebido em 13/9/2010.
Aceito em 7/10/2010.
Received for publication: September 13, 2010.
Accepted for publication: October 7, 2010.













