Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.66 no.2 Sao Paulo Abr./Jun. 2012
Relato de caso clínico
O uso de rhBMP-2 para aumento ósseo maxilar: relato de caso clínico
rhBMP-2 for maxillary bone augmentation: case reporty
Rubens Moreno de FreitasI; Rubens Spin NetoII; Claudio MarcantonioIII; Rosemary Adriana Chierici MarcantonioIV; Luis Antonio Violin Dias PereiraV; Elcio Marcantonio JuniorVI
IGraduado em Odontologia pela Faculdade de Odontologia de Araraquara (Unesp), Doutorando em Implantodontia pela Unesp
IIDoutor em Periodontia pela Unesp, Pesquisador no Departamento de Odontologia - Radiologia Oral, Aarhus University, Dinamarca
IIIMestre - Doutorando em Implantodontia pela Unesp
IVProfessor Titular do Departamento de Diagnóstico e Cirurgia, Disciplina de Periodontia da Unesp
VProfessor Associado do Departamento de Histologia e Embriologia do Instituto de Biologia – Unicamp
VIProfessor Titular do Departamento de Diagnóstico e Cirurgia, Disciplina de Periodontia da Unesp
RESUMO
A perda óssea na região anterior da maxila, por tratar-se de região estética, é um dos grandes desafios atuais da implantodontia. A estratégia mais indicada para o aumento ósseo dessa região, com o objetivo de reabilitação protética com implantes, é o emprego de enxerto ósseo autógeno. Alternativamente, outras metodologias de aumento ósseo têm sido utilizadas, tais como o enxerto ósseo homógeno, xenógeno, os biomateriais e diferentes associações destes materiais. Adicionalmente, grande atenção tem sido dada às Proteínas Ósseas Morfogenéticas (BMPs), principalmente à rh (recombinante humana) BMP-2, a qual foi caracterizada como um potente osteoindutor e alternativa em potencial ao enxerto ósseo autógeno, sem necessidade de associação com outros biomateriais. O objetivo deste estudo é apresentar um relato de caso clínico com a utilização da rhBMP-2.
Descritores: regeneração óssea; aumento do rebordo alveolar; proteína morfogenética óssea 2
ABSTRACT
The bone resorption in the anterior maxilla, due to its aesthetic importance, can be considered one of the challenges in implant dentistry. Autogenous bone graft is the most indicated bone augmentation procedure, aiming an implant supported rehabilitation.. Alternatively, some other graft procedures can be done with homogenous and xenogenous bone graft, biomaterials and different associations. Additionally to the mentioned biomaterials, the bone morphogenetic protein (BMP), specially the rhBMP-2, which was characterized as a bone osteoinductor, and consecutively, a potential autogenous graft substitute, with previsibility and no necessity of association to other biomaterial. The objective of this study is to present a single case using the rhBMP-2 for bone augmentation.
Descriptors: bone regeneration; alveolar ridge augmentation; bone morphogenetic protein 2
RELEVÂNCIA CLÍNICA
O presente manuscrito apresenta, baseando-se na literatura, o relato de um caso clínico utilizando a Proteína Óssea Morfogenética 2 recombinante humana (rhBMP-2), que representa um material de interesse na prática clínica atual, principalmente na Implantodontia.
INTRODUÇÃO
O sucesso dos implantes osseointegráveis depende das características dos tecidos mole e duro presentes na região a ser reabilitada, dentre alguns outros requisitos. Em muitos casos, a quantidade e a qualidade óssea não favorece a reabilitação com o uso de implantes dentários. Com base nessas necessidades, há uma tendência na busca por novas alternativas biológicas e técnicas cirúrgicas para regenerar os tecidos perdidos, e assim viabilizar a reabilitação dos pacientes.
Por muitas décadas, o enxerto ósseo autógeno tem sido considerado o "padrão ouro" na correção de defeitos ósseos, devido à sua característica osteoindutora, osteogênica e osteocondutora1. Por outro lado, com base na literatura, fica nítido que a grande maioria dos substitutos ósseos disponíveis até o momento atua quase que exclusivamente como osteocondutor. No entanto, diversos grupos de pesquisa têm focado no desenvolvimento de novas metodologias para regeneração óssea, principalmente as embasadas na criação de um ambiente osteoindutor na região a ser regenerada2. O objetivo é obter um material regenerador ósseo que possua fatores osteoindutores, células osteoprogenitoras e uma matriz osteocondutora, e que possa ser reabsorvido e completamente substituído por tecido ósseo neoformado1.
Em 1965, Marshall Urist3 observou, através da implantação de matriz óssea desmineralizada em tecido muscular de animal, a formação de tecido ósseo após um período de 21 dias. De maneira geral, a BMP inicialmente relatada por Urist tem potencial osteoindutor4 e, justamente por esta característica, apresenta-se como alternativa aos procedimentos de regeneração óssea.
Estudos posteriores aos de Urist demonstraram que as BMPs constituem uma família de proteínas de extrema importância no processo de formação óssea e no desenvolvimento esqueletal, uma vez que estimulam células indiferenciadas a se diferenciarem em osteoblastos, além de inibirem a formação mioblástica5. As BMPs, com mais de 20 subtipos descritos na literatura, são proteínas transmembrânicas de baixo peso molecular (19 a 30 kDa), pertencentes à família do fator de crescimento de transformação β (TGF-β), com exceção da BMP-1. Dentro da subfamília das BMPs, quatro têm sido relacionadas com a capacidade de promover formação óssea através da osteoindução: BMP-2, BMP-4, BMP-6 e BMP-76. Nesta revisão de literatura, o enfoque será dado à BMP-2.
MECANISMOS DE AÇÃO DAS PROTEÍNAS ÓSSEAS MORFOGENÉTICAS
As BMPs osseoindutoras regulam os três passos da cascata de regeneração óssea, que incluem quimiotaxia, mitose e diferenciação celular, além do processo de ossificação propriamente dito. A ossificação induzida por BMPs pode ser realizada de duas maneiras: através de uma formação cartilaginosa prévia (ossificação endocondral ou indireta), que estimula células indiferenciadas a se multiplicarem e se diferenciarem, inicialmente, em fenótipo condroblástico. O tecido cartilaginoso previamente formado servirá como base para uma segunda onda de migração e diferenciação de células indiferenciadas em osteoblastos7. O outro tipo de formação óssea ocorre através da diferenciação de células progenitoras diretamente em células ósseas (ossificação intramembranosa ou direta)8. Devido à sua atuação no processo de remodelação óssea a quantidade de BMP empregada tende a ser diretamente proporcional à quantidade de matriz óssea neoformada9. Além disso, altas concentrações de BMP-2 induzem preferencialmenteà ossificação direta ou intramembranosa.
ESTUDOS IN VIVO/CLÍNICOS
Estudos prévios forneceram informações relevantes sobre a ação da BMP-2, tais como: comprovação da propriedade osteoindutora4 com formação óssea dose-dependente10 e ausência de toxicidade. O carreador dessas BMPs é de extrema importância para a eficiência das mesmas11, permitindo que as BMPs possam atuar localmente sem efeito sistêmico12. Porém, um estudo13 sugere o acompanhamento sistêmico de pacientes submetidos à enxertia com o uso da rhBMP-2, uma vez que nesse estudo, um dos pacientes tratados (correspondente a 0,7% da amostra) apresentou produção de anticorpos séricos a esta proteína, embora sem interferência aparente no enxerto ou do ponto de vista sistêmico.
Em 1991 foi publicado o primeiro relato de sucesso em regeneração óssea em modelo canino usando a rhBMP-214. Neste experimento a rhBMP-2 foi incorporada em uma esponja de colágeno e posicionada em um defeito crítico da mandíbula de cães. Os resultados demonstraram que com a utilização da rhBMP-2 foi possível a regeneração óssea no defeito mandibular. No entanto, somente em 2001 foi publicado o primeiro estudo clínico conduzido em humanos demonstrando a formação óssea induzida por rhBMP-2 na correção de defeitos mandibulares1. Neste estudo, os autores relatam que três meses após a enxertia com rhBMP-2 foi possível, radiográfica e clinicamente, detectar neoformação óssea em quantidade significativa em altura e espessura na área previamente enxertada. Além dos estudos em mandíbula, um grande número de estudos em humanos foi realizado em procedimentos de elevação da mucosa do seio maxilar e em regiões de alvéolo dentário pós-exodontia15,16.
Em 2005 foi realizado um estudo com 80 pacientes com a intenção de comparar o uso de rhBMP-2 com o coágulo sanguíneo (controle) em defeitos ósseos alveolares pós-exodontia16. Os autores utilizaram a rhBMP-2 associada a um carreador a base de colágeno tipo I absorvível, em concentrações de 0,75 mg/ml e 1,5 mg/ml, tendo como resultado um aumento superior e significativo de formação óssea no grupo de 1,5 mg/ml (rhBMP-2/colágeno, respectivamente) quando comparado ao grupo controle.
Também em 2005 foi realizado outro estudo avaliando o uso de rhBMP-2 associada a esponja de colágeno absorvível na concentração de 0,75 mg/ml e 1,5 mg/ml para aumento ósseo após a elevação da mucosa do seio maxilar, comparando com enxerto ósseo autógeno e bovino15. A avaliação foi feita pela análise da altura, espessura e densidade ósseas obtidas através de tomografias computadorizadas realizadas previamente, após quatro meses ao procedimento cirúrgico, e seis meses após a instalação de implantes dentários osseointegráveis. O grupo tratado com rhBMP-2/colágeno na concentração de 1,5 mg/ml apresentou maior densidade óssea no período de quatro meses, porém no período de seis meses, ambos os grupos de rhBMP-2 apresentaram resultados semelhantes. Os autores consideram este estudo como sendo o primeiro contendo grupo controle randomizado a demonstrar a neoformação óssea em humanos através do uso de proteínas recombinantes humanas, e concluíram que a combinação da rhBMP-2/colágeno absorvível é de uso seguro no processo de formação óssea na região de seio maxilar. Dentre os efeitos adversos relacionados ao uso de rhBMP-2 relatados neste estudo, o edema facial pós-operatório teve uma prevalência estatisticamente maior nos pacientes tratados com o fator de crescimento em comparação ao grupos controles (enxerto ósseo autógeno e xenógeno). A maior concentração de rhBMP-2 utilizada foi diretamente proporcional na manifestação do edema pós-operatório.
Estudos clínicos em seio maxilar e em rebordo alveolar edêntulo demonstraram que o uso da rhBMP-2 (embebida em colágeno absorvível) na concentração de 1,5 mg/ml, induziu formação óssea significante quantitativa e, qualitativamente, demonstrando que o osso neoformado é biologicamente similar ao osso nativo, possibilitando, assim, a reabilitação com implantes e próteses dentárias17.
Devido aos excelentes resultados relatados em trabalhos com o uso de rhBMP-2 em humanos na área odontológica e médica, o FDA (Food and Drug Administration), órgão regulador de produtos na área da saúde nos EUA, aprovou em 2002, a comercialização da rhBMP-2, a qual foi introduzida no mercado com o nome de Infuse Bone Graft®. Este produto passou a ser utilizado em larga escala no tratamento de doenças e traumas ósseos na coluna vertebral em humanos e, em 2004, como tratamento coadjuvante em fraturas de tíbia. Mais recentemente, em março de 2007, o uso de rhBMP-2 foi aprovado para aumento ósseo na maxila posterior (através do procedimento de elevação da mucosa do seio maxilar) e para o preenchimento de alvéolo dentário pós-extração, como uma alternativa ao enxerto ósseo autógeno, sendo estes casos denominados de utilização in label, ou seja, dentro da aprovação legal (pelo FDA) das indicações do material18.
Alguns estudos, em caráter experimental em humanos, já foram realizados a fim de ampliar a aplicação da rhBMP-2 em outros tipos de defeitos ósseos na cavidade oral, sendo considerado um uso off label, não aprovado legalmente (pelo FDA) nas indicações do material. A maioria destes estudos foi realizada em mandíbula, principalmente em regiões de grande perda óssea devido à presença de algum tipo de lesão que levasse à reabsorção óssea. Em 2008 foi publicado o resultado de 14 casos clínicos, onde os pacientes, que apresentavam, por motivos diversos, defeitos ósseos de dimensão considerável na mandíbula foram tratados com rhBMP-2 na concentração de 1,5 mg/ml19. Após os enxertos com rhBMP-2, os pacientes foram acompanhados por um período de seis a 18 meses e reabilitados com implantes e próteses dentárias. Todos os casos apresentaram sucesso clínico após a realização do tratamento, indicando que a rhBMP-2, sem associação com enxerto ósseo, pode ser utilizada em defeitos de tamanhos críticos em mandíbula. Os autores utilizaram, como modificação da técnica cirúrgica, uma malha de titânio com a finalidade de manter o espaço com a esponja de colágeno e o fator de crescimento em posição, impedindo assim que os tecidos moles comprimissem a região enxertada e diminuíssem o volume de ganho tecidual.
Outro relato de caso clínico foi apresentado, no ano de 200820 onde os pacientes com defeitos ósseos críticos na mandíbula foram tratados com rhBMP-2 isoladamente, ou em associação com enxerto ósseo autógeno. Foi relatado que apenas um dos casos apresentou insucesso, o qual foi associado à ausência do uso de um mantenedor de espaço. Os autores concluíram que esse tipo de defeito pode ser reconstruído com sucesso pelo uso da rhBMP-2 isoladamente, ou em associação com osso autógeno.
O uso da rhBMP-2 embebida em colágeno (Infuse Bone Graft®) é contraindicado em pacientes com hipersensibilidade à rhBMP-2 ou ao colágeno bovino tipo I, em áreas com infecção, em áreas de tumor e em pacientes grávidas ou planejando gravidez dentro de um período de um ano. É contraindicado a utilização do produto em pacientes com idade inferior a 18 anos (ou que ainda não terminaram o crescimento), devido à ausência de estudos comprobatórios sobre a interferência no crescimento ósseo natural18.
EFEITOS COLATERAIS DA APLICAÇÃO LOCAL DA PROTEÍNA ÓSSEA MORFOGENÉTICA
O uso da rhBMP-2 é promissor e tem apresentado resultados clínicos significativos, conforme demonstrado nesta revisão da literatura. Porém, sua utilização clínica, tanto na medicina quanto na Odontologia, vem sendo realizada com cautela, visto que o tema ainda é controverso e, em alguns casos, polêmico. Um recente número do Spine Journal, publicação com alto fator de impacto na área da ortopedia médica (coluna vertebral) colocou sob suspeita a ausência de resultados adversos em publicações previamente realizadas por pesquisadores que receberam fundos da empresa fabricante do produto21.
No mesmo número do periódico, outro estudo realizado sobre artrodese de vértebras, comparando rhBMP-2 e enxerto ósseo autógeno da crista do ilíaco, demonstrou diferenças entre os dados que foram reportados ao FDA, destinado a aprovação clínica do rhBMP-2 e, nas publicações posteriores, os quais foram obtidos com base nos mesmos pacientes e pelos mesmos autores22. No documento enviado ao FDA em 2002, efeitos adversos como inflamação precoce e tardia, e até mesmo complicações geniturinárias, como ejaculação retrógrada, foram reportados mais frequentemente com a utilização do rhBMP-2 do que com a utilização do enxerto ósseo autógeno da crista do ilíaco no procedimento de artrodese vertebral. Porém, estes efeitos adversos "desapareceram" das publicações posteriores em periódicos científicos, embora o foco destas publicações tenha sido os mesmos pacientes previamente reportados ao FDA e publicado pelos mesmos autores. Estes fatos poderiam levar o leitor a acreditar que rhBMP-2 não teria efeitos colaterais quando aplicado na coluna vertebral. É importante salientar que os efeitos adversos mencionados neste parágrafo se referem a efeitos colaterais locais em aplicações da rhBMP-2 em procedimentos de fusão lombar (artrodese) anterior21,22. A maior incidência de complicações relacionadas à rhBMP-2 pode não estar relacionada com a proteína propriamente dita, mas pelo provável mecanismo de ação da mesma no local aplicado, principalmente o edema inicial. Esta justificativa é plausível, uma vez que, com o uso do enxerto ósseo autógeno da crista do ilíaco na artrodese lombar anterior são relatados os mesmos efeitos colaterais com a aplicação da rhBMP-2. A diferença é que alguns destes efeitos colaterais foram mais frequentes com a utilização do rhBMP-2 do que com o enxerto ósseo autógeno da crista do ilíaco. Na Odontologia, não foram identificados estudos demonstrando complicações sistêmicas nos pacientes tratados com rhBMP-2. A literatura demonstra a aplicação de rhBMP-2 na região craniofacial como sendo um procedimento seguro, não tóxico e sem alteração sistêmica12. Outros estudos15,16,19,20 relatam como principal fator adverso frente a utilização da rhBMP-2 na região craniofacial, um edema considerável (reversível espontaneamente), que pode estar relacionado com o mecanismo de ação da mesma, isto é, um potente agente angiogênico. Mais estudos, com maior abrangência metodológica, necessitam ser realizados.
O objetivo deste artigo é apresentar um relato de caso clínico onde a rh (recombinante humana) BMP-2 foi utilizada no processo de aumento ósseo na região anterior da maxila edêntula.
RELATO DE CASO CLÍNICO
A metodologia realizada no caso clínico descrito foi submetidaà apreciação do Comitê de Ética em Pesquisa da Faculdade de Odontologia de Araraquara (CEP-FOAr) e aprovada sob o protocolo número 32/09. Um paciente do sexo masculino, 41 anos de idade, relatando boa saúde sistêmica à anamnese, não fumante, procurou atendimento odontológico na clínica do curso de especialização em Implantodontia da Fundação Araraquarense de Ensino e Pesquisa em Odontologia (Faepo), com o objetivo de instalar implantes osseointegráveis na região anterior da maxila.
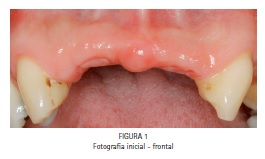
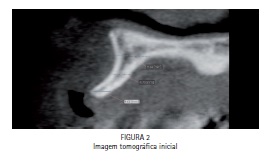
Após avaliação odontológica (Figura 1) e tomográfica (Figura 2), foi diagnosticada a necessidade de enxertia óssea na região entre dentes caninos superiores previamente à instalação dos implantes osseointegráveis. Como método de enxertia óssea, foi proposto a realização do procedimento de aumento ósseo com a rhBMP-2 (Infuse Bone Graft®, Medtronic Sofamor Danek, Memphis, TN - EUA). O paciente foi informado sobre o caráter experimental do procedimento e assinou termo de consentimento livre e esclarecido.
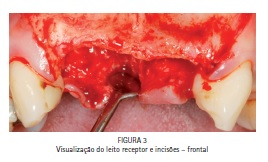
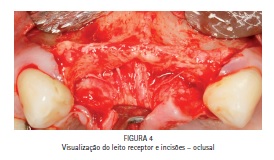
A cirurgia foi realizada com anestesia local. Após a realização das incisões verticais e horizontal, foi feito o descolamento do tecido mole adjacente até que o início do soalho da fossa nasal fosse visualizado e todo o leito receptor estivesse livre de periósteo (Figuras 3 e 4). Nesta etapa, após avaliação clínica transcirúrgica, foi preparado e utilizado, conforme as recomendações do fabricante, o Kit Infuse Bone Graft® tamanho pequeno, composto por uma dose de 4,2 mg de rhBMP-2 a uma concentração de 1,5 mg/ml, mais duas esponjas carreadoras a base de colágeno bovino tipo 1 (2,5 x 5 cm de tamanho).
Após o preparo do material de enxertia, foi realizada a divisão do retalho vestibular para que houvesse um posterior fechamento passivo da área enxertada, e também o preparo do leito ósseo receptor através de estrias de desgaste ósseo com o auxílio de brocas cirúrgicas específicas, objetivando um aumento da vascularização local e consequentemente a presença de células mesenquimais indiferenciadas para auxiliar o mecanismo de osteoindução da rhBMP-2.
Neste caso, para a estabilização do sistema Infuse Bone Graft® foi utilizada uma malha de titânio de 0,2 mm de espessura (Stryker Corporation - EUA), moldada no momento transcirúrgico.
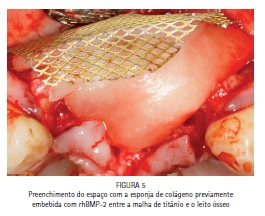
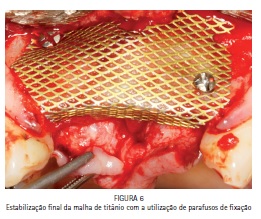
A malha de titânio foi moldada ao tecido do rebordo ósseo remanescente de forma que se evitasse o tensionamento do tecido mole na região durante o pós-operatório e, consequentemente, uma deiscência da sutura; ao mesmo tempo, cuidou-se para que o posicionamento da malha de titânio permitisse um aumento ósseo suficiente para a futura instalação dos implantes osseointegráveis. Após a delimitação e acomodação da malha de titânio, o material Infuse Bone Graft® foi colocado em posição e a malha foi fixada com parafusos de enxerto ósseo (1,5 x 6 mm - Conexão Sistema de Próteses, Arujá, SP – Brasil)(Figuras 5 e 6).
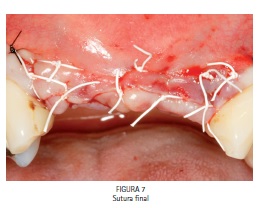
O retalho foi suturado com fio de politetrafluoretileno (e-PTFE, Gore-Tex, Flagstaff, AZ, EUA) combinado com fio mononylon (Ethicon, São José dos Campos, SP, Brazil). (Figura 7)
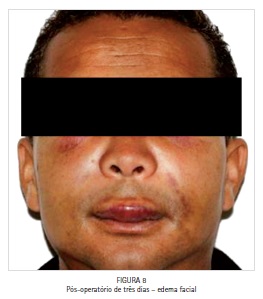
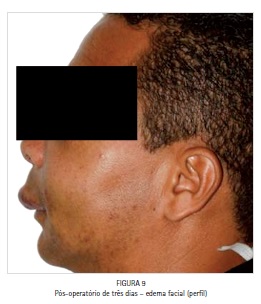
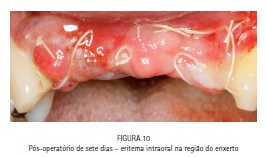
O paciente foi medicado com analgésico (Paracetamol 750 mg a cada seis horas em caso de dor), anti-inflamatório (Nimesulida 100 mg a cada 12 horas por quatro dias) e antibiótico (Amoxicilina 500 mg a cada oito horas por sete dias), e acompanhado durante todo o período pós-operatório. A principal queixa do paciente no período pós-operatório foi em relação ao edema facial exacerbado (Figuras 8 e 9) e ao eritema intraoral (Figura 10) presentes nos cinco primeiros dias de pós-cirúrgico, sem relato de dor ou qualquer outro tipo de desconforto ou intercorrência. O edema desapareceu espontaneamente em sete dias.
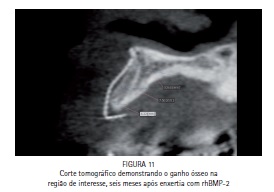
Após seis meses, foi realizada uma tomografia na região previamente operada sendo possível verificar o aumento de tecido mineralizado (Figura 11) e planejar a cirurgia para a instalação dos implantes.
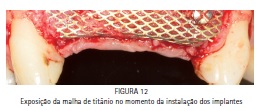
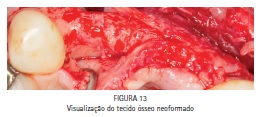
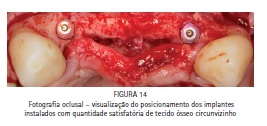
Na segunda etapa cirúrgica, após anestesia local da área previamente enxertada, foi realizada uma incisão horizontal (crestal) e duas verticais (relaxantes), bem como o descolamento do retalho e exposição da malha de titânio (Figura 12). A malha de titânio foi removida com alguma dificuldade, pois entre a malha e o tecido ósseo neoformado existia um tecido conjuntivo de aparência fibrosa com cerca de 0,5 a 1 mm de espessura, o qual foi removido com a finalidade de se visualizar o tecido ósseo neoformado (Figura 13). Dois implantes osseointegráveis (3,5 x 11,5 mm Flash HI – Conexão Sistema de Próteses, Arujá, SP - Brasil) foram instalados na área previamente enxertada, um implante na região do dente 12 e outro implante na região do dente 22 (Figura 14). Os implantes apresentaram um travamento de 60 N.cm2. Posteriormente, o retalho foi reposicionado e foi realizada sutura oclusiva com fio Seda 4-0 (Ethicon, São José dos Campos, SP - Brasil).
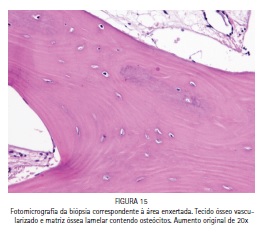
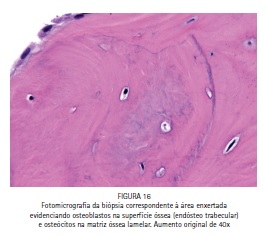
Em adição ao procedimento de instalação dos implantes, uma biópsia óssea foi coletada na área enxertada no momento da cirurgia de reabertura para a instalação dos implantes. A realização da biópsia objetivou a avaliação microscópica do tecido ósseo neoformado, uma vez que se tratava de um procedimento experimental off label. A Figura 15 é uma fotomicrografia demonstrando tecido ósseo bem vascularizado e contendo osteócitos na matriz óssea, o que indica a neoformação de um tecido ósseo vivo, bem como rimas de osteoblastos nas superfícies ósseas e em contato com a matriz óssea (Figura 16), evidenciando atividade celular em favor da formação óssea.
DISCUSSÃO
O objetivo deste estudo é exemplificar o uso da rhBMP-2 para aumento ósseo com a finalidade de instalação de implantes na região anterior da maxila, baseando-se na literatura disponível.
Estudos relacionados ao uso clínico da rhBMP-2 na Odontologia são relativamente recentes na literatura, havendo poucos artigos científicos com metodologia sistematizada e enfoque no uso clínico15,16; mesmo assim, a maioria dos artigos científicos são classificados como relatos de caso19,20. As informações sobre estudos in vivo/clínicos presentes na literatura podem ser divididas em dois tipos diferentes: in label, onde o uso da rhBMP-2 se limita ao procedimento de enxertia óssea no seio maxilar e em alvéolos de extração15,16,23,24 e off label, o qual envolve aumento em espessura e/ou altura óssea, não relacionados ao seio maxilar ou a alvéolos de extração20,21.
O uso clínico da rhBMP-2 é dependente da quantidade, da concentração da rhBMP-2 e do tipo de carreador a ser utilizado10,11. Comercialmente, encontra-se a rhBMP-2 na concentração de 1,5 mg/ml, com o carreador a base de colágeno bovino tipo I18. A literatura ainda não é clara quanto à melhor concentração de rhBMP-2 a ser utilizada para aumento ósseo15,16,19,20. Alguns autores sugerem a concentração de 1,5 mg/ml como sendo a de eleição para estudos científicos e consequentemente utilização clínica15,16 pois, com esta concentração, é possível obter-se uma neoformação óssea satisfatória em um período de tempo relativamente mais curto e comparável ao tempo de neoformação óssea com a utilização do enxerto ósseo autógeno. Com a utilização intraoral de rhBMP-2 não foram observadas ou relatadas reações sistêmicas adversas até o momento na literatura. O caso clínico relatado neste estudo é de uso off label da rhBMP-2, onde, a partir de uma situação clínica inicial desfavorável à instalação dos implantes osseointegráveis, conseguiuse restabelecer a arquitetura óssea através do uso deste material de enxertia, de maneira suficiente para a instalação de implantes, com subsídios histológicos da qualidade do osso neoformado. Considerando-se o pós-operatório dos pacientes submetidos a cirurgias orais com enxerto de rhBMP-2, a literatura possui relatos de efeitos adversos, tais como dor, edema facial, eritema oral, sinusite, rinite, e equimose15,16,19,20. De maneira geral, o paciente relatado neste estudo apresentou edema facial exacerbado e eritema intraoral por um período de ao menos cinco dias, sem, no entanto, apresentar dor por um período prolongado, ou qualquer outro tipo de efeito adverso.
Cabe ressaltar que a literatura foi recentemente alertada por um debate sobre possíveis efeitos adversos graves da utilização do rhBMP-2, variando de eventos inflamatórios agudos até problemas geniturinários severos21,22, porém tais efeitos foram relacionado apenas ao uso da rhBMP-2 em cirurgias de coluna lombar, sem maiores informações ou outras informações relevantes no que diz respeito à sua aplicação maxilofacial.
Com relação ao carreador utilizado, a esponja de colágeno bovino tipo I, trata-se de um material que apresenta pouca interação sistêmica, não influenciando no mecanismo de ação da proteína e aumentando a meia vida do material, embora não possua características mecânicas favoráveis à utilização em defeitos ósseos, necessitando de um mantenedor de espaço10,12,13,19. No caso clínico apresentado neste estudo, o mantenedor de espaço foi uma tela de titânio sobreposta ao Infuse Bone Graft® e parafusada ao leito ósseo receptor.
A tela de titânio possui o objetivo de criar um espaço onde o fator de crescimento (rh-BMP2) associado ao carreador possa ser posicionado, permitindo um ganho ósseo previsível e dentro dos limites do espaço circunscrito pela tela de titânio. O inconveniente de se utilizar um mantenedor de espaço é que existe o risco de deiscência de sutura e, consequentemente, exposição do material enxertado19; portanto, deve haver cautela no planejamento cirúrgico dos casos clínicos, visando um ganho de tecido ósseo suficiente para restabelecer uma situação favorável à instalação de implantes osseointegráveis, além de se evitar complicações cirúrgicas.
O uso da rhBMP-2 vem sendo amplamente estudado concomitantemente a sua utilização clínica por diversos profissionais da área médica e odontológica. Do mesmo modo que a concentração e o carreador desta proteína são fatores discutíveis na literatura, seu uso clínico e possíveis complicações também são, ainda, objetos de investigação científica.
CONCLUSÃO
O uso da rhBMP-2 é uma alternativa viável, comprovada clínica e cientificamente para aumento ósseo após a elevação da membrana sinusal no seio maxilar e para o preenchimento de alvéolos pós-exodontia. Porém, o uso da rhBMP-2 exige cautela e conhecimento clínico e científico por parte do cirurgião, uma vez que é um material cuja comprovação científica para outros tipos de defeitos ósseos na região craniofacial ainda se encontra em estado de evolução.
REFERÊNCIAS
1. Moghadam HG, Urist MR, Sandor GK, Clokie CM. Successful mandibular reconstruction using a BMP bioimplant. J Craniofac Surg 2001 Mar;12(2):119-27; discussion 28. [ Links ]
2. Bruder SP, Fox BS. Tissue engineering of bone. Cell based strategies. Clin Orthop Relat Res 1999 Oct(367 Suppl):S68-83. [ Links ]
3. Urist MR. Bone: formation by autoinduction. Science 1965 Nov 12;150(698):893-9. [ Links ]
4. Bedouelle J. Induction osseuse—Réparation osseuse. Protéine osseuse morphogénétique (BMP). Protéine osseuse morphogénétique humaine recombinante (rh BMP). Rev Chir Orthop1994; 80:165-8.
5. Katagiri T, Yamaguchi A, Komaki M, Abe E, Takahashi N, Ikeda T, et al. Bone morphogenetic protein-2 converts the differentiation pathway of C2C12 myoblasts into the osteoblast lineage. J Cell Biol1994 Dec;127(6 Pt 1):1755-66. [ Links ]
6. Sakou T. Bone morphogenetic proteins: from basic studies to clinical approaches. Bone 1998 Jun;22(6):591-603. [ Links ]
7. Rebecca HL, Wozney JM. Delivering on the promise of bone morphogenetic proteins. Trends Biotechnol 2001;19(7):255-65. [ Links ]
8. Solofomalala GD, Guery M, Lesiourd A, Le Huec JC, Chauveaux D, Laffenetre O. Bone morphogenetic proteins: from their discoveries till their clinical applications. Eur J Orthop Surg Traumatol 2007;17:609-15. [ Links ]
9. Valcourt U, Moustakas A. BMP signaling in osteogenesis, bone remodeling and repair. Eur J Trauma 2005;31:464-79. [ Links ]
10. Yasko AW, Lane JM, Fellinger EJ, Rosen V, Wozney JM, Wang EA. The healing of segmental bone defects, induced by recombinant human bone morphogenetic protein (rhBMP-2). A radiographic, histological, and biomechanical study in rats. J Bone Joint Surg Am 1992 Jun;74(5):659-70. [ Links ]
11. Seeherman H, Wozney JM. Delivery of bone morphogenetic proteins for orthopedic tissue regeneration. Cytokine Growth Factor Rev 2005 Jun;16(3):329-45. [ Links ]
12. Einhorn TA. Clinical applications of recombinant human BMPs: early experience and future development. J Bone Joint Surg Am 2003;85-A Suppl 3:82-8. [ Links ]
13. Hwang CJ, Vaccaro AR, Lawrence JP, Hong J, Schellekens H, Alaoui-Ismaili MH, et al. Immunogenicity of bone morphogenetic proteins. A review. J Neurosurg Spine 2009;10:443-51. [ Links ]
14. Toriumi DM, Kotler HS, Luxenberg DP, Holtrop ME, Wang EA. Mandibular reconstruction with a recombinant bone-inducing factor. Functional, histologic, and biomechanical evaluation. Arch Otolaryngol Head Neck Surg 1991 Oct;117(10):1101-12. [ Links ]
15. Boyne PJ, Lilly LC, Marx RE, Moy PK, Nevins M, Spagnoli DB, et al. De novo bone induction by recombinant human bone morphogenetic protein-2 (rhBMP-2) in maxillary sinus floor augmentation. J Oral Maxillofac Surg 2005 Dec;63(12):1693-707. [ Links ]
16. Fiorellini JP, Howell TH, Cochran D, Malmquist J, Lilly LC, Spagnoli D, et al. Randomized study evaluating recombinant human bone morphogenetic protein-2 for extraction socket augmentation. J Periodontol 2005 Apr;76(4):605-13. [ Links ]
17. McKay WF, Peckham SM, Badura JM. A comprehensive clinical review of recombinant human bone morphogenetic protein-2 (Infuse Bone Graft). Int Orthop 2007 Dec;31(6):729-34. [ Links ]
18. 2.1 Physician Labeling (03/08/2007). Infuse Bone Graft for Certain Oral Maxillofacial and Dental Regenerative Uses. Important Medical Information, Rx Only. Available at:http://www.accessdata.fda.gov/cdrh_docs/pdf5/P050053c.pdf. Accessed June 05, 2009. [ Links ]
19. Herford AS, Boyne PJ. Reconstruction of mandibular continuity defects with bone morphogenetic protein-2 (rhBMP-2). J Oral Maxillofac Surg 2008 Apr;66(4):616-24. [ Links ]
20. Carter TG, Brar PS, Tolas A, Beirne OR. Off-label use of recombinant human bone morphogenetic protein-2 (rhBMP-2) for reconstruction of mandibular bone defects in humans. J Oral Maxillofac Surg 2008 Jul;66(7):1417-25. [ Links ]
21. Carragee EJ, Ghanayem AJ, Weiner BK, Rothman DJ, Bono CM. A challenge to integrity in spine publications: years of living dangerously with the promotion of bone growth factors. Spine J. 2011;11(6):463-8. [ Links ]
22. Carragee EJ, Hurwitz EL, Weiner BK. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J. 2011;11(6):471-91. [ Links ]
23. Vidote RM, Guastaldi FPS, Kluppel LE, Spagnoli DB, Mazzoneto R. Uso da proteína morfogenética óssea recombinante humana-2 em levantamento de assoalho de seio maxilar. ImplantNews 2009; 6(1):27-31.34. [ Links ]
24. Serra e Silva FM, Mazzoneto R. Avaliação clínica e histológica da associação de enxerto ósseo bovino e proteína óssea morfogenética em levantamento de seio maxilar. Implant-News 2006; 3(4):377-82. [ Links ]
 Autor para correspondência:
Autor para correspondência:
Elcio Marcantonio Junior
Unesp - Depto. de Diagnóstico e Cirurgia
Rua Humaitá, 1680 – 2º andar
Araraquara, SP
Brasil
14801-903
Recebido em: mar/2012
Aprovado em: mar/2012
CEP/FO-Car nº 32/09













