Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.68 no.2 Sao Paulo Abr./Jun. 2014
Potencial osteoindutor de blocos de osso alógeno humano in vitro
Osteoinductive potential of allogeneic human bone blocks in vitro
Alex Paulo Sérvio de Sousa I; Elizabeth Ferreira Martinez II; Marcelo Henrique Napimoga III
I Cirurgião-Dentista - Mestre em Implantodontia pela Faculdade São Leopoldo
II Doutora em Biologia Celular - Docente da Faculdade São Leopoldo Mandic
III Doutor - Coordenador de Pós-Graduação da Faculdade São Leopoldo Mandic
RESUMO
O enxerto alógeno apresenta diversas vantagens em relação ao enxerto autógeno, porém sua utilização é relativamente recente e cercada de incertezas em relação ao seu comportamento biológico/imunológico e eficácia como biomaterial. Alguns autores consideram-no estritamente osteocondutor, enquanto outros acreditam que ele pode ser osteoindutor. O objetivo deste trabalho foi estudar o potencial osteoindutor do osso alógeno analisando os efeitos dos extratos proteicos provenientes de blocos de aloenxerto sobre células pré-osteoblásticas humanas. As proteínas extraídas dos blocos ósseos foram incubadas em culturas de células pré-osteoblásticas, a fim de verificar o potencial de indução de proliferação celular. Foram utilizados os métodos do RT-qPCR, Vermelho de Alizarina e Von Kossa para avaliar o metabolismo das células ósseas e a formação de nódulos minerais contendo cálcio e fosfato, respectivamente. Também foi pesquisado se havia nos blocos ósseos a proteína morfogenética BMP-2. Foi possível observar, nos grupos experimentais, aumento na proliferação celular, do metabolismo das células ósseas e da produção de nódulos de cálcio e fosfato, em relação ao grupo controle. Foi possível detectar a presença de BMP-2 em seis dos nove blocos ósseos. Conclui-se que os blocos de aloenxerto mineralizado possuem proteínas com potencial osteoindutor quando testado seu comportamento in vitro em células osteoblásticas.
Palavras-chave: transplante homólogo; osteoblastos; osso e ossos
ABSTRACT
The allogenic bone has several comparative advantages in relation to autograft bone, but its use is relatively recent and surrounded by uncertainties regarding the biological/immunological behavior and effectiveness as a biomaterial. Some authors consider the material strictly osteoconductive, while others believe that the material can also possess osteoinductive activity. Thus, we evaluated the osteoinductive potential of allograft bone by analyzing the effects of protein extracts from allograft blocks using human pre-osteoblastic cells. The protein extract from allograft block was incubated in cultures of pre-osteoblast cells in order to verify the cell proliferation potential. Moreover, it was employed the RT-qPCR, Alizarin and Von Kossa staining to evaluate the bone metabolism, as well as, the potential induction of calcium and phosphate nodule formation. Finally, it was quantified the morphogenetic protein BMP-2. It was possible to observe in the experimental group, an increase in the cell proliferation and cellular metabolism, as well as, a significant increase in the formation of nodules of calcium and phosphate in comparison to control group. It was possible to detect amounts of BMP-2 in six of nine total samples tested. It was possible to conclude that the mineralized allografts blocks have in vitro osteoinductive activity on osteoblastic cells.
Keywords: bone transplantation; osteoblasts; bone and bones
RELEVÂNCIA CLÍNICA
A importância clínica do presente estudo está no conhecimento acerca das características do osso alógeno como material de enxerto. Chegamos à conclusão de que o material é potencialmente osteoindutor, além de osteocondutor. Assim pode-se inferir que o osso alógeno deve ser considerado uma boa alternativa ao osso autógeno para enxertias em blocos - situações que exigem uma maior capacidade do material de integrar-se biologicamente ao leito receptor. Além disso, os resultados aqui apresentados ajudam na compreensão de que o osso alógeno é um material biologicamente viável e apresenta-se como uma valiosa opção clínica nos procedimentos reconstrutivos ósseos. No entanto, cabe a ressalva de que o osso alógeno pode desencadear uma resposta imunológica no indivíduo receptor.
INTRODUÇÃO
Os enxertos ósseos reconstrutivos prévios à instalação de implantes dentais foram desenvolvidos, inicialmente, tendo como material de eleição o osso autógeno, ou seja, a reposição do tecido perdido se dá através da obtenção em uma região doadora no próprio indivíduo. Algumas desvantagens relacionadas à enxertia autógena, sobretudo a necessidade de envolvimento de dois sítios cirúrgicos (um apenas para a obtenção do tecido ósseo doador), levaram ao desenvolvimento de técnicas que utilizam diferentes biomateriais. O osso alógeno, proveniente de um doador da mesma espécie, surgiu como uma alternativa principalmente para grandes reconstruções que requerem uma maior quantidade de tecido.1
A utilização do osso alógeno na Implantodontia é relativamente recente e, portanto, ainda está cercada de incertezas relacionadas à escolha do material, seu processamento e o risco de transmissão de doenças. Os estudos têm-se mostrado discordantes quanto ao comportamento e o real potencial de utilização deste material, principalmente quanto à eficácia de sua incorporação ao leito receptor e sua capacidade de se portar como material não apenas osteocondutor, mas também osteoindutor, 2-4 além de incertezas no que se refere ao potencial de reação imunológica do indivíduo receptor frente aos blocos alógenos.5
A osteoindução é um processo importante para a neoformação óssea, pois diz respeito à capacidade de recrutamento de células pluripotentes indiferenciadas e sua estimulação para originarem novas células de fenótipo osteoblástico. Para isso, fatores de crescimento, principalmente as BMPs, devem estar presentes, e de forma viável, no osso doador no momento da enxertia.4,6 Porém, o processamento necessário à inativação das células no osso alógeno pode influenciar na sua pretensa capacidade osteoindutiva justamente por ser capaz de reduzir drasticamente, ou mesmo eliminar, a presença destas proteínas ósseas morfogenéticas no interior do tecido. Mesmo presentes, as BMPs podem ainda ser inativadas por desnaturação proteica durante o processamento.6
O presente estudo foi delineado para investigar o potencial osteoindutor dos blocos de osso alógeno congelados comumente utilizados na prática clínica odontológica. Propomo-nos a examinar e quantificar a presença de BMP-2 e verificar a capacidade do extrato proteico proveniente das amostras em estimular culturas de células pré-osteoblásticas. Assim, queremos não apenas identificar a presença da proteína óssea morfogenética nos blocos do aloenxerto, mas também utilizar a análise do comportamento das culturas celulares osteoblásticas para demonstrar se estes fatores de crescimento apresentam-se ativos em sua capacidade de estimular a produção de novo tecido ósseo in vitro.
MATERIAIS E MÉTODOS
Configuração da amostra
Foram utilizados nove blocos de osso alógeno provenientes do Banco de Tecidos Músculo-Esqueléticos da Universidade de Marília - UniOss. Os blocos tinham tamanhos e formatos padronizados de 15 mm x 10 mm. Foram utilizados blocos provenientes de diversos lotes, a fim de serem consideradas variações fenotípicas e genotípicas dos doadores. Todos os blocos foram previamente triturados de maneira estéril pelo próprio banco de ossos e enviados na forma particulada e congelados. O presente projeto foi aprovado pelo Comitê de Ética em Pesquisa para Seres Humanos do Centro de Pesquisas Odontológicas São Leopoldo Mandic (Campinas, Brasil) sob o número de protocolo n° 2012/0079.
Extração proteica
A cada um dos nove tubos contendo os blocos ósseos triturados foi acrescentado 1,5 mL de solução tampão de lise RIPA (Thermo Scientific, EUA) contendo em sua composição 50mM Tris HCl (pH 7,4), 150mM NaCl, 1mM EDTA, 1% Triton X-100, 1% desoxicolato de sódio e 0,1% dodecil sulfato de sódio (SDS) acrescido de coquetel inibidor de protease (Sigma, St. Louis, MO, EUA) na concentração final de 1%. Cada tubo foi então agitado em um agitador (Phoenix AP 56) por 30 segundos para a homogeneização dos elementos das amostras. As amostras foram levadas à centrífuga (Eppendorf 5804 R) a 4ºC, 1100 rpm, por 15 minutos, resultando em soluções de três fases. A camada de cada amostra, correspondente aos extratos proteicos, foram pipetadas e transferidas para novos tubos de poliestireno (Eppendorf, EUA), devidamente identificados.
Quantificação de proteínas totais
Para a determinação das proteínas totais das amostras foi utilizado o ensaio BCA Protein Assay (Thermo Scientific, EUA) com curva padrão de proteínas utilizando-se albumina de soro bovino (Albumin Standard ou BSA). O ensaio foi realizado em microplacas de 96 poços (em temperatura ambiente), onde foram pipetadas as amostras-padrão e as amostras pesquisadas. Foi utilizado um leitor de microplacas (Epoch Biotek, EUA), que, a partir da leitura da absorbância das amostras-padrão, determinou as concentrações das proteínas totais das nove amostras pesquisadas. Estas amostras resultantes da extração proteica dos blocos de osso alógeno, depois de quantificadas as proteínas totais, foram então utilizadas nas próximas etapas deste estudo.
Proliferação celular
Cada extrato proteico foi diluído até atingir as concentrações finais de 10 ng/mL, 50 ng/mL ou 100 ng/mL, as quais foram incubadas juntamente com culturas de pré-osteoblastos humanos (HFOb) obtida do ATCC (American Type Collection, ATCC, VA, EUA) para determinação da capacidade das proteínas extraída dos blocos ósseos em estimular a proliferação celular. As células pré-osteoblásticas foram cultivadas em meio Essencial Mínimo alfa (α-MEM) (Nutricell®, Campinas, SP, Brasil), suplementado com 10% de soro fetal bovino (Cultilab®, Campinas, SP, Brasil) e 1% de solução antibiótica-antimicótica (Sigma, St. Louis, Missouri, EUA). Todos os procedimentos foram realizados em capela de fluxo laminar para manutenção da esterilidade dos materiais e das substâncias utilizadas para o cultivo celular.
As células foram mantidas em estufa a 34ºC, em atmosfera úmida contendo 95% de ar e 5% de dióxido de carbono. O meio de cultura foi trocado a cada 2-3 dias e a progressão da cultura avaliada por microscopia de fase em culturas crescidas sobre poliestireno (plástico), que serviu como controle.
Foi utilizado o método de exclusão vital por azul de Trypan após 24, 48 e 72 horas à adição do extrato proteico para o estudo da proliferação celular. Para tal, após atingirem a subconfluência, as células foram enzimaticamente desprendidas das placas e o precipitado de células resultante foi ressuspenso em 1 mL de meio. Foram retirados 10 μL da suspensão de células e a ela juntou-se 10 μL de azul de Trypan, sendo que 1 μL desta solução foi colocada em um hemocitômetro (câmara de Neubauer-Fisher Scientific, Pittsburgh, PA, EUA) e levado ao microscópio invertido de fase (Nikon, Eclipse TS100) para a contagem e observação das células.
Atividade celular osteoblástica
A fim de mensurar a expressão de RNA mensageiro do RUNX- 2, fator de transcrição que desencadeia a expressão dos genes relacionados à produção de grande parte das proteínas da matriz óssea, como osteopontina, sialoproteína óssea, osteocalcina e fibronectina nas células osteoblásticas7,8 foi empregada a técnica de qPCR.
Para tal, as células osteoblásticas foram cultivadas em placas de 10 cm2 por 72h na presença das diferentes concentrações de extratos proteicos dos blocos ósseos. Após este período foi adicionado 1 ml de Trizol (Amersham) e a separação das fases ocorreu com a adição de 0,2 ml de clorofórmio, seguida de centrifugação (12.000 g, 15 minutos, 4ºC). O RNA foi precipitado a partir da fase aquosa com 0,5 ml de isopropanol, lavado com etanol 75% e ressuspendido em água. Foram obtidas amostras de RNA em duplicata das células osteoblásticas tratadas com os extratos proteicos dos blocos de osso alógeno nas concentrações de 10, 50 e 100 ng/ml, além do grupo controle (0 ng/ml).
A integridade das amostras foi verificada por eletroforese em gel denaturante de agarose a 1,2%. As amostras íntegras apresentaram duas subunidades ribossomais: 18S e 28S. Após a eletroforese, as amostras de RNA foram armazenadas em freezer - 80°C.
A quantificação das amostras de RNA total foi realizada em espectrofotômetro (NanoDrop Techonologies) e estas foram submetidas à síntese de DNA complementar (cDNA) utilizando-se o kit Superscript III RTTM (Invitrogen). Para transcrição reversa de cada amostra foi utilizado 1 μg de RNA, 1,0 μl de 50 μM oligo(dT) e 1,0 μl de 10 mM dNTPs os quais foram mantidos por 5 minutos a 65°C e em seguida por 1 minuto a 4°C. Para cada amostra, foram adicionados 10,0 μl da seguinte mistura de reação: 2 μl de tampão RT 10x, 4,0 μl de 25 mM MgCl2, 2,0 μl de 0,1 M DTT, 1,0 μl de 40U/ μl Rnase OUTTM e 1,0 μl de 200 U/μl Superscript III RTTM. A reação ocorreu por 50 minutos a 50°C, seguida de 5 minutos a 85°C.
As amostras de cDNAs utilizadas na reação de PCR em tempo real foram quantificadas em espectrofotômetro. As reações foram feitas em duplicatas utilizando-se como sistema de detecção o reagente SYBRTM Green contido no PCR Master Mix® (Applied Biosytems), que também contém todos os reagentes necessários para PCR (dNTP's, MgCl2, tampão, Taq Ampli-Gold). Para a análise do fator de transcrição RUNX-2, foi utilizado um primer específico.
A detecção da amplificação em tempo real foi realizada no equipamento 7300 Real Time PCR System (Applied Biosystems) em gráficos de fluorescência versus número de ciclos. O programa foi iniciado a 95°C/10 minutos, seguido de 40 ciclos: 95°C/15 segundos e 60°C/1 minuto. Ao final de uma amplificação normal adicionou-se um passo de 20 minutos, referente à curva de dissociação, no qual a temperatura aumenta gradualmente de 60° para 95°C.
A expressão dos genes do RUNX-2 foi determinada de forma relativa, ou seja, os valores de expressão foram normalizados em relação a genes endógeno β-actina (ACTB). Foi utilizada a fórmula de cálculo 2-ΔΔCt que representam os níveis de expressão do gene de interesse em ensaio de quantificação relativa. Os valores obtidos foram expressos em unidades arbitrárias (UA).
Vermelho de Alizarina e Von Kossa
A) Vermelho de Alizarina
As células osteoblásticas foram cultivadas com o extrato proteico obtidos dos blocos ósseos por 14 dias na concentração de 100 ng/ml, sendo que o meio de cultura foi trocado a cada 2-3 dias, assim como a adição de extrato proteico. Após os 14 dias, os meios de cultura foram retirados e os poços lavados com solução de Hanks (Sigma), pH 7,4. As amostras foram fixadas com álcool etílico 70%, por 1 hora, a 4ºC, seguido de lavagem com PBS e água destilada, sendo posteriormente coradas com vermelho de alizarina S (Sigma), pH 4,2 por 15 minutos. Após o término, as lâminas foram lavadas e preparadas para análise em microscópio óptico (Nikon eclipse E800, Japão). A presença de depósitos de cálcio foi identificada pelo aparecimento de uma coloração vermelha na matriz.
B) Von Kossa
As células osteoblásticas foram cultivadas com o extrato proteico obtidos dos blocos ósseos por 14 dias na concentração de 100 ng/ml, sendo que o meio de cultura foi trocado a cada 2-3 dias, assim como a adição de extrato proteico. Após os 14 dias, foram retirados os meios de cultura e colocados em cada poço 2 ml de nitrato de prata (AgNO3) por 20 minutos. Em seguida, os poços foram lavados com água destilada e acrescidos 2 ml de hidroquinona (C6H4(OH)2) por 2 minutos. Sem lavar, foram colocados. 2 ml de tiossulfato (S2O3 2−) por 2 minutos. As amostras foram lavadas com água destilada e preparadas para análise em microscópio óptico (Nikon eclipse E800, Japão). Os depósitos de fosfato foram identificados pela presença de depósitos com coloração negra.
Quantificação de BMP-2
Por fim, buscou-se quantificar a proteína morfogenética-2 (BMP-2) nos blocos de osso alógeno. Para tal, a proteína BMP- 2 foi quantificada por meio de teste ELISA. Em uma placa de poliestireno com 96 poços foram adsorvidos previamente os anticorpos monoclonais específicos para o antígeno pesquisado (BMP-2). Após incubação overnight à temperatura ambiente, a placa foi lavada com tampão específico e bloqueada com tampão de bloqueio contendo albumina por 2 horas. Em seguida, as amostras com os extratos proteicos obtidos de cada bloco de osso alógeno (n = 9) foram então pipetadas em cada um destes poços de reação. As amostras foram então incubadas por duas horas à temperatura ambiente em um agitador orbital horizontal regulado em 500 rpm. Após este período de incubação, as amostras foram aspiradas e cada poço de reação novamente lavado com tampão específico.
O próximo passo foi adicionar 200 uL de anticorpo anti-BMP-2 conjugado à peroxidase. E incubado por 1 hora a temperatura ambiente. Procedeu-se nova lavagem com tampão especifico e então adicionado aos poços um substrato solúvel TMB. Após 30 minutos a reação colorimétrica foi paralisada com a adição de H2SO4 e levado a uma leitora de placas de ELISA para aquisição da absorbância a 450 nm. Os dados foram gerados baseados na curva padrão fornecidos pelo kit.
Análise estatística
A análise estatística empregada para os diferentes testes foi a de comparação múltipla ANOVA seguido de Bonferroni. O nível de significância adotado foi de 5%.
RESULTADOS
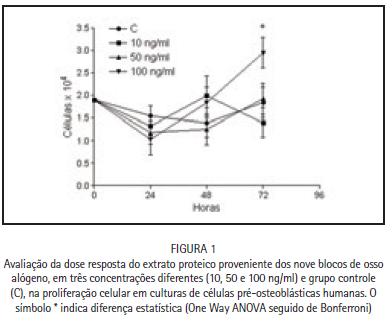
O comportamento das culturas de células osteoblásticas tratadas com o extrato proteico proveniente dos blocos de osso alógeno, nas concentrações de 10, 50 e 100 ng/ml, em relação aos grupos controles (não tratados), está expresso na Figura 1. É possível observar que a taxa de proliferação celular das amostras e grupo controle não apresentou diferença estatisticamente significativa nos períodos de 24 horas e 48 horas. No entanto, após 72 horas a amostra contendo 100 ng/ml de extrato proteico dos blocos ósseos foi capaz de promover um aumento na taxa de proliferação celular estatisticamente significante (p < 0,05) em relação aos demais grupos.
Em seguida, analisamos a atividade metabólica das células osteoblásticas na presença das diferentes concentrações de extrato proteico dos blocos de osso alógeno. Pode-se observar que a expressão do fator de transcrição RUNX-2 após 72 horas na presença das três diferentes concentrações do extrato proteico proveniente dos blocos de osso alógeno apresenta uma tendência de aumento da expressão do RUNX-2 especialmente nas amostras contendo 100 ng/ml (Figura 2), apesar de não ser
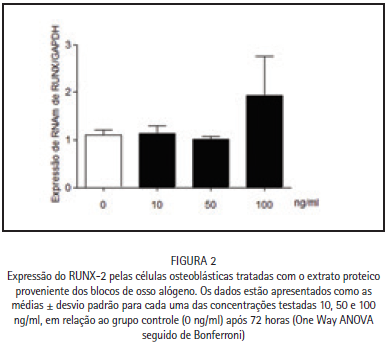
estatisticamente significante (p > 0,05).
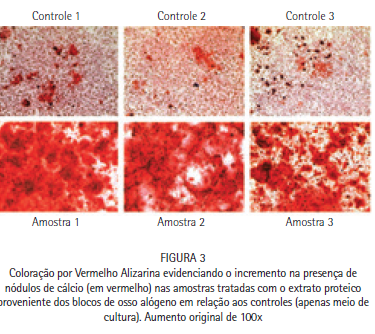
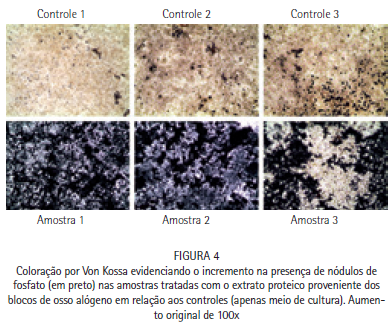
A análise da formação de nódulos mineralizados foi realizada através da comparação da formação dos nódulos de cálcio e fosfato na presença das diferentes concentrações de extrato proteico. O vermelho de Alizarina pigmenta nódulos de cálcio, enquanto o teste de Von Kossa evidencia os nódulos de fosfato com uma coloração negra. É possível observar na Figura 3 um aumento expressivo na formação dos nódulos de cálcio, assim como um aumento expressivo na formação de nódulos de fosfato (Figura 4) quando na presença de 100 ng/ml de extrato proteico proveniente dos blocos de ossos alógenos, indicando que o extrato proteico foi capaz de aumentar a capacidade mineralizante dos osteoblastos.
Os dados obtidos pela pesquisa quantitativa para BMP-2 dos extratos proteicos provenientes dos nove blocos de osso alógeno estudados estão expressos na Tabela 1. Os resultados mostram
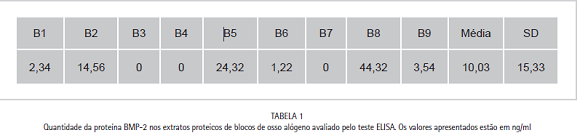
que foi possível identificar e quantificar a proteína óssea morfogenética em seis dos nove blocos testados apresentando uma média de 10,03 ng/ml de BMP-2.
DISCUSSÃO
O conhecimento científico atual acerca do potencial osteoindutor dos blocos de osso alógeno como material de enxertia é escasso e insuficiente. Apesar de cada vez mais utilizado na prática clínica odontológica, conhece-se pouco a respeito das reais características do material, o que compromete a eficiência de sua indicação e uso.
O osso alógeno é reconhecido como um material essencialmente osteocondutor e a literatura é bastante controversa quando se trata da sua atividade osteoindutora. Alguns estudos põem em dúvida a capacidade do material em reter BMPs e liberá-las no sítio receptor ao ponto de caracterizar-se uma atividade osteoindutora. 9-11 Outros autores acreditam que o aloenxerto pode apresentar ambas atividades, osteocondução e osteoindução, já que é possível identificar na matriz óssea do material, substâncias osteoindutoras, além do fato de que o material não ser esterilizado nem liofilizado poder preservar a capacidade de estimular a formação óssea em áreas distantes do enxerto.12,13
Delineamos os experimentos no sentido de investigarmos se o aloenxerto seria capaz de estimular a proliferação quantitativa das células osteoblásticas, bem como se seria capaz de interferir em seu metabolismo no sentido de promover uma maior produção e deposição de tecido mineralizado, o que caracterizaria o potencial osteoindutor do material. Ademais, pesquisamos se, dentre o total de proteínas extraídas dos blocos de osso alógeno, a BMP-2, reconhecidamente a proteína óssea morfogenética que possui a maior atividade osteoindutora, estaria presente, sendo capaz, inclusive, de atuar isoladamente na ausência de outros fatores de crescimento.14,15
Os dados obtidos neste estudo nos mostra que, na maioria dos blocos de osso alógeno mineralizado, por nós pesquisados, a BMP-2 estava presente. Dos nove blocos do aloenxerto testados, apenas em três não foi possível detectar a presença de BMP-2. Este é um forte indício do potencial osteoindutor do material de enxertia estudado. No entanto, cabe a ressalva de que foi possível detectar a BMP-2 nos blocos, porém, não testamos a atividade específica desta proteína. Estes dados corroboram com pesquisa prévia na qual os autores também identificaram a presença de BMP-2 em bloco de osso alógeno, porém fizeram a ressalva de que haviam tão somente identificado e quantificado os fatores de crescimento, e, assim, não poderiam atestar se estes estariam ou não bioativos em sua capacidade de desencadearem os eventos característicos da osteoindução.16 Nossa pesquisa buscou explorar esta lacuna e, em adição a identificação do fator de crescimento, avançou, com a utilização dos demais experimentos aqui expostos, no intuito de apurar se estas proteínas constituintes dos blocos de osso alógeno se mostrariam realmente ativas em sua capacidade de estimular as células ósseas humanas in vitro. Interessante que os extratos proteicos dos blocos de aloenxerto aqui estudados apresentaram-se ativos o suficiente para estimular significativamente uma maior proliferação celular, bem como, o aumento da expressão do RUNX-2 e uma maior produção de íons cálcio e fosfato pelas células osteoblásticas humanas in vitro quando as células osteoblásticas estão em contato com as proteínas provenientes dos blocos de osso alógeno. Estes dados, em conjunto, são outro forte indício que apontam para a existência de um potencial osteoindutor dos blocos de osso alógeno como material de enxerto.
No entanto, cabe uma ressalva importante e muitas vezes negligenciada quando do uso de ossos alógenos provenientes de banco de tecidos. Atualmente, são adotados alguns procedimentos a fim de reduzir a antigenicidade do osso alógeno tal como o processamento e o ultracongelamento destas peças, fazendo com que haja a morte celular diminuindo assim seu potencial imunogênico.17 Contudo, apesar deste processamento, o enxerto destes blocos alógenos funciona como um aporte de proteínas ou fragmentos de proteínas estranhas no paciente receptor. Tem sido proposto que o grau de resposta imunológica do receptor contra o osso alógeno depende da concentração de antígeno (proteínas).18 Em trabalho prévio, pacientes que receberam enxerto alógeno apresentaram resposta imunológica aumentada e produção de anticorpos contra inúmeras proteínas ósseas quando comparado com pacientes que não receberam enxerto alógeno.19 Desta maneira, como demonstramos um potencial osteoindutor de extrato proteico de blocos alógenos, é possível que estas proteínas que estão presentes nos blocos funcionem como potencial antígeno quando transplantado para um receptor, uma vez que não é realizado nenhum tipo de cuidado em relação a tipagem de compatibilidade entre doador e receptor.
Não obstante, esta pesquisa nos impele a duas importantes ressalvas. A primeira, de que este é um estudo in vitro, portanto a extrapolação dos resultados aqui obtidos para realidade clínica obviamente demanda a realização de mais estudos que envolvam outras metodologias e pesquisem outros parâmetros determinantes. A segunda, diretamente relacionada à anterior, é que utilizamos ao longo de todo o trabalho o termo "potencial osteoindutor", em detrimento da ideia de "propriedade osteoindutora", já que esta é um conjunto de processos que só poderá ser atestado definitivamente quando for devidamente demonstrada sua função in vivo.
CONCLUSÃO
O conjunto de dados gerados por esta pesquisa nos permite concluir que os blocos de osso alógeno mineralizado apresentam atividade osteoindutora quando testados seu comportamento in vitro em células osteoblásticas.
APLICAÇÃO CLÍNICA
Este estudo avança no conhecimento das características básicas dos aloenxertos mineralizados, como seus constituintes e potencial osteoindutor, o que ajuda a elucidar suas potenciais características para a utilização como biomaterial em enxertias reconstrutivas dos maxilares.
REFERÊNCIAS
1. Pelegrine AA, Macedo LGS, Cosmo LAM. Osso alógeno fresco congelado em reconstruções ósseas do tipo onlay. 1a ed. São Paulo: Napoleão Editora; 2008. [ Links ]
2. Gondak R, Duvoisin C, Drechsel L, Navarro Jr W. Banco de tecidos musculoesqueléticos: coleta, processamento e distribuição. Implant news 2007;4(6):665-69.
3. Fontanari LA, Manne JM, Junior WT. Utilização de enxerto ósseo homógeno para reconstrução em áreas atróficas pré-implante: banco de ossos. Implant news 2008;5(6):593-95.
4. Takata M, Sugimoto N, Yamamoto N, Shirai T, Hayashi K, Nishida H, et al. Activity of bone morphogenetic protein-7 after treatment at various temperatures: freezing vs. pasteurization vs. allograft. Cryobiology 2011;63(3):235-39.
5. Graham SM, Leonidou A, Aslam-Pervez N, Hamza A, Panteliadis P, Heliotis M, et al. Biological therapy of bone defects: the immunology of bone allo-transplantation. Expert Opin Biol Ther 2010;10(6):885-901.
6. Wildemann B, Kadow-Romacker A, Haas NP, Schmidmaier G. Quantification of various growth factors in different demineralized bone matrix preparations. J Biomed Mater Res 2006;437-42.
7. Komori T. Regulation of bone development and extracellular matrix protein genes by RUNX2. Cell Tissue Res 2010;339(1):189-95.
8. Andrade AD, Marinho CF, Barcelos M, Zorzal MB, Conz MB, Vidigal Jr GM. Biologia óssea: uma revisão da literatura. Implant news 2007;4(6):659-662.
9. Guerrero JS, Al-Jandan BA. Allograft for maxilary sinus floor augmentation: a retrospective study of 90 cases. Implant Dent 2012;21(2):136-40.
10. Buser D. 20 anos de regeneração óssea guiada na implantodontia. 2a edição. São Paulo: Quintessence; 2010.
11. Misch CE. Implantes dentais contemporâneos. 3a edição. São Paulo: Elsevier; 2008.
12. Ellis E, Douglas PS. Use of homologous bone in maxillofacial surgery. J. Maxillofac. Surg 1993;51:1181-93.
13. Pelegrine AA, Costa CES, Sendyk WR, Gromatky A. The comparative analysis of homologous fresh frozen bone and autogenous bone graft, associated or not with autogenous bone marrow, in rabbit calvaria: a clincal and histomorphometric study. Cell Tissue Bank 2011;12:171-84.
14. Bostrom M, Lane JH, Tomin E, Brwne M, Berberian W, Turek T, et al. Use of morphogenetic protein-2 in the rabbit ulnar nonunion model. Clin. Orthop 1996;327:272-82. 15. Wozney JM, Rosen V. Bone morphogenetic protein and bone morphogenetic protein gene family in bone formation and repair. Clin. Orthop 1998;346:26-37.
16. Wildemann B, Kadow-Romacker A, Pruss A, Haas NP, Schmidmaier G. Quantification of growth factors in allogenic bone grafts extracted with three different methods. Cell Tissue Bank. 2007;8:107-14.
17. Giannoudis PV, Dinopoulos H, Tsiridis E. Bone substitutes: an update. Injury 2005;36(Suppl 3):S20-7
18. Burchardt H. The biology of bone graft repair. Clin Orthop Relat Res 1983;(174):28-42 19. VandeVord PJ, Nasser S, Wooley PH. Immunological responses to bone soluble proteins in recipients of bone allografts. J Orthop Res 2005;23(5):1059-64.
 Endereço para correspondência:
Endereço para correspondência:
Marcelo Henrique Napimoga
Faculdade São Leopoldo Mandic
Rua José Rocha Junqueira, 13
Ponte Preta – Campinas - SP
13045-755 Brasil
e-mail: marcelo.napimoga@gmail.com
Recebido: mar/2014
Aceito: mar/2014













