Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.68 no.3 Sao Paulo Jul./Set. 2014
Artigo original
Eficiência da desinfecção dos cones de guta-percha na endodontia
Disinfection efficiency of gutta-percha cones in endodontics
Jefferson José de Carvalho MarionI;Thais Mageste DuqueII; Felipe da SilvaIII; Marlon Maragno BuenoIV
I Cirurgião-Dentista graduado pela PUC-PR, Doutor em Clínica Odontológica - Concentração Endodontia - pela FOP/Unicamp, Mestre em Clínica Odontológica - Concentração Endodontia – pela Faculdade Unimar, especialista em Endodontia pela PUCPR - Professor adjunto da Faculdade de Odontologia da Universidade Federal do Mato Groso do Sul (UFMS)
IICirurgiã- Dentista graduada pela UFJF,.Mestre e Doutoranda em Clínica Odontológica - Concentração Endodontia - pela FOP/ Unicamp, especialista em Endodontia pela FOP/Unicamp - Profa. Assistente de Odontologia na Área de Endodontia da Faculdade Ingá/Uningá
IIICirurgião-Dentista graduado pela Faculdade Ingá/Uningá
IVCirurgião- Dentista graduado pela Faculdade Ingá/ Uningá
RESUMO
Os objetivos do presente estudo foram: verificar a contaminação dos cones de guta-percha presentes em embalagens lacradas, bem como dos que estavam sendo usados em consultórios pelos cirurgiões dentistas (CD); e avaliar se protocolos de desinfecção com agentes antimicrobianos, são eficientes. Os cones de guta-percha foram coletados em 30 consultórios particulares e os CD forneciam dados referentes ao uso ou não de protocolos de desinfecção. Os cones de guta-percha das embalagens lacradas não passaram por nenhum tipo de desinfecção e foram imediatamente transferidos para tubos contendo BHI caldo. Os protocolos de desinfecção, quando existiam, foram simulados e depois os cones foram transferidos para os tubos de BHI caldo. Todas as amostras foram incubadas a 37ºC e a leitura feita após 48 horas. A presença de contaminação foi verificada através da turvação do meio de cultura. Os resultados mostraram ausência de contaminação em todos os cones das caixas lacradas ou que foram coletados de consultórios. Os autores concluíram que apesar dos cones se apresentarem sem contaminação, o protocolo de desinfecção previamente à obturação, deveria ser adotado por todos.
Palavras-chave: obturação do canal radicular; hipoclorito de sódio; desinfecção
ABSTRACT
The aims of this study were to evaluate the contamination of gutta percha cones in sealed packages, as well as those packages which were being used by dentists (D) in private clinical after opening. Additionally, it was evaluated if disinfection protocols with antimicribial agent are efficient. The gutta-percha points were collected from 30 private offices and data about the use or not of disinfection protocols were provided. The sealed packages of gutta-percha were immediately transferred to tubes containing BHI broth tubes. The gutta-percha from opening packages were transferred to BHI broth tubes or were first passed for disinfection protocols and then transferred for the tubes. All samples were incubated at 37 °C and they were analyzed after 48 hours. The presence of contamination was measured by the turbidity of the culture medium. The results showed no contamination in all gutta-percha cones. The authors concluded that although the cones had no contamination, the disinfection protocol, before root canal obturation, should be adopted.
Keywords: root canal obturation; sodium hypochlorite; disinfection
RELEVÂNCIA CLÍNICA
O sucesso do tratamento endodôntico está relacionado com a ausência de microrganismos no sistema de canais radiculares. Essa completa desinfecção é importante e deve ser observada em todas as etapas da terapia endodôntica, principalmente no momento da obturação.
Embora os cones de guta-percha das embalagens lacradas se apresentem estéreis, estes podem se tornar contaminados após a abertura. Dessa forma, é necessário o uso de substâncias químicas para desinfecção desses cones, que vai favorecer a integridade do tratamento endodôntico e impedir com que ocorra a quebra da cadeia asséptico deste tratamento.
Introdução
Um dos principais objetivos do tratamento endodôntico é a desinfecção do sistema de canais radiculares através da eliminação e/ ou redução de microrganismos. Todo este processo depende de uma cadeia asséptica realizada antes e durante o tratamento endodôntico, favorecendo assim o sucesso da terapia, através do reparo biológico.1
A obturação e o bom selamento do sistema de canais radiculares são fatores importantes para que não haja espaços vazios que possam ser preenchidos posteriormente por microrganismos.
Os cones de guta-percha, juntamente com os cimentos obturadores são considerados essenciais na fase final da terapia endodôntica, auxiliando e favorecendo o fechamento e obturação do sistema de canais radiculares. Sendo assim, é de extrema importância que eles se apresentem livres de qualquer tipo de contaminação no momento de sua inserção no canal radicular.
A guta-percha é um material conhecido há mais de 100 anos na Odontologia. É uma substância vegetal extraída sob a forma de látex de árvores classificadas como Palagenicemgutta, da família sapotácea (Gatah = goma e pertja = árvore). Possui grande capacidade de isolamento, não conduz bem calor e eletricidade, e é impermeável à água. Representa em torno de 19% a 20% da composição dos cones juntamente com 59% a 75% de óxido de zinco e 1,5% a 15% de radiopacificadores.2
Segundo Siqueira et al.1, os cones de guta-percha são os materiais mais bem aceitos pelos tecidos vivos e não interferem no processo de reparo que acontece após a obturação. São substâncias maleáveis e biocompatíveis, se aderindo melhor às paredes dos canais radiculares durante a obturação.
Apesar dos cones de guta-percha serem confeccionados sob condições assépticas, eles podem ser contaminados através do manuseio, aerossóis e forças físicas durante o processo de estocagem. Devido suas características termoplásticas e por ser um material de baixa fusão, a guta-percha não pode ser esterilizada em autoclaves ou por métodos de alta temperatura, porque esses procedimentos causariam deformações em sua estrutura. Dessa forma, outros métodos de desinfecção química rápida devem estar disponíveis nos consultórios.3,4,5
Os cones de guta-percha devem ser armazenados preferencialmente em geladeira, pois quando expostos à luz e ao ar, se tornam frágeis e quebradiços perdendo suas propriedades físico-químicas. É recomendado também que sejam desinfectados com agentes químicos antes da obturação do canal radicular pelo Cirurgião-Dentista.6 No entanto, não há um acordo na literatura sobre qual protocolo seria o ideal.
Essa desinfecção dos cones de guta-percha é realizada preferencialmente, por agentes químicos também utilizados durante a desinfecção dos canais radiculares. O hipoclorito de sódio (NaOCl) em diferentes concentrações, tornou-se a solução química auxiliar mais utilizada na terapia endodôntica.7
Substâncias químicas como hipoclorito de sódio 5,25% (NaOCl) e clorexidina 2% (CHX) são substâncias efetivas para desinfecção dos cones e, 1 minuto de imersão é suficiente para essa desinfecção.4
Dentro deste contexto, o objetivo do presente estudo foi avaliar se diferentes marcas de cones de guta-percha comprados em dentais com embalagens lacradas, apresentam ou não contaminação; e também analisar cones de guta-percha, que já estavam sendo manuseados na prática clínica por Cirurgiões-Dentistas e especialistas em Endodontia. Dessa forma, foi verificada a contaminação quanto ao simples fato de uma embalagem se manter aberta em meio contaminado (consultório) e, se há efetividade das soluções químicas quando utilizadas como agente de desinfecção.
MATERIAIS E MÉTODOS
As marcas de cones de guta-percha avaliadas nesse trabalho foram: Tanari (Tariman Industrial Ltda – Manacapuru¬¬-AM), EndoPoints (Endopoints Industrial da Amazônia Ltda – Manacapuru- AM), Dentsply (Dentsply – Maillefer, Petrópolis, RJ, Brazil), Meta (Cheongju, Coréia) e Precise (Precise Dental Internacional S.A. de C.V.Zapopan-Mexico). Todas as marcas apresentavam-se dentro do prazo de validade.
Para avaliar a esterilidade dos cones de guta-percha, foram utilizados três cones de guta-percha para cada marca analisada. Os grupos avaliados foram:
• Grupo experimental 1 (E1): cones de guta-percha coletados de caixas não lacradas, que foram abertas nos consultórios e estavam em uso;
• Grupo experimental 2 (E2): cones de guta-percha coletados de caixas lacradas de fábrica.
Durante as coletas, o operador esteve com toda paramentação individual necessária (luva, máscara, óculos, gorro, jaleco) para evitar possíveis contaminações externas.
O Cirurgião-Dentista era questionado do uso ou não de protocolos de descontaminação. Nos consultórios que realizavam a desinfecção, a coleta era realizada duas vezes. Dessa forma, três cones eram coletados e avaliados sem desinfecção previa e três cones, da mesma marca, eram coletados e avaliados após a realização do protocolo sugerido pelo profissional, simulado exatamente o que ocorria na prática do consultório.
Em relação aos protocolos de desinfecção, anotações referentes à solução química utilizada, concentração da solução e tempo de uso, foram registradas. Essas informações eram posteriormente simuladas no laboratório de Microbiologia da Faculdade Ingá/Uningá. Com isso, foi verificado se o ambiente do consultório poderia influenciar na contaminação dos mesmos.
Para as coletas do Grupo E1, os cones foram removidos da caixa com pinça clínica estéril, e imediatamente transferidos para tubos de ensaio individuais estéreis/vazios. Para cada marca, foram utilizados três tubos de ensaio com 1 cone de guta-percha em cada tubo.
Depois foram transferidos dos tubos estéreis/vazios, para placas de Petri. Quando havia protocolo de descontaminação, este era realizado na placa de petri, de acordo com o protocolo da clínica. Na sequência os cones foram transferidos das placas de Petri para tubos estéreis contendo o meio de cultura BHI caldo (Brain Heart Infusion Broth / Himedia). Quando o Cirurgião-Dentista não realizava protocolo de desinfecção, os cones eram transferidos imediatamente dos tubos estéreis/vazios para tubos estéreis contendo o meio BHI-caldo.
Para as coletas do Grupo E2, os cones foram retirados das embalagens lacradas com pinça clínica estéril, e imediatamente transferidos para os tubos de ensaio estéreis contendo o meio de cultura BHI-caldo. Nesse grupo, os cones não forram transferidos para placas de Petri, pois não era realizado nenhum processo de desinfecção. Para cada marca, foram utilizados três tubos de ensaio, com 1 cone de guta-percha em cada tubo.
Toda metodologia foi realizada em triplicata e, todo procedimento laboratorial realizado próximo a um bico de Bunsen para evitar contaminações externas.
Os cones inseridos nos tubos contendo BHI-caldo foram incubados em estufa bacteriológica a 37ºC (Figura 1a) e mantidos em ambiente de aerobiose. Após 48 horas, foi realizada uma leitura para observar a turbidez do meio de cultura. O método de análise das amostras foi realizado através da turbidez do meio de cultura, que caracteriza o crescimento microbiano, ou seja, uma contaminação. Dessa forma, os cones foram considerados contaminados quando o meio se apresentava turvo e não contaminados na ausência de turbidez.
Além dos grupos experimentais, foi realizado o controle positivo (C1). No qual, os cones de guta percha de todas as marcas avaliadas foram contaminados, propositalmente, com saliva humana e imersos no BHI-caldo para verificar a turbidez do mesmo (Figura 1b); e o controle negativo (C2), no qual os tubos de ensaio apresentavam apenas BHI-caldo para confirmação da esterilidade do meio de cultura (Figura 1c).


RESULTADOS
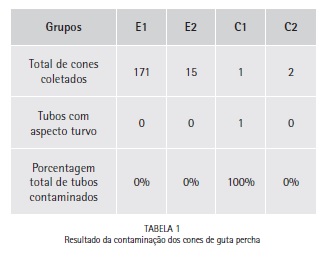
Para todas as amostras experimentais E1 e E2 não foram observados turbidez do caldo, indicando ausência total de contaminação dos cones de guta-percha avaliados após 48 horas (Figura 2). Todas as amostras do grupo controle C1 se apresentaram contaminados e, as do grupo C2 não apresentaram contaminação. Os resultados obtidos para cada grupo são apresentados na Tabela 1.
Dos 30 consultórios avaliados, 27 relataram que realizavam algum protocolo de desinfecção nos cones de guta-percha previamente à obturação. A solução química empregada era exclusivamente o Hipoclorito de Sódio, nas concentrações de 0,5% (5/27), 1% (12/27), 2,5% (9/27) e 5,25% (1/27). Em relação ao tempos de desinfecção, este variava entre 1 a 5 minutos (2/27), 5 a 10 minutos (21/27) e 15 a 20 minutos (4/27). Os cones que passaram por essa simulação de desinfecção, também apresentaram ausência de turbidez e contaminação.
DISCUSSÃO
O tratamento endodôntico dos sistemas de canais radiculares é de extrema importância, pois visa diminuir ao máximo a quantidade de microrganismos, contribuindo para o reparo biológico.

Neste contexto, objetivando elucidar algumas duvidas referentes a desinfecção ou não dos cones de guta-percha e, se esse processo influi no resultado final do tratamento endodôntico, é que passamos a tecer considerações sobre os pontos mais evidenciados em nossa pesquisa.
Dentre os materiais mais empregados nos procedimentos de obturação do sistema de canais radiculares, os cones de guta-percha se destacam por serem termo sensíveis e não permitir um processo de esterilização através de calor seco ou úmido. Assim, diferentes protocolos têm sido descritos na literatura com o objetivo de realizar a desinfecção eficiente dos cones de guta-percha.8,9,10,11
Ao avaliarmos os resultados dos cones das embalagens lacradas, não foi evidenciado crescimento bacteriano em nenhum dos tubos. Este resultado está de acordo com os obtidos por Moraes e Olmedo. 8 Eles observaram, através da mesma metodologia, ausência de crescimento bacteriano em todos os cones avaliados, concluindo não ser necessário o uso de soluções desinfetantes. Santos et al.12, Namazikhah, Sullivan e Trnavsky13, Silva e Santos14 e Kotaka15 corroboram com estes resultados. No entanto, Montgomery16 observou, através da mesma metodologia, crescimento bacteriano em 8% dos cones percha. Assim, ele recomenda a necessidade de desinfecção dos cones antes da obturação dos canais radiculares.
Várias substâncias químicas antissépticas têm sido descritas na literatura10,15,17,18, merecendo destaque as soluções de hipoclorito de sódio (NaOCl) e clorexidina, por serem consideradas potentes agentes antimicrobianos na desinfecção dos cones de guta-percha.11,19,20,21,22
Em nosso estudo, dos 30 consultórios avaliados, 27 informaram que realizavam algum protocolo de desinfecção. A solução química empregada era exclusivamente o Hipoclorito de Sódio, nas concentrações de 0,5% (5/27), 1% (12/27), 2,5% (9/27) e 5,25% (1/27). Em relação ao tempos de desinfecção, este variava entre 1 a 5 minutos (2/27), 5 a 10 minutos (21/27) e 15 a 20 minutos (4/27).
A ação antimicrobiana do NaOCl nas concentrações de 0,5%, 1% e 5%, em cones de guta foram efetivas quando usadas entre 5 e 10 minutos23, assim como em nosso estudo. Com uma proposta semelhante, Gomes et at.11, usaram concentrações de 0,5%, 1%, 2,5% e 5,25%. Em seu estudo, constataram que, em todas as concentrações avaliadas, não houve crescimento bacteriano nos cones de guta-percha e, a concentração mais indicada, por sua praticidade é do NaOCl 5,25% por 45 segundos. Eles concluíram que o tempo de desinfecção é inversamente proporcional ao da concentração da solução.
Em nosso trabalho, os cones desinfectados com NaOCl 5,25% por 1 minuto foi efetivo. Trabalhos mostram que períodos maiores podem deteriorar e danificar as estruturas de superfície do material. 24,25 Além disso, Valois et al.25 mostraram um aumento da elasticidade das pontas de guta-percha após imersão de 1 minuto em solução de NaOCL 5,25%, que pode dificultar o processo de obturação, especialmente em canais curvos.
Assis et al.5 mostrou que a clorexidina 2% pode ser a melhor opção para desinfecção dos cones de guta percha antes da obturação do sistema de canais radiculares, o que corrobora com Sahinkesen et al.26 que afirmou que a clorexidina 2% é o melhor método utilizado para a eliminação de microrganismos.
Souza et al.27 mostrou que vários agentes químicos, dentre eles solução aquosa depolivinilpirrolidona – iodo 10%, solução aquosa de NaOCl 5,25% e formaldeído, são eficientes para esterilização de cones de guta-percha em curtos espaços de tempo.
Em relação aos cones de guta-percha coletados em consultórios e que apresentavam protocolos de desinfecção, independentemente do protocolo, da solução, da concentração e do tempo utilizado, todos apresentaram ausência de contaminação. Esses dados estão de acordo com a literatura11,13,19,23 e, nenhum trabalho contrapõe estes resultados. Dessa forma, quando indicado, o processo de desinfecção é eficaz e, não é contraindicado caso haja opção por realizá-lo.
Os mesmos resultados foram obtidos para os cones coletados em consultório que não apresentavam protocolo de desinfecção, ou seja, houve ausência total de contaminação para todas as amostras testadas. Nossos resultados estão de acordo com os de Moraes e Olmedo8, Santos et al.12 e Kotaka15. No entanto Silva e Santos14 demonstraram proliferação bacteriana em um dos grupos avaliados.
Alguns estudos, cujos resultados evidenciaram contaminação de cones expostos ao ambiente clínico, ressaltam que a manipulação excessiva pode levar a contaminação dos cones que se apresentavam assépticos.26,28,29 Por este motivo é que estes autores indicam a desinfecção dos cones antes da inserção dentro do conduto radicular. Namazikhah, Sullivan e Trnavsky13 afirmaram que se a guta-percha não for intencionalmente contaminada, não há necessidade de desinfecção.
Acreditamos que a razão pela qual obtivemos 100% de ausência de contaminação em todas as amostras coletadas também seja em função da composição dos cones de guta-percha. Os cones são compostos por 59% a 75% de óxido de zinco que é uma substância antimicrobiana.3 Segundo Moraes e Olmedo8, além dos materiais que constituem o cone de guta-percha, sua superfície lisa não favorece o crescimento bacteriano. Também em função da composição é que eles julgam desnecessária a desinfecção prévia dos cones de guta-percha.
CONCLUSÃO
De acordo com o presente estudo, os autores concluíram que: 1. Os cones de guta-percha presentes em embalagens lacradas ou em embalagens que foram anteriormente abertas em consultórios, apresentaram-se livres de contaminações. Esse fato pode estar relacionado com o poder antimicrobiano do óxido de zinco, presente na composição dos cones de guta percha.
2. O hipoclorito de sódio, independentemente da concentração, mostrou-se eficiente no processo de desinfecção dos cones de guta-percha. No entanto, concentração está diretamente relacionada com o tempo utilizado.
3. A realização do protocolo de descontaminação prévia dos cones de guta-percha serve para reforçar a manutenção da cadeia asséptica do tratamento endodôntico. Assim, apesar dos cones se apresentarem sem contaminação, o protocolo de desinfecção previamente à obturação, deveria ser adotado por todos.
APLICAÇÃO CLÍNICA
A ausência de contaminação dos cones de guta-percha é indispensável para que se tenha sucesso do tratamento endodôntico. Esses materiais obturadores são os últimos a serem colocados no interior do sistema de canais radiculares após o preparo químico mecânico. Em todas as fases da terapia endodôntica, há uma importância na manutenção da cadeia asséptica que pode ser quebrada. Na fase de obturação, os cones são muito manipulados pelos clínicos, podendo ser facilmente contaminados. Assim, apesar dos cones se apresentarem sem contaminação, o protocolo de desinfecção previamente à obturação, deveria ser adotado por todos os Cirurgiões-Dentistas.
REFERÊNCIAS
1. Siqueira Jr JF et al. Princípios biológicos do tratamento endodôntico de dentes com polpa viva. Rev. bras. odontol., Rio de Janeiro 2011; 68(2):161-5. [ Links ]
2. Vidotto APM, Kamachi JT, Bueno CES, Ribeiro MC, Bernardi SM. Contaminação bacteriana dos cones de guta-percha utilizados nas clínicas odontológicas da Faculdade de Odontologia da Pontifícia Universidade Católica de Campinas. Rev Ciênc Med. 2006; 15(1):41-6.
3. Motta PG, de Figueiredo CBO, Maltos SMM, et al. Efficacy of chemical sterilization and storage conditions of gutta-percha cones. Int Endod J 2000;34:435–9.
4. Gomes BPFA, Berber VB, Montagner F, et al. Residual effects and surface alterations in disinfected gutta-percha and Resilon cones. J Endod 2007;33:948–51.
5. Prado M, Gusman H, Gomes BP, Simão RA. The importance of final rinse after disinfection of gutta-percha and Resilon cones. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2011;111:e21–4.
6. Holland R et al. Métodos de esterilização dos cones na endodontia. Rev. Gaúcha Odont. 1990 mar./abr.; 38(2):133-7.
7. Hauman CHJ, Love RM. Biocompatibility of dental materials used in contemporary endodontic therapy: a review. Part 1. Intracanal drugs and substances. Int Endod J 2003; 36(2):75-85.
8. Moraes LCT, Olmedo AL. Análise das condições de assepsia dos cones de guta-percha. Rev. Gaúcha de Odont. 1971 abr./jun.; 19(2):116-8.
9. Linke HAB, Chohayeb AA. Effective surface sterilization of gutta-percha points. Oral Surg 1983;55:73-7.
10. Cardoso CL, Redmerski R, Bittencourt NL, Kotaka CR. Effectiveness of different chemical agents in rapid decontamination of gutta-percha cones. Braz J of Microbiol 2000; 31(1):67-71.
11. Gomes BPFA, Ferraz CCR, Carvalho KC, Teixeira FB, Zaia AA, Souza-Filho FJ. Desinfecção química de cones de guta-percha por diferentes concentrações de NaOCl. Rev APCD 2001; 55(1):27-31.
12. Santos RB, Poisl MIP, Mattiello VS, Arruda FZ. Esterilidade dos cones de guta-percha, mito ou realidade? Rev Bras Odontol. 1999; 56(5):201-3.
13. Namazikhah MS, Sullivan DM, Trnavsky G.L. Gutta-Percha: a look at the need for sterilization. J Calif Dent Assoc. 2000; 28(6):427-32.
14. Silva LJG, Santos ACM. Esterilidade de cones de guta percha; Rev. biociênc, Taubaté 2002 jan./jun.; 8(1):71-5.
15. Kotaka CR, Redmerski R, Queiroz AF, Cardoso CL. Desinfecção rápida de cones de guta-percha na prática endodôntica. Rev FOB 1998; 6(2):73-80.
16. Montgomery S. Chemical descontamination of gutta-percha cones with polyvinilpyrrolidone – iodine. Oral Surg., Oral Med., Oral Pathol. 1971; 31(258-66).
17. Souza RE, Souza EA, Sousa-Neto MD, Pietro RCLR. Avaliação in vitro de diferentes agentes de desinfecção de cones de guta-percha. Pesq Odontol Brás 2003; 17(1):75-7.
18. Fagundes FS, Leonardi DP, Baratto Filho F, Haragushiku GA, Tomazinho LF, Tomazinho PH. Eficiência de diferentes soluções na desinfecção de cones de guta percha exposto ao Enterococus faecalis. Rev Sul-Bras Odontol 2005; 2(2):7-11.
19. Gomes CC, Camões ICG, Freitas LF, Pinto SS, Saraiva SM, Sambati S. Avaliação do hipoclorito de sódio e da clorexidina na desinfecção de cones de guta percha. Revista de Odontologia da Universidade Cidade de São Paulo 2010 maio/ago.; 22(2):94-103.
20. Cardoso CL, Kotaka CR, Redmerski R, Guilhermetti M, Queiroz AF, Rapid decontamination of Gutta-Percha cones with Sodium Hypochlorite. JOE 1999 Jul.; 25(7):498-501.
21. Gahyva SM, Siqueira Jr JF. Avaliação da contaminação de cones de guta-percha disponíveis comercialmente. J Bras Endo/Perio 2001; 2(6):193-5.
22. Silva AS, Paiva JG, Antoniazzi JH. Avaliação da contaminação do cone de guta-percha durante seu manuseio de ajuste para obturação de canais radiculares. Rev Paul Odontol 1988; 10(6):46-51.
23. Pupo J, Biral RR, Almeida OP. Atividade antimicrobiana de soluções para irrigação de canais radiculares. RGO, Porto Alegre 1994 jan./fev.; 42(1):17-9.
24. Royal MJ, Willianson AE, Drake DR. Comparison of 5.25% sodium hypochlorite, MTAD and 2% chlorhexidine in the rapid disinfection of prolycaprolactane-based root canal filling materials. J Endod 2007;33:42–4.
25. Valois CRA, Silva LP, Azevedo RB. Effects of 2% chlorhexidine and 5.25% sodium hypochlorite on gutta-percha cones studied by atomic force microscopy. Int Endod J 2005;38:425–9.
26. Sahinkesen G1, Oktay EA, Er Ö, Koçak MM, Kiliç A. Evaluation of residual antimicrobial effects and surface changes of gutta-percha disinfected with different solutions. J Contemp Dent Pract. 2011 Jan 1;12(1):47-51.
27. Souza RE , Souza EA , Sousa-Neto MD, Pietro RCLR. In vitro evaluation of different chemical agents for the de contamination of gutta-percha cones. Pesqui Odontol Bras 2003;17(1):75-7.
28. Isci S, Yoldas O, Dumani A. Effects of Sodium Hypochlorite and Chlorhexidine Solutions on Resilon (Synthetic Polymer Based Root Canal Filling Material) Cones: an Atomic Force Microscopy Study. JOE 2006 Oct.; 32(10):967-9.
29. Bortolini MCT. Desinfecção de cones de guta-percha. Rev Uningá 2007; 11:11-22..
 Endereço para correspondência:
Endereço para correspondência:
Jefferson José de Carvalho Marion
Rua Cora Coralina, 189
Chácara Cachoeira - Campo Grande - MS
79040-510 Brasil
e-mail: jefferson@jmarion.com.br
Recebido: set/2013
Aceito: set/2013













