Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.69 no.2 Sao Paulo Abr./Jun. 2015
Artigo Original
Capacidade remineralizadora de princípios bioativos no esmalte dental submetido a desafio erosivo
Remineralizing ability of different bioactive materials on artificially eroded enamel
Livia Tosi TrevellinI; Angela Mayumi Shimaoka II; Rubens Côrte Real de CarvalhoIII; Alessandra Pereira de AndradeIV
I Mestre e aluno de doutorado - Departamento de Dentística da Faculdade de Odontologia da Universidade de São Paulo (Fousp)
II Pós- Doutora - Departamento de Dentística da Fousp
III Professor Titular do Departamento de Dentística da Fousp
IV Pós- Doutora - Departamento de Dentística da Fousp
RESUMO
Este estudo analisou o potencial remineralizador de compostos com diferentes princípios bioativos no esmalte dental submetido a desafio erosivo. 40 espécimes de dentes bovinos com dimensões padronizadas (4x4mm2) foram submetidos ao desafio erosivo com ácido cítrico (pH=2,3 durante 1 hora) e submetidos a diferentes tratamentos remineralizadores com compostos bioativos, compondo os grupos experimentais: G1-sem tratamento; G2-fosfato de cálcio amorfo e fosfopeptídeo de caseína (RecaldentTM); G3- fosfato de cálcio nanoestruturado (NANO P); G4-flúor 1,23%. Os fragmentos foram analisados quantitativamente pelo método de fluorescência do tecido dental (QLF) em 4 momentos: baseline, desafio erosivo, 1°dia e 7ºdia. Os dados obtidos pelo método QLF foram submetidos à análise estatística por meio dos testes ANOVA 2 fatores para medidas repetidas e de comparações múltiplas de Bonferroni (α=5%). Não foram encontradas diferenças significantes entre os grupos experimentais tanto para o momento de análise baseline quanto para o momento desafio erosivo. No momento de análise 1°dia o grupo sem tratamento apresentou os maiores valores de ΔQ (valor final da perda mineral do substrato), enquanto os menores foram encontrados para os grupos G2 e G3 que não apresentaram diferença estatística entre si. No momento de análise 7°dia os menores valores foram apresentados pelo grupo G2 e os maiores pelo grupo G1. Os tratamentos realizados acarretaram diferentes graus de remineralização no esmalte dental submetido a desafio erosivo. O composto bioativo RecaldentTM mostrou melhor desempenho nos índices de remineralização após sete dias de tratamento.
Descritores: erosão dentária; desmineralização do dente; remineralização dentária
ABSTRACT
The aim of this study was analyze the remineralizing potential of different bioactive compounds on dental enamel submitted to erosive challenge. Forty bovine enamel specimens' teeth with standardized dimensions (4x4mm2) were subjected to erosive challenge with citric acid (pH = 2.3 for one hour) and to different remineralizing treatments with bioactive compounds, composing the experimental groups: G1-without treatment; G2-amorphous calcium phosphate and casein phosphopeptide (RecaldentTM Plus); G3-calcium phosphate nanocluster (NANO P); G4- fluoride 1.23%. The fragments were quantitatively analyzed by the method of dental tissue fluorescence (QFL) in four different moments: baseline, erosive challenge, first day and seventh day. The data obtained through the QLF method were subjected to statistical analysis using two way ANOVA for repeated measurements and Bonferroni multiple comparison (α= 5%). No statistical differences were identified among the experimental groups in regards to the baseline analysis moment and to the erosive challenge moment. In the first day period analysis without treatment showed the highest values of ΔQ (final value of substrate´s mineral loss) while the lowest values were obtained in the G2 and G3 groups, which did not presented statistical difference among them. During the seventh day analysis moment, the lowest value was presented by the G2 group while the highest value was presented by the G1 group. The tests performed led to different degrees of remineralization in dental enamel subjected to erosive challenge. The bioactive compound RecaldentT presented the highest levels of remineralization after the seventh day of treatment.
Descriptors: tooth erosion; tooth demineralization; tooth remineralization
RELEVÂNCIA CLÍNICA
A utilização de compostos bioativos pode auxiliar na remineralização do esmalte afetado pela erosão dental.
INTRODUÇÃO
Erosão dentária é um processo progressivo e destrutivo, caracterizado pela dissolução por ácidos do tecido mineralizado dos dentes, sem o envolvimento bacteriano.1
Os ácidos podem ser de origem intrínseca ou extrínseca. Os fatores intrínsecos são provenientes de patologias crônicas, tais como, doença do refluxo gastroesofageal e transtornos alimentares como a bulimia.1,2 Os ácidos da dieta são os agentes etiológicos mais extensivamente estudados e pode-se dizer que é o fator extrínseco mais importante.2 A composição química dos componentes da dieta, a qualidade e quantidade de saliva e a frequência de ingestão estão relacionados com a severidade da erosão.1
Observa-se que na sociedade moderna, tanto os transtornos quanto os hábitos alimentares propiciam o aparecimento da erosão dental, por isso são essenciais sua prevenção e tratamento.3 O tratamento envolve a remoção da causa e dos fatores contribuintes com o seu desenvolvimento. A prevenção inclui o aumento da resistência do dente aos ácidos e a remineralização dos mesmos por meio do contato com agentes específicos.4
A saliva tem sido descrita na literatura como o fator biológico mais importante na proteção da patogênese da erosão dental.3,5 Seu mecanismo protetor está relacionado com a composição química, fluxo salivar e capacidade tampão.1
A lesão causada pela erosão dental se inicia com o amolecimento do esmalte dental, causado pelos ácidos, levando à perda da integridade estrutural e da resistência mecânica, embora, nesta fase, seja passível de remineralização.6,7
Nas últimas décadas, houve um crescente interesse no desenvolvimento de tecnologias com potenciais para remineralizar as estruturas dentais.8 Agentes bioativos baseados em proteínas do leite, como o complexo CPP-ACP (fosfopeptídio de caseína e fosfato de cálcio amorfo) têm mostrado potencial de reduzir a erosão do esmalte dental. Este agente promove a precipitação de íons cálcio e fosfato, incorporando-os à película adquirida e a placa9,10, atuando como um grande reservatório de íons com potencial remineralizador. Estudos sugerem que o CPP-ACP tem também a capacidade de inibir a desmineralização do esmalte11, sendo considerada uma estratégia preventiva importante.
Outra tecnologia desenvolvida é baseada em nanopartículas de fosfato de cálcio (HAP). Essas nanopartículas têm similaridade com a morfologia dos cristais de hidroxiapatita e com a estrutura cristalina do esmalte dental.12 Essa nova pasta apresenta características químicas e estruturais semelhantes à da hidroxiapatita natural. Nos últimos anos a nano hidroxiapatita tem sido amplamente estuda como material biomimético e, este material, possui a capacidade de atuar como um agente "anticariogênico", além de possuir um potencial remineralizador13, sendo um método importante para prevenir a erosão dental.
Tradicionalmente utilizado para prevenção de cárie, o flúor também tem sido indicado para a prevenção e tratamento da erosão.11 Íons fluoretos no biofilme desempenham um papel protetor importante no processo de desmineralização, por diminuírem o pH crítico para dissolução mineral14-17, assim como alteram a estrutura química da hidroxiapatita, tornando-a menos solúvel.15-17
Se o tratamento preventivo remineralizador não for eficiente, a progressão dessa lesão ocorrerá devido ao contínuo contato dos agentes erosivos com as estruturas dentais que tornam o processo irreversível.7,8 Neste caso, o tratamento necessário será restaurador.
Diversas metodologias têm sido empregadas para o estudo de erosão dental como a microscopia eletrônica de varredura (SEM), microscopia de força atômica (AFM)2, microdureza superficial, perfilometria7 e Quantificação de conteúdo mineral pelo método de fluorescência do substrato dental (QLF™)18. Com exceção do QLF™, estes métodos são destrutivos e invasivos por necessitar de uma planificação da superfície, o que limita a utilização em estudos longitudinais e promovem somente, informações sobre os efeitos superficiais. Já o método de quantificação de fluorescência induzida por luz, é um método capaz de diagnosticar com alta especificidade o grau de desmineralização do esmalte. A técnica mensura a perda de autofluorescência do esmalte na presença de desmineralização.19 Além da sua capacidade de detectar a profundidade de lesão de esmalte, o QLF™ é capaz de realizar análise quantitativa da mesma lesão em diferentes períodos.20,21 Portanto, as características descritas denotam que esse método é indicado para o estudo de erosão.20
Assim, estudos capazes de acompanhar a capacidade remineralizadora de compostos bioativos aplicados sobre esmalte erodido são essenciais para estabelecer um protocolo de tratamento eficiente na prevenção e tratamento das lesões causadas por ácidos. Este estudo tem por objetivo analisar o potencial remineralizador desses agentes com diferentes princípios ativos no esmalte dental bovino submetido a desafio erosivo.
MATERIAIS E MÉTODOS
Para a realização da parte laboratorial deste estudo os parâmetros de um estudo previamente realizado foram utilizados.18
Seleção da amostra
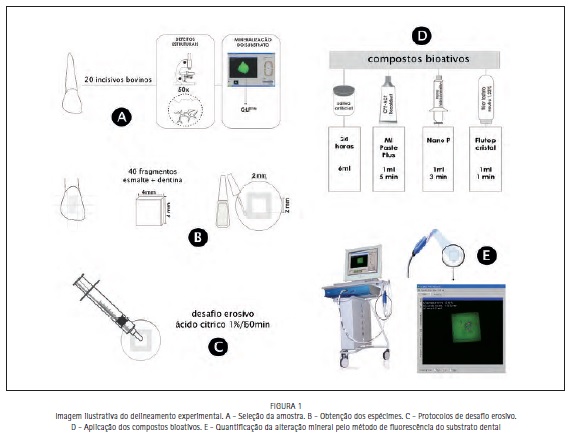
Para a obtenção dos espécimes foram selecionados 20 incisivos bovinos que após profilaxia foram selecionados segundo dois critérios:
Defeitos estruturais – foram observados em um microscópio digital em aumento de 50 vezes (MiView USB Digital Microscope, Chinavasion Wholesale, Guangdong, CN) com o objetivo de verificar a ausência de defeitos, trincas e/ou imperfeições no esmalte (Figura 1A).
Mineralização - todos os elementos dentais foram analisados pelo método de fluorescência do substrato dental (QLF™ System, Inspektor Reserch Systems BV, Amsterdan, NL – Auxílio Pesquisa Regular FAPESP, processo 2006/01177-8); o método será detalhadamente descrito no item referente à quantificação do conteúdo mineral do substrato dental. Esta análise teve por objetivo verificar se algum dos 45 elementos dentais apresentava, em suas faces lisas, alguma área de desmineralização previamente ao início do estudo. (Figura 1A).
Elementos dentais que apresentassem algum tipo de imperfeição ou áreas de desmineralização prévias foram descartados e substituídos. Os dentes permaneceram armazenados em água deionizada em geladeira a 5°C até o início da fase experimental.
Preparação dos espécimes e tratamentos realizados
Foram obtidos dois fragmentos de esmalte de cada coroa dental, em formato quadrangular, com dimensões de 4mm de altura, 4mm de comprimento e 3mm de espessura, proveniente da face vestibular das coroas dentais, totalizando 40 espécimes.
Os fragmentos de esmalte foram incluídos em resina quimicamente ativada e submetidos a uma profilaxia com pedra-pomes e água. A seguir, foram lavados em cuba ultrassônica por um período de 10 minutos (Figura 1B).
A porção central dos 40 fragmentos foi recoberta por fita adesiva de dimensões de 2x2mm e por uma camada de verniz ácido resistente. Após a secagem do verniz por 24 horas, foi retirada a fita adesiva, expondo uma área de esmalte 4mm2 (Figura 1B).
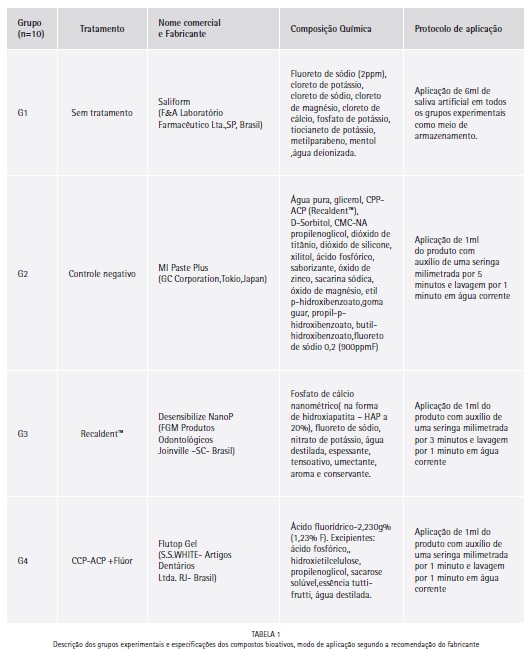
Os espécimes foram distribuídos aleatoriamente em 4 grupos (n=10), divididos conforme quatro tratamentos propostos: G1- Sem tratamento (controle negativo); G2- Recaldent™; G3- NanoP; e G4- Flúor. As composições dos produtos e os protocolos de aplicação de cada grupo estão exibidos na Tabela 1.
O desafio erosivo foi realizado com 1ml de ácido cítrico % (Fórmula & Ação- Laboratório Farmacêutico Ltda.,SP,Brasil, pH=2,3) na área delimitada de cada espécime, durante 60 minutos (protocolo obtido por estudo piloto preliminar). Após este período, os espécimes foram lavados em água corrente e secos com jatos de ar comprimido durante 30 segundos para padronização do grau de desidratação do esmalte desmineralizado (Figura 1C).
Em seguida, foi aplicado 1ml de cada substância proposta como tratamento remineralizador, de acordo com as especificações de cada fabricante (Tabela 1), nos grupos experimentais. Imediatamente após a aplicação do tratamento remineralizador sobre o esmalte erosionado. Os espécimes foram armazenados em 6ml de saliva artificial em estufa a 37°C, em recipientes plásticos individuais (Figura 1D).
A aplicação dos tratamentos remineralizadores ocorreu durante sete dias consecutivos e neste período, os espécimes foram mantidos em saliva conforme descrito acima, sendo cada recipiente lavado com água e o conteúdo de saliva substituído diariamente.
Quantificação de conteúdo mineral pelo método de fluorescência do substrato dental
Os momentos de análise foram realizados no primeiro dia da fase experimental antes do início do tratamento erosivo (baseline), após a exposição ao desafio erosivo, no primeiro e sétimo dia de tratamento remineralizador (Figura 1E).
Os espécimes foram avaliados em relação ao conteúdo mineral do esmalte dental por meio do método de fluorescência do tecido dental com o auxílio do equipamento QLF™ System (Inspektor Reserch Systems BV, Amsterdan, NL – Auxílio Pesquisa Regular FAPESP, processo 2006/01177-8).
O método de quantificação mineral por fluorescência do tecido dental baseia-se em diferenças ópticas entre esmalte sadio e esmalte desmineralizado. Um feixe de luz azul-violeta produzido por uma fonte de radiação lâmpada de xenon, λ=404 nm, 10- 20 mW cm-2) é conduzido à área de avaliação através de uma fibra óptica, produzindo uma fluorescência amarela no tecido dental mineralizado irradiado. Quando iluminado por luz azul, o esmalte hígido aparece fluorescente devido à dentina subjacente; o esmalte desmineralizado, por sua vez, aparece escuro, como resultado do espalhamento da luz. Uma micro-câmera, contendo um filtro laranja (λ≥520nm) responsável por eliminar a luz espalhada no tecido, capta a fluorescência produzida no tecido iluminado, produzindo imagens do substrato dental (Figura 1D).
Para a obtenção das imagens dos fragmentos de esmalte os espécimes foram secos com jato de ar comprimido por 30 segundos para padronização do grau de desidratação do esmalte desmineralizado. O espécime e a ponta da peça de mão do equipamento foram posicionados no suporte para estudos laboratoriais (QLFTM in vitro, Inspektor Dental Care, Amsterdam, NL - Auxílio Pesquisa Regular FAPESP, processo 2006/01177-8). Este suporte possibilita que o espécime analisado e a peça de mão permaneçam dispostos paralelos entre si permitindo que a distância entre eles possa ser ajustada a fim de propiciar uma condição de foco ideal e para que manutenção da distância entre o espécime analisado e a peça de mão seja a mesma em todas as mensurações.
As imagens foram capturadas em câmara escura, armazenadas no disco rígido da unidade principal do equipamento QLFTM. As imagens obtidas serão analisadas, por meio do aplicativo do equipamento (Inspektor™PRO, Inspektor Dental Care, Amsterdam, NL, Auxílio Pesquisa Regular FAPESP, processo 2006/01177-8), quanto à área da lesão (mm2), profundidade da lesão expressa em percentual de perda de fluorescência do tecido (ΔF em %). O volume da lesão (ΔQ em mm2 %) é o índice final relativo ao valor de perda mineral do substrato analisado (Figura 1D).
Os dados obtidos por meio do método de quantificação de conteúdo mineral pelo método de fluorescência do substrato dental (ΔQ mm2 %) foram submetidos à análise estatística por meio do teste Kolmogorov-Smirnov, para avaliação de suposição de normalidade e homocedasticidade (α=0,05).
O teste estatístico ANOVA 2 fatores de variação para mensurações repetidas e o teste de comparações múltiplas de Bonferroni foram utilizados admitindo-se nível de significância estatística de 5%.
RESULTADOS
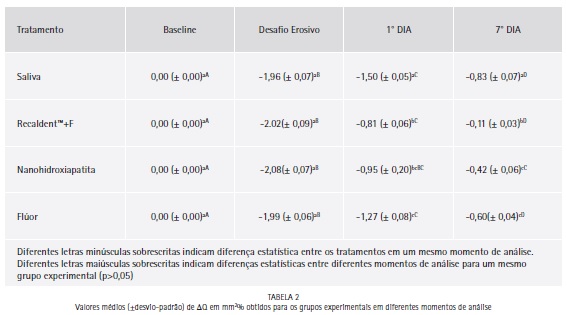
Foi observada diferença estatisticamente significante para os fatores tratamento (p=0,046) e momento de análise (p=0,032), mas a interação não apresentou diferença estatisticamente significante (p=0,093), conforme Tabela 2.
Não foram encontradas diferenças significantes entre os grupos experimentais tanto para o momento de análise baseline quanto para o momento desafio erosivo.
No momento de análise 1°dia o grupo saliva apresentou os maiores valores de ΔQ, enquanto os menores valores foram encontrados para os grupos Recaldent™ e Nano P que não apresentaram diferença estatística entre si. No momento de análise 7°dia os menores valores foram apresentados pelo grupo Recaldent™ e, os maiores valores pelo grupo sem tratamento (saliva).
O grupo Recaldent™ apresentou diferenças estatísticas quando comparado a todos os outros três grupos. O grupo sem tratamento foi significativamente maior que todos os outros grupos. Os grupos NanoP e flúor não apresentaram diferenças estatísticas entre si.
DISCUSSÃO
No presente estudo in vitro, o QLF foi utilizado a fim de verificar a capacidade remineralizadora de diversos compostos bioativos na superfície do esmalte. Este recente método de detecção e quantificação de lesões incipientes é baseado na fluorescência induzida por uma lâmpada de gás xênon azul-violeta, responsável por provocar fluorescência natural do dente.
Essa fluorescência natural é atribuída aos fluoróforos localizados predominantemente na junção amelodentinária e dentina. A presença de lesões no esmalte dental provoca um maior espalhamento da luz incidente e uma menor quantidade de luz excitatória atingem a junção amelodentinária e dentina subjacente e, consequentemente, menor fluorescência da junção amelodentinária e dentina é refletida e capturada pelo equipamento. Sendo assim, a lesão aparecerá escura em contraste com a área intacta circundante fluorescente. As alterações na intensidade da fluorescência indicam alterações minerais no esmalte dental.21
Comparando os dados de perda mineral do substrato (ΔQ em mm2 %) dos grupos estudados, o grupo em que foi aplicado o composto bioativo patenteado pela marca Recaldent™, apresentou os melhores resultados de remineralização das superfícies de esmalte, resultado concordante com estudo preliminar. 18 Seu mecanismo de ação é baseado na capacidade do fosfopeptídeo de caseína (CPP) em estabilizar o fosfato de cálcio amorfo (ACP), em uma solução metaestável.23,24
O fosfopeptídeo de caseína é composto pelo grupamento sequencial –Ser (P)- Ser(P)- Ser(P)- Ser(P)- Glu-Glu. Este grupamento se liga formando nanoaglomerados de ACP em soluções supersaturadas, impedindo o crescimento ao tamanho crítico necessário para transformação da fase nucleação e precipitação na solução.25 O CCP-ACP tem demonstrado uma atividade anticariogênica, tanto em experimentos in vitro quanto in situ26, além de uma potencial capacidade remineralizadora em lesões subsuperficiais de esmalte.11 O composto Recaldent™ produz nanoaglomerados de íons Ca+2, flúor e
fosfato e é capaz de inseri-los como íons biodisponíveis para a formação de fluorapatita.23,25
Esse aumento na concentração de íons cálcio, flúor e fosfato na superfície dental, pode gerar maior difusão desses íons em direção ao esmalte desmineralizado, resultando em remineralização e incorporação de flúor na fase mineral do esmalte dental.12
O grupo G2, demonstrou um aumento de ΔQ, ou seja, houve um processo de remineralização do esmalte que se manteve ao longo do tempo. Esse resultado, obtido de forma não invasiva com QLF, está de acordo com os resultados obtidos em outras pesquisas que avaliaram a capacidade remineralizadora do Recaldent™, por meio de estudos de microscopia de força atômica3, QLF™18, autofluorescência com laser27 e em ensaios clínicos e in vitro28.
Os resultados do presente estudo indicam uma ação positiva dos fluoretos na remineralização de lesões de erosão quando comparado ao grupo controle (saliva). Magalhães et al., (2009), acreditam que a ação efetiva do flúor ocorre devido a formação de uma barreira mecânica por meio da deposição de fluoreto de cálcio na superfície do esmalte. Quando há íons fluoreto em quantidade adequada no meio bucal ocorrerá formação da hidroxiapatita fluoretada, que torna o esmalte mais resistente a desafios erosivos.29
O composto bioativo NanoP também promoveu uma remineralização. Apesar de ser estruturalmente semelhante à hidroxiapatita, esta possui uma menor solubilidade que o composto ACP, o que lhe confere uma menor atividade remineralizadora. Nos estudos realizados por Huang et al.,(2009), utilizaram pastas com diferentes concentrações de partículas de HAP (1%, 5%, 10% e 15%) e demonstraram que a concentração de 10% foi mais efetiva na remineralização do esmalte. Os autores explicam que o papel remineralizador do HAP é devido à capacidade de precipitar e atrair uma grande quantidade de íons cálcio e fosfato da solução para preencher as microporosidades criadas no processo de desmineralização.30
O grupo sem tratamento quando comparada aos demais grupos, promoveu os menores valores de ΔQ.
Após um desafio ácido, a saliva pode desempenhar um papel reparador, fornecendo material orgânico e mineral para preencher defeitos microscópicos criados durante o processo de erosão. A saliva ainda pode atuar como um agente de diluição, por meio da remoção gradual dos agentes erosivos pelo processo de deglutição.17
CONCLUSÃO
Diante da metodologia utilizada e dos resultados obtidos é possível inferir que todos os tratamentos realizados acarretaram diferentes graus de remineralização no esmalte dental submetido a desafio erosivo sendo que o composto bioativo Recaldent™ mostrou os maiores índices de remineralização após sete dias de tratamento.
APLICAÇÃO CLÍNICA
Agregar informações à prática clínica diária que auxiliem o Cirurgião-Dentista na escolha de protocolos de remineralização que possibilitem minimizar os efeitos deletérios da erosão dental.
REFERÊNCIAS
1. Hemingway CA, Parker DM, Addy M, Barbour ME. Erosion of enamel by non-carbonated soft drinks with and without toothbrushing abrasion. Br Dent J. 2006 Oct 7;201(7):447– 50.
2. Poggio C, Lombardini M, Dagna A, Chiesa M, Bianchi S. Protective effect on enamel desmineralization of a CPP-ACP paste: an AFM in vitro study. J Dent. 2009 Dec; 37(12):949-54.
3. Buzalaf MA, Hannas AR, Kato MT. Saliva and dental erosion. J Appl Oral Sci. 2012 Sep-Oct; 20(5):493–502.
4. Krikken JB, Zijp JR, Huysmans MC. Monitoring dental erosion by colour measurement: an in vitro study. J Dent. 2008; 36(9):731–5.
5. Hara AT, Lussi A, Zero DT. Biological factors. Monogr Oral Sci. 2006; 20:88–99.
6. Huysmans MC, Chew HP, Ellwood RP. Clinical studies of dental erosion and erosive wear. Caries Res. 2011; 45 Suppl 1:60–8.
7. Shellis RP, Ganss C, Ren Y, Zero DT, Lussi A. Methodology and models in erosion research: discussion and conclusions. Caries Res 2011;45 Suppl 1:69–77.
8. Walsh LJ. Contemporary technologies for remineralisation therapies: a review. Int Dent South Afr. 2009; 11(6):6–16.
9. Schupbach P, Neeser JR, Golliard M, Rouvet M, Guggenheim B. Incorporation of caseinoglycomacropeptide and caseinophosphopeptide into the salivary pellicle inhibits adherence of mutans streptococci. J Dent Res. 1996 Oct; 75(10):1779–88.
10. Rose RK. Effects of an anticariogenic casein phosphopeptide on calcium diffusion in streptococcal model dental plaques. Arch Oral Biol. 2000 Jul; 45 (7):569–75.
11. Caruana PC, Mulaify SA, Moazzez R, Bartlett D. The effect of casein and calcium containing paste on plaque pH following a subsequent carbohydrate challenged. J Dent. 2009 Jul; 37(7): 522-6.
12. Vandiver J, Dean D, Patel N, Bonfield W, Ortiza C.Nanoscale variation in surface charge of synthetic hydroxyapatite detected by chemically and spatially specific high-resolution force spectroscopy. Biomaterials.2005 Jan;26(3):271-83.
13. Kim MY, Kwon HK, Choi CH, Kim CI.Combined effects of nano-hydroxyapatite and Naf on remineralization of early caries lesion. Key Eng Mater.2007; 330-332: 1347-1350.
14. Casals E, Boukpessi T, McQueen CM, Eversole SL, Faller RV. Anticaries potential of commercial dentifrices as determined by fluoridation and remineralization efficiency. J Contemp Dent Pract. 2007Nov; 8(7):1–10.
15. Cury JA, Tenuta LM, Ribeiro CCC, Paes Leme AF. The importance of fluoride dentifrices to the current dental caries prevalence in Brazil. Braz Dent J. 2004; 15(3):167–74.
16. Fejerskov O, Clarkson BH. Dynamics of caries lesion formation. In: Fejerskov O, Ekstrand J, Burt BA, editors. Fluoride in dentistry. 2nd ed. Copenhagen: Munksgaard; 1996. p. 187–214.
17. Ten Cate JM. Current concepts on the theories of the mechanism of action of fluoride. Acta Odontol Scand. 1999 Dec; 57 (6):325–9.
18. Shimaoka AM. Potencial remineralizador de dentifrícios com compostos bioativos no esmalte dental submetido a desafios erosivos de diferentes severidades [Tese de Doutorado]. São Paulo: Universidade de São Paulo, Faculdade de Odontologia; 2010.
19. Meller C, Heyduck C, Tranameus S, Splieth C. A new in vitro method for measuring caries activity using quantitative light-induced fluorescence. Caries Res. 2006 Jan; 40(2):90-6.
20. Nakata K, Nikaido T, Ikeda M, Foxton RM, Tagami J. Relationship between fluorescence loss of QLF and depth of desmineralization an in enamel erosion model. Dent Mater J.2009 Sep: 28(5):523-9.
21. Gmür R, Giertsen E, van der Veen MH, de Josselin de Jong E, ten Cate JM, Guggenheim B. In vitro quantitative light-induce fluorescence to measure changes in enamel mineralization. Clin Oral Investing. 2006 Sep:10 (3):187-95.
22. Pretty IA, Edgar WM, Higham SM. The effect of ambient light on QLF analyses. J Oral Rehabil. 2002 Apr; 29(4): 369-73.
23. Reynolds EC. Anticariogenic complexes of amorphous calcium phosphate stabilized by casein phosphopeptides: a review. Spec Care Dentist 1998 Jan-Feb;18(1):8-16.
24. Reynolds EC, Black C, Cai F, et al. Advances in enamel remineralization: anticariogenic casein phosphopeptide-amorphous calcium phosphate. J Clin Dent 1999;10:86-88.
25. Walker GD, Cai F, Bailey DL, Yuan Y, Cochrane NJ, Reynolds C, Reynolds EC. Consumption of milk with added casein phosphopeptide-amorphous calcium phosphate remineralizes enamel subsurface lesions in situ. Aust Dent J. 2009 Sep; 54(3):245-9.
26. Shen P, Cai F, Nowicki A, Vincent J, Reynolds EC. Remineralization of enamel subsurface lesions by sugarfree chewing gum containing casein phosphopeptide– amorphous calcium phosphate. J Dent Res. 2001 Dec; 80(12): 2066–70.
27. Reynolds EC. Casein phosphopeptide- amorphous calcium phosphate: the scientific evidence. Adv Dent Res. Aug 2009; 21(1):25-9.
28. Elsayad I, Sakr A, Badr AY. Combining casein phosphopeptide amorphous calcium phosphate with fluoride: synergistic remineralization potential of artificially demineralized enamel or not? J Biomed Opt. 2009 July-Aug; 14(4):044039.
29. Magalhães AC, Wiegand A,Rios D, Honório HM, Buzalaf MA. Insights into preventive measures for dental erosion. J Appl Oral Sci. 2009 Mar- Apr; 17(2):75-86.
30. Huang SB, Gao SS, Yu HY. Effect of nano-hydroxyapatite concentration on remineralization of initial enamel lesion in vitro. Biomed Mater.2009 Jun; 4(3):034104.
 Autor para correspondência:
Autor para correspondência:
Alessandra Pereira de Andrade
Faculdade de Odontologia da Universidade de São Paulo (Fousp)
Avenida Professor Lineu Prestes, 2227 SAOS-Fousp
Cidade Universitária - São Paulo - SP
05508-000
Brasil
e-mail: alealesi@usp.br
Recebido: abr/2015
Aceito: mai/2015













