Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista da Associacao Paulista de Cirurgioes Dentistas
versão impressa ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.70 no.1 Sao Paulo Jan./Mar. 2016
Artigo original
Influência da contaminação cavitária na adaptação marginal das restaurações de resina composta
Influence of cavity contamination on marginal adaptation of composite resin restorations
Sergio Luiz PinheiroI; Isadora Leite SilvaII; Mariane de Lourdes Hernandes Martins PeresIII; Thaís Gondim Camargo NevesIV; Thais Rabello MarisauV; Samira Helena João de SouzaVI; Ana Paula Teixeira BoscarioliVII
I Doutorado - Professor Pesquisador da PUC-Campinas
II Aluna de graduação da Faculdade de Odontologia da PUC-Campinas
III Aluna de graduação da Faculdade de Odontologia da PUCCampinas
IV Aluna de graduação da Faculdade de Odontologia da PUC-Campinas
V Aluna de graduação da Faculdade de Odontologia da PUC-Campinas
VI Doutoranda em Dentística pela Fousp
VII Doutora em Materiais Dentários pela FOP- Unicamp - Professora doutora da Faculdade de Odontologia da PUCCampinas
RESUMO
Objetivo: avaliar a influencia da contaminação cavitária na adaptação marginal das restaurações de resina composta e a associação da lisozima ao sistema adesivo. Materiais e Métodos: Foram selecionados 40 terceiros molares permanentes e confeccionados preparos cavitários classe V com pontas diamantadas cilíndricas 1090 (4 mm de largura, 6 mm de comprimento e 1,5 mm de profundidade). Todos os dentes foram esterilizados e divididos aleatoriamente em 4 grupos (n=10): G1: sistema adesivo (SA) e restauração com resina composta (RC); G2: cavidades contaminadas com 10 μl de Streptococcus mutans (0,5 de Mc Farland), SA e RC; G3: sistema adesivo associado com lisozima (ADL) e RC e G4: cavidades contaminadas com 10 μl de Streptococcus Mutans (0,5 de Mc Farland), ADL e RC. A lisozima foi adicionada ao SA com um microbrush embebido no SA e na lisozima em pó. Os dentes foram impermeabilizados e imersos em azul de metileno por 4 horas a 37ºC. Os dentes foram seccionados e fotografados. Resultados: A avaliação da microinfiltração foi feita por dois avaliadores utilizando o Programa Tpsdig. Para avaliar a calibração entre os examinadores, foi utilizado o teste de Correlação de Pearson. As médias das porcentagens de fendas e bolhas foram submetidas ao teste de Kruskal Wallis com 5% de significância. Conclusão: a contaminação cavitária com Streptococcus mutans acarretou na formação de fendas entre a resina composta e as margens cavitárias. A lisozima associada ao sistema adesivo não influenciou na formação de fendas e bolhas nas restaurações de resina composta.
Descritores: adesivos dentinários; streptococcus mutans; infiltração dentária.
ABSTRACT
Objective: evaluate the influence of cavity contamination on marginal adaptation of composite restorations and the association of lysozyme to the adhesive system. Materials and Methods: Were selected 40 permanent third molars and made cavity preparations class V with cylindrical diamond burs 1090 (4 mm wide, 6 mm long and 2 mm deep). All teeth were sterilized and randomly divided into 4 groups (n = 10): G1: adhesive system (SA) and restoration with composite resin (CR); G2: cavity contaminated with 10 μl of Streptococcus mutans (0.5 McFarland), SA and RC; G3: adhesive system associated with lysozyme (ADL) and RC and G4: cavity contaminated with 10 μl of Streptococcus mutans (0.5 Mc Farland), ADL and RC. Lysozyme was added to the SA with a microbrush embedded in the SA and powdered lysozyme. The teeth were sealed and immersed in a methylene blue for 4 hours at 37 ° C. The teeth were sectioned and photographed. Results: The evaluation of microleakage was made by two reviewers using the Tpsdig Program. To assess the calibration of examiners, we used the Pearson correlation test. The mean percentages of cracks and bubbles were submitted to Kruskal Wallis test at 5% significance level. Conclusion: the cavity Streptococcus mutans contamination resulted in the formation of cracks between the composite resin and the cavity margins. Lysozyme associated with the adhesive system did not influence the formation of cracks and bubbles in the composite restorations.
Descriptors: adhesives; streptococcus mutans; dental leakage.
RELEVÂNCIA CLÍNICA
O número de restaurações com resina composta realizadas em consultório odontológico é muito alto, por isso é importante que ocorra o mínimo de contaminação microbiana durante os procedimentos. A existência de bactérias viáveis na cavidade durante o procedimento adesivo é a principal causa de sensibilidade pósoperatória e lesão de cárie recorrente.
INTRODUÇÃO
O controle da infecção cruzada em consultórios odontológicos inclui cuidados especiais no que diz respeito à intensidade da contaminação microbiana existente no ambiente odontológico. Existe grande risco de transmissão de doenças infectocontagiosas, uma vez que o profissional está em contato direto com a cavidade bucal e materiais contaminantes, como sangue, saliva e outros exsudatos.1 Nos procedimentos odontológicos, os agentes infecciosos podem ser transmitidos de três maneiras: contato direto, indireto e através dos respingos de sangue e saliva emitidos pelo uso de aerossóis da caneta de alta rotação.2
As principais espécies bacterianas associadas ao desenvolvimento da doença cárie são Streptococcus mutans e Lactobacillus sp. Estas espécies estão intimamente ligadas aos índices de cárie de um indivíduo, apresentando associação positiva entre os seus níveis e a alta prevalência de lesões de cárie. O Streptococcus mutans é considerado um microrganismo específico das lesões de cárie dentárias e constitui uma das bactérias com maior poder cariogênico.3
Com o objetivo de redução microbiana após o preparo cavitário, a literatura tem preconizado a incorporação de antimicrobianos nos sistemas adesivos.4 A possibilidade de contaminação microbiana dos sistemas adesivos decorrentes dos procedimentos clínicos deve ser uma preocupação constante na prática clínica. A utilização do protocolo de biossegurança previamente à inserção na cavidade dos agentes de união é de fundamental importância. A capacidade antimicrobiana dos sistemas adesivos está relacionada com a sua composição química e a interação desses agentes de união com as diversas cepas microbianas existentes na cavidade oral.5
Entre os agentes antimicrobianos relacionados com a imunidade presentes na saliva está a lisozima.3,6 Esse agente pode apresentar efeito inibitório e até mesmo bactericida contra os patógenos da cavidade oral, entre eles o Streptococcus mutans. A interação da bactéria com os componentes salivares que formam a película adquirida na superfície do esmalte está associada com a aderência seletiva dos Streptococcus à superfície. Além da lisozima, outros componentes podem interagir com os Streptococcus, como as mucinas, lactoperoxidase, aglutininas, prolinas e imunoglubinas secretórias.3
A lisozima provoca a lise bacteriana através da quebra da ligação entre o ácido n-acetil-murâmico e o n-acetil-glucosamina na parede celular, neutralizando a patogenicidade das bactérias gram positivas e negativas. Além da atividade muramidase que hidrolisa o peptidoglicano, a lisozima apresenta atividade não-muramidase que é atribuída pelo rompimento da função da membrana bacteriana através de peptídeos aminoácidos catiônicos antimicrobianos. No Streptococcus mutans, a lisozima atua causando uma acentuada perda de potássio na célula bacteriana alterando a membrana, tornando o meio intracelular mais acidificado matando a bactéria.3
Com isso, o objetivo desse trabalho foi avaliar a influencia da contaminação cavitária na adaptação marginal das restaurações de resina composta e a associação da lisozima ao sistema adesivo.
MATERIAIS E MÉTODOS
O presente trabalho foi aprovado pelo Comitê de Ética em Pesquisa da PUC-Campinas (Protocolo 1.230.454) (Anexo A). Foram selecionados 40 terceiros molares permanentes da Clínica Odontológica da PUC-Campinas com Termo de Consentimento Livre e Esclarecido assinado pelos respectivos pacientes doadores. Os critérios de inclusão foram: terceiros molares permanentes com ausência de fraturas, trincas, restauração ou lesão de cárie na face vestibular examinadas por lupa (Stemi DV4 – Carl Zeiss, São Paulo, Brasil) com aumento de 10X e dentes doados por pacientes que assinaram o Termo de Consentimento Livre e Esclarecido. Os critérios de exclusão foram: terceiros molares permanentes com trincas ou fraturas, com restauração ou lesão de cárie na face vestibular examinadas por lupa (Stemi DV4 – Carl Zeiss, São Paulo, SP, Brasil) com aumento de 10X e Pacientes que não assinaram o Termo de Consentimento Livre e Esclarecido. Nos dentes selecionados foi realizada a profilaxia através da remoção dos indutos com ultrassom (Kavo, São Paulo, SP, Brasil) e curetas periodontais (Millenium, São Paulo, SP, Brasil), desinfetados com clorexidina 2% (Fórmula e Ação, São Paulo, SP, Brasil) e armazenados em soro fisiológico (Eurofarma, São Paulo, SP, Brasil) até o início da pesquisa. Foram confeccionados preparos cavitários classe V na junção amelo-cementária da face vestibular com a terminação em esmalte e cemento com pontas diamantadas cilíndricas 1090 (KG Sorense Indústria e Comércio Ltda, São Paulo, SP, Brasil) apresentando aproximadamente 4 mm de largura, 6 mm de comprimento e 1,5 mm de profundidade. A mensuração da cavidade foi feita com sonda periodontal milimetrada (Duflex – S.S. White Artigos Dentários Ltda, Rio de Janeiro, RJ, Brasil). Os dentes foram impermeabilizados com resina epóxi (Araldite, São Paulo, SP, Brasil) para vedamento apical e com esmalte de unha (Colorama, São Paulo, SP, Brasil) para todos os corpos de prova exceto a 1 mm das margens cavitárias e esterilizados em autoclave.
Todos os dentes foram divididos aleatoriamente em 4 grupos n=10: G1 Controle, cavidades estéreis, aplicação do sistema adesivo Ambar (FGM, Joinville, SC, Brasil) sem associação de lisozima (Sigma, São Paulo, SP, Brasil) e restauração com resina composta Opallis (FGM, Joinville, SC, Brasil); G2, cavidades contaminadas com 10 μl de Streptococcus mutans (0,5 de Mc Farland) (Fundação André Tosello, Campinas, SP, Brasil), aplicação do sistema adesivo Ambar (FGM, Joinville, SC, Brasil) sem associação de lisozima e restauração de resina composta Opallis (FGM, Joinville, SC, Brasil); G3, cavidades estéreis, aplicação do sistema adesivo Ambar (FGM, Joinville, SC, Brasil) associado com lisozima (Sigma, São Paulo, SP, Brasil) e restauração com resina composta Opallis (FGM, Joinville, SC, Brasil); G4, cavidades contaminadas com 10 μl de Streptococcus mutans (0,5 de Mc Farland) (Fundação André Tosello, Campinas, SP, Brasil), aplicação do sistema adesivo Ambar (FGM, Joinville, SC, Brasil) com associação de lisozima (Sigma, São Paulo, SP, Brasil) e restauração com resina composta Opallis (FGM, Joinville, SC, Brasil). Foi realizado o condicionamento ácido nas cavidades com ácido fosfórico 37% (FGM, Joinville, SC, Brasil) durante 15 segundos. As cavidades foram lavadas com soro fisiológico (Eurofarma, São Paulo, SP, Brasil). A remoção do excesso de umidade das cavidades foi feita com uma gaze estéril (MedGauze, Santo Antônio da Posse, SP, Brasil). O Streptococcus mutans (Fundação André Tosello, Campinas, SP, Brasil) foi colocado em um tubo de ensaio, homogenizado em agitador de tubos (Vixer, Campinas, SP, Brasil) e inserido na cavidade imediatamente após o condicionamento ácido através de uma pipeta 10 μl.
A lisozima (Sigma, São Paulo, SP, Brasil) foi adicionada ao sistema adesivo Ambar (FGM, Joinville, SC, Brasil) da seguinte forma: o microbrush foi embebido no sistema adesivo Ambar (FGM, Joinville, SC, Brasil), em seguida na lisozima (Sigma, São Paulo, SP, Brasil) em pó e aplicado duas vezes a cavidade durante 10 segundos de forma ativa, depois fotopolimerizado por 10 segundos.
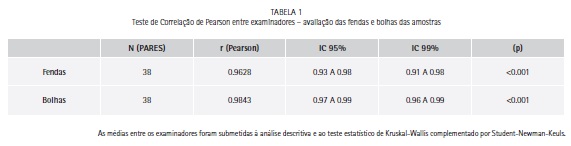
A técnica restauradora com resina composta Opallis (FGM, Joinville, SC, Brasil) nos 4 grupos foi feita da seguinte forma: aplicação do sistema adesivo Ambar (FGM, Joinville, SC, Brasil) com ou sem associação de lisozima (Sigma, São Paulo, SP, Brasil) de acordo com as instruções do fabricante (duas aplicações de forma ativa por 10 segundos e posterior fotopolimerização por 10 segundos). A resina composta Opallis (FGM, Joinville, SC, Brasil) foi inserida pela técnica incremental com incrementos de 2 mm: o primeiro incremento uniu a parede cervical com axial, o segundo a oclusal com axial, o terceiro a mesial com axial, o quarto a distal com axial e o quinto foi colocado para fechar a cavidade, sendo que cada incremento foi fotopolimerizado por 40 segundos de forma escalonada. Imediatamente, foi removido o excesso com o removedor de excesso (Duflex – S.S. White Artigos Dentários Ltda, Rio de Janeiro, RJ, Brasil). As restaurações foram imersas por 1 semana em soro fisiológico em temperatura ambiente (Eurofarma, São Paulo, SP, Brasil) para o posterior polimento final com pasta Diamond R (FGM, Joinville, SC, Brasil) e com os Feltros Diamond Flex (FGM, Joinville, SC, Brasil). A seguir, os dentes foram imersos em azul de metileno 0,05% (Fórmula e Ação, São Paulo, SP, Brasil) por 4 horas a 37ºC para facilitar a visualização das fendas e bolhas. Com o disco de aço diamantado de dupla face (KG, São Paulo, SP, Brasil) os dentes foram seccionados separando a cora da raiz e no sentido vestíbulo-palatino no centro das restaurações de resina composta Opallis (FGM, Joinville, SC, Brasil). Cada dente ficou dividido em duas partes que, por sua vez, foram lixadas com lixa d'água e fotografadas com câmera digital microscópica (Digital Microscope S07 – 500 X) em aumento de 50. A avaliação da adaptação das restaurações de resina composta foi feita por dois avaliadores utilizando o programa Tpsdig (QSC – James Rohlf, 2005) (Figuras 1, 2 e 3). A área do preparo e as áreas de fendas e bolhas foram mensuradas. Os resultados foram submetidos ao teste de Correlação Pearson para determinar se os dois avaliadores estavam calibrados. A porcentagem de fendas e bolhas foi calculada de acordo com a fórmula abaixo:
Área total das restaurações ----------------100%
Somatória das áreas de fendas/bolhas--------- X



As médias entre os examinadores foram submetidas a análise descritiva e ao teste estatístico de Kruskal-Wallis complementado por Student-Newman-Keuls.
RESULTADOS
Houve correlação adequada entre os examinadores nas avaliações das fendas marginais e bolhas das amostras desse estudo (Tabela 1).
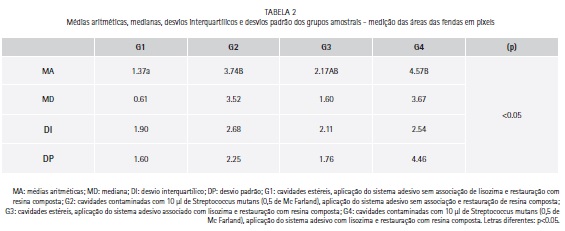
A menor formação de fendas ocorreu no grupo 1 com diferença significante em relação aos grupos 2 e 4 (p<0.05). O grupo 3 não apresentou diferença estatisticamente significante em relação aos outros grupos amostrais (p>0.05). A associação da lisozima não influenciou na formação de fendas marginais entre os grupos amostrais (Tabela 2 e Gráfico 1).
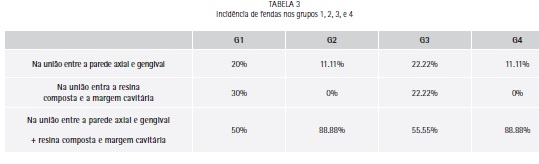
Foi analisada nas fotos a localização das fendas de cada dente. Em todos os grupos, houve maior porcentagem de fendas na união entre a parede axial e gengival e também na união entre a resina composta e a margem cavitária (Tabela 3).
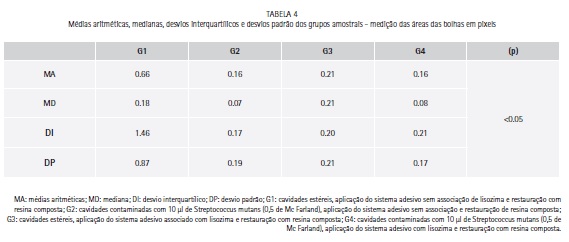
Não houve diferença significante na formação de bolhas entre os grupos amostrais (p>0.05) (Tabela 4 e Gráfico 2).
DISCUSSÃO
A contaminação em qualquer passo do processo da aplicação do sistema adesivo pode impactar negativamente na longevidade da restauração e dificultar o sucesso clínico.7,8 A contaminação pode resultar em infiltração, sensibilidade, irritação pulpar, descoloração dos dentes, lesões de cárie secundárias, eventual perda de restauração e falha clínica.9,10,11 Além da composição dos sistemas adesivos, a técnica operatória de aplicação influencia na possibilidade de contaminação microbiana.5 Os sistemas adesivos de quinta geração normalmente apresentam necessidade de aplicação de duas camadas no preparo cavitário, possibilitando a contaminação desses agentes de união.5 Nesse trabalho foram utilizados adesivos sem utilização prévia, concordando com Almeida et al.12 (2010); Batista et al.2 (2013); Cardoso et al.13 (2010); Oliveira et al.14 (2010) e Werle et al.15 (2012). Em nossa pesquisa, não foi feita a termociclagem assim como foi relatado por Duarte et al.16 (2005); Kumar et al.8 (2012); Rosa et al.17 (2007); Spahr et al.18 (2000) e Veronezi et al.19 (2002) que perceberam que os ciclos térmicos não influenciaram significativamente na microinfiltração.
Foram confeccionadas cavidades classe V padronizadas, utilizando pontas diamantadas cilíndricas 1090, apresentando aproximadamente 4 mm de largura, 6 mm de comprimento e 1,5 mm de profundidade. A mensuração da cavidade foi feita com sonda periodontal milimetrada. Depois foi feita a impermeabilização das amostras com resina epóxi e esmalte de unha exceto a 1 mm das margens cavitárias, seguindo os autores Ferreira et al.11 (2007); Rosa et al.17 (2007) e Spahr et al.18 (2000), ressaltando que Ferreira et al.11 (2007) utilizou amálgama e uma gota de cola super bonder ao invés de resina epóxi, porém com a mesma intenção. O presente trabalho usou o azul de metileno 0,05% como corante na avaliação da infiltração concordando com Rosa et al.17 (2007).
A adesão eficaz entre as paredes cavitárias e materiais restauradores é desejada para produzir restaurações duradouras e com resultados adequados. A variação da composição química dos monômeros, solvente e técnica de aplicação dos sistemas adesivos estão relacionadas com a contaminação microbiana. Os sistemas adesivos de quinta geração normalmente apresentam necessidade de aplicação de duas camadas no preparo cavitário possibilitando a contaminação desses agentes de união. O efeito antibacteriano dos sistemas adesivos ocorre somente no momento da aplicação na cavidade, visto que o pH ácido é neutralizado e os componentes antimicrobianos permanecem no interior da matriz resinosa após a polimerização.5,8,20
Em nosso trabalho, os dentes foram cortados no sentido vestíbulo- lingual no centro das restaurações com disco diamantado dupla face concordando com Duarte et al.16 (2005); Ferreira et al.11 (2007) e Rosa et al.17 (2007), porém Ferreira et al.11 (2007) utilizou máquina de corte para seccionar os corpos-de-prova.
Kumar et al.8 (2012) e Rosa et al.17 (2007) avaliaram a microinfiltração por score, porém nesse trabalho foi feita a medição por área, pois é mais precisa e menos subjetiva. As médias encontradas por dois avaliadores calibrados foram submetidas à análise estatística para a avaliação das fendas dos grupos 1, 2, 3 e 4, através do teste de Kruskal-Wallis assim como Azenha et al.21 (2015); Duarte et al.16 (2005); Dietrich et al.10 (2002); Ferraz et al.22 (2010); Ferreira et al.11 (2007); Pinheiro et al.23 (2014); Rosa et al.17 (2007); Soares, Pinheiro5 (2009); Spahr et al.18 (2000) e Veronezi et al.19 (2002).
O Streptococcus mutans desempenha um papel importante na iniciação e na progressão da lesão de cárie dentária, é altamente acidogênico e capaz de diminuir o pH abaixo do ponto crítico em que a dissolução do esmalte torna-se significativa.3,6,24 Em nosso trabalho, foi utilizado o Streptococcus mutans para a contaminação das cavidades concordando com Kho et al.6 (2004); Senpuku et al.3 (1996) e Wang, Germaine24 (1991).
A lisozima é considerada um componente importante de defesa do hospedeiro não imune contra as bactérias. A lisozima é catiônica, de baixo peso molecular considerada uma proteína que tem a capacidade de lisar certas bactérias agindo na ligação glicosídica entre N-acetilmurâmico e ácido N-acetil-D-glucosamina no polissacárido da parede celular bacteriana. Porém, muitas bactérias orais gram-positivas, incluindo Streptococcus mutans, são resistentes à lise pela lisozima, não sendo a causa principal da morte celular. A lisozima causa uma grande perda de potássio no Streptococcus mutans, essa perda pode resultar em uma queda acentuada no potencial da membrana alterando as funções de transporte, inativação de enzimas celulares, cessação de crescimento e morte celular. Quando a lisozima é utilizada ela vai interferir nas células do Streptococcus mutans diminuindo a captação da glicose, diminuindo a produção de ATP e tornando a célula bacteriana menos energizada. Com essa diminuição de ATP ocorrerá uma diminuição no transporte de potássio do meio extracelular para o intracelular retendo íons H+ no interior da célula, mantendo assim o meio intracelular com o pH mais baixo (ácido) possibilitando a efetividade da lisozima matando o Streptococcus mutans.3,6,24 Em nossos resultados a lisozima não conseguiu agir sobre o Streptococcus mutans de forma eficaz concordando com Kho et al.6 (2005); Senpuku et al.3 (1996) e Wang, Germaine24 (1991).
Em nosso trabalho a técnica utilizada para a confecção de restaurações de resina composta foi a técnica incremental, com inserção na cavidade de pequenos incrementos (no máximo 2 mm) de resina composta para minimizar a contração de polimerização, permitir a passagem de luz e evitar a incorporação de ar evitando a presença de bolhas concordando com Oliveira et al.14 (2010) e Ferreira et al.25 (2012). Nossos resultados comprovaram a eficiência dessa técnica pelo não aparecimento significativo de bolhas.
CONCLUSÃO
Pode-se concluir que a contaminação cavitária com Streptococcus mutans acarreta na formação de fendas entre a resina composta e as margens cavitárias e que a lisozima associada ao sistema adesivo não influenciou na formação de fendas e bolhas nas restaurações de resina composta.
APLICAÇÃO CLÍNICA
A aplicação adequada do sistema adesivo respeitando os protocolos de biossegurança e as instruções do fabricante, assim como o adequado isolamento campo operatório são formas de evitar a contaminação cavitária durante as restaurações de resina composta.
AGRADECIMENTOS
- FGM pela doação dos materiais utilizados em nessa pesquisa;
- Ao Prof. Daniel Guimarães Pedro Rocha, Professor de Endodontia e Clínica Odontológica da Faculdade de Odontologia da PUC-Campinas, pelo fornecimento da câmera de microscopia digital.
REFERÊNCIAS
1. Aleixo RQ, Queiroz RC, Custódio VC, Moura J. A contaminação dos tubos de resina composta utilizados na clínica odontológica. Clínica e Pesquisa em Odontologia-UNITAU. 2010; 2(1): 39-45. [ Links ]
2. Batista ME, Gomes PS, Freitas MRLS, Leite MEA. Avaliação da contaminação microbiológica de tubos de resina composta, seringas de ácido e pincéis de pelo marta utilizados em diferentes restaurações na clínica odontológica. Rev. Odontol. Univ. Cid. São Paulo. 2013; 25(2): 115-25.
3. Senpuku H, Kato H, Todoroki M, Hanada N, Nisizawa T. Interaction of lisozyme with a surface protein antigen of streptococcus mutans. FEMS Microbiol Lett. 1996; 139: 195-201.
4. Imazato S, Ohmori K, Russell RR, McCabe JF, Momoi Y, Maeda N. Determination of bactericidal activity of antibacterial monomer mdpb by viability staining method dental materials. Dent Mater J. 2008; 27(1): 145-48.
5. Soares HH, Pinheiro SL. Avaliação da contaminação microbiana dos procedimentos de dentística no ambiente odontológico. Anais do XIV encontro de iniciação científica da Puc-Campinas, Campinas, 2009.
6. Kho HS, Smith AMV, Koo H, Scott-Anne K, Bowen WH. Interactions of streptococcus mutans glucosyltranferase B with lysozyme in solution and on the surface of hydroxyapatite. Caries Res. 2005; 39(5): 411-6.
7. Ernst CP, Galler P, Willershausen, B, Haller B. Marginal integrity of class V restorations: SEM versus dye penetration. Dent Mater. 2008; 24(3): 319-27.
8. Kumar P, Shenoy A, Joshi S. The effect of various surface contaminants on the microleakage of two different generation bonding agents: A stereomicroscopic study. J Conserv Dent. 2012; 15(3): 265-9.
9. Dietrich T, Kraemer M, Losche GM, Wernecke KD, Roulet JF. Influence of dentin conditioning and contamination on the marginal integrity of sandwich Class II restorations. Oper Dent. 2000; 25(5): 401-10.
10. Dietrich T, Kraemer MLJ, Roulet JF. Blood contamination and dentin bonding – effect of anticoagulant in laboratory studies. Dent Mater. 2002; 18(2): 159-62.
11. Ferreira KB, Cardoso LM, Aranha MFB, Daher MCV, Francischone CE. Efeito de dois selantes de superfície na microinfiltração marginal de restaurações de resina comporta: estudo in vitro. Salusvita. 2007; 26(2): 213-27.
12. Almeida JCF, Prado AKS, Silva WC, Pedrosa SF, Moura MAO, Chaves RM, Lopes LG. Contaminação de Resinas Compostas em Consultórios Odontológicos. Rev. Odontol. Brasil-Central. 2010; 19(50): 211-15.
13. Cardoso CT, Junior JRP, Pereira EA, Barros LM, Freitas ABDA. Contaminação de Tubos de Resina Composta Manipulados sem Barreira de Proteção. Rev. Odontol. Brasil-Central. 2010; 19(48): 71-75.
14. Oliveira M, Barreto RM, Salgado IO, Chaves HDM, Diniz CG. Avaliação da contaminação bacteriana em resinas compostas utilizadas nas clínicas de graduação da FO-UFJF. Odontologia Clínico-Científica (Online). 2010; 9(1): 73-76.
15. Werle SB, Santos RCV, Dotto PP. Contaminação das resinas compostas em clínicas de instituição de ensino. Pesqui bras. odontopediatria clín. integr. 2012; 12(4): 473-76.
16. Duarte SJ, Lovato AL, Freitas CRB, Dinelli W. Sem analysis of internal adaptation of adhesive restorations after contamination with saliva. J Adhes Dent. 2005; 7(1):51-56.
17. Rosa CB, Cavalcanti AN, Fontes CM, Mathias P. Effect of salivary contamination at different steps of the bonding processo on the microleakage around Class V restorations. Braz J Oral Sci. 2007; 6(23): 1445-1449.
18. Spahr A, Schon F, Haller B. Effect of gingival fluid on marginal adaptation of Class II resin-based composite restorations. Am J Dent. 2000; 13(5): 261-6.
19. Veronezi, MC, Ishikiriama A, Bastos MTAA, Franco ED. Influência da ciclagem térmica e do método de avaliação na determinação da microinfiltração em restaurações de resina composta [Tese de Doutorado]. Bauru: Faculdade de Odontologia de Bauru; 2000.
20. Esteves CM, Reis AF, Rodrigues JA. Atividade antibacteriana de sistemas adesivos autocondicionantes antibacterial. Revista Saúde-UnG. 2010; 4(1): 10-17.
21. Pinheiro SL, Azenha GR, Milito F, Democh YM. Antimicrobial Capacity of Casein Phosphopeptide/ Amorphous Calcium Phosphate and Enzymes in Glass Ionomer Cement in Dentin Carious Lesions. ACTA Stomatologica Croatica. 2015; 49(2): 104-111.
22. Ferraz C, Rocha C, Rocha MMNP, Martins MDGA, Jacques P. Contaminação de Resinas Compostas na Prática Odontológica. Pesqui Bras Odontopediatria Clín Integr. 2010; 10(1): 73-8.
23. Pinheiro SL, Pereira DR, Milito F, Villalpando KT. Influence of metalloproteinases on dentin hybridization of one-bottle or self-etch dental bonding systems. J Contemp Dent Pract. 2014; 15(6): 705-11.
24. Wang YB, Germaine GR. Effect of lysozyme on glucose fermentation, cytoplasmic pH, and intracellular potassium concentrations in streptococcus mutans. Infect Immun. 1991; 59(2): 638-44.
25. Ferreira RDO, Caires NCM. Avaliação da contaminação dos tubos de resina composta nas clínicas do Curso de Odontologia de uma universidade particular em Manaus- AM. J Health Sci. 2012; 30(3): 206-10.
 Endereço para correspondência:
Endereço para correspondência:
Sergio Luiz Pinheiro - PUC-Campinas
Av John Boyd Dunlop, s/n°
Jardim Ipaussurama - Campinas – SP
13060-904
e-mail: psergio@usp.br
Recebido: dez/2015
Aceito: jan/2016













