Revista da Associacao Paulista de Cirurgioes Dentistas
ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.70 no.2 Sao Paulo abr./jun. 2016
Artigo original (convidado)
Uma nova estratégia para PDT antimicrobiana em Endodontia
A new approach for antimicrobial Endodontic PDT
Aguinaldo Silva GarcezI; Juliano Alves RoqueII; Wilson H. MurataIII; Michael R. HamblinIV
I Professor doutor do Centro de Pesquisa e pós-graduação em Odontologia São Leopoldo Mandic, Campinas
II Doutorando do Centro de Pesquisa e pós-graduação em Odontologia São Leopoldo Mandic - Professor assistente do Departamento de Ortodontia da SLMandic, Campinas
III Professor mestre da Universidade Cruzeiro do Sul, São Paulo
IV Professor doutor da Harvard-MIT Division of Health Sciences and Technology, Boston, EUA
RESUMO
O presente estudo avaliou diferentes parâmetros como concentração do fotossensibilizador, tempo/energia de irradiação e uso de fibras ópticas, na aPDT para redução bacteriana intracanal. Avaliou-se, in vitro, em cubetas de quartzo contendo concentrações de 50, 100, 150 e 300μM de solução aquosa de Azul de Metileno (AM) a produção de espécies reativas de oxigênio (EROs) em irradiações adicionais de 30s com um laser de diodo emitindo em 660nm. Utilizando-se a mesma metodologia, foi avaliado os efeitos na produção de EROs com e sem o uso de fibra óptica. Concentrações de 50, 150 e 300μM de AM e análise por imagens, avaliaram a formação do fenômeno escudo óptico. Dez incisivos contaminados com P. Aeruginosas bioluminescentes, foram utilizados para analisar as energias/tempo para redução bacteriana intracanal. Imagens obtidas nos dentes avaliaram a contaminação inicial. Os canais foram preenchidos com o fotossensibilizador (PS) e irradiações de 2,4J foram realizadas. A cada irradiação, imagens foram obtidas e a redução bacteriana avaliada. A formação de EROs é maior em concentrações menores do PS, assim como a formação de escudo óptico. O uso de fibra aumenta a formação de ERO quando comparado a irradiação sem fibra. Irradiação com 7J impossibilitou a detecção de biofilme intracanal. A concentração do PS em que há maior eficiência na formação de EROs e menor formação de escudo óptico se encontra entre 50 a 100μM. O uso de fibras ópticas contribui para maior formação de EROs. Energia de irradiação mínima de 7J promove significativa redução bacteriana intracanal.
Descritores: endodontia; microbiologia; lasers; fotoquimioterapia.
ABSTRACT
This study evaluates different approach such as photossensitizer (PS) concentration, irradiation time/energy, and the use of optical fiber for intracanal microbial reduction. In a quartz curvet, aqueous solution of Methylene blue at 50, 100, 150 and 300μM was tested for reactive oxygen species production (ROS) after successive irradiations of 30s with a diode laser (660nm, 100mW). Using the same methodology, the ROS production was tested using an optical fiber. Image analyses evaluated the presence of optical shield in 3 different concentration of PS. Ten central incisors were contaminated with bioluminescent P. aeruginosas to test the ideal energy/ time for endodontic microbial reduction. Initial contamination was recorded by image after biofilm grown. The root canals were fulfilled with Ps and irradiated with successive energies of 2.4J. After every irradiation new images were recorded to compare the microbial reduction. ROS formation was improved using low concentration of PS, such as optical shield formation. The use of optical fiber did enhance the ROS formation when compared to irradiation with the laser tip. Energy of 7J was the minimal energy to achieve lost of bioluminescent signal. For more efficient ROS production and minor optical shield presence, a concentration between 50 and 100μM seams to be ideal. The use of an optical fiber improves ROS production. Energy of 7J promotes significative intracanal decontamination.
Descriptors: endodontics; microbiology; lasers; photochemotherapy.
INTRODUÇÃO
Um dos objetivos fundamentais do tratamento endodôntico, seja ele tratamento convencional, cirúrgico ou retratamento, é a eliminação dos microrganismos presente no sistema de canais radiculares. Para que se obtenha êxito, uma combinação de instrumentação mecânica e irrigação química tem sido utilizada.1 Entretanto, devido a características particulares da infecção microbiana, tanto no interior do sistema de canais, como na região periapical, em certas circunstâncias, o tratamento convencional poderá apresentar falhas, mesmo quando os procedimentos de limpeza e desinfecção forem adequadamente realizados.2
De forma geral, a microbiota encontrada em infecções endodôntica primária é tipicamente formada por anaeróbios, bacilos e Gram negativos.3,4 Nos casos em que há falha no tratamento endodôntico e um retratamento é indicado, a microbiota encontrada, geralmente é composto por algumas poucas espécies microbiana, geralmente Gram positivas e sem predominância entre anaeróbias estritas ou facultativas.5 Características como formação de biofilme, resistência a medicação intracanal, anatomia dos canais radiculares e acesso restrito dos sistemas de instrumentação, fazem com que microrganismos como o Enterococcus faecalis e Candida albicans sejam frequentemente isolados em casos de infecções endodônticas persistentes.6,7 Como uma apropriada desinfecção intracanal aumenta substancialmente o índice de sucesso do tratamento ou retratamento endodôntico, protocolos de desinfecção mais efetivos tem sido proposto na literatura atual.
A Terapia Fotodinâmica antimicrobiana (aPDT – Antimicrobial Photodynamic Therapy) é um método que tem demonstrado tanto in vitro8,9, ex-vivo (dentes extraídos)10,11 e principalmente em estudos clínicos em pacientes12,13, um grande potencial como terapia adjuvante na descontaminação de canais radiculares. Esta terapia é um método que utiliza um agente fotossensibilizador (geralmente um corante não tóxico) e uma fonte de luz de baixa potência (usualmente um laser com potência não superior a 100 mW) e sem potencial térmico (aumento de temperatura inferior a 1o.C), para a geração de espécies reativas de oxigênio (EROs) citotóxico para os microrganismos. O fotossensibilizador (PS) ao ser ativado pelo laser, em uma cascata fotoquímica, via transferência de elétrons (reação tipo I) ou transferência de energia (reação tipo II), reage com o oxigênio, formando íons hidroxila, superóxidos e oxigênio singleto, promovendo assim redução microbiana.5,8,9,11,13
Diversos estudos suportam o uso da aPDT associado ao tratamento endodôntico para a redução microbiana intracanal.5,8-13 Entretanto não há consenso quanto ao parâmetros ideais para sua utilização. O presente estudo se propõe a avaliar diferentes parâmetros como concentração do fotossensibilizador, tempo/energia de irradiação e uso de fibras ópticas, para uso da aPDT na a redução bacteriana intracanal.
MATERIAIS E MÉTODOS
Todos os experimentos foram realizados de acordo com os princípios éticos. Os protocolos de pesquisa foram submetidos e avaliados e receberam aprovação para sua realização de acordo com CEP do IPEN/CNEN-SP.
Eficiência fotoquímica de diferentes concentrações do PS
Para avaliar a concentração ideal do fotossensibilizador quanto à produção de espécies reativas de Oxigênio, concentrações incrementais do corante Azul de Metileno (Sigma Aldrich – Milwaukee EUA) a 50, 100, 150 e 300 micromolares, em solução aquosa, foram testadas em uma cubeta de quartzo em presença dos compostos L-histidina (15μM) e RNO (13,3 μM). Irradiações de 30 a 240 segundos (energia de 1,2 a 9,6J) foram realizadas, com um laser de diodo emitindo em 660nm e com potência de 40mW (MMOptics - São Carlos Brasil) e as amostras foram imediatamente avaliadas em um espectrofotômetro quanto a sua absorbância em 440nm, de acordo com metodologia proposta por Nunez et al.14, de forma breve, ao ser fotoativado, o PS produz espécies reativas de oxigênio, que reagem com a L-histidina e então promove degradação do RNO. Este tem sua coloração alterada por esta reação, podendo assim ser detectado e quantificado, de forma indireta pelo espectrofotômetro, a produção de EROs.
Posteriormente, o mesmo experimento foi realizado com o fotossensibilizador na concentração de 50 μM e a irradiação sendo realizada com e sem o acoplamento de uma fibra óptica ao laser.
Formação de escudo óptico em relação da concentração do PS
Escudo óptico é um fenômeno que ocorre quando a concentração de uma solução é alta o suficiente para que a absorção da luz ocorra na superfície do liquido, impedindo sua penetração. No caso da aPDT, a reação fotoquímica ocorreria na superfície da solução de PS impedindo a descontaminação em profundidade do sistema de canais, diminuindo portanto a eficiência da terapia.
Para avaliar a possível formação de escudo óptico, devido à concentração do PS, foram avaliadas soluções aquosas do Azul de metileno nas concentrações de 50, 150 e 300μM. Em uma cubeta de quartzo foi colocada 5ml de cada uma das solução aquosa do PS e um feixe laser de 10mW, de um ponteira laser (Multilaser AC - Brasil) foi disparado em direção à cubeta. Utilizando uma câmera digital (Pentax K200) acoplada a uma lente macro 100mm, foram obtidas imagens perpendicular ao feixe laser. As imagens foram, gravadas em uma resolução de 32-bits e 265 níveis de cinza e então, avaliadas pelo software Image J (National Institute of Health, EUA)10.
Avaliação da dosimetria e redução microbiana em dentes extraídos
Para avaliar em tempo real os efeitos da aPDT em dentes extraídos, cultura, gentilmente cedidas pela Xenogem Corp. (Alameda, CA EUA), de Pseudomonas aeruginosa (XEN5), modificadas geneticamente para que expressem bioluminescência, foram crescidas em meio de cultura BHI a 37o C por 24 horas.
Foram utilizados 10 incisivos centrais, humanos, com canais retos, recém-extraídos por motivos periodontais. Os dentes tiveram suas coroas removidas com um disco diamantado e seus canais preparados, utilizando o sistema de preparo rotatório Mtwo (Munique Alemanha) até a lima 35.04, associado à irrigação com hipoclorito de sódio a 2,5% e irrigação final com EDTA (Biodinâmica – Ibiporã Brasil). Ao final do preparo, os dentes foram esterilizados em auto-clave e armazenados em tubos plásticos estéreis (Eppendorf).
Para o crescimento do biofilme e contaminação dos canais, foram inoculados 10 microlitros da suspensão da cultura de P. aeruginosa e as amostras foram armazenadas em estufa a 37o C por 72hs, sob agitação (150 rpm). A cada 24hs o líquido no interior dos canais foi sugado e substituído por 10μl de meio de cultura novo, para possibilitar o crescimento de biofilme.
Após 72hs os canais radiculares foram irrigados com 10ml de solução salina estéril, para a remoção de bactérias planctônicas e foram obtidas imagens digitais dos dentes para a quantificação da contaminação inicial, em uma câmera de alta sensibilidade (Hamamatsu Photonics KK), seguindo metodologia proposta por Sabino et al.15, de forma sucinta, este sistema acumula durante 120 segundo o sinal de bioluminescência. O software ARGUS (Hamamatsu Photonics KK) apresenta as imagens como um falso-colorido de acordo com o grau de contaminação, sobreposta à imagem em preto e branco do dente.
Os canais radiculares foram, então, preenchidos com a solução aquosa de AM a 50 μM, esperou-se um tempo de pré-irradiação de 1 minuto para que o PS penetrasse no biofilme e foram irradiados com a fibra óptica acoplada ao laser por 60 segundos. Novas imagens de bioluminescência foram obtidas a cada irradiação (1 minuto – 2,4J), até que não fosse possível obter o sinal da contaminação dos canais.11
Os parâmetros de irradiação foram os seguintes: laser de diodo emitindo em 660m (MMOptics São Carlos, Brasil) e com potência de 40mW. A energia irradiada foi de 2,4J a cada minuto de irradiação.
RESULTADOS
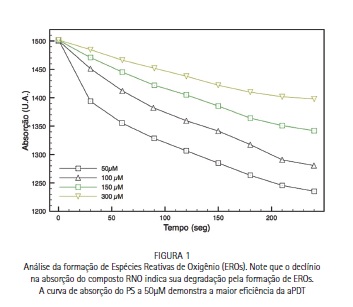
Comparando os dados referentes à formação in vitro de EROs em cada concentração de AM na solução (Figura 1), podemos notar que a cada irradiação de 30 segundos (ou 1,2J) ocorre uma degradação na absorção do composto RNO, resultante da reação fotoquímica para todas as concentrações. Entretanto em concentrações menores como 50 e 100μM a degradação do composto ocorre de forma mais efetiva do que em concentrações maiores.
As imagens da análise da formação do escudo óptico (Figura 2) podem ajudar a entender os resultados da produção de EROs em diferentes concentrações do PS. Note que ao se aumentar a concentração da solução, a penetração da luz ocorre em menor profundidade do que em concentrações menores do PS. Na concentração de 50 μM, ocorreu uma penetração da luz por todo o volume da solução, a 150μM esta penetração ocorre até aproximadamente 75% do volume total e a 300μM a penetração se restringe a 1/3 do volume. Como a reação fotodinâmica só ocorre em presença do PS, da luz e do oxigênio, a reação tende a ocorrer apenas superficialmente (visto que a penetração da luz é restrita em maiores concentrações) e, portanto, sua eficiência diminui.
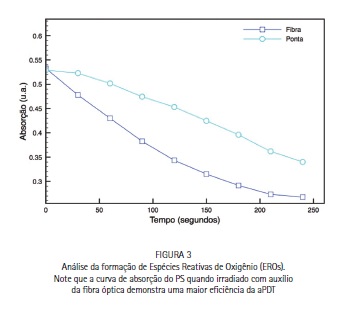
Em relação ao uso da fibra óptica, a Figura 3 mostra que ao se realizar a irradiação com o uso da fibra, a formação de EROs, detectada indiretamente pela degradação do composto RNO, ocorre de forma mais efetiva do que quando se irradia somente com a ponteira do equipamento.
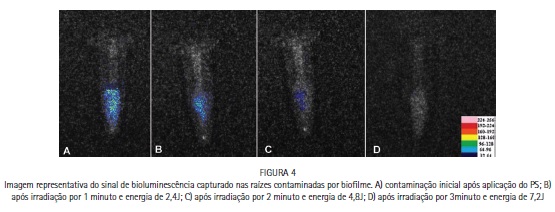
A redução bacteriana intracanal, foi medida em relação à redução do sinal de bioluminescência. A Figura 4 mostra a redução da bioluminescência a cada irradiação adicional de 1 minuto (ou 2,4J) até que não fosse possível captar o sinal. A redução obtida foi de 45% após a primeira irradiação, 77% após a segunda e não foi possível captar sinal de bioluminescência após 3 minutos (7,2J).

DISCUSSÃO
O uso da aPDT como terapia coadjuvante ao tratamento endodôntico convencional tem se mostrado uma alternativa interessante para uma maior redução microbiana intracanal.5,8,9,11,12
Em uma revisão da literatura sobre os efeitos da aPDT em endodontia, Trindade et al.5 relata um excelente potencial anti-microbiano desta terapia. Entretanto estes autores concluem que devido a uma grande variação nos parâmetros utilizados na literatura, é virtualmente impossível chegar a um protocolo de uso clínico. Parece haver certo consenso quanto ao uso de laser de baixa potência como fonte de luz e em relação aos PS, compostos fenotiazínicos como o Azul de metileno tem sido utilizado em diversos trabalhos. Entretanto, parâmetros como concentração do fotossensibilizador, uso de fibras ópticas e tempo de irradiação permanecem como temas controversos.
Neste estudo, quando avaliado a formação de EROs em diferentes concentrações do AM, notamos que concentrações menores como 50 e 100μM, quando irradiadas, promovem uma maior formação de EROs. Estes dados corroboram os resultados encontrados quando avaliamos a formação do fenômeno escudo óptico em diferentes concentrações da solução do PS. A maior formação de EROs em concentrações entre 50 e 100μM possivelmente ocorra devido a não formação do escudo óptico. Na concentração de 150μM, o escudo óptico impede que a luz atinja todo o volume do PS, portanto reduzindo o efeito fotodinâmico, fato agravado pela concentração de 300μM. Diversos autores têm utilizado concentrações não superiores a 100μM, mesmo quando utilizados PS diferente do AM.9,10,12,16 Além do fenômeno escudo óptico e a perda da eficiência da aPDT, Carvalho e colaboradores17 relatam manchamento dentário e comprometimento estético quando utilizado o AM em concentração de 300μM (0,01%).
A redução microbiana em endodontia deve ocorrer não só no canal principal, mas de forma ideal, em todo o sistema de canais, como canais secundários, istmos, canais acessórios, delta apical e ainda no interior de túbulos dentinários, pois o biofilme microbiano não se limita ao canal principal.1-3,6,7 O uso de concentrações maiores do PS (como 300μM) dificultam a penetração da solução pelos túbulos dentinários, conforme já relatado na literatura1, adicionalmente, esta concentrações permitem a formação de escudo óptico, promovendo assim, uma absorção da luz na superfície do líquido, reduzindo como já visto o efeito fotodinâmico e reduzindo ainda a ação antimicrobiana em profundidades na dentina radicular.
O uso de fibra óptica para a irradiação intracanal, conforme já relatado por Garcez et al.10, Fimple et al.9 e Sabino et al.15 promove uma melhor distribuição e acesso da luz no sistema de canais e em áreas como a região apical. Esta melhor distribuição da luz por toda a solução do PS, permite uma maior formação de EROs e consequentemente uma maior redução microbiana. Sabino e colaboradores15, comparando o uso da fibra intracanal, relatam uma redução microbiana aproximadamente 30% superior com o uso da fibra, em nossa analise in vitro a irradiação com a fibra óptica obteve uma produção de ERO proporcionalmente semelhante (30% maior com o uso da fibra).
Energias de irradiação entre 2 e 30J, que resultam em tempos de 30 segundos a 15 minutos de tratamento com o laser, tem sido relatadas na literatura5,18 e como podemos notar este é mais um dos controversos parâmetros encontrado.
O uso de microrganismos bioluminescentes, justifica-se, pois possibilita uma analise em tempo real da redução microbiana obtida pela terapia que esta sendo utilizada19,20; ainda trabalhos prévios de nosso grupo já utilizaram com sucesso esta metodologia. 10,11,21 Neste estudo, mais especificamente, a analise em tempo real, permite identificar os parâmetros mínimos de irradiação para a utilização da aPDT em Endodontia. Os resultados mostram que uma energia mínima de aproximadamente 7J é necessária para a redução total do sinal de bioluminescência (portanto da presença de microbiota viável) em contaminação endodôntica com biofilme crescido em 72h. Conforme já relatado5,18, energia de 2 a 30J tem sido utilizadas com sucesso na descontaminação intracanal. Entretanto, nossos resultados mostram que com energias mais baixas, como 2,4J ocorre uma redução expressiva da contaminação (45%), mas esta redução é significativamente melhorada após irradiações adicionais. Da mesma forma, energias de 30J possivelmente possam resultar em descontaminação efetiva intracanal, mas nosso estudo mostra que energias próximas a 7J já se mostram suficientes, concordando com os resultados de Sabino et al.15, que afirma que após 12J não é possível identificar sinal de bioluminescência em contaminação intracanal com biofilme de C. albicans. Portanto, irradiações adicionais, talvez não signifiquem reduções adicionais, apenas acréscimo de tempo clínico.
Baseados nos achados deste trabalho e apoiado nos trabalhos da literatura8,10,12,13,15, recomendamos o seguinte protocolo para uso clínico da aPDT em Endodontia:
A) O uso de composto fenotiazínicos, como o azul de metileno, em concentrações de 50 a 100μM. Estas concentrações promovem maior produção de espécies reativas do oxigênio, como radicais hidroxila, íons superóxido e oxigênio singleto. Adicionalmente, estas concentrações minimizam ou mesmo impedem a formação do fenômeno físico conhecido como escudo óptico, possibilitando, desta forma uma maior eficiência do efeito antimicrobiano da aPDT no sistema de canais.
B) Uso de fibra óptica acoplada ao laser para melhorar a distribuição de luz intracanal e consequentemente a formação de EROs, maximizando a redução microbiana, quando comparado à irradiação sem fibra.
C) Irradiação com energias entre 7 e 12J. O que nos equipamentos atualmente disponíveis no mercado (que apresentam potência entre 40 e 100mW) resultam em irradiações de aproximadamente 2 a 4 minutos.
CONCLUSÃO
A indicação e uso da aPDT na a redução bacteriana intracanal, tem sido comprovado por diversos estudos na literatura, entretanto, não há consenso sobre os parâmetro ideais. Avaliando os dados obtidos neste trabalho, concluímos que:
• A concentração do PS em que há maior eficiência na formação de EROs e menor formação de escudo óptico se encontra entre 50 a 100μM;
• O uso de fibras ópticas contribui para maior formação de EROs;
• Energia de irradiação mínima de 7J promove significativa redução bacteriana intracanal.
APLICAÇÃO CLÍNICA
O uso da Terapia fotodinâmica antimicrobiana em endodontia tem se mostrado um método efetivo na redução microbiana intracanal, tanto em trabalhos in vitro, quanto em trabalhos em pacientes. Entretanto, não há concordância quanto aos seus parâmetros ideais para uso clinico. A padronização de parâmetros de irradiação e de concentração na solução fotossensibilizadora, certamente levará a uma maior utilização e reconhecimento da eficiência desta terapia. A falta de consenso nestes parâmetros dificulta ao clínico na hora da escolha dos protocolos de utilização e na comparação entre diferentes protocolos encontrados na literatura, desestimulando seu uso na rotina diária do consultório.
REFERÊNCIAS
1. Kosarieh E, Khavas SS, Rahimi A, Chiniforush N, Gutknecht N. The comparison of penetration depth of two different photosensitizers in root canals with and without smear layer: An in vitro study. Photodiagnosis Photodyn Ther. Mar 2016;13:10-14. [ Links ]
2. Rosa TP, Signoretti FG, Montagner F, Gomes BP, Jacinto RC. Prevalence of Treponema spp. in endodontic retreatment-resistant periapical lesions. Braz Oral Res. 2015;29.
3. Gautam S, Thapa A, Rajkumar B. Reasons for failure of nonsurgical root canal treatment in Nepali population. Nepal Med Coll J. Jun 2012;14(2):142-145.
4. Siqueira JF, Jr. Aetiology of root canal treatment failure: why well-treated teeth can fail. Int Endod J. Jan 2001;34(1):1-10.
5. Trindade AC, De Figueiredo JA, Steier L, Weber JB. Photodynamic therapy in endodontics: a literature review. Photomed Laser Surg. Mar 2015;33(3):175-182.
6. Gomes BP, Pinheiro ET, Gade-Neto CR, et al. Microbiological examination of infected dental root canals. Oral Microbiol Immunol. Apr 2004;19(2):71-76.
7. Stuart CH, Schwartz SA, Beeson TJ, Owatz CB. Enterococcus faecalis: its role in root canal treatment failure and current concepts in retreatment. J Endod. Feb 2006;32(2):93-98.
8. Silva Garcez A, Nunez SC, Lage-Marques JL, Jorge AO, Ribeiro MS. Efficiency of NaOCl and laser-assisted photosensitization on the reduction of Enterococcus faecalis in vitro. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. Oct 2006;102(4):e93-98.
9. Fimple JL, Fontana CR, Foschi F, et al. Photodynamic treatment of endodontic polymicrobial infection in vitro. J Endod. Jun 2008;34(6):728-734.
10. Garcez AS, Fregnani ER, Rodriguez HM, et al. The use of optical fiber in endodontic photodynamic therapy. Is it really relevant? Lasers Med Sci. Jan 2013;28(1):79-85.
11. Garcez AS, Ribeiro MS, Tegos GP, Nunez SC, Jorge AO, Hamblin MR. Antimicrobial photodynamic therapy combined with conventional endodontic treatment to eliminate root canal biofilm infection. Lasers Surg Med. Jan 2007;39(1):59-66.
12. Garcez AS, Nunez SC, Hamblim MR, Suzuki H, Ribeiro MS. Photodynamic therapy associated with conventional endodontic treatment in patients with antibiotic-resistant microflora: a preliminary report. J Endod. Sep 2010;36(9):1463-1466.
13. Garcez AS, Arantes-Neto JG, Sellera DP, Fregnani ER. Effects of antimicrobial photodynamic therapy and surgical endodontic treatment on the bacterial load reduction and periapical lesion healing. Three years follow up. Photodiagnosis Photodyn Ther. Dec 2015;12(4):575- 580.
14. Nunez SC, Garcez AS, Kato IT, et al. Effects of ionic strength on the antimicrobial photodynamic efficiency of methylene blue. Photochem Photobiol Sci. Mar 2014;13(3):595-602.
15. Sabino CP, Garcez AS, Nunez SC, Ribeiro MS, Hamblin MR. Real-time evaluation of two light delivery systems for photodynamic disinfection of Candida albicans biofilm in curved root canals. Lasers Med Sci. Aug 2015;30(6):1657-1665.
16. Bago I, Plecko V, Gabric Panduric D, Schauperl Z, Baraba A, Anic I. Antimicrobial efficacy of a high-power diode laser, photo-activated disinfection, conventional and sonic actvated irrigation during root canal treatment. Int Endod J. Apr 2013;46(4):339-347.
17. Carvalho Edos S, Mello I, Albergaria SJ, Habitante SM, Lage-Marques JL, Raldi DP. Effect of chemical substances in removing methylene blue after photodynamic therapy in root canal treatment. Photomed Laser Surg. Aug 2011;29(8):559-563.
18. Javed F, Romanos GE. Does photodynamic therapy enhance standard antibacterial therapy in dentistry? Photomed Laser Surg. Nov 2013;31(11):512-518.
19. Dai T, Gupta A, Huang YY, et al. Blue light rescues mice from potentially fatal Pseudomonas aeruginosa burn infection: efficacy, safety, and mechanism of action. Antimicrob Agents Chemother. Mar 2013;57(3):1238-1245.
20. Ragas X, Dai T, Tegos GP, Agut M, Nonell S, Hamblin MR. Photodynamic inactivation of Acinetobacter baumannii using phenothiazinium dyes: in vitro and in vivo studies. Lasers Surg Med. Jul 2010;42(5):384-390.
21. Garcez AS, Nunez SC, Lage-Marques JL, Hamblin MR, Ribeiro MS. Photonic real-time monitoring of bacterial reduction in root canals by genetically engineered bacteria after chemomechanical endodontic therapy. Braz Dent J. 2007;18(3):202-207.
 Endereço para correspondência:
Endereço para correspondência:
Wilson H. Murata
Centro de Pesquisa e pós-graduação em Odontologia SLMandic
Rua José Rocha Junqueira, 13
Ponte Preta - Campinas – SP
13045-755
e-mail: wmurata@uol.com.br
Recebido: mar/2016
Aceito: abr/2016