Revista da Associacao Paulista de Cirurgioes Dentistas
ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.70 no.2 Sao Paulo abr./jun. 2016
Revisão de literatura(convidado)
Carcinoma de células escamosas de cabeça e pescoço (HNSCC): desvendando os mistérios do microambiente tumoral
Head and neck squamous cell carcinoma (HNSCC): unmasking the tumor microenvironment
Jorge Augusto Borin ScuttiI; Mariana PinedaII; Enos Emerick JrIII; Eliete Rodrigues de AlmeidaIV
I PhD, Research Scientist MD Anderson Cancer Center, Departament of Immunology, Houston, Texas, EUA
II BSc, Research Assistant MD Anderson Cancer Center, Departament of Immunology, Houston, Texas, EUA
III BDS, Aluno do Curso de Especialização em Implantodontia, Faculdades Metropolitanas Unidas/FMU-Laureate, São Paulo, SP, Brasil
IV PhD, Docente do Programa de Pós-graduação em Odontologia, Universidade Cruzeiro do Sul, São Paulo, SP, Brasil
RESUMO
Este artigo refere-se à uma revisão sobre o carcinoma de células escamosas de cabeça e pescoço (HNSCC), o qual está envolvido em cerca de 90% dos cânceres de cabeça e pescoço, originado do revestimento escamoso da superfície das mucosas do trato aerodigestivo superior, incluindo cavidade oral, faringe, laringe e trato sinonasal. Atualmente, o HNSCC apresenta-se como o sexto tipo de câncer mais comum no mundo, sendo que apenas 50% dos pacientes permanecem vivos por 5 anos, após o diagnóstico. Devido à sua distribuição acelerada e alta prevalência, este tipo de câncer tornou-se, nas últimas décadas, uma das principais ameaças para a saúde pública. Seu desenvolvimento e progressão vem ganhando um destaque especial, considerando-se as novas descobertas relacionadas à instabilidade no cerne da genômica e epigenômica, metabolômica, remodelamento celular e fatores de risco associados, principalmente com o envolvimento de infecções virais e, mais recentemente, aos aspectos imunológicos inerentes ao microambiente tumoral (TME), principalmente o perfil celular (fibroblastos associados ao câncer, linfócitos T reguladores, linfócitos e macrófagos com perfil imunossupressor Th2 e M2, respectivamente e neutrófilos associados ao tumor) e o perfil humoral (quimiocinas, citocinas imunossupressoras tais como TGF-B, IL-13, IL-10, proteínas responsáveis pela quebra da matrix extracelular–metaloproteases e fatores que contribuem para o desenvolvimento e progressão tumoral mediados pela angiogênese, tais como EGF e VEGF). Nos próximos anos, a compreensão da imunobiologia do HNSCC será paralelamente acompanhada de importantes avanços na detecção precoce de pacientes de alto risco, baseada na identificação de biomarcadores, na manipulação do sistema imune e na compreensão da farmacogenômica. Estratégias baseadas na imunoterapia, as quais têm sido utilizadas com sucesso em diversos tipos de câncer, podem contribuir positivamente para a reeducação de alguns componentes do microambiente e reduzir as graves consequências associadas a este tipo de malignidade.
Descritores: carcinoma de células escamosas de cabeça e pescoço (HNSCC); microambiente tumoral; imunoterapia.
ABSTRACT
This article refers to a review about head and neck squamous cell carcinoma (HNSCC), which involves about 90% of all head and neck cancers, originated from the squamous lining of the upper aero digestive tract, including the oral cavity, pharynx, larynx and sinonasal tract. Currently, it is known as the 6th most common cancer in the world and only 50% of patients will remain alive for 5 years post-diagnosis. Due to its accelerated spreading and its high occurrence, this kind of cancer has become, in the last decades, one of the major threats to public health. Its development and progression has been gaining special attention, considering the new findings associated to the core instability of genetic and epigenetic, metabolomics, cellular remodeling and associated risk factors, especially with the involvement of viral infections and, more recently, to the immunological aspects inherent from the tumor microenvironment (TME) particularly cell profiles (fibroblast associated with cancer, regulatory T cells, lymphocytes, and macrophages with immunosuppressive profile Th2 and M2, respectively, and neutrophils associated with tumor) and humoral profile (chemokines, immunosuppressive cytokines such as TGF-B, IL-13, IL-10, proteins responsible for the breakdown of extracellular matrix- metalloproteinase and factors that contribute to the development and tumor progression mediated by angiogenesis, such as EGF and VEGF). In the upcoming years, understanding the immunobiology of head and neck squamous cell carcinoma will be accompanied simultaneously by important advances in the early detection of high-risk patients, based on the identification of biomarkers, on the manipulation of the immune system and on the understanding of the pharmacogenomics. Strategies based on immunotherapy, which have been successfully used in numerous types of cancer, can contribute positively to the rehabilitation of some microenvironment components and reduce the serious consequences associated with this type of malignancy.
Descriptors: head and neck squamous cell carcinoma (HNSCC); tumor microenvironment; immunotherapy.
RELEVÂNCIA CLÍNICA
Abordar o papel do microambiente tumoral no contexto do carcinoma de células escamosas de cabeça e pescoço (HNSCC) e as futuras estratégias terapêuticas que podem ser úteis para a melhora clínica dos pacientes, aumento da sobrevida e possível erradicação da mesma.
INTRODUÇÃO
O câncer de cabeça e pescoço refere-se a um grupo de cânceres biologicamente similares, os quais afetam principalmente os lábios, cavidade oral (boca), cavidade nasal, faringe, laringe e seios paranasais.1 É considerado um dos cânceres mais agressivos e invasivos. Histologicamente, cerca de 90% de todos os casos de câncer de cabeça e pescoço caracterizam-se como carcinomas de células escamosas de cabeça e pescoço (HNSCC).2 Os principais sítios anatômicos acometidos nesse grupo de neoplasias constituem a cavidade oral (mucosa bucal, gengiva, palato duro, lingual e assoalho de língua); a faringe (orofaringe, nasofaringe e hipofaringe); a cavidade nasal e os seios paranasais; a laringe glótica, supraglótica e glândulas. Cerca de 40% das lesões ocorrem na cavidade oral, 15% na faringe, 25% na laringe e os 20% restantes estão distribuídos nos demais sítios.3 Apesar do amplo espectro das abordagens terapêuticas, incluindo a quimioterapia pré ou pós-operatória e/ou radioterapia associada à cirurgia reconstrutiva, pacientes com HNSCC não obtém melhora significativa e a sobrevida após 5 anos de diagnóstico ainda não é satisfatória.4 Os insucessos dessas estratégias baseiam-se principalmente na reincidência loco regional ou devidos as constantes metástases em linfonodos cervicais, marca registrada deste tipo de câncer.5 Historicamente, a alta taxa de reincidência local levou à criação em meados dos anos de 50, dos termos conhecidos como condenação da mucosa ou campo de cancerização. Estes conceitos não só evidenciaram a dificuldade do tratamento, mas também enfatizaram a complexidade com que o HNSCC se desenvolve.6 Fenotipicamente, o HNSCC exibe um perfil agressivo de malignidade caracterizado principalmente pelo extensivo potencial de invasão aos tecidos adjacentes e sítios de metástases para órgãos distantes mesmo em estágios precoces. Aproximadamente 560.000 novos casos de HNSCC e cerca 300.000 mortes são reportadas anualmente em todo o mundo.7,8 É amplamente aceito que a presença de metástases linfáticas tornou-se um fator de prognóstico negativo para pacientes com HNSCC.9 Com o intuito de determinar o estágio da progressão, o desenvolvimento tumoral e as estratégias terapêuticas a serem abordadas no futuro, dados clínicos radiológicos, parâmetros histológicos e marcadores moleculares são de fundamental importância para a caracterização do HNSCC. Como resultado, vários marcadores moleculares mostram-se caracterizados e associados a esta neoplasia.
As alterações iniciais nas células epiteliais nos casos de HNSCC são primariamente resultantes da transformação celular associadas as propriedades químicas do tabaco, álcool e mais recentemente pela associação de vírus oncogênicos, tais como HPV (Papiloma vírus humano) principalmente HPV16, HPV18, pela ação das proteínas E6 e E7 além do HPV 31.10 Dentre as alterações canônicas neste tipo de câncer perfis mutacionais são resultantes da alteração da expressão e funcionalidade do gene TP53. Este padrão molecular está alterado em cerca de 50% das lesões pré-malignas e malignas.11 Este perfil mutagênico está altamente associado com maiores níveis de agressividade e piores prognósticos12, sendo que 95% dos pacientes resistentes à radioterapia desenvolvem este perfil.13 Além disso, a alteração neste gene implica em um desbalanço metabólico tumoral contribuindo com o aumento da glicólise e o metabolismo oxidativo, fatores que auxiliam a lesão celular. 14 Além do gene p53 demais genes tais como NOTCH1, EGFR, CDKN2a, STAT3, ciclina D1, proteína do retinoblastoma, p16, p27, p21WAF1/CIP1 e CYP1A1 mostram-se alterados em pacientes com HNSCC.15 As últimas décadas contribuíram muito para a compreensão da biologia do câncer e principalmente quanto aos mecanismos envolvidos na iniciação, desenvolvimento e progessão tumoral. Para que ocorra a tumorigênese, vários fatores são indispensáveis, podendo-se destacar: 1) potencial replicativo imortal; 2) produção de fatores de crescimento; 3) insensibilidade aos fatores anti-crescimento; 4) habilidade de evadir dos mecanismos intrínsecos da apoptose; 5) angiogênese; 6) invasão e metástase.16
Apesar dos avanços nas ferramentas de biologia molecular e a compreensão da instabilidade genética em pacientes com estágios avançados de HNSCC, recentes estudos revelam que não há uma diferença significativa nos acúmulos de mutação de pacientes com ou sem envolvimento metastático. Estas evidências indicam que há outras modificações em questão do que os eventos de mutação propriamente ditos. Assim, a contribuição em favor das metástases oriundas nesses pacientes é uma constante alteração no comportamento das células tumorais e as interações com diversos componentes do estroma no microambiente.17
Neste cenário, um dos aspectos mais relevantes é de que forma o sistema imunológico, seus produtos e demais células não tumorais podem contribuir de maneira direta com o desenvolvimento e progressão do câncer. Damos o nome de microambiente do câncer ou simplesmente microambiente tumoral, o conjunto de células não-tumorais presentes no próprio tumor que de alguma maneira fornecem aporte para o desenvolvimento e progressão do mesmo. Fazem parte deste contexto os fibroblastos, células do sistema imune e seus produtos além de células que compõem os vasos sanguíneos. Ele também inclui as proteínas produzidas por todas as células presentes no tumor que suportam o crescimento das células tumorais. Nesse artigo iremos abordar o papel do microambiente tumoral no contexto do carcinoma de células escamosas de cabeça e pescoço (HNSCC) e as futuras estratégias terapêuticas que podem ser úteis para a melhora clínica dos pacientes, aumento da sobrevida e possível erradicação da mesma.
REVISÃO DE LITERATURA
Microambiente e mecanismos de imunoedição em pacientes com HNSCC
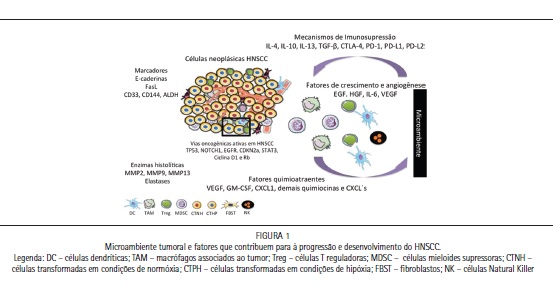
A compreensão do envolvimento do sistema imunológico e do câncer é recente. Lloyd J. Old18, considerado o pai da imunologia tumoral foi o primeiro pesqusiador à levantar questões imunológicas relacionadas ao câncer na década de 50. Na célebre obra intitulada "Effect of Bacillus Calmette Guérin infection on transplanted tumours in the mouse" os autores introduziram um novo conceito ao associar a BCG, um método de imunização contra a tuberculose, como uma via inespecífica de gerar uma reposta contra os tumores – estimulação do sistema imune via componentes bacterianos contra a resistência do crescimento e desenvolvimento tumoral. A partir daí, conceitos sobre imunovigilância e imunogenicidade foram ganhando relevância científica nos anos subsequentes. Infelizmente, muito desses conceitos foram sendo abandonados principalmente com o advento da genômica e uma possível cura baseada na expressão gênica de pacientes com câncer. Atualmente a expansão de conceitos inerentes ao sistema imune e sua correlação com o prognóstico de pacientes com câncer vem crescendo exponencialmente e hoje, tratado como indispensável. Os últimos quinze anos foram muito importantes para a compreensão da importância do sistema imune e sua relação direta com o câncer, principalmente pelos experimentos de meta-análise e experimentos realizados em uma diversidade de modelos experimentais deficientes para células e moléculas chaves da resposta imune, tais como linfócitos T e B, granzimas e perforinas, anticorpos, citocinas tais como IFN-γ e TNF-α, fatores de transcrição tais como STAT-1, NFAT, Ap-1, Eomes, Ki67 dentre outros. Estes dados em conjunto revelaram que o sistema imune é, de fato, indispensável para proteger contra o desenvolvimento de cânceres induzidos por carcinógenos químicos e tumores primários. Estas hipóteses tornaram-se fato quando populações específicas de linfócitos T foram encontradas nos infiltrados celulares nas regiões intratumorais de determinados tumores sólidos. No entanto, esses mesmos resultados levantaram uma questão ímpar: por qual razão organismos com sistemas imunes eficientes e responsivos falham em responder especificamente contra os mais variados tipos de câncer? Surge então o conceito de imunoedição, ou seja, mecanismos liderados pelas próprias células tumorais capazes de subverter a resposta imune levando a exaustão e inatividade. Por essa razão, o câncer não pode ser definido apenas como um conjunto de massa provinciana oriunda de um perfil celular transformado que adquiriu o caráter de malignidade ao longo do tempo mas sim como um complexo celular com perfil transformado capaz de induzir a produção de fatores autócrinos capazes de recrutar e subverter células que auxiliam em seu desenvolvimento e progressão, principalmente células do sistema imune além de um arsenal específico de estratégias capazes de ludibriar e inativar sucessivas tentativas de resposta imune específica. As interações entre células malignas e não transformadas criam o que chamamos de microambiente tumoral (TME). As células não-malignas do TME têm uma função dinâmica e muitas vezes induzem fases subsequentes da carcinogênese.18 Essa comunicação é impulsionada por uma rede complexa e dinâmica de citocinas, quimiocinas, fatores de crescimento, enzimas histolíticas, proteínas pró-inflamatórias e remodeladoras da matrix extracelular as quais são capazes de modular diretamente o desenvolvimento tumoral. Dentre os principais componentes do microambiente podemos citar: Linfócitos T e B, macrófagos associados ao tumor (TAM), células Natural Killer (NK) e Natural Killer T (NKT), células mielóides supressoras (MDSC), células dendríticas, fibroblastos associados ao tumor (CFA), neutrófilos associados ao tumor, células endoteliais vasculares, linfáticas e pericitos, além dos fatores secretados tais como: metaloproteases (MMP2, MMP9, MMP13), radicais de oxigênio (ROS), fator de crescimento endotelial vascular (VEGF), fator de crescimento derivado de plaquetas (PDGF), fator de crescimento fibroblástico, quimiocinas (CXCL8, CXCL1), citocinas (IL-10, IL-13, IL-12, TGF-B, TNF-a, IL-1, GM-CSF, IL-4, IL-6) e enzimas histolíticas (proteases, colagenases, hialuronidades e elastases).19 Poucos trabalhos ainda configuram no papel do microambiente tumoral, porém uma qualidade científica revela que o microambiente está marcantemente envolvido no desenvolvimento e progressão de pacientes com HNSCC, assim como na aquisição de resistência as diversas estratégias de quimioterapia. Diversas evidências ainda apontam para os efeitos imunomoduladores em pacientes com HNSCC principalmente no que se refere à imunoedição do TME. A figura 1 sumariza os eventos do TME em pacientes com HNSCC.
Fibroblastos
Fisiologicamente, o revestimento escamoso da mucosa no trato aerodigestivo é organizado em distintos compartimentos: camada superior de células epiteliais escamosas ou respiratórias diferenciadas, uma camada epitelial basal, a membrana basal subjacente e a camada estromal. Os fibroblastos são abundantes no estroma e são elementos primários na secreção de proteínas estruturais, tais como colágeno e laminina, além de produzirem citocinas e sinais parácrinos. Os fibroblastos associados ao tumor (CAFs) no microambiente do HNSCC são os mais críticos, distribuídos como fibroblastos fenotipicamente alterados e participam ativamente do processo de tumorigênese promovendo crescimento e metástases.8 Mutações no gene TP53 em células de HNSCC favorecem o recrutamento e a migração de CAFs para o microambiente tumoral enquanto a expressão intacta do mesmo gene fornece sinais supressores para esta migração. Os CAFs estão diretamente envolvidos com o desenvolvimento do HNSCC através da expressão de proteínas contráteis as quais são ativadoras de seu fenótipo transformado, apresentando frequentemente um acúmulo de actina do músculo liso alfa (α-SMA), característico da diferenciação miofibrástica (MF).20 No microambiente do HNSCC, os fibroblastos associados ao tumor adquirem o fenótipo MF e estão associados com uma densa deposição de colágeno e desmoplasia estromal. A resposta a esta desmoplasia é considerada um marcador específico da progressão do câncer, uma vez que a secreção e reestruturação das proteínas ECM (proteínas da matriz extracelular) direcionam a invasão celular por vias proteolíticas, além de estimularem a criação de cursos para a degradação independente da proteólise. Fibroblastos são especializados para exercerem estas tarefas e, assim, podem contribuir para a degradação e rearranjo de uma variedade de proteínas da matriz extracelular, incluindo colágeno tipo I e IV, laminina e fibronectina.21 A expressão da integrina α6 é outro marcador na caraterização de CAFs no microambiente do HNSCC, uma molécula crítica na adesão e sinalização celular. Esta integrina é responsável pela ligação dos CAFs na membrana basal, principalmente pela conexão com a laminina, e é capaz de induzir a degradação da mesma mediada pela proteólise. Diversos trabalhos evidenciam que os CAFs fornecem sinais pró tumorigênicos favorecendo um aumento no desenvolvimento e na progressão do HNSCC, através da estimulação da proliferação de células tumorais e por contribuírem com a angiogênese, potencial migratório e invasivo. Além disso, CAFs podem modular a sensibilidade a uma série de drogas e este fato poderia explicar a resistência de células resistentes às diversas estratégias quimioterápicas.22
Infiltrado de células T
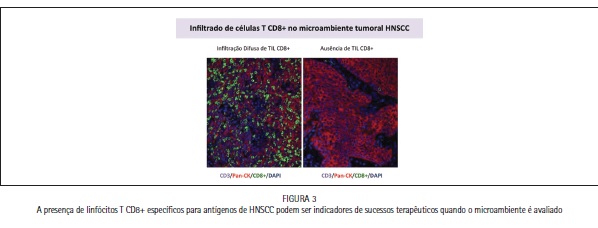
A resposta imune contra tumores sólidos pode ser evidenciada pelos mecanismos de imunovigilância - presença do infiltrado de células T (TIL). No entanto, as neoplasias são caracterizadas por possuírem um microambiente altamente supressivo, o qual impede, em um primeiro momento, não só a função das células T efetoras, como também promove crescimento, migração e invasão de células tumorais. Muitos casos de sucesso hoje alcançados pelas estratégias terapêuticas se devem ao fato da elucidação do microambiente tumoral e uma resposta imunológica pré-existente, capaz de potencializar os efeitos da quimioterapia e radioterapia. Os linfócitos infiltrantes do tumor geralmente representam uma resposta imune específica do hospedeiro dirigido contra antígenos expressos nas células do tumor. Em particular, linfócitos T citotóxicos CD8+ (CTL) são considerados como sendo as principais células efetoras dirigidas contra células tumorais. Esta noção é suportada pela observação de que TIL citotóxicos é um indicador de prognóstico positivo em certos carcinomas, enquanto que células T reguladoras infiltrantes tumorais (Treg) estão associadas com prognóstico desfavorável. Em casos avançados de HNSCC é possível observar que há uma redução significativa dos linfócitos citotóxicos específicos e um aumento dos linfócitos T reguladores com perfil imunossupressor. Strauss et al. (2007) demonstraram através da análise de linfócitos T infiltrantes de pacientes com HNSCC assim como de PBMC no sangue periférico um aumento significativo na expressão de uma população ímpar de linfócitos T reguladores CD4+ CD25+ Foxp3+ secretando IL-10 e TGF- β1.23I Além disso, outros fatores contribuem para com o perfil imunossupressor em pacientes com HNSCC no microambiente tumoral, como por exemplo: ausência ou redução da expressão de moléculas chaves tais como CD3α, redução da proliferação e inativação específica de linfócitos efetores, desbalanço do perfil de citocinas que favorecem a expansão clonal de linfócitos T CD8+, indução da apoptose mediada pela expressão de Fas, redução da expressão de moléculas de MHC de classe I devido o aumento da produção de gangliosídeos, aumento da expressão de checkpoints tais como CTLA-4 e PD1 - além da expressão de seus ligantes tais como PD-L1 e PD-L2. A evasão tumoral pode ocorrer através da expressão elevada de PD-L1.24 Recentes estudos indicam que PD-L1 é expresso em 50% a 60% dos casos de HNSCCs e que a infiltração do tumor por células T reguladoras positivas para a expressão de PD-1 podem ser mais comum para os casos relacionados ao HPV do que aos demais fatores. Jie et al. (2015) observaram um aumento na expressão de CTLA-4 e PD-1 em células Treg intratumorais quando comparadas às amostras de sangue periféricos correspondentes a 27 pacientes com HNSCC. Estes dados apoiam fortemente a ideia da possível inibição futura destes checkpoints via imunoterapia.25 Considerando que HNSCC expressam moléculas inibidoras do sistema imunológico e secretam fatores supressores, torna-se indispensável o desenvolvimento de protocolos multiespectrais, a fim de avaliar o caráter imunológico do microambiente tumoral, a partir de técnicas de imunohistoquímica, imunoflourescência e citometria de fluxo.
Células dendríticas (DC)
Células dendríticas são essenciais para a geração de uma resposta imune específica e de memoria, principalmente por serem capazes em reconhecer antígenos oriundos de HNSCC, processar, apresentar e serem fundamentais na maturação do repertório de células T. Porém, quando estas células são expostas à concentrações de TGF-β e IL-10, fornecidas no TME de pacientes com HNSCC, são capazes de induzir a tolerância imunológica periférica e a diferenciação de linfócitos T CD4+ em células T reguladoras.26 Infelizmente, a heterogeneidade e número de subpopulações de DC envolvidas no HNSCC cria dificuldades na obtenção de dados concisos.
Macrófagos
Macrófagos pertencem à linhagem mieloide da diferenciação do sistema imune, e estes, são caracterizados por participarem ativamente das respostas imunes em relação a endocitose de micro- organismos assim como debris celulares. Também podem ser encontrados como fazendo parte do microambiente tumoral contribuindo principalmente para a progressão tumoral e metástase em nível de linfonodos. Macrófagos associados aos tumores (TAM) estão presentes em uma variedade de tumores e são comumentes encontrados em pacientes com HNSCC e podem ser classificados como macrófagos pró-inflamatórios (M1) e supressores (M2). Sabidamente, M1 contribuem com respostas imunes anti-tumorais, via produção de uma série de citocinas pró-inflamatórias, tais como IL- 12, IL-23 e IFN-y, ao passo que macrófagos M2 podem ser encontrados distribuídos próximos ao endotélio vascular e são caracterizados pela produção de fatores pró angiogênicos e uma série de citocinas anti-inflamatórias tais como IL-10 e TGF-β. Os macrófagos M2 também estão relacionados com o remodelamento tecidual, além de inibirem os efeitos citotóxicos mediados pelos M1.27 Lago Costa et al. (2013) demonstraram um aumento no perfil de macrófagos produzindo TGF-β no TME. Além da produção deste perfil de citocinas, esta população de macrófagos foi capaz de secretar ROS, RNS e prostaglandinas, todas relacionadas em contribuir com a inflamação e tumorigênese.28 TAMs em pacientes com HNSCC também são capazes de produzir MIF (fator inibidor da migração de macrófagos), uma citocina inflamatória que estimula a quimiotaxia de neutrófilos. MIF recruta neutrófilos aos sítios tumorais via CXCR2, em um mecanismo claramente envolvido na migração e invasividade. Além disso, esses neutrófilos podem contribuir para a progressão tumoral principalmente pela indução da angiogênese via MMP9, VEFG e HGF. TAMs ainda contribuem com o crescimento, desenvolvimento, migração e invasão de células de HNSCC por secretarem EGF. Curiosamente, células de HNSCC aumentam o recrutamento, a diferenciação e a proliferação de macrófagos no TME por secretarem CFS-1. Em resposta à secreção de fatores parácrinos, TAMs são capazes de desenvolver podossomos, os quais são capazes de auxiliar as células tumorais no rompimento da membrana basal e acesso ao endotélio vascular ou rede linfática. Estes podossomos são formados na borda das células móveis, contribuindo para a motilidade celular e adesão via ECM. Além disso, estas estruturas podem conter MMP´s, incluindo MMP-2, MMP-9 e MMP-MT1, contribuindo para a degradação proteolítica e a reorganização do ECM. Por fim, TAMs secretam um fator quimiotático conhecido como MIP-3α, capaz de induzir a migração e invasão de células neoplásicas no contexto HNSCC.29
Células supressoras mielóides (MDSC)
Células supressoras mielóides (MDSC) foram descritas em sangue periférico, tecido linfóide e TEM e desempenham papel fundamental na atividade imunossupressora de vários tipos de câncer, incluindo HNSCC. MDSC circulantes associados aos estágios avançados de HNSCC (estágios III e IV) estão sendo frequentemente identificados e, assim, representam uma população chave no microambiente para este tipo de neoplasia. Dunddel et al. (2013) avaliaram MDSC de pacientes com HNSCC a partir do infiltrado tumoral, gânglios linfáticos e sangue periférico. Nos três compartimentos avaliados houve uma redução significativa na atividade de linfócitos T independentemente de antígenos tumorais, demonstrando que esse perfil de células MDSC foi capaz de limitar uma resposta imune direcionada contra células T. Interessantemente, em todos esses compartimentos um aumento significativo na expressão de STAT-3 fosforilado com atividade de arginase I também foi evidenciado. Além disso, a direta supressão de células T mediada pelas MDSC também pode ser caracterizada pela diferenciação e expansão de células T reguladoras CD4+ CD25+ Foxp3+ dependente ou independente de TGF-β.30 MDSCs são capazes de suportar neoangiogênese, o crescimento tumoral e metástases. Estas células produziem VEGF (fator de crescimento endothelial vascular), bFGF (fator de crescimento de fibroblastos e HIF-1 (fator inductor de hypoxia 1) além do TGF-β, e a MMP9, já descritos anteriormente, os quais promovem neoangiogênese e criam um ambiente pré-metastático.31
Células Natural killer (NK) e Natural killer T (NKT)
Células Natural killer (NK) são um elemento chave do sistema imunológico inato nas respostas contra células neoplásicas, principalmente por apresentarem sua capacidade citotóxica à células que reduzem à expressão de moléculas tais como MHC de classe I, um evento conhecido como missing self. Afim de avaliar os níveis de células NK em sangue periférico Accomando et al. (2013) avaliaram 122 pacientes com HNSCC e observaram uma drástica redução dos níveis de células NK.32 Pouco se sabe sobre a biologia e a participação de células NK no microambiente tumoral, assim como no sangue periférico. Células NKT também parecem desempenhar um importante papel nas repostas imunológicas em pacientes com HNSCC, principalmente mediante as respostas via glicosídeos e CD1d. Apesar de sua biologia ser pouco compreendida, ao que tudo indica, baixos níveis de NKT predizem um pior prognóstico aos pacientes com HNSCC.33
INVASÃO MEDIADA PELAS CÉLULAS DE HNSCC
O primeiro passo necessário para transpor a barreira imposta pelas membranas biológicas é o rompimento da membrana basal. A progressão, o desevolvimento e a invasão tecidual de células oriundas do HNSCC necessitam de (1) motilidade, (2) alteração do perfil de aderência e (3) remodelamento da matriz extracelular. Fisiologicamente, a membrana basal não atua somente como uma estrutura física de células epiteliais capaz de delimitação e permeabilidade seletiva, mas também fornece sinais parácrinos que afetam o comportamento cellular, tais como diferenciação e migração. A maior parte desses elementos inclui colágeno tipo IV e fibronectina, os quais se mostram desregulados em HNSCC. As metaloproteases (MMP´s) são os representantes mais importantes de um grupo de enzimas proteolíticas utilizadas pelas células de HNSCC para degradar a matriz extracelular e iniciar o processo de invasão. Dentre as MMP´s mais estudadas no microambiente do HNSCC estão MMP-2, MMP-9 e MT-MMP. As duas primeiras são gelatinases e se destacam pela degradação do colágeno do tipo IV e por fazerem parte do processo mais crítico na ruptura da membrana basal, com aumento das MMP-2 e MPP-9, intrinsicamente envolvidas nos processos de metástases e pior prognóstico em pacientes com HNSCC.33 Estruturalmente, a MMP-9 é mais complexa e capaz de degradar uma série de substratos, incluindo elastina, fibrina, laminina, gelatina e colágeno do tipo IV, V, XI e XIV. Anteriormente aos estudos do microambiente tumoral, as MMP foram inicialmente atribuídas como sendo produzidas somente pelas células tumorais, porém, com o advento da imunobiologia dos tumores, hoje sabemos que estas enzimas podem ser oriundas dos CAFs, neutrófilos e macrófagos do TME. Uma vez que as células oriundas do HNSCC atingem o sangue ou vasculatura linfática, estas células devem sobreviver em circulação até que elas atinjam nódulos linfáticos ou outros locais metastáticos. Embora pouco elucidado até o momento, são denominadas células tumorais circulantes (CTC´s). A quantidade de CTC nos casos de HNSCC aumenta significativamente na fase IV, correlacionando-se diretamente com o aumento das metástases e inversamente com a qualidade da resposta terapêutica e sobrevida. Infelizmente, CTC´s de HNSCC ainda não estão bem definidos, porém, podem ser caracterizados tipicamente como células que expressam moléculas epidérmicas (EpCAM), citoqueratina 8 (CK8), CK18 e CK19. Krishnamurthy et al. (2014) demosntraram que a citocina IL-6 foi responsável pelo aumento da sobrevivência e auto-renovação de uma populacão de células caracterizadas como CD44 high ALDH high (aldeído desidrogenase), potencialmente CTC´s e essa mesma população foi responsável pelo crescimento tumoral e mestástases em modelos de xenotransplante. Além disso, essa populacão celular mostrou-se resistente à indução da morte mediada por cisplastina.34 Uma vez que este perfil de células é capaz de induzir a proliferação de células de HNSCC e, consequentemente, de mestástases, novos alvos terapêuticos podem ser criados a fim de reduzir esta população de células ou inibição específica de componentes nestas células.
IMUNOTERAPIA PARA HNSCC
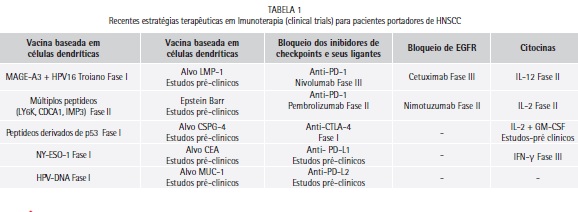
Uma vez que tumores primários detectados precocemente são removidos ou regredidos via radioterapia com sucesso, pacientes com HNSCC com caráter invasivo e mestastático não possuem a mesma eficácia no caráter terapêutico. Uma vez que o microambiente tumoral foi fortemente caracterizado como uma das principais formas de subversão de células tumorais frente ao sistema imune e seu desenvolvimento e progressão se tornam embasados nesse TME, estratégias que visam em um primeiro momento alterar o perfil do TME e assim induzir uma resposta imune mais ávida e de memória contra o câncer começaram a ser levantadas. Como vimos até aqui, diversas evidências demonstram que indivíduos com HNSCC possuem um desbalanço no perfil de citocinas, disfunção de células T e demais células do sistema imune, marcadores celulares, apresentação de antígenos e fatores de crescimento os quais, em conjunto, corroboram para o perfil de imunosupressão associado à progressão, desenvolvimento e frequentes metástases. Além disso, o microambiente associado à HNSCC revelou papel crítico para a sua progressão, em pacientes com HNSCC. Essas recentes descobertas têm provocado um interesse crescente voltado à imunoterapia, como uma estratégia potencial de tratamento de HNSCC, tornando a imunoterapia uma realidade. Nos Estados Unidos, o FDA (Food and Drug Administration) vem aprovando uma diversidade de estratégias imunoterapêuticas e somente no ano de 2015, 18 diferentes estratégias capazes de modular não só o microambiente tumoral de diversos tipos de câncer, mas também em induzir uma resposta ávida contra eles, foram aprovadas. A imunoterapia foi considerada como o grande avanço da Medicina nos últimos anos e no tratamento de pacientes com câncer. Determinados antígenos estão sendo amplamente estudados, como potenciais alvos na criação de imunizações utilizando células dendríticas para pacientes com HNSCC em diversos estágios, tais como MUC-1, EGFR, RAGE, GAGE, NY-ESO-1 e CEA. Além disso, os bloqueios de determinados receptores (antagonistas) e estimulação (agonistas), mediante anticorpos monoclonais, estão sendo amplamente utilizados em ensaios clínicos. Como exemplos destas terapias destacam-se: o bloqueio dos inibidores de checkpoints (checkpoints inhibitors), tais como PD-1 (Nivolumab e Pembrolizumab) e seus ligantes (PD-L1 e PD-L2) e CTLA-4 (Ipilimumab), anti-EGFR (Cetuximab e Nimotuzumab), anti-EpCAM (Catumaxomab), agonistas de moléculas coestimuladoras tais como OX40, vacinas baseadas em peptídeos específicos, capazes de estimular uma resposta específica, terapia baseada em citocinas, tais como GM-CSF, IL-2, IL-12 e IFN-γ, inibidores de MDSC, terapias baseadas em CAR´s (Chimeric Antigen Receptors) e vírus recombinantes, capazes de produzir GM-CSF e transferência de células T adotivas.35
CONSIDERAÇÕES FINAIS
Pacientes com HNSCC, além de apresentarem um desbalanço nos mecanismos celulares e controles do ciclo e comportamento celular apresentam, concomitantemente, falhas importantes em seu sistema imune, incluindo os mecanismos efetores das respostas imunes celular e humoral. As atuais terapias para pacientes com HNSCC carecem de eficácia e ainda podem conduzir a efeitos secundários graves. A imunovigilância é uma estratégia evolutiva em constante permuta, permite que o sistema imunológico possa reconhecer e responder à neoplasias - um conjunto de alterações celulares que culminaram de uma alteração genética e/ou epigenética e conquentemente metabólica. Qualquer alteração que se afaste do padrão de normalidade é passível de eliminação por esse sistema. Essas alterações influenciam no comportamento celular e a resultante deste processo direciona-se à expressão de diversos receptores celulares, sinais de transdução e síntese de proteínas, capazes de estimular o crescimento desse novo perfil celular e sustentar o seu desenvolvilmento. A partir dos antígenos associados aos tumores (TAA), células especializadas, conhecidas como células apresentadoras de antígenos (APC´s), são capazes de reconhecer, processar e apresentar antígenos derivados desses tumores para um braço da imunidade conhecida como adaptativa e, assim, delinear um perfil de resposta baseado em morte celular específica (especificidade) e a longo prazo (memória). Este fato explica a razão de alguns tumores não evoluirem, caracterizados como regressores espontâneos. Atualmente, sabe-se que o conjunto celular presente no ambiente tumoral (microambiente), aqui apresentado em caráter descritivo, desempenha um papel fundamental no desenvolvimento, progressão e metástase de diversas neoplasias malignas, especialmente o HNSCC.
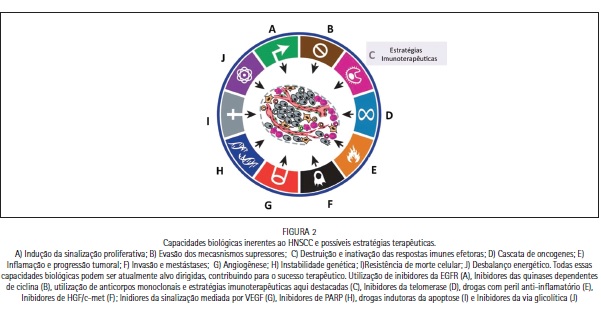
A imunoterapia pode contribuir, potencialmente, para evitar os efeitos secundários associados com a quimioterapia tradicional e induzir uma memória imunológica que conduz a eficácia de longa duração. A estimulação immune, visando antígenos tumorais de HNSCC e desenvolvimento de vacinas, pode fornecer opções terapêuticas para o futuro. Assim, esta técnica pode interferir nesse contexto e alterar o curso e o desenvolvimento dos pacientes com HNSCC, podendo ser usado em caráter monoterápico ou como adjuvante de outras formas terapêuticas, como quimioterapia e radioterapia. A imunologia de tumores vêm crescendo rapidamente e novas moléculas vem sendo descobertas. Estas por sua vez, auxiliam na compreensão de respostas imunes frente às neoplasias. Há uma necessidade de novas abordagens terapêuticas para pacientes com HNSCC, visto que nos últimos anos nenhum progresso efetivo pôde ser visto em relação à sobrevida desses pacientes (Figura 2). Neste sentido, a imunoterapia pode ser um forte candidato para tal abordagem. No entanto, estudos clínicos testando a eficácia de algumas abordagens têm deixado a desejar, quando comparado com ensaios clínicos para outros cânceres sólidos, como mama, pulmão e colorretal. Estes insucessos podem ser atribuídos às características aqui apresentadas, como o microambiente tumoral, estratégias de inibição da resposta immune, devido aos inibidores específicos e perfil imunossupressor. Sabemos que a presença de linfócitos T CD8+ específicos após o tratamento com inibidores de checkpoint aumenta a eficácia da resposta imune, além da sobrevida de pacientes com HNSCC (Figura 3). Assim, novas moléculas têm sido testadas, como possíveis alvos da imunoterapia (Quadro 1), sendo as mais recentes: 4-1BB, GITR, ICOS, TIM-3, LAG-3 e CD28, além dos fatores de transcrição Eomes, T-bet, BLIMP-1 e c-myc. Estas estratégias tornam-se ainda mais promissoras quando acompanhadas pelos avanços da imunobiologia e da biologia do HNSCC.
REFERÊNCIAS
1. KuSafdari Y, Khalili M, Farajnia S, Asgharzadeh M, Yazdani Y, Sadegui M. Recent advances in head and neck squamous cell carcinoma – A review. Clinical Biochemistry 2014;47:1195-202.
2. Curado MP, Hashibe M. Recent changes in the epidemiology of head and neck cancer. Curr Opin Oncol 2009;21:194-200.
3. Colombo J, Rahal P. Alterações genéticas em câncer de cabeça e pescoço. Rev Bras de Cancerologia 2009;55(2):165-74.
4. Lothaire P, de Azambuja E, Dequanter D, Lalami Y, Sotiriou C, Andry G, Casto G Jr, Awada A. Molecular markers of head and neck squamous cell carcinoma: promising signs in need of prospective evaluation. Head Neck 2006;28(3):256-69.
5. Rodrigo JP, Suárez C, Ferlito A, Devaney KO, Petruzzelli GJ, Rinaldo A. A potential molecular prognostic marker lymph node metastasis in head and neck for squamous cell carcinoma. Acta Otolaryngol 2003;123(1):100-5.
6. Curry JM, Sprandio J, Cognetti D, Luginbuhl A, ad-Bar V, Pribitkin E, Tuluc M. Tumor microenvironment in head and neck squamous cell carcinoma. Seminars in Oncology 2014;41(2):217-334.
7. Prystowsky MB, Adomako A, Smith RV, Kawachi N, McKimpson W, Atadja P. The histone deacetylase inhibitor LBH589 inhibits expression of mitotic genes causing G2/M arrest and cell death in head and neck squamous cell carcinoma cell lines. J Pathol 2009;218:467-77.
8. Pulte D, Brenner H. Changes in survival in head and neck cancers in the late 20th and early 21st century: a period analysis. Oncologist 2010;15:994-1001.
9. Masood R, Hochstim C, Cervenka C, Zu S, Baniwal SK, Patel V, Kobielak A, Sinha UK. A novel orthotopic mouse model of head and neck cancer and lymph node metastasis. Oncogenesis 2013;2:1-8.
10. Rautava J, Syrjanen S. Biology of human papillomavirus infections in head and neck carcinogenesis. Head Neck Pathol 2012;6(1):3-15.
11. Boyle JO, Hakim J, Koch W, Van der Riet P, Hruban RH, Roa RA. The incidence of p53 mutations increases with progression of head and neck cancer. Cancer Res 1993;53:4477-80.
12. Koch WM, Brennan JA, Zahurak M, Goodman SN, Westra WH, Schwab D. p53 mutation and locoregional treatment failure in head and neck squamous cell carcinoma. J Natl Cancer Inst 1996;88:1580-6.
13. Alsner J, Sorensen SB, Overgaard J. TP53 mutation is related to poor prognosis after radiotherapy, but not surgery, in squamous cell carcinoma of the head and neck. Radiother Oncol 2001;59:179-85.
14. Skinner HD, Sandulache VC, Ow TJ, Meyn RE, Yordy JS, Beadle BM. TP53 disruptive mutations lead to head and neck cancer treatment failure through inhibition of radiation-induced senescence. Clin Cancer Res 2011;18:290-300.
15. Brandwein-Gensler M, Smith RV, Wang B, Penner C, Theilken A, Broughel A. Validation of the histologic risk model in a new cohort of patients with head and neck squamous cell carcinoma. Am J Surg Pathol 2010;34:676-88.
16. Hanahan D, Weinberg R. Hallmarks of cancer: The next generation. Cell 2011;144(5):646-74.
17. Markwell SM, Weed SA. Tumor and stromal-based contributions to head and neck squamous cell carcinoma invasion. Cancers 2015;7:382-406.
18. Colombo MP, Modesti A, Parmiani G, Forni G. Local cytokine availability elicits tumor rejection and systemic immunity through granulocyte-T- lymphocyte cross-talk. Cancer Res 1992;52:4853-7.
19. Old L, Clarke D.A, Benacerraf B. Effect of Bacillus Calmette-Guérin Infection on Transplanted Tumours in the Mouse. Nature 1959;184:291-2.
20. Szatrowski TP, Nathan, CF. Production of large amounts of hydrogen peroxide by human tumor cells. Cancer Res 1991;51:794-8.
21. Bhowmick NA, Neilson EG. Moses Stromal fibroblasts in cancer initiation and progression. Nature 2004;432:332-7.
22. Wheeler SE, Shi H, Lin F, Dasari S, Bednash J, Thorne, S. Enhancement of head and neck squamous cell carcinoma proliferation, invasion, and metastasis by tumor-associated fibroblasts in preclinical models. Head Neck 2013;36(3):385-92.
23. Strauss L, Bergmann C, Szczepanski M, Gooding W, Johnson JT, Whiteside TL. A unique subset of CD4+CD25highFoxp3+ T cells secreting interleukin-10 and transforming growth factor-beta1 mediates suppression in the tumor microenvironment. Clinical Cancer Research 2007;1(13):4345-54.
24. Kunz-Schughart LA, Knuechel R. Tumor-associated fibroblasts (part I): Active stromal participants in tumor development and progression? Histol Histopathol 2002;17:599-621.
25. Jie HB, Schuler PJ, Lee SC. CTLA-4+ regulatory T cells increased in cetuximab-treated head and neck cancer patients, suppress NK cell cytotoxicity and correlate with poor prognosis. Cancer Res 2015;75:2200-10.
26. Lin J, Liu C, Ge L, Gao Q, He X, Liu Y. Carcinoma-associated fibroblasts promotes the proliferation of a lingual carcinoma cell line by secreting keratinocyte growth factor. Tumour Biol 2011;32:597-602.
27. Mizutani K, Miki H, He H, Maruta H, Takenawa T. Essential role of neural Wiskot-Aldrich syndrome protein in podosome formation and degradation of extracellular matrix in src-transformed fibroblasts. Cancer Res 2002;62:669-74.
28. Costa NL, Valadares MC, Souza PP, Mendonca EF, Oliveira JC, Silva TA. Tumor-associated macrophages and the profile of inflammatory cytokines in oral squamous cell carcinoma. Oral Oncol 2013;49:216-23.
29. Mantovani A, Bottazzi B, Colotta F, Sozzani S, Ruco L.The origin and function of tumor-associated macrophages. Immunol Today 1992;13:265-70.
30. Dunddel DV, Pan F, Zeng Q, Gorbounov M, Albesiano E, Fu J, Tam AJ, Bruno T, Zhang H, Pardoll D, Kim Y. STAT-3 regulates arginase-I in myeloid-derived suppressor cells from cancer patients. J Clin Invest 2013;123(4):1580-9.
31. Younis RH, Han KL, Webb TJ. Human Head and Neck Squamous Cell Carcinoma−Associated Semaphorin 4D Induces Expansion of Myeloid-Derived Suppressor Cells. J Immunol 2016;196:1-11.
32. Accomando WP, Wlencke JK, Houseman EA, Butler RA, Zhen S, Nelson HH, Kelsey KT. Descreased NK cells in patients with head and neck cancer determined in archival DNA. Clin Cancer Res 2012;18(22):6147-54.
33. Molling JW, Langius J, Langendijk JA, Leemans CR, Bontkes HJ, van der Vliet HJJ et al.. Low levels of circulating invariant natural killer T cells predict poor clinical outcome in patients with head and neck squamous cell carcinoma. J Clin Oncol 2007;25(7):862-8.
34. Krishnamurthy S, Warner KA, Dong Z, Imai A, Nör C, Ward BB, Helman JI, Taichman RS, Bellile EL, McCauley LK et al. Endothelial interleukin-6 defines the tumorigenic potential of primary human cancer stem cells. Stem Cells 2014;32:2845-57.
35. Egan JE, Quadrini KJ, Santiago-Schwarz F, Hadden JW, Brandwein HJ, Signorelli KL. IRX- 2, a novel in vivo immunotherapeutic, induces maturation and activation of human dendritic cells in vitro. J Immunother 2007;30:624-33.
 Endereço para correspondência:
Endereço para correspondência:
Jorge Augusto Borin Scutti
7455 Fannin, 1SCR3.3020
Houston, Texas
77054
e-mail: jascutti@mdanderson.org
Recebido: mar/2016
Aceito: abr/2016