Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista Brasileira de Odontologia
versão On-line ISSN 1984-3747versão impressa ISSN 0034-7272
Rev. Bras. Odontol. vol.69 no.1 Rio de Janeiro Jan./Jun. 2012
ARTIGO ORIGINAL / ORIGINAL ARTICLE
Estabilidade dimensional de modelos obtidos com poliéter e silicone de adição após desinfecção comácido peracético e hipoclorito de sódio
Dimensional stability of casts obtained with polyether and addition reaction silicone after disinfection with sodium hypochlorite and peracetic acid
Frederico Emygdio Cabral de VasconcellosI; Rafael Ferrone AndreiuoloII; Carlos Eduardo SabrosaIII; Maximiliano Piero NeisserIV; Marcos Augusto do RegoIV
I Mestre em Prótese pela Universidade de Taubaté (Unitau) Professor do Curso de Especialização em Prótese Dentária da UVA
II Doutorando em Dentística pela Uerj / Professor do Curso de Especialização em Prótese Dentária da UVA
III Doutor em Prótese pela Boston University / Professor de Dentística da Uerj
IV Professores do Programa de Pós-Graduação em Odontologia da Unitau
RESUMO
Este estudo buscou comparar a estabilidade dimensional de modelos após moldagem com poliéter (P), silicone de adição espatulado mecanicamente (SAP) e manualmente (SAM), desinfetados com hipoclorito de sódio 1% (HP), ácido peracético 0,2% (AP) e sem desinfecção. Foram feitas mensurações cruzando o arco posterior (CAP) e anterior (CAA), ântero-posterior direita (APD) e esquerda (APE). A análise estatística (Kruskal-Wallis) mostrou que houve diferença significativa apenas na medida CAP: 1) entre P (0,1203% ± 0,0442) e SAP (0,0350% ± 0,0158) desinfetados com HP; 2) entre P (0,1345% ± 0,1059) e SAP (0,0264%± 0,0302) desinfetados com AP; 3) entre os grupos SAM (0,1054% ± 0,0419) e SAP (0,0264% ± 0,0302). A desinfecção com ácido peracético e hipoclorito de sódio não interferiu negativamente na estabilidade dimensional das moldagens realizadas neste estudo.
Palavras-chave: materiais de moldagem; desinfecção;ácido peracético; hipoclorito de sódio.
ABSTRACT
This study aimed to compare the dimensional stability of polyether (P), addition silicone auto mixed (ASP) and addition silicone hand mixed (ASM) molds after disinfection with sodium hypochlorite 1% (HP), peracetic acid 0,2% (AP), and no disinfection. Mensurations cross posterior arch (CAP), cross-anterior arch (CAA), and antero-posterior on right (APD) and left sides (APE). Statistical analysis (Kruskall-Wallis) showed significant difference only in measure CAP: 1) between P (0,1203% ± 0,0442) and SAP (0,0350% ± 0,0158) disinfected with HP; 2) between P (0,1345% ± 0,1059) and SAP (0,0264% ± 0,0302) disinfected with AP; and 3) between SAM (0,1054% ± 0,0419) and SAP (0,0264% ± 0,0302). Disinfection with peracetic acid and sodium hypochlorite did not interfere negatively in the dimensional accuracy of the impressions tested in this study. Keywords: impression materials; disinfection; peracetic acid; sodium hypochlorite.
Keywords: impression materials; disinfection; peracetic acid; sodium hypochlorite.
Introdução
As moldagens são procedimentos realizados rotineiramente na prática odontológica e moldes contaminados com micro-organismos, saliva e sangue podem representar causa de infecção cruzada 3,14.
A American Dental Association (ADA) 1 recomenda a desinfecção dos moldes por imersão por no máximo trinta minutos. Diversos desinfetantes podem ser utilizados para esse fim, tais como hipoclorito de sódio, compostos de amina quaternária, compostos de iodo, glutaraldeído, entre outros. Com o uso constante da desinfecção, outro fator passou a ser observado: a interferência do desinfetante nas propriedades dos materiais de moldagem, tanto em sua composição como em sua precisão. Neste contexto, muitos estudos foram realizados com o objetivo de verificar a influência dos desinfetantes na precisão dos materiais de moldagem 19,20.
O ácido peracético tem sido proposto com o intuito de substituir o glutaraldeído como desinfetante de alto nível 6. Esse desinfetante ainda é pouco utilizado no meio odontológico 4,5, mas existem diversos estudos comprovando sua eficácia em outras áreas 7,8,10,11,15,18. Uma das grandes vantagens desse desinfetante em relação ao glutaraldeído é que os compostos formados como resultado das reações durante o processo de desinfecção não são considerados prejudiciais ao ecossistema 18. O ácido peracético é bastante utilizado para desinfecções em âmbito hospitalar. O objetivo desse estudo foi comparar a estabilidade dimensional de modelos obtidos com poliéter e silicone de adição, após desinfecção com ácido peracético e hipoclorito de sódio.
Material e Método
Um modelo mestre foi confeccionado em aço inoxidável, baseado em estudos previamente realizados 5, com marcações em "X" 16 para que fossem realizadas medições no sentido de investigar qualquer alteração dimensional pós-desinfecção (Figura 1).
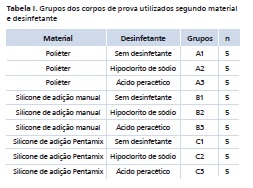
Foram realizadas moldagens do modelo mestre com três tipos de material de moldagem: a) poliéter base leve e pesada (Impregum Penta, 3M-ESPE, Brasil); b) silicone de adição base leve (Express Regular Set Type 3, 3M-ESPE, Brasil) e massa densa (Express, 3M-ESPE, Brasil); c) silicone de adição base leve (Express Regular Set Type 3, 3M-ESPE, Brasil) e pesada (Express Penta, 3M-ESPE, Brasil). Quinze moldagens foram realizadas para cada tipo de material, onde cinco moldes foram desinfetados por imersão em ácido peracético a 0,2% (Sterilife®, Lifemed, Brasil), cinco em hipoclorito de sódio a 1% (Cloro Rio, Brasil) e cinco não foram desinfetados para controle, totalizando 9 grupos (Tabela I).
Para padronizar o posicionamento das moldagens e a espessura de material, foram confeccionadas guias de resina acrílica (JET, Brasil) e utilizadas moldeiras metálicas número 028 (AG, Brasil) idênticas em todas as amostras 15.
Para as moldagens com poliéter (grupos A1, A2 e A3) foram utilizadas duas máquinas Pentamix (3M-ESPE, Brasil), para levarem o material de moldagem leve e o pesado a uma seringa de moldagem eà moldeira, respectivamente. Aguardou-se sete minutos para a polimerização do material e o mesmo foi removido do modelo. As moldagens do silicone de adição Pentamix (grupos C1, C2 e C3) foram feitas com auxílio da máquina de automistura Pentamix para a base pesada e da pistola de automistura para a base leve. A base leve foi injetada diretamente da pistola de automistura no modelo e logo em seguida a base pesada foi levada ao modelo na moldeira. Em todos os grupos foram utilizados os adesivos específicos para moldeira do material em questão.
As moldagens com o silicone de adição manual (grupos B1, B2 e B3) foram feitas com a técnica de dois tempos. Primeiramente, a massa densa foi manipulada manualmente e então colocada na moldeira e coberta com um pedaço de filme de pvc (Rolopac, Brasil), para criar espaço uniforme de cerca de 2 mm para a base leve. Em seguida, a base leve foi injetada no modelo e na moldeira com a massa densa com auxílio de uma pistola de automistura e o molde foi obtido, sempre utilizado adesivo específico para a moldeira recomendado pelo fabricante.
Todos os moldes foram lavados em água corrente por dez segundos e, posteriormente, os moldes dos grupos A2, B2 e C2 foram colocados em imersão no hipoclorito de sódio a 1% e dos grupos A3, B3 e C3 foram colocados em ácido peracético a 0,2% por dez minutos. A seguir, os moldes desinfetados foram lavados por dez segundos para remoção do desinfetante e foram deixados em temperatura ambiente por cinquenta minutos. Os grupos A1, B1 e C1 ficaram sessenta minutos em temperatura ambiente como controle 19. Os desinfetantes foram manipulados conforme recomendações do fabricante.
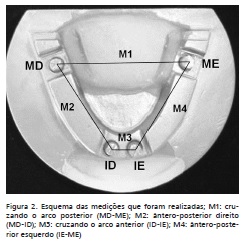
Após desinfecção, os moldes foram vazados com gesso tipo IV (Durone, Dentsply, Brasil) na proporção de 100 g de pó para 19 ml de água, o qual foi manipulado manualmente por dez segundos e depois em um espatulador a vácuo (Polidental, Brasil) por vinte segundos. A vazagem foi feita com o auxílio de um vibrador (VH Equipamentos, Brasil) e o tempo de cristalização do gesso foi de 45 minutos 16. Os modelos foram então recortados em um recortador de gesso (VH Equipamentos, Brasil), deixando uma altura da base do modelo até a região mais oclusal de 20 mm, para padronizar as alturas dos modelos. Os modelos foram marcados com o respectivo grupo na sua parte inferior e foram numerados de forma aleatória de 1 a 45 na parte superior para que as medições fossem feitas sem que o operador soubesse que grupo estava medindo. As medições foram realizadas com auxílio de microscópio de luz, modelo STM (Olympus, Japão), com precisão de 0,0005 mm, das seguintes marcações: M1) cruzando o arco posterior, MD-ME; M2) ântero-posterior direita, MD-ID; M3) cruzando o arco anterior, ID-IE; M4) ântero-posterior esquerda, ME-IE (Figura 2). Foram feitas medições no modelo mestre e em todos os modelos, sendo que foram realizadas três medições de cada medida e a média delas foi utilizada. Um único operador realizou todas as medições para padronização da mesma.
Os resultados das medições foram transformados em porcentagem de variação do modelo mestre através da seguinte fórmula 15:

Os resultados em variação de porcentagem das medições foram submetidos ao teste estatístico Kolmogorov-Smirnov (Lilliefors) para verificação da normalidade da amostra. O resultado do teste foi não paramétrico. Por esse motivo, foi escolhido o teste de Kruskal-Wallis para fazer a análise estatística dos resultados do presente estudo.
Resultados
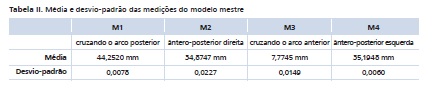
Os valores médios das quatro medidas do modelo mestre estão dispostos na Tabela II. Esses valores foram utilizados para calcular a variação em porcentagem dos modelos estudados.
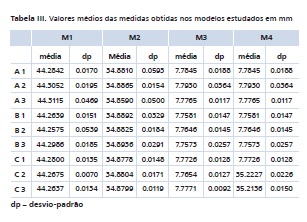
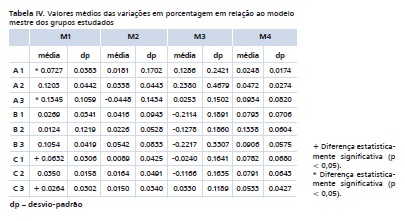
Os resultados em mm das medições realizadas nos modelos estudados podem ser observados na Tabela III. Os resultados dessas medições transformados em porcentagem de variação podem ser observados na Tabela IV.
Os resultados mostraram que na medida cruzando o arco posterior (M1) não houve diferença estatística entre o grupo controle e os grupos desinfetados com o mesmo tipo de material de moldagem, sendo p = 0,37 nos grupos de poliéter (A1, A2 e A3), p = 0,2101 nos grupos de silicone de adição manual (B1, B2 e B3) e p = 0,1451 nos grupos de silicone de adição Pentamix (C1, C2 e C3). Mas quando foi feita a comparação levando-se em conta o tipo de desinfetante, observou-se que dentro dos grupos sem desinfecção não houve diferença estatística, mas nos grupos que foram desinfetados com hipoclorito de sódio a 1%, houve diferença estatística entre os grupos do poliéter e silicone de adição Pentamix (A2 e C2, respectivamente) (p = 0,0133), sendo que o grupo A2 variou 0,1203% ± 0,0442 e o grupo C2, 0,0350% ± 0,0158. Assim como nos grupos desinfetados com ácido peracético a 0,2%, entre os grupos do poliéter (A3, 0,1345% ± 0,1059) e do silicone de adição Pentamix (C3, 0,0264% ± 0,0302) (p = 0,0339) e silicone de adição manual (B3, 0,1054% ± 0,0419) e silicone de adição Pentamix (C3, 0,0264% ± 0,0302) (p = 0,0196). Na medida M1, 0,1% equivale a 44 μm. A maior variação média na medida M1 foi do grupo do poliéter desinfetado com ácido peracético a 0,2% (A3, 0,1345% ± 0,1059) e a menor foi do grupo do silicone de adição manual desinfetado com hipoclorito de sódio a 1% (B2, 0,0124% ± 0,1219).
Nas medidas (M2), (M3) e (M4) os resultados não mostraram diferença estatisticamente significante levando-se em consideração o tipo de material ou o desinfetante.
Discussão
As recomendações da American Dental Association 1 são de que os moldes devem ser desinfetados por imersão com produtos compatíveis, pelo tempo máximo de trinta minutos. Isso se deve ao fato de que quando o spray é utilizado o desinfetante pode não ficar em íntimo contato com o molde em alguma região, enquanto que na desinfecção por imersão o molde fica totalmente em contato com o desinfetante, proporcionando melhor desinfecção. Por esse motivo foi feita a desinfecção por imersão no presente estudo. Por esse motivo também os grupos controles não foram imersos em água ou qualquer outro líquido, pois apenas quandoé feita a desinfecção os moldes são imersos em líquido.
Os modelos obtidos com os materiais de moldagem estudados após desinfecção com ácido peracético a 0,2% e hipoclorito de sódio a 1% apresentam uma boa estabilidade dimensional. Os dados obtidos estão dentro da variação aceitável pela ADA (0,5% de variação). As medições médias obtidas no presente estudo foram menores que 0,15% na medição cruzando o arco posterior que representa uma variação menor que 66 μm, 0,06% na medição ântero-posterior direita que representa uma variação menor que 20,4 μm, 0,25% na medição cruzando o arco anterior que representa uma variação menor que 17,5 μm e 0,15% na medição ântero-posterior esquerda que representa uma variação menor que 52,5 μm. Diferenças estatisticamente significantes só foram encontradas na medição cruzando o arco posterior, entre os grupos de poliéter (A2) e silicone de adição Pentamix (C2) desinfetados com hipoclorito de sódio, com uma diferença menor que 40 μm e entre os grupos de poliéter (A3) e silicone de adição Pentamix (C3) e entre os grupos de silicone de adição manual (B3) e silicone de adição Pentamix (C3) desinfetados com ácido peracético com uma diferença menor que 48 μm. Essas variações não apresentaram relevância clínica, pois quando o paciente faz o movimento de abertura de boca, pode ocorrer uma variação entre os primeiros molares (cruzando o arco posterior) de 100 a 500 μm 9. Os resultados obtidos com todos os materiais e desinfetantes estão dentro da variação encontrada na literatura. JOHNSON et al. 9 demonstraram resultados que variavam menos que 44 μm nas medições cruzando o arco e menos que 34 μm nas medições ântero-posteriores em relação ao modelo mestre. WADHWANI et al. 19 demonstraram variação menor que 85 μm e 45 μm, respectivamente.
Os resultados obtidos com o poliéter foram melhores dos que os encontrados por WADHWANI et al. 19, que verificaram um aumento médio de 82 μm na medição cruzando o arco posterior em relação ao modelo mestre e no presente estudo foi encontrado um aumento de 48,04 μm. JOHNSON et al. 9 verificaram um aumento de 23 μm nessa mesma medida. Essas diferenças podem ser atribuídas em parte ao tipo de moldeira utilizado nestes estudos. WADHWANI et al. 19 utilizaram moldeiras de estoque plásticas perfuradas. Enquanto que, no presente estudo, foram utilizadas moldeiras metálicas perfuradas e no estudo de JOHNSON et al. 9 foram utilizadas moldeiras individuais de resina acrílica deixando 3 mm de espaço para o material de moldagem. As moldeiras individuais apresentam uma melhor precisão por ter uma quantidade menor e mais uniforme de material de moldagem fazendo com que ocorra uma menor distorção no momento da polimerização 12,13. Já quando se compara a moldeira de estoque perfurada metálica com a plástica, a diferença na precisão pode ser atribuída ao fato da moldeira metálica ser mais rígida que a plástica 2. Em contrapartida, segundo THONGTHAMMACHAT et al. 17, o tipo de moldeira não interferiu na precisão da moldagem.
Nas medições cruzando o arco anterior, que simula uma prótese fixa anterior, a maior variação não passou de 20 μm, o que não impediria um bom assentamento da prótese, tendo em vista que o ligamento periodontal tem uma variação entre 90 e 240 μm, uma variação de 90 μm é aceitável clinicamente 17.
Dentro das limitações observadas neste estudo, algumas foram mais relevantes, tais como a moldagem ter sido feita em ambiente seco enquanto que na boca há umidade, o que pode interferir na estabilidade dimensional. Por esse motivo também, a remoção da moldagem do modelo de estudo foi dificultada o que pode ocasionar alguma distorção do molde e, consequentemente, do modelo de gesso.
A alteração na estabilidade dimensional dos materiais de moldagem utilizados neste estudo, após desinfecção, pode ser considerada insignificante clinicamente. Não há motivos para a desinfecção não ser realizada em todos os moldes feitos com esses materiais, tanto com hipoclorito de sódio a 1% quanto com ácido peracético a 0,2%.

Conclusão
Dentro das limitações deste estudo, podemos concluir que:
• Todos os modelos obtidos com os diferentes tipos de materiais de moldagem utilizados no presente estudo apresentaram boa estabilidade dimensional, não apresentando diferenças clinicamente relevantes quando imersos nos diferentes desinfetantes;
• O ácido peracético pode ser utilizado como desinfetante de moldes dentários com tempo de imersão de dez minutos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. AMERICAN DENTAL ASSOCIATION Council on Scientific Affairs and American Dental Association Council on Dental Practice. Infection control recommendations for the dental office and the dental laboratory. Journal of American Dental Association. 1996; 127: 672-80. [ Links ]
2. BALKENHOL, M., FERGER, P., WÖSTMANN, B. Dimensional accuracy of 2-stage putty-wash impressions: influence of impression trays and viscosity. International Journal of Prosthodontics. 2007; 20 (6): 573-5. [ Links ]
3. BLAIR, F. M., WASSEL, R. W. A survey of the methods of disinfection of dental impressions used in dentals hospitals in the United Kingdom. British Dental Journal. 1996; 180 (10): 369-75. [ Links ]
4. CHASSOT, ANC, POISL et al. In Vivo and In Vitro Evaluation of the efficacy of a peracetic acid-based disinfectant for decontamination of acrylic resins. Brazilian Dental Journal. 2006; 17 (2): 117-21. [ Links ]
5. FRACARO, G. B. et al. A inf luência da imersão em ácido peracético sobre a reprodução de detalhes e compatibilidade dos elastômeros com gesso. Revista Odonto Ciência – Faculdade Odontologia/PUCRS. 2007; 22 (55): 61-5.
6. HERNÁNDEZ, A. et al. In use evaluation of Perasafe compared with Cidex in fibreoptic bronchoscope disinfection. Journal of Hospital Infection. 2003; 54 (1): 46-51. [ Links ]
7. HERNÁNDEZ, A. et al. In-vitro evaluation of perasafe compared with 2% alkaline glutaraldehyde against Mycobacterium spp. Journal of Hospital Infection. 2003; 54 (1): 52-6. [ Links ]
8. HERRUZO-CABRERA, R., VIZCAÍNO-ALCAIDE, M. J., RODRIGUEZ, J. Comparison of the microbicidal efficacy on germ carries of several tertiary amine compounds with ortho-phhthaldehyde and Perasafe. Journal of Hospital Infection. 2006; 63 (1): 73-8. [ Links ]
9. JOHNSON, GH. et al. Dimensional stability and detail reproduction of irreversible hydrocolloid and elastomeric impressions disinfected by immersion. Journal of Prosthetic Dentistry. 1998; 79 (4): 446-53. [ Links ]
10. LEPE, X., JOHNSON, G. H. Accuracy of polyether and addition silicone after long-term immersion disinfection. Journal of Prosthetic Dentistry. 1997; 78 (3): 245-9. [ Links ]
11. MCDONELL, G., RUSSELL, A. D. Antiseptics and Disinfectants: Activity, Action, and Resistance. Clinical Microbiology Reviews. 1999; 12 (1): 147-79. [ Links ]
12. MILLSTEIN, P., MAYA, A., SEGURA, C. Determining the accuracy of stock and custom tray impression/casts. Journal Oral Rehabilitation. 1998; 25 (8): 645-8. [ Links ]
13. RUEDA, L. J. et al. The effect of using custom or stock trays on the accuracy of gypsum casts. International Journal of Prosthodontics. 1996; 9 (4): 367-73. [ Links ]
14. SOFOU, A. et al. In vitro study of transmission of bacteria from contaminated metal models to stone models via impressions. Clinical Oral Investigations. 2002; 6 (3): 166-70. [ Links ]
15. STAMPI, S. et al. Peracetic acid as an alternative wastewater disinfectant to chlorine dioxide. Journal of Applied Microbiology. 2002; 93 (5): 725-31. [ Links ]
16. TAYLOR, R. L., WRIGHT, P. S., MARYAN, C. Disinfection procedures: their effect on the dimensional accuracy and surface quality of irreversible hydrocolloid impression materials and gypsum casts. Dental Materials. 2002; 18 (2): 103-10. [ Links ]
17. THONGTHAMMACHAT, S. et al. Dimensional accuracy of dental casts: influence of tray material, impression material, and time. Journal of Prosthodontics. 2002; 11 (2): 98-108. [ Links ]
18. VIZCAÍNO-ALCAIDE, M. J., HERRUZO-CABRERA, R., FERNANDEZ-ACEÑERO, M. J. Comparison of the disinfectant efficacy of Perasafe and 2% glutaraldehyde in vitro tests. Journal of Hospital Infection. 2003; 53 (2): 124-8. [ Links ]
19. WADHWANI, C. P. K. et al. Accuracy of newly formulated fast-setting elastomeric impression materials. Journal of Prosthetic Dentistry. 2005; 93 (6): 530-9. [ Links ]
20. WALKER, M. P. et al. Surface Quality and Long-term Dimensional Stability of Current Elastomeric Impression Materials after Disinfection. Journal of Prosthodontics, Philadelphia. 2007; 16 (5): 343-51. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Frederico Emygdio Cabral de Vasconcellos
Rua Nossa Senhora de Copacabana, 749/410 - Copacabana
Rio de Janeiro/RJ, Brasil – CEP: 22.050-002
e-mail: fredericoecvasconcellos@gmail.com
Recebido em 03/08/2011
Aprovado em 26/01/2012













