Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista Brasileira de Odontologia
versão On-line ISSN 1984-3747versão impressa ISSN 0034-7272
Rev. Bras. Odontol. vol.72 no.1-2 Rio de Janeiro Jan./Jun. 2015
ARTIGO DE REVISÃO
O uso da proteína recombinante no aumento ósseo em Implantodontia
Recombinant protein for bone augmentation in Implantology
Luciano Bonatelli Bispo I
I Doutor em Dentística pela FO/USP Especialista Implantodontia pelo SENAC
RESUMO
A reabsorção do osso alveolar ocorre após a perda dentária por vários fatores, tais como: exodontia, traumatismo, processos patológicos ou mesmo reabsorção por desuso. A reabilitação com implantes requer osso em quantidade e qualidade. Os enxertos autógenos são considerados os enxertos tipo "padrão ouro" para regeneração óssea guiada. Contudo, o aumento ósseo dessa região tem sido feito também com biomateriais, que é qualquer substância, droga, combinação de substâncias de origem natural ou sintética que pode ser usado como reposição de algum tecido, órgão ou função do corpo. Embora promissora, a utilização das proteínas morfogenéticas ósseas na Implantodontia e na Cirurgia Bucomaxilofacial ainda necessita de maior respaldo científico. O objetivo desse estudo foi fazer uma breve revisão sobre a utilização das proteínas recombinantes e esclarecer os clínicos sobre suas indicações e reais limitações.
Palavras-chave: proteínas recombinantes; implantes dentários; proteína morfogenética óssea 2.
ABSTRACT
The bone alveolar reabsortion occurs after lost dental by many factors such as: exodontic, traumatism, pathologic process or even atrophy due to disuse. Implant supported rehabilitation requires amount and quality of bone. Autogenous bone has been considered "the gold standard" graft to guided bone regeneration. However, the bone augmentation in this region has been done with biomaterials too, that is any substance, drug, combination of substances of natural or synthetic origin which may be used for a replacement tissue, organ or body function. Although promising, the widespread use of bone morphogenetic proteins in Implantology and in Maxillofacial Surgery demands greater scientific support. The aim of this study was to do a brief review to the use of recombinant proteins and clarify clinical about its indications and true limitations.
Keywords: recombinant proteins; dental implants; bone morphogenetic protein 2.
Introdução
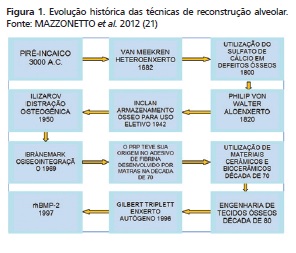
O advento do fenômeno da osseointegração 1,7 proporcionou a reabilitação estética e funcional de inúmeras discrepâncias do complexo maxilofacial. A perda do osso alveolar devido à exodontia precoce por doença periodontal, fraturas dentárias e ósseas, tumores, alterações genéticas e até por iatrogenias é alvo de exaustivos estudos no intuito de reestabelecer a altura, o volume e a qualidade óssea perdida 7 (Figura 1). Cerca de 25% dos pacientes que necessitam de reabilitação por implantes precisam de algum tipo de aumento ósseo que anteceda a reabilitação 40.
Aproximadamente 0,7% de todo esqueleto humano é substituído diariamente, teoricamente renovando os tecidos duros em 142 dias em condições normais de fisiologia 18. Contudo, após exodontia, a maxila anterior perde 25% do volume ósseo no primeiro ano; e, de 40 a 60% de espessura depois de três anos, sendo uma reabsorção de cunho centrípeto 30. Na região posterior da maxila, perde-se 50% em três anos, considerando-se que o volume da maxila nessa região é duas vezes maior que na parte anterior. Para a mandíbula, a perda é de 60%, sendo maior na região de segundo pré-molar até primeiro molar inferior; e, centrífuga, ou seja, maior nas corticais internas da região posterior associada a tábua óssea vestibular na região de sínfise 27.
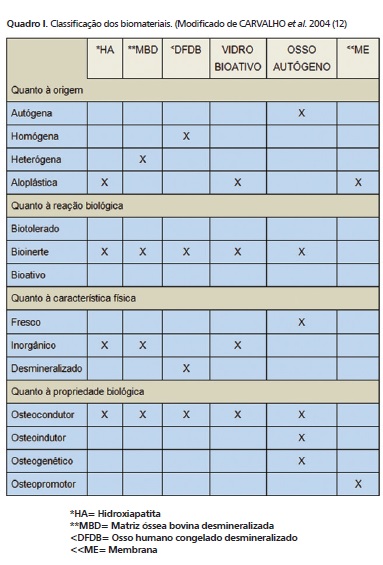
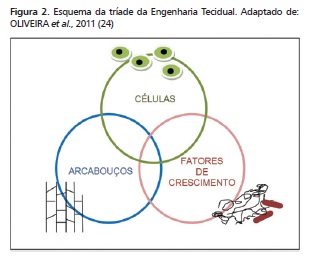
Substitutos ósseos chamados biomateriais (Quadro 1) têm sido desenvolvidos na expectativa de que qualquer substância, droga ou combinação delas, seja de origem natural ou sintética, possa ser usada como uma parte do sistema que necessite de reposição em algum tecido, órgão ou função 11,27,34. Assim, em 1965, MARSHALL URIST 33 descobriu uma proteína com a propriedade biológica de ser osteoindutora 29, posteriormente sofrendo recombinação e denominada rhBMP-2 (proteína óssea humana recombinante tipo 2). Atualmente, a Engenharia Tecidual 14 apoiada no tripé: arcabouço, células e fatores de crescimento (Figura 2), distribui comercialmente a rhBMP-2 para uso in label, ou seja, aprovado pela FDA (Food and Drug Administration). Entretanto, problemas quanto ao custo de produção 25,28,40, concentração adequada (grau de pureza) 31, carreador mais efetivo (esponja de colágeno ou membrana de polietilenoglicol) 15,17, sistemas de cultura de células em larga escala 16, efeitos colaterais 10,14,36, falta de estudos clínicos e de divulgação 12, todos têm impedido um interesse maior nas BMPs.
O objetivo deste trabalho é fazer uma revisão sobre a proteína recombinante humana informando o clínico sobre o sucesso e as limitações inerentes ao processo produtivo, bem como a escassez de informações que permeiam a literatura pertinente ao assunto.
Revisão de Literatura
Em 1965, MARSHALL URIST 33 implantou fragmentos de matriz desmineralizada em tecido intramuscular e subcutâneo de ratos e coelhos, constatando que, após 21 dias, houve a formação de tecido ósseo e cartilaginoso, justificando as proteínas usadas como uma das opções para regeneração de tecido duro. A hipótese aventada foi o da autoindução pelo fato das células enxertadas servirem às células totipotentes locais como diferenciadoras em células osteoprogenitoras e condroprogenitoras. Só em 1971, o mesmo URIST daria o nome dessas proteínas de BMP (Bone Morphogenetic Proteins). Em 1977, desenvolveu-se um método para extração da BMP do osso, ratificando-se sua propriedade osteoindutora. Em 1985, a molécula da BMP-2 é isolada do osso. Já em 1988 é produzida a primeira proteína humana recombinante, a rhBMP-2. O potencial da rhBMP-2 em estudos pré-clínicos são confirmados (WOZNEY, 1988, 1993 e 1995) 37,38,39. BOYNE (2), em 1996, iniciou os estudos clínicos com BMP na técnica de levantamento do seio maxilar 3,4,5,6,7. Em 2001, a FDA 3 aprovou a primeira marca comercial de proteína humana osteogênica para fusão de ossos longos. Em 2002, foram aprovadas duas marcas comerciais famosas, uma para fraturas de tíbia, e outra, na coluna vertebral para tratamento de doenças e traumas, pelo Comitê para uso de produtos médicos em humanos nos Estados Unidos 19. Em março de 2007, a FDA aprovou o uso da rhBMP-2 no complexo craniofacial, tendo sido aprovado para aumento ósseo na maxila posterior (através do procedimento de elevação do seio maxilar), bem como para o preenchimento de alvéolo dentário pós-extração, como uma alternativa ao enxerto ósseo autógeno, sendo esses casos denominados como in label, ou seja, dentro da aprovação legal pelo FDA 19. Apesar de já existirem, atualmente, diversos casos de utilização off label (sem a aprovação legal da FDA), por exemplo, em mandíbulas nos locais de extensa reabsorção óssea 9,13,21,22,24,32. Recentemente, a FDA publicou uma carta em que recomenda o não emprego da rhBMP-2 para tratamento de vértebras cervicais (portanto próximas ao complexo maxilofacial), com risco de obstrução das vias aéreas por edema dos tecidos moles 10,14.
Discussão
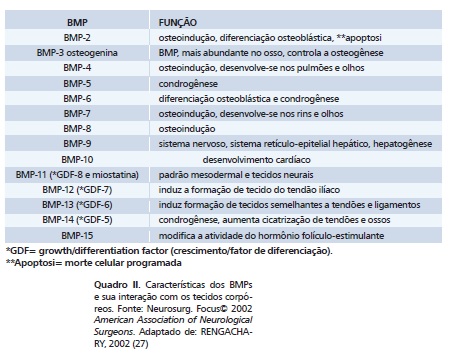
Classificadas como um subgrupo da superfamília dos fatores de crescimento transformadores beta (TGF-ß, do inglês Transforming Growth Factor-ß) têm mais de 20 tipos descritos na literatura 14,23, excetuando-se a BMP-1 que participa no processo de lise de fibras maduras de colágeno e cuja estrutura não é semelhante à da família das TGF-ß. As restantes são polipeptídeos multifuncionais transmembrânicos, não colagenosas, de baixo peso molecular (19.000 a 30.000 Da - Daltons). São sintetizadas intracelularmente como uma molécula percursora de grandes dimensões (400- 500 aminoácidos), constituída por três partes, um peptídeo hidrofóbico de sinalização, pró-domínio e o peptídeo maduro 25. O peptídeo de sinalização é clivado e a proteína precursora é glicosilada e dimerizada via pontes dissulfídricas 25. Na secreção da BMP madura, dimérica e bioativa, o pró-domínio é clivado. As BMPs maduras são compostas por 50-130 aminoácidos e possuem uma cadeia distal carboxilada, comum entre todas do grupo 25. O seu terminal carboxílico possui sete resíduos de cisteína, característica das TGF-ß. Podem ser secretadas como homodímeros ou heterodímeros, esta quando as subunidades são diferentes. Essas diferenças estruturais e químicas são a causa de variação no seu potencial biológico 25. Assim, possuem características pleiotrópicas, ou seja, a mesma molécula pode produzir efeitos diferentes em células variadas. Como curiosidade, o gene da BMP-2 localiza-se no cromossoma 20p12, quando transcrito, origina uma proteína em forma de homodímero, com duas subunidades de 114 aminoácidos 25. Têm papel regulador no desenvolvimento da medula hematopoiética, na diferenciação mioblástica, nas células da crista neural em fenótipo neural, bem como, nas fases de migração e adesão de células progenitoras, multiplicação, diferenciação nas linhagens celulares osteoblásticas e condroblásticas, mineralização e remodelação 25 (Quadro 2).
Duas BMPs têm sido relacionadas com propriedade osteoindutiva em Medicina e Odontologia: a BMP-2 e a BMP-7. Atualmente denominadas rhBMP, a tecnologia recombinante conseguiu gerar comercialmente clones complementares do DNA das moléculas do BMP humano, principalmente a rhBMP do tipo 2, através de sua inserção em células de mamíferos, células de ovário de hamsters chineses, células-tronco (Stem Cells) ou mesmo de bactérias Escherichia coli 13,14. A quantidade natural de BMPs que existe na matriz óssea humana é de 1µg (micrograma) por grama de osso 33. Estão presentes em células da medula óssea, plaquetas, osteoclastos, células musculares, periósteo e endósteo 25. Podem ter efeito autócrino ou parácrino, atuando nas células que a secretam como mediadores químicos locais sem nenhum efeito sistêmico ou em células vizinhas 25,28,40. Devido ao turnover dos tecidos duros, renovados inteiramente em 142 dias 18, os osteoblastos mais basófilos; devido a proteínas ribossômicas presentes em seu citoplasma; quando depositam a matriz óssea, também secretam BMP que fica retida na região mineralizada 28. A BMP é ácido-insolúvel, assim quando os osteoclastos dissolvem o mineral, não afetam sua estrutura orgânica 28. Aderindo-se a receptores proteicos transmembrânicos presentes na superfície de células mesenquimais indiferenciadas (receptores serina/treonina quinase), as BMPs promovem a formação de proteínas que atuam como fatores de transcrição, proliferação gênica e celular, diferenciação das células em osteoblastos, quimiotaxia, angiogênese, neoformação óssea e remodelagem 30. Assim, a ossificação induzida pelas BMPs pode se processar de duas formas: através da ossificação endocondral ou indireta, em que as células se diferenciam em fenótipo condroblástico e o tecido cartilaginoso formado servirá como base para a uma nova migração e diferenciação em osteoblastos, como ocorre, por exemplo, nas epífises dos ossos longos. Ou ainda, pela diferenciação das células progenitoras diretamente no fenótipo de células ósseas (ossificação intramembranosa ou direta) 13,14,23,22,28,30.
As BMPs são moléculas de difícil isolamento, logo produzidas em pequena quantidade 28. Inicialmente, a BMP-2 foi isolada a partir de matriz óssea bovina desmineralizada. Contudo, para isolar poucos microgramas de BMP-2, são necessários quilogramas de matriz óssea bovina, tornando o processo laborioso e de alto custo financeiro 40. Devido a essa lentidão, houve um estímulo para o uso de técnicas de Biologia Molecular, com clonagem dos genes em sistemas de culturas de células em larga escala 40. Para ser produzida por recombinação de DNA, gerando réplica exata da proteína em larga escala e comercialmente acessível, são seguidos os seguintes passos: (identificação) - isolamento do gene específico para fazer a BMP, (recombinação) - o gene é inserido para produção de uma célula específica, (clonagem) - cópias de diversas células com o gene no seu DNA permitindo uma população celular homogênea, (criação e armazenamento do banco de células) - várias amostras armazenadas em câmaras controladas para futuros bancos de células, (imersão em meio nutricional) - células são inseridas num spinner flask para crescimento e produção de proteína, (transferência para um biorreator) - ambiente fechado e monitorado por computador em que se produz a proteína em larga escala, (purificação e nanofiltragem) - para segurança viral; e, por último, (controle de qualidade) - testes para garantir segurança, consistência e pureza antes da comercialização 30. Estudos têm se concentrado numa tendência de outras áreas, que é o uso de células-tronco, células-fonte ou stem cells. Possuem alto grau de diferenciação, capacidade de autorreprodução, geram células diferenciadas de vários tecidos. Há de se ressaltar a terapia celular por meio de transplantes de células totipotentes em doenças degenerativas, alterações de desenvolvimento e regeneração de tecidos. Espera-se na Odontologia, num futuro próximo, a regeneração dentinopulpar, periodontal, óssea e cartilaginosa da articulação temporomandibular 16.
Carreador é o meio que permite a fixação do infiltrado de BMP no sítio cirúrgico, conduzindo uma liberação gradual em determinado período de tempo, auxiliando a diferenciação, quimiotaxia e neoformação óssea às expensas dos osteoblastos, impedindo que células epiteliais e fibroblastos atuem como concorrentes da regeneração óssea guiada (ROG). Geralmente para manutenção do contorno ósseo que se pretende restaurar, telas de titânio parafusadas na região adjacente ao defeito, ajudam a osteopromoção e mantêm a arquitetuta, desde que não sofram deiscência de sutura e contaminação por exposição precoce ao meio bucal. Quanto à farmacocinética da RhBMP-2 durante a aposição óssea no defeito, é importante verificar as condições do microambiente, doses no material utilizado como carreador e os parâmetros geométricos 25. Dentre os três carreadores aprovados atualmente pela FDA incluem-se: a esponja absorvível de colágeno tipo I - ACS (Absorbable Collagen Sponge), matriz de colágeno tipo I derivada de osso e uma combinação de rhBMP-7 em matriz de colágeno particulado combinado com carboximetilcelulose 23. A concentração clínica utilizada pode ser reduzida a ponto de maximizar os efeitos terapêuticos locais e minimizar os efeitos sistêmicos indesejáveis. Assim, a descoberta de carreadores que tenham as propriedades de maior facilidade de aplicação, tridimensionais, altamente porosos, capacidade de fornecerem um espaço adequado para a regeneração, permitirem adesão celular, ajudarem a proliferação e diferenciação celular, serem reabsorvíveis e permitirem um controle da liberação das moléculas bioativas (biocompatíveis); é imprescindível 13,28. Testados como carreadores estão a ACS, a matriz óssea descalcificada, o ácido hialurônico, a matriz óssea bovina sem proteína, a hidroxiapatita, o fosfato de cálcio, o ácido polilático e o polimetilmetracrilato 28. Para JUNG et al. 15, o uso de matriz sintética de polietilenoglicol como carreador da rhBMP-2 contendo grânulos de hidroxiapatita e fosfatotricálcico preenchem os requisitos de carreador ideal para liberação lenta e gradual. No entanto, CALIXTO et al. 8, discordam que a mistura de BMPs associadas à hidroxiapatita microgranular absorvível sejam um carreador adequado a um sistema de liberação lenta compatível com uma neoformação óssea adequada. Logo, estudos que busquem o material carreador ideal e a dose necessária de rhBMP são decisivos para extrapolar os achados histológicos para uma efetiva melhora nos resultados clínicos 13.
A concentração correta da BMP ainda é controversa. Procura-se uma liberação, pelo fabricante, da rhBMP-2 no sítio que sofreu a perda óssea, como uma "liberação como dose de ataque" (burst release) 23. Os estudos realizados em fratura de tíbia e elevação do seio maxilar demonstraram que o rhBMP-2 na concentração de 1,5 mg/mL é mais eficaz quando comparada com a de 0,75 mg/mL 2,4,33. Como estimativa, a concentração de 1,5 mg/mL é 200.000 vezes a concentração fisiológica de BMP no osso nativo 12. Sabe-se que quanto maior o grau de pureza do material utilizado, melhor será a resposta do leito receptor do defeito ósseo 28,40. Conforme SOLOFOMALALA et al. 29, o crescimento de novo osso também é dose dependente, podendo ocorrer crescimento exagerado, edema e reabsorção caso a dose indicada não seja respeitada ou exceda a capacidade do carreador no local de tratamento (25). Apesar de relatos clínicos com poucas complicações graves nas regiões maxilofacial e ortopédica, com demonstração de benefícios da rhBMP-2 nos casos in label; efeitos colaterais como edema, seroma, reações alérgicas locais, perda do enxerto, infecções, complicações no reparo e aumentado risco de câncer têm sido associados a elevadas doses de BMP 14,36. Principalmente devido à proteólise significativa durante o pós-cirúrgico com consequente eliminação pelo organismo 14,22,36. Estudos realizados sobre artrodese de vértebras comparando rhBMP-2 com enxerto de osso autógeno da crista do ilíaco demonstraram discrepâncias de estudos apresentados como de alto impacto e baseados em evidência científica, anteriormente pela FDA. Efeitos adversos como inflamação precoce e tardia, problemas geniturinários e até ejaculação retrógrada foram encontrados com maior índice de frequência em casos de procedimentos médicos de fusão lombar anterior (artrodese). Até aqui procedimentos realizados em Ortopedia, no entanto, a FDA lançou uma carta recomendando a não utilização do rhBMP-2 nas vértebras cervicais, devido ao edema de tecidos moles, podendo ocasionar fechamento da glote, região próxima da de atuação do cirurgião-dentista 10.
Em Implantodontia, Cirurgia Bucomaxilofacial e Periodontia as BMPs têm sido usadas após exodontias, entre as paredes ósseas alveolares do terço cervical e o implante (espaço denominado diastase); no enxerto de levantamento do seio maxilar (indicações in label) 27; mas também em "extrapolações" off label, como: após ressecções tumorais benignas, defeitos de excisões neoplásicas, mutilações decorrentes de osteomielites, acidentes automobilísticos e balísticos traumáticos, fendas palatinas congênitas, reabsorções maxilo-mandibulares, sequelas de doenças periodontais e exposição de roscas do implante advindas de técnica incorreta ou peri-implantite, entre outras. Na Medicina, destacam-se os tratamentos da espondilose, aceleração da consolidação de fraturas de não união em ossos longos, reconstrução de ligamentos em Ortopedia, pseudoartrose, aplicações regenerativas, entre outras 25,27. A FDA refere como contraindicação absoluta o emprego do rhBMP-2 durante a gestação, pois tem efeito durante o desenvolvimento embrionário e atravessa a placenta, assim também as mulheres não devem engravidar até um ano após uso. Também contraindicadas nos pacientes com hipersensibilidade ao colágeno bovino tipo I e nas reconstruções ósseas advindas de defeitos oriundos de patologia neoplásica maligna. Tal fato concorda que as BMPs (lembre-se que são pleiotrópicas) participam de eventos não só na embriogênese e na angiogênese, sobretudo, na carcinogênese, pois são liberadas nos fatores de necrose de células tumorais (TNF) 25.
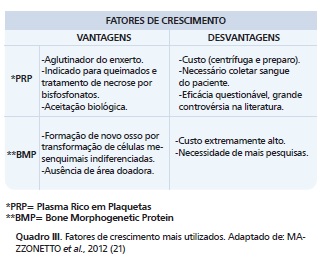
Em todas essas modalidades o alto custo dificulta ou incapacita tentativas e resultados; que, apesar de promissores acabam sendo limitados pela onerosidade 13,14,22,23,24,25,27,28. Para uma ideia, a consulta ao fabricante da marca mais conhecida de rhBMP-2 para uso odontológico estima que 2.8 cc custa em torno de USD 3.500,00 (dólares americanos), 5.6 cc (2 vidros de 2.8 cc) custa em torno de USD 4.900,00 (dólares americanos) e o vidro de 8.0 cc custa em torno de USD 6.300,00 (dólares americanos), corroborado por PRAXL 25, em 2014 (Quadro 3).
Conclusão
Dentre as considerações pesquisadas, pôde-se apontar que:
- Na área de Implantodontia não há relatos de complicações severas quanto às propriedades tóxicas, imunogênicas ou carcinogênicas da rhBMP-2. Os benefícios apresentados e aspirações potenciais quanto à substituição do emprego do osso autógeno, homógeno, xenógeno ou mesmo aloplástico nas reconstruções ósseas em Implantodontia incentivam a busca e pesquisas por resultados mais profícuos.
- Carreadores que liberem o rhBMP-2 de forma lenta e controlada, fisiologicamente efetivos na regeneração óssea guiada, impedindo uma burst release que não ultrapasse a dose farmacocinética tóxica de 5,3 mg/Kg (25) são desejáveis para evitar proteólise excessiva e devem ser melhor investigados.
- A Engenharia Tecidual e a Engenharia Genética precisam desenvolver meios de produção em larga escala que viabilizem, por exemplo, o uso de células-tronco ou fontes celulares mais acessíveis que permitam rapidez e confiabilidade no processo produtivo.
- A utilização das BMPs em clínicas e hospitais públicos e privados oneram demais o sistema de saúde, havendo outras indicações e substitutos com relação custo/benefício mais vantajosa. Temos que aceitar que os estudos ainda não chegam a um consenso quanto aos protocolos ideais de indicação, intervenção, acompanhamento a médio e longo prazos, nem tão pouco conseguem estimar como prevenir o sobretratamento.
- A divulgação de informações a clínicos e pesquisadores ainda é controversa e causa vieses que dificultam uma melhor compreensão dos mecanismos fisiológicos e intervencionistas envolvidos no uso das BMPs.
Referências
1. ADELL, R, ERIKSSON, B, LEKHOLM, U, et al. Long-term follow-up study of osseointegrated implants in the treatment of totally edentulous jaw. Int J Oral Maxillofac Impl 1990;5(4):347-59. [ Links ]
2. BOYNE, PJ. Animal studies of application of rhBMP-2 in maxillofacial reconstruction. Bone 1996;19(1 Suppl.):83S-92S.
3. BOYNE, PJ. Application of bone morphogenetic proteins in the treatment of clinical oral and maxillofacial osseous defects. J Bone Joint Surg Am 2001;83 (A Suppl. 1 Pt 2):S146-S50.
4. BOYNE, PJ, MARX, RE, NEVINS, M, et al. A feasibility study evaluating rhBMP-2/absorbable collagen sponge for maxillary sinus floor augmentation. Int J Period Rest Dent 1997;17(1):11-25.
5. BOYNE, PJ, NAKAMURA, A, SHABAHANG, S. Evaluation of the long-term effect of function on rhBMP-2 regenerated hemimandibulectomy defects. Br J Oral Maxillofac Surg 1999;37(5):344-52.
6. BOYNE, PJ, NATH, R, NAKAMURA, A. Human recombinant BMP- 2 in osseous reconstruction of simulated cleft palate defects. Br J Oral Maxillofac Surg 1998;36(2):84-90.
7. BRÅNEMARK, P-I, ZARB, GA, ALBREKTSSON, T. Tissue-integrated prostheses. Osseointegration in clinical dentistry. Chicago: Quintessence Publishing, 1985, p. 350.
8. CALIXTO, RFE, et al. Bovine BMPs and alveolar bone healing 29 alveolar wound healing after implantation with a pool of commercially available bovine bone morphogenetic proteins (BMPs). A histometric study in rats. Braz Dent J 2007;18(1):29-33.
9. CAMPISI, P, et al. Expression of bone morphogenetic proteins during mandibular distraction osteogenesis. Plastic and Reconst Surg 2003;111(1): 201-8.
10. CARREIRA, AC, LOJUDICE, FH, HALCSIK, E, et al. Bone morphogenetic proteins: facts, challenges and future perspectives. J Dent Res 2014;93:335-45.
11. CARVALHO, PSP, BASSIA, APF, VIOLIN, LA. Revisão e proposta de nomenclatura para os biomateriais. Implant News 2004:1(3):256-61.
12. CHIN, M, et al. Repair of alveolar clefts with recombinant human bone morphogenetic protein (rhBMP-2) in patients with clefts. The J Craniofacial Surg 2005;16(5):778-89.
13. DAUDT, EB. Uso de rhBMPs em reconstruções alveolares para implantes: revisão sistemática de literatura. RS, 2012, 38p. Trabalho de conclusão de curso (graduação) – FO/UFRS.
14. FREITAS, RM, NETO, RS, MARCANTONIO, C, et al. O uso de rhBMP-2 para aumento ósseo maxilar: relato de caso clínico. Rev APCD, 2012; 66(2):110-7.
15. JUNG, RE, et al. Bone morphogenetic protein-2 enhances bone formation when delivered by a synthetic matrix containing hydroxyapatite/ tricalciumphosphate. Clin Oral Impl Res 2008; 19:188-95.
16. LEITE SEGUNDO, AV, VASCONCELOS, BCE. Células-tronco e Engenharia Tecidual: perspectivas de aplicação em Odontologia. Rev Ciênc Méd; 2007;16(1):23-30.
17. MAGINI, RC, et al. Bioengenharia aplicada à Implantodontia. In: TOESCAN, FF, BECHELLI, A, ROMANELLI, H. (Coord.). Implantodontia Contemporânea: Cirurgia e Prótese. São Paulo: Artes Médicas, 2005; p. 467-95.
18. MARX, RE, GARG, AK. Bone structure, metabolism and physiology: Its impact on dental Implantology Impl Dent 1998;7(4):267-76.
19. MAZZONETTO, R, NASCIMENTO, FFA. O uso da Proteína Morfogenética Recombinante Humana (rhBMP-2) na Implantodontia. In: ZÉTOLA, A, SHIBLI, JA, JAYME, SJ. (Coord.). Implantodontia Clínica Baseada em Evidência Científica: ABROSS 2010 – IX Encontro Internacional da Academia Brasileira de Osseointegração. São Paulo: Quintessence, 2010. P. 277-84.
20. MAZZONETTO, R, OLIVEIRA, NK, NÓIA, CF et al. Biomateriais: conceitos e aplicações. In: MAZZONETTO, R; NETTO, H D, NASCIMENTO, FF. Enxertos ósseos em Implantodontia. São Paulo: Napoleão; 2012, p. 78-103.
21. MENDES, SM. Avaliação histológica e histomorfométrica do reparo de cavidades ósseas em tíbias de ratos preenchidas por osso desmineralizado ou por osso composto com e sem proteína morfogenética do osso (BMP). Rev Odontol Araçatuba 2006;27(1):34-40.
22. NAUMANN, SP. Utilização de proteína morfogenética humana (rhBMP) no tratamento de defeitos peri-implantares: revisão de literatura. PR, 2014, 38p. Monografia (Especialização em Implantodontia) – ILAPEO/CURITIBA.
23. OLIVEIRA, EMF, VITORINO, NS, FREITAS, PHL, et al. Uso de proteínas recombinantes na reconstrução de maxilares. RGO, 2011;59(3):491-6.
24. PACHECO, CR, CAMPOLI, MA, GOMES, SSR, et al. Implantes dentários recobertos com proteína morfogenética óssea recombinante humana tipo-2. RGO, 2010; 58(3): 333-7.
25. PRAXL, DS. A utilização das BMP-2 em estratégias de regeneração do tecido ósseo. Portugal: Porto, 2014, 29p. Dissertação (Mestrado) – Faculdade de Medicina Dentária/ Universidade do Porto.
26. RENGACHARY, SS. Bone morphogenetic proteins: basic concepts. Neurosurg. Focus. 2002; 13 (6): 1-10. American Association of Neurological Surgeons. Disponível em: http://www.medscape.com/viewarticle/ 446738_3. Acesso em: 19/02/2015.
27. SANCHES, JF. Biomateriais substitutos ósseos na Implantodontia. AM, 2010, 49p. Monografia (Especialização em Implantodontia) – FUNORTE/ SOEBRAS Núcleo Manaus.
28. SILVA, P. A utilização das proteínas morfogenéticas ósseas (BMPs) na Implantodontia. RS, 2011, 34p. Monografia (Especialização em Implantodontia) – UNINGÁ/INGÁ.
29. SOLOFOMALALA, GD, GUERY, M, LESIOURD, A, et al. Bone morphogenetic proteins: from their discoveries till their clinical applications. Eur J Orthop Surg Traumatol 2007; 17:609-15.
30. SPAGNOLI, DB, SANTOS, SE, MOREIRA, RWF, et al. A utilização da proteína óssea recombinante humana nas reconstruções ósseas. In: MAZZONETTO, R, NETTO, HD, NASCIMENTO, FF. Enxertos ósseos em Implantodontia. São Paulo: Napoleão, 2012; p. 436-69.
31. SYKARAS, N, OPPERMAN, LA. Bone morphogenetic proteins (BMPs): How do they function and what can they offer the clinician? J Oral Science 2003;45(2):57-73.
32. TORIUMI, DM, KOLTER, HS, LUXENBERG, DP et al. Mandibular reconstruction with a recombinant bone-inducing factor. Functional, histologic, and biomechanical evaluation. Arch Otolaryngol Head Neck Surg 1991:117: 1110-2.
33. URIST, MR. Bone: formation by autoinduction. Science.1965:150 (698):893-9.
34. WILLIAMS, DF. Definitions in biomaterials. Proceedings of a consensus conference of the european society for biomaterials, vol. 4. Chester, England, March 3-5 1986. New York: Elsevier, 1987.
35. WILLIAMS, KR, BLAYNEY, AW. Tissue response of several polymeric materials implanted in the rat middle ear. Biomaterials. 1987; 8(4): 254-8.
36. WOO, E. J. Adverse events reported after the use of recombinant human bone morphogenetic protein 2. J Oral Maxillofac Surg 2012;70(4):765-7.
37. WOZNEY, JM. BMPs: Roles in bone development and repair. In: Proceedings of the Portland Bone Symposium. Portland, OR: Aug 2-5 1995.
38. WOZNEY, JM. Bone morphogenetic proteins and their gene expression. In: NODA, M. Cellular and Molecular Biology of bone. San Diego, CA: Academic Press; 1993, p. 131-167.
39. WOZNEY, JM, ROSEN, V, CELESTE, AJ, et al. Novel regulators of bone formation: Molecular clones and activities. Science. 1988;242(4885): 1528-35.
40. ZÉTOLA, A, PEREIRA, LAV. Proteína Óssea Morfogenética: do básico à aplicabilidade clínica. In: ZÉTOLA, A, SHIBLI, JA, JAYME, SJ. (Coord.). Implantodontia Clínica Baseada em Evidência Científica: ABROSS 2010 – IX Encontro Internacional da Academia Brasileira de Osseointegração. São Paulo: Quintessence, 2010. p. 285-297.
 Endereço para correspondência:
Endereço para correspondência:
Luciano Bonatelli Bispo
Av. Doutor Bernardino Brito Fonseca de Carvalho, 1.661
apto. 126 - Torre 2 Vila Matilde, São Paulo/SP, Brasil
CEP: 03535-000
e-mail: lbbispo@ig.com.br
Recebido em 15/07/2014
Aprovado em 15/08/2014













