Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista Brasileira de Odontologia
versão On-line ISSN 1984-3747versão impressa ISSN 0034-7272
Rev. Bras. Odontol. vol.73 no.3 Rio de Janeiro Jul./Set. 2016
ARTIGO DE REVISÃO DE LITERATURA/PERIODONTIA
A relação entre doença periodontal e o câncer oral
The relationship between periodontal disease and oral cancer
Vitor de Toledo StuaniI; Adriana Campo Passanezi Sant'AnaI; Luiz Alberto Valente Soares JuniorII; Paulo Sérgio da Silva SantosIII
I Departamento de Prótese e Periodontia, Disciplina de Periodontia, Faculdade de Odontologia de Bauru, Universidade de São Paulo, Bauru, São Paulo, Brasil
II Divisão de Odontologia, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, Brasil
III Departamento de Cirurgia, Estomatologia, Patologia e Radiologia, Disciplina de Estomatologia, Faculdade de Odontologia de Bauru, Universidade de São Paulo, Bauru, São Paulo, Brasil
RESUMO
Objetivo: O objetivo deste artigo foi revisar os dados na literatura sobre possíveis mecanismos que estabeleçam uma relação entre o câncer oral e a doença periodontal. Material e Métodos: Foi realizada uma busca nas bases de dados Pubmed, Scopus e Web of Science por publicações até abril de 2016. Resultados: Os artigos analisados apontaram evidências que corroboram com o papel da doença periodontal na carcinogênese. Esta atuação baseia-se na liberação de mediadores inflamatórios e de periodontopatógenos das bolsas periodontais até sítios sadios através do sangue e da saliva, sendo capaz alterar o padrão epigenético do hospedeiro. Em consequência, esta alteração na expressão gênica pode inibir regiões relacionadas à supressão tumoral, crescimento celular, reparo do DNA, ligação intracelular, inibição de metástase, entre outros. Conclusão: É possível concluir que há bases biológicas para sustentar uma relação entre doença periodontal e o câncer oral, porém mais estudos são necessários para avaliar seu real impacto.
Palavras-chave: Periodontite; Neoplasias malignas orais; Periodontia.
ABSTRACT
Objective: The aim of this article was to review the extant literature about possible mechanisms for a relationship between periodontal disease and oral cancer. Material and Methods: A search was performed using PubMed, Scopus, and Web of Science for articles published through April 2016. The articles showed evidence supporting the role of periodontal disease in carcinogenesis. Results: The relationship between periodontal disease and oral cancer is based on the release of inflammatory mediators and periodontopathogens from periodontal pockets to healthy sites via the blood and saliva, thereby changing the host's epigenetic patterns. Consequently, these changes in gene expression can inhibit genetic regions related to tumor suppression, cell growth, DNA repair, intracellular binding, and inhibition of metastasis, among other processes. Conclusion: There is sufficient biological evidence to support the relationship between periodontal disease and oral cancer; however, more studies are needed to evaluate the impact of this relationship on patients.
Keywords: Oral malignant neoplasms; Periodontics.
Introdução
A progressiva produção científica possibilitou o entendimento de diversas enfermidades da mucosa oral, porém ainda hoje os mecanismos que regem a instalação e progressão da doença periodontal (DP) não são plenamente compreendidos. No entanto, a literatura é praticamente uníssona ao identificar que sua natureza deriva de um processo inflamatório desencadeado e perpetuado pela presença de biofilme dental composto, em sua maioria, por bactérias anaeróbicas Gram negativas.1 Também se sabe que variados agentes podem influenciar seu estabelecimento e progressão, como fatores genéticos, epigenéticos, medicamentosos e ambientais.2 Como consequência direta, a DP leva à perda contínua da inserção dental, observável clinicamente através do aumento da profundidade de sondagem, da recessão ou de ambos.
De modo menos evidente que estas manifestações orais, vários achados das últimas décadas apontam evidências para um efeito sistêmico, expandindo assim a antiga noção de restrição dos efeitos da doença ao ambiente oral. A principal justificativa que fundamentou a busca por associações entre desordens sistêmicas e o desarranjo periodontal está no cenário fornecido pela periodontite, que possibilita o transporte de mediadores inflamatórios e patógenos periodontais via sangue e saliva da região das bolsas periodontias até sítios saudáveis. Assim, vários estudos observaram com sucesso uma relação entre a presença da DP e outras desordens, como doenças cardiovasculares, diabetes, osteoporose, malformações neonatais e até mesmo o câncer.3,4
O termo câncer é usado de forma ampla para nomear o conjunto de doenças caracterizado pelo crescimento e proliferação descontrolada de células anormais.5 Dentre estes, denomina-se câncer de cabeça e pescoço aqueles que acometem as regiões de cavidade oral, cavidade nasal, laringe e faringe.6 São considerados os principais agentes etiológicos comuns a estes tipos de tumores a exposição ao tabaco e uso abusivo de álcool, mas outros fatores de risco já foram listados na literatura, como o hábito de mascar bétele, a exposição a químicos carcinogênicos, HPV, idade avançada, gênero, mediadores inflamatórios e a higiene oral deficitária.7 No entanto, a predisposição genética possui grande representatividade sobre o efeito destes carcinogênicos, fazendo com que apenas parte da população exposta a estes agentes desenvolva a doença.8 Visto que a DP é capaz de induzir a alterações na expressão gênica,9-12 é plausível o seu potencial de influenciar o risco de desenvolvimento e progressão tumoral. Assim, esta revisão foi elaborada para esclarecer os possíveis mecanismos que regem a associação entre DP e o câncer oral.
Material e Métodos
Foi realizada uma busca nas bases de dados PUBMED, SCOPUS e Web of Science por publicações de todos os anos até abril de 2016, articulando as palavras chaves "periodontitis", "head and neck", "oral", "cancer" e "neoplasm" por meio dos operadores booleanos (AND, OR). Não foi adotada restrições de idioma ou tipo de publicação. Foram incluídos na revisão estudos laboratoriais e clínicos que analisassem possíveis mecanismos para sustentar uma relação entre a doença periodontal e o câncer oral.
Revisão de Literatura
• A Epigenética e a Expressão Gênica
Os primeiros passos no campo da epigenética foram dados por Waddington no início da segunda metade do século XIX ao tentar justificar a origem da variedade de fenótipos celulares presentes em um mesmo organismo e, assim, compartilhando do mesmo material genético.13,14 O motivo da variabilidade estaria atrelado à quais desses genes estão expressos ou não em cada tipo de célula devido a uma série de alterações epigenéticas. Assim, o epigenoma pode ser definido como o conjunto de alterações químicas no DNA e proteínas associadas que levam à reorganização da cromatina sem alterar sua codificação, sendo a ativação e inibição dos genes uma consequência do processo.11
Os eventos epigenéticos ocorrem naturalmente desde o período embrionário, porém também podem ser desencadeados por influências externas ao longo da vida.9,11 As principais modificações no epigenoma são a metilação e acetilação das histonas e a metilação do DNA (Figura 1).15 Estes processos podem favorecer o desenvolvimento e manutenção de cânceres, doenças autoimunes e inflamatórias, como a periodontite.11
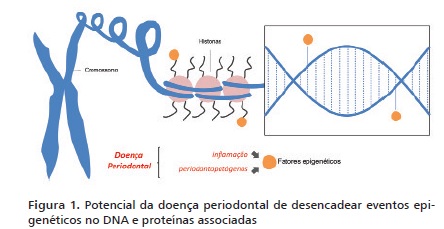
A carcinogênese inicia-se a partir de uma série de acúmulos de alterações no material genético celular que resulta no comprometimento de suas funções. Os eventos epigenéticos resultantes da exposição a agentes pró-oncogênicos permitem estas alterações no painel genômico, determinando a expressão ou supressão de certos genes.16 Na maioria dos tumores é notada uma hipometilação global do DNA associada à hipermetilação de genes promotores específicos.17 Estes genes inibidos geralmente estão relacionados à supressão tumoral, crescimento celular, reparo do DNA, ligação intracelular, inibição de metástase, entre outros.18
• A Epigenética na Doença Periodontal
Recentemente, a epigenética também tem sido explorada para preencher lacunas na compreensão dos mecanismos que regem a DP (Figura 1).9-12 Como se sabe, a DP é resultado de uma complexa interação entre os estímulos dos periodontopatógenos e a resposta inflamatória do hospedeiro. Visto que a resposta inflamatória é um reflexo do painel gênico de um indivíduo, pois este codifica a expressão de mediadores inflamatórios, o modo como estes genes estão ou não ativados pode ser orientado por eventos epigenéticos. A própria inflamação da periodontite pode promover metilações no DNA que irão contribuir para a progressão da doença.10
Zhang et al.19 observaram hipermetilações em áreas controladoras da diferenciação celular, da apoptose, da oncogênese e da adesão celular no tecido gengival inflamado de pacientes com periodontite crônica quando comparado a tecidos sadios de indivíduos saudáveis. Além disto, também foram observadas alterações importantes na região responsável pela expressão de IFN-γ. Outros eventos epigenômicos também parecem conduzir a DP por meio da expressão de mediadores inflamatórios ao longo da progressão da doença, como a hipometilação em áreas promotoras dos genes responsáveis pela expressão da IL-8 e IL-6, e a hipermetilação em áreas promotoras do TNF-α, COX-2 e do gene TLR2, que apresenta uma correlação positiva com a profundidade de sondagem.20-24
A ação dos periodontopatógenos também pode desencadear alterações epigenéticas. Yin et al.25 compararam os efeitos da infecção de células epiteliais gengivais com P. gingivalis e Fusobacterium nucleatum, concluindo que as células epiteliais respondem a diferentes bactérias com eventos epigênicos em genes distintos.
Miao et al.26 notaram que a Treponema denticola levou à hipometilação do gene promotor relacionado à MMP-2 em células do ligamento periodontal. Larsson et al.27 observaram a estimulação resultante do lipopolissacarídeo de Escherichia coli, havendo aumento na acetilação das histonas H3 e H4 e na metilação das H3 no promotor de IL-10 de células B.
Em seus dois estudos, Imai et al.28,29 notaram que o patógeno periodontal Porphyromonas gingivalis produz altas concentrações de ácido butírico, favorecendo a acetilação de histonas. Outra ação atribuída às P. gingivalis foi a redução da transcrição nos queratinócitos de DNMT1, DNMT3a e histona desmetilase com domínio Jumonji 3 (JMJD3). O decréscimo de JMJD3 poderia levar a alterações no nível da transcrição de genes ligados à inflamação.30
• A Epigenética na Doença Periodontal
Recentemente, a epigenética também tem sido explorada para preencher lacunas na compreensão dos mecanismos que regem a DP (Figura 1).9-12 Como se sabe, a DP é resultado de uma complexa interação entre os estímulos dos periodontopatógenos e a resposta inflamatória do hospedeiro. Visto que a resposta inflamatória é um reflexo do painel gênico de um indivíduo, pois este codifica a expressão de mediadores inflamatórios, o modo como estes genes estão ou não ativados pode ser orientado por eventos epigenéti-
A inflamação e o Câncer Oral
A inflamação é um mecanismo de defesa não específico desencadeado por danos teciduais de qualquer natureza.31 Este painel formado pela constante renovação celular e presença de agentes pró e anti-inflamatórios e espécies reativas de oxigênio e nitrogênio podem causar danos ao DNA e/ou alterações na expressão gênica. A instabilidade resultante pode favorecer tanto a transformação inicial de células neoplásicas quanto a progressão do tumor.32 Já é aceito que a inflamação crônica representa um fator de risco importante para o desenvolvimento e progressão de neoplasias, sendo esta relação notada em, aproximadamente, uma em cada quatro manifestações da doença.33 Esta influência pode se manifestar em vários eventos, como na transformação celular e na progressão, sobrevivência, invasão, angiogênese e metástase do tumor.34
O ambiente oral é propício ao estresse inflamatório, visto que mantém contato constante com agentes irritantes e carcinogênicos, como micro-organismos, o tabaco e o álcool.35 Algumas condições inflamatórias orais já foram associadas com a patogênese do carcinoma espinocelular em cabeça e pescoço, como a fibrose submucosa, o líquen plano, o lúpus eritematoso discoide e a doença periodontal crônica.32 No entanto, como a presença de lesões orais crônicas é muito superior à do câncer oral, fica claro que apenas em poucos casos apresentam possibilidade de induzir à carcinogênese.32 Ainda assim, qualquer risco em potencial merece atenção.
A DP em suas manifestações mais graves instaura uma significativa carga inflamatória no organismo. A despeito de sua natureza localizada, concentrações elevadas de marcadores inflamatórios podem ser encontrados no sangue de pacientes com periodontite, ampliando seu campo de influência. 36 Nos casos de todos os cânceres de cabeça e pescoço, a saliva também parece desempenhar um importante papel na interação e mobilidade anatômica dos carcinogênicos. Além de atuar como meio para a dispersão destes produtos, ainda favorece a origem de novos agentes agressores através da metabolização do tabaco, do álcool e de componentes alimentares por meio de enzimas salivares. Somando-se a isto, também é um veículo para as citocinas inflamatórias, bactérias e vírus originados das bolsas periodontais.37,38 Esta atuação transportadora pode ser intuída ao observar que mais de 75% dos cânceres de cabeça e pescoço ocorrem em áreas de drenagem salivar.39
A produção persistente de citocinas, quimiocinas, radicais livres, prostraglandina, fatores de crescimento, metaloproteinases, enzimas como a ciclooxigenase e outros sinalizadores criam um ambiente propício ao acúmulo de mutações das células epiteliais, também auxiliando na sobrevivência, proliferação, migração, angiogênese e inibição de apoptose das células malignas.34,40 Já foi observado que a IL-6 induzida pela inflamação crônica pode ocasionar a hipermetilação de genes supressores tumorais através da indução transcripcional e estabilização da DNA metiltransferase- 1, uma enzima relacionada ao status e metilação do DNA.41 A interleucina 6 também apresenta o potencial de induzir à hipometilação global das sequências do LINE-1.35 Além disto, os mediadores inflamatórios também são capazes de estimular os fatores de transcrição STAT-3, AP-1 e NF-κB, que por sua vez podem ativar oncogênese e a produção de mais produtos da inflamação, como citocinas e prostaglandinas.32
Outra maneira de observar a ação da inflamação sobre o câncer é através da inibição dos mediadores inflamatórios, que pode coibir o desenvolvimento de cânceres experimentais. 42 De forma semelhante, a supressão de genes inflamatórios altera a susceptibilidade e gravidade da doença e o uso prolongado de anti-inflamatórios não esteroidais pode até mesmo reduzir o risco de alguns tumores.32
Os Periodontopatógenos e o Câncer Oral
Em sua revisão sistemática, Hooper et al.43 concluíram que há uma soma considerável de evidências para sugerir uma ligação epidemiológica e etiológica entre infecções orais e o câncer oral. Uma delas é contribuição de tipos bacterianos, como os Streptococci, no aumento da concentração oral de acetaldeídos.44 Em um estudo comparativo, indivíduos com má higiene oral apresentaram níveis de acetaldeído maiores do que aqueles com bons hábitos de escovação em um modelo ajustado quanto ao gênero, idade e consumo de álcool e fumo.45 A DP e um ambiente de pouca higiene oral também predispõem a níveis elevados de nitrosamina por conta da presença de bactérias redutoras de nitrato. Isto pode culminar na ativação de vias mitogênicas e antiapoptóticas nos queratinócitos e eventualmente contribuir para acarcinogênese.8
Niwa et al.46 analisaram a metilação em células gástricas cancerosas infectadas por Helicobacter pylori em gerbos. Entre a 5ª e 10ª semana após a infecção, iniciou-se um aumento no nível de metilação, atingindo seu ápice por volta da 50ª semana. Curiosamente, após a erradicação do H. Pylori, os níveis de metilação decresceram entre 10 e 20 semanas, mas ainda estavam superiores aos de células cancerosas nunca infectadas. Somando-se a isto, observaram que a utilização de ciclosporina para induzir à imunossupressão nas células infectadas bloqueou a indução de metilações aberrantes no DNA. Estes resultados evidenciaram que as mudanças epigenéticas dependem da infecção associada à resposta inflamatória, não somente do fator bacteriano.46
Células gástricas cancerosas também foram utilizadas por Huang et al.47, onde notaram um aumento do nível de metilação no gene de E-caderina após estimulação da Helicobacter pylori. A ação bacteriana induziu a eventos epigenômico via estimulação da IL-1β, que influencia a transcrição do gene NF- κB, resultando na ativação de DNA metiltransferase pela produção de óxido nítrico. Este processo possivelmente indica um papel do óxido nítrico na alteração epigenômica que liga inflamação à carcinogênese.
Outra possível explicação para a associação entre periodontite e desenvolvimento do carcinoma espinocelular é a invasão do tumor por Porphyromonas gingivalis, levando à indução da expressão de proMMP e sua ativação. Em um estudo de Inaba et al.48, a proMMP9 foi continuamente secretada por células de carcinoma espinocelular oral, enquanto que a infecção por P. gingivalis aumentou a expressão da pró-enzima, subsequentemente processando a ativação de MMP9 no sobrenadante, favorecendo a invasão celular. Além disso, P. gingivalis foi observada com células altamente invasivas, mas não com tipos pouco invasivos. Os resultados obtidos demonstraram que P. gingivalis ativam as vias do ERK1/2-Ets1, p38/HSP27, e PAR2/ NF-kB para induzir a expressão de proMMP9. Em seguida, a proMMP9 é ativada pelas gingipaínas bacterianas, levando à invasão celular pelas linhagens de carcinoma espinocelular oral.
A análise imuno-histoquímica conduzida por Katz et al.49 para investigar a presença de Porphyromonas gingivalis e Streptococcus Gordonii em biópsias de carcinoma de gengiva (n = 10) e gengival normal (n = 5) mostrou a presença das bactérias nas duas amostras, porém em níveis significativamente maiores (> 33%) nas amostras de carcinoma. A intensidade da marcação também foi aumentada significativamente em 2 vezes nas amostras de carcinoma, sugerindo potencial associação das bactérias com carcinoma gengival.
Também foi demonstrado que a P ginigivalis pode induzir à expressão dos receptores B7-H1 e B7-DC em células de carcinoma e queratinócitos gengivais humanos, facilitando o escape de neoplasias malignas orais. O receptor B7-H1 das células do hospedeiro pode influenciar a cronicidade de desordens inflamatórias que frequentemente precedem o desenvolvimento do câncer em humanos.50
Assim, vários achados biológicos evidenciam que há plausibilidade na relação entre a DP e neoplasias malignas, cabendo a realização de mais estudos para investigar a profundidade deste elo.
Conclusão
Diversos estudos sugerem que o processo infeccioso-inflamatório da DP é capaz de engatilhar complexas reações envolvendo mediadores da inflamação e micro-organismos que podem afetar o painel de expressão gênica do indivíduo, influenciando o risco de desenvolvimento tumoral e a progressão subsequente do câncer oral. No entanto, para total compreensão do processo, ainda são necessários mais estudos.
Referências
1. Page RC, Eke PI. Case definitions for use in population-based surveillance of periodontitis. J Periodontol. 2007;78(7 Suppl):1387-99. [ Links ]
2. Meyle J, Chapple I. Molecular aspects of the pathogenesis of periodontitis. Periodontol 2000. 2015;69(1):7-17.
3. Tezal M, Sullivan MA, Hyland A, et al. Chronic periodontitis and the incidence of head and neck squamous cell carcinoma. Cancer Epidemiol Biomarkers Prev. 2009;18(9):2406-12.
4. Kim J, Amar S. Periodontal disease and systemic conditions: a bidirectional relationship. Odontology. 2006;94(1):10-21.
5. American Cancer Society. Cancer facts & Figures 2015. Atlanta: American Cancer Society 2015.
6. Thompson LDR, Brennan P, Pinto LFR. Head and neck cancers. In: Stewart BW, Christopher PW, editors. World Cancer Report 2014. Lyon: IARC Press; 2014. p. 422-30.
7. Lacko M, Braakhuis BJ, Sturgis EM, et al. Genetic susceptibility to head and neck squamous cell carcinoma. Int J Radiat Oncol Biol Phys. 2014;89(1):38-48.
8. Choi S, Myers JN. Molecular pathogenesis of oral squamous cell carcinoma: implications for therapy. J Dent Res. 2008;87(1):14-32.
9. Barros SP, Offenbacher S. Epigenetics: connecting environment and genotype to phenotype and disease. J Dent Res. 2009;88(5):400-8.
10. Gomez RS, Dutra WO, Moreira PR. Epigenetics and periodonal disease: future perspectives. Inflamm Res. 2009;58(10):625-9.
11. Larsson L, Castilho RM, Giannobile WV. Epigenetics and its role in periodontal diseases: a state-of-the-art review. J Periodontol. 2015;86(4):556-68.
12. Lindroth AM, Park YJ. Epigenetic biomarkers: a step forward for understanding periodontitis. J Periodontal Implant Sci. 2013;43(3):111-20.
13. Waddington CH. Canalization of development and genetic assimilation of acquired characters. Nature. 1959;183(4676):1654-5.
14. Waddington CH. Genetic assimilation. Adv Genet. 1961;10:257-93.
15. Wilson AG. Epigenetic regulation of gene expression in the inflammatory response and relevance to common diseases. J Periodontol. 2008;79(8 Suppl):1514-9.
16. Wood RD, Mitchell M, Lindahl T. Human DNA repair genes, 2005. Mutat Res. 2005;577(1-2):275-83.
17. Jeltsch A, Jurkowska RZ. New concepts in DNA methylation. Trends Biochem Sci. 2014;39(7):310-8.
18. Diez-Perez R, Campo-Trapero J, Cano-Sanchez J, et al. Methylation in oral cancer and pre-cancerous lesions (Review). Oncol Rep. 2011;25(5):1203-9.
19. Zhang S, Crivello A, Offenbacher S, et al. Interferon-gamma promoter hypomethylation and increased expression in chronic periodontitis. J Clin Periodontol. 2010;37(11):953-61.
20. Oliveira NF, Damm GR, Andia DC, et al. DNA methylation status of the IL8 gene promoter in oral cells of smokers and non-smokers with chronic periodontitis. Journal Clin Periodontol. 2009;36(9):719-25.
21. Ishida K, Kobayashi T, Ito S, et al. Interleukin-6 gene promoter methylation in rheumatoid arthritis and chronic periodontitis. J Periodontol. 2012;83(7):917-25.
22. Zhang S, Barros SP, Moretti AJ, et al. Epigenetic regulation of TNFA expression in periodontal disease. J Periodontol. 2013;84(11):1606-16.
23. Loo WT, Jin L, Cheung MN, et al. Epigenetic change in E-cadherin and COX-2 to predict chronic periodontitis. J Transl Med. 2010;8:110.
24. De Faria Amormino SA, Arao TC, Saraiva AM, et al. Hypermethylation and low transcription of TLR2 gene in chronic periodontitis. Hum Immunol. 2013;74(9):1231-6.
25. Yin L, Chung WO. Epigenetic regulation of human beta-defensin 2 and CC chemokine ligand 20 expression in gingival epithelial cells in response to oral bacteria. Mucosal Immunol. 2011;4(4):409-19.
26. Miao D, Godovikova V, Qian X, et al. Treponema denticola upregulates MMP-2 activation in periodontal ligament cells: interplay between epigenetics and periodontal infection. Arch Oral Biol. 2014;59(10):1056- 64.
27. Larsson L, Thorbert-MRO SS, Rymo L, et al. Influence of epigenetic modifications of the interleukin-10 promoter on IL10 gene expression. Eur J Oral Sci. 2012;120(1):14-20.
28. Imai K, Ochiai K, Okamoto T. Reactivation of latent HIV-1 infection by the periodontopathic bacterium Porphyromonas gingivalis involves histone modification. J Immunol. 2009;182(6):3688-95.
29. Imai K, Inoue H, Tamura M, et al. The periodontal pathogen Porphyromonas gingivalis induces the Epstein-Barr virus lytic switch transactivator ZEBRA by histone modification. Biochimie. 2012;94(3):839-46.
 Endereço para correspondência:
Endereço para correspondência:
Vitor de Toledo Stuani
e-mail: vitortoledo@usp.br
Recebido: 17/06/2016
Aceito: 21/07/2016