Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RPG. Revista de Pós-Graduação
versão impressa ISSN 0104-5695
RPG, Rev. pós-grad. vol.17 no.3 São Paulo Jul./Set. 2010
ARTIGOS ORIGINAIS ORIGINAL ARTICLES
Análise morfológica e morfométrica da camada híbrida formada por adesivo autocondicionante na presença de sangue
Morphological and morphometrical analisys of a self-etching adhesive system hybrid layer formed in the presence of blood
Ellen Cristina de Carvalho MendonçaI; Sergio Brossi BottaII; Maria Cecília Barbosa da Silveira SalvadoriIII; Adriana Bona MatosIV
IMestre em Dentística pela Faculdade de Odontologia da Universidade de São Paulo (FOUSP), São Paulo/SP
IIDoutor em Dentística pela Faculdade de Odontologia da Universidade de São Paulo (FOUSP), São Paulo/SP
IIIProfessora Associada do Instituto de Física da Universidade de São Paulo (USP), São Paulo/SP
IVProfessora Associada do Departamento de Dentística da Faculdade de Odontologia da Universidade de São Paulo (FOUSP), São Paulo/SP
RESUMO
Este estudo objetivou analisar, por meio de microscopia eletrônica de varredura (MEV), a interface adesiva de restaurações realizadas com sistema adesivo autocondicionante de dois passos (Clearfill SE Bond, Kuraray Co., Ltd., Osaka, Japão), contaminadas por sangue em dois momentos diferentes, recebendo essa contaminação dois tratamentos distintos. Quinze molares humanos foram divididos em cinco grupos experimentais (n = 3): G1 – controle (sem contaminação); G2 – contaminação antes do primer, com lavagem e secagem; G3 – contaminação antes do primer com secagem; G4 – contaminação após bond fotopolimerizado com lavagem e secagem; G5 – contaminação após bond fotopolimerizado com secagem. Os dentes tiveram sua superfície oclusal seccionada e lixada para obtenção de dentina plana. Os espécimes foram contaminados, de acordo com os grupos experimentais, e então foram restaurados e preparados para análise em MEV. Os resultados obtidos foram descritos de duas formas: análise morfológica, na qual foram observadas alterações na formação da camada híbrida (CH) em grupos com a presença do contaminante, e análise morfométrica, em que os dados foram analisados estatisticamente, e pode-se constatar uma relação entre a presença do contaminante e a diminuição do tamanho de tags, em µm, quando comparados ao grupo controle (p < 0,05). Adicionalmente, foi observado que o tratamento de lavagem com água não foi suficiente para restabelecer a formação de CH semelhante à observada em G1.
Descritores: Contaminação. Dentina. Sangue. Adesivos Dentários. Microscopia eletrônica de varredura.
ABSTRACT
This study aimed to analyze, by scanning electron microscopy (SEM), the interface of adhesive restorations performed with a two-step self-etching adhesive system (Clearfill SE Bond, Kuraray Co., Ltd.), contaminated with blood at two different times, receiving two different treatment to the contamination. Fifteen human molars were divided into five experimental groups (n = 3): G1 – control (no contamination); G2 – contamination before primer, with rinsing and drying treatment; G3 – contamination before primer with drying treatment; G4 – contamination after light curing bond, with rinsing and drying treatment; G5 – contamination after light curing bond with drying treatment. The teeth were then sectioned in the occlusion surface and polished in order to obtain a flat dentin. The specimens were subsequently contaminated, according to the experimental groups. Thus, they were restored and passed through preparation for SEM analysis. The results were described in two ways: morphological analysis, in which changes were observed in formation of hybrid layer (HL) of groups presenting the contaminant, and morphometric analysis, in which the data were analyzed statistically and an association between the presence of the contaminant and a decreasing size of tags, in µm, was found when compared to the control group (p < 0.05). Additionally, it was observed that treatment of washing with water was not sufficient to restore the formation of HL similar to that observed in G1.
Descriptors: Contamination. Dentin. Blood. Dental Adhesives. Microscopy, Electron, Scanning.
Introdução
O uso do isolamento absoluto é uma forma de controlar a umidade proveniente de fluidos bucais e impedir a contaminação do campo operatório. Entretanto, algumas situações clínicas dificultam a colocação do isolamento absoluto, por exemplo, em preparos cavitários nos quais a margem estende-se próximo à gengiva ou em nível subgengival21,22,24,28,31,33,41 e durante a restauração de lesões cervicais não cariosas ou lesões em raiz32. Adicionalmente, apenas um número aproximado de 17%15,34 dos profissionais usa o isolamento absoluto na prática clínica diária.
Estudos a respeito dos efeitos de diferentes contaminantes na adesão aos tecidos dentais2,14,18,24,26 mostram que a contaminação com plasma reduz a resistência de união (RU) em esmalte (33%) e dentina (70%).
Pesquisas recentes1,8,11,14,25,30,40 relatam que sistemas adesivos hidrofílicos são menos sensíveis à contaminação por saliva quando comparados aos agentes de união hidrofóbicos. Entretanto, os efeitos da contaminação por sangue nesses sistemas adesivos não estão completamente esclarecidos.
Os estudos sobre contaminação mostram resultados conflitantes1,4,7,10,13,17,19,23,24,27,39,40,42 e, assim, são de difícil comparação devido à variedade dos delineamentos experimentais. Essas variáveis podem ter grande importância na variação dos resultados de resistência de união obtidos17 – reforçando a dificuldade de obter consenso por meio da literatura.
Assim, novos estudos são necessários para investigar com maior profundidade as condições já descritas na literatura e, assim, obter um protocolo de conduta mais seguro para lidar com a contaminação.
Objetivo
Este trabalho objetivou analisar qualitativa e quantitativamente, pelo método de MEV, a influência da presença do contaminante na formação da camada híbrida quando da utilização de um sistema adesivo autocondicionante. Os tags resinosos foram quantificados quanto à sua frequência, densidade e comprimento.
Materiais e Método
Neste estudo in vitro foram utilizados 15 molares humanos permanentes provenientes do Banco de Dentes da Faculdade de Odontologia da Universidade de São Paulo (FOUSP). Este projeto foi aprovado pelo Comitê de Ética da FOUSP com parecer favorável número 101/08.
A totalidade da amostra (15 molares humanos) foi seccionada em sua face oclusal (Figura 1A) e, em seguida, a superfície de dentina foi planificada com auxílio de uma politriz automática (Ecomet 6/Automet 2 – Buehler Ltd., Lake Bluff, IL, EUA) com lixas de carbeto de silício (SiC) de granulação #120 a #400 (Buehler Ltd., Lake Buff, IL, EUA) (Figura 1B). O esfregaço padronizado foi obtido com a lixa de granulação #600, utilizada por 1 minuto35. Esses espécimes foram divididos segundo os grupos experimentais descritos na Tabela 1 (n = 3).
O sangue utilizado neste experimento foi obtido a partir de um único indivíduo. O sangue venoso foi coletado e imediatamente acondicionado em um tubo Vacuette (BD, São Paulo, SP) contendo heparina sódica, armazenado sob refrigeração em temperatura de 4ºC e utilizado em até 7 dias. A contaminação ocorreu de acordo com os grupos experimentais da Tabela 1. Foram utilizados 1,5 µL de sangue heparinizado40 de modo que toda a área preparada fosse recoberta pelo contaminante, permanecendo em contato com a superfície de dentina durante 30 segundos (Figura 1C). Em seguida, foram aplicados os tratamentos de acordo com a Tabela 1.
O sistema adesivo autocondicionante de dois passos Clearfill SE Bond (Kuraray Co., Ltd., Osaka, Japão) foi aplicado seguindo-se as orientações do fabricante, e todos os espécimes foram restaurados com um incremento de resina Flow (Filtek Flow Z350 – 3M ESPE, St. Paul, MN, EUA – Cor: A1 – Lote 7BA – Validade 07/2010) e 2 incrementos de resina composta (Filtek Z350 – 3M ESPE, St. Paul, MN, EUA – Cor: A2 Lote 8GU – Validade 05/2010) fotopolimerizados individualmente por 20 segundos (Figura 1D). Todos os espécimes foram armazenados em água destilada, em estufa a 37ºC, por 24 horas.
Findo esse período, os espécimes tiveram suas raízes seccionadas 2 mm abaixo da junção amelocementária (Figura 1E) e foi retirada a polpa de cada dente. Imediatamente após, foram imersos individualmente em solução de glutaraldeído 2,5% por 24 horas6,20, lavados com solução de tampão fosfato por 15 minutos, lavados com água destilada por 1 minuto e, então, novamente seccionados no sentido mesiodistal (Figura 1F).
As superfícies de interesse de cada metade dos espécimes foram lixadas com o auxílio da politriz automática com sequência de lixas dágua: #600, #1200, #4000, cada uma por 20 segundos, e polidas com pasta diamantada para polimento 3 µm (Buehler, Ltd., Lake Buff, IL, EUA) com disco de feltro por 10 segundos20. Os espécimes foram, então, imersos em água destilada e levados a cuba ultrassônica por 10 minutos, tendo sido esse tempo estabelecido em estudo piloto.
Ainda determinado por estudo piloto, foi realizado o condicionamento ácido da superfície de interesse aplicando-se ácido fosfórico 37% sobre a superfície de cada espécime individualmente por 30 segundos, para exposição dos tags de resina. Em seguida, os espécimes foram imersos individualmente em solução de hipoclorito de sódio 1% por 30 minutos e, então, lavados com água por 30 segundos20.
Após essas etapas, os espécimes foram imersos em solução de glutaraldeído 2,5% (SPI – CHEN – Spi supplies, West Chester, PA, EUA) por 2 horas para fixação e depois lavados com solução de tampão fosfato de sódio 0,1 M, pH 7,4 (Sigma-Aldrich, St Louis, MO, EUA) e, então, submetidos a sequência de desidratação em álcool, de concentração de 30% até absoluto6,19.
Para secagem dos espécimes foi utilizado hexadimetil disilazona (HMDS – Sigma-Aldrich, St. Louis, MO, EUA) por 10 minutos e, após 20 minutos, os espécimes foram secos com papel absorvente19.
Os espécimes metalizados foram levados ao microscópio eletrônico de varredura (JEOL 6460 – LV, Jeol Ltd., Tokio, Japão) para análise em aumento padronizado de 500X, sempre no centro de cada espécime, focalizando-se a camada híbrida logo acima da câmara pulpar. Como cada espécime foi dividido em duas metades e ambas foram analisadas, foi escolhida a imagem da metade que melhor representou o grupo experimental.
Após terem sido obtidas e selecionadas três fotomicrografias de cada grupo (uma de cada espécime), foram analisadas qualitativamente (análise morfológica) e quantitativamente (análise morfométrica) com o auxílio do software Microsoft® Office Power Point 2007 (Microsoft® Corp., Redmond, WA, EUA) por dois examinadores calibrados. Os dados provenientes da análise morfométrica foram avaliados estatisticamente pelo teste de análise de variância (ANOVA de um fator) seguida pelo teste de Tukey para comparação entre os grupos. A análise estatística foi realizada com o software Minitab (Minitab Inc., State College, PA, EUA), sendo que o nível de significância adotado foi o de 5% (p < 0,05).
Resultados
Análise morfológica
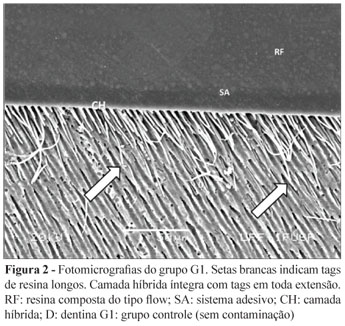
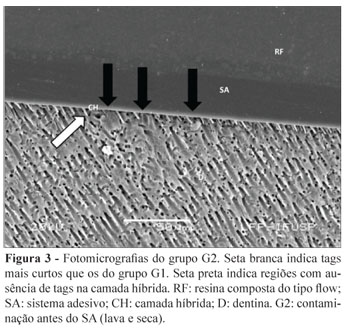
Nas fotomicrografias, podem-se observar os constituintes da interface dentina-resina: resina composta do tipo flow (RF), sistema adesivo (SA), camada híbrida (CH) e dentina (D).
No grupo G1 (controle) (Figura 2), observa-se a formação de CH íntegra, com presença de tags em toda sua extensão, tags longos e íntegros (seta branca), e o maior número de tags (densidade de tags/cm) ao longo da extensão da CH quando comparado aos demais grupos experimentais.
No grupo G2 (Figura 3), observam-se tags de resina mais curtos (seta branca) e em menor número quando comparados ao G1; observa-se também que não há formação de tags em toda extensão da CH (seta preta), como observado no grupo anterior.
No grupo G3 (Figura 4), foi observada CH homogênea semelhante ao grupo G1, quanto à presença constante de tags ao longo da CH, porém com tags em menor número. A principal diferença notada nesse grupo é a formação de tags curtos (seta branca).

No grupo G4 (Figura 5), observa-se uma irregularidade entre a camada de adesivo e RF (seta quadriculada), identificando-se que a falha ocorre no local onde foi depositado o contaminante. Nesse grupo, os tags de resina têm formação (seta branca) e frequência semelhante ao G3; entretanto, seu comprimento é maior. A CH e os tags de resina foram destacados da dentina (seta com listras verticais), deixando toda a extensão dessa falha sem formação de CH (seta preta).

No grupo G5 (Figura 6), observam-se tags curtos (seta branca). Em relação à formação da CH, há regiões desta sem a presença de tags de resina (seta preta). Ressalta-se neste grupo que a dimensão da falha observada entre o SA e a RF é maior do que as observadas no grupo G4, além da presença de resíduos.

Análise morfométrica
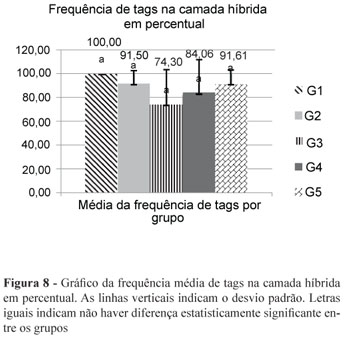
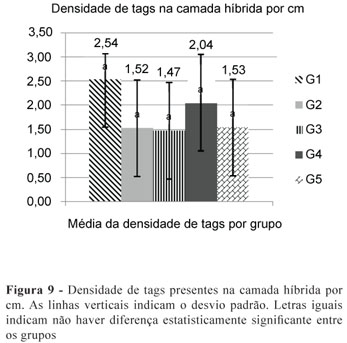
A Figura 7 ilustra a forma como os dados foram trabalhados por meio do Power Point, semelhantemente ao trabalho realizado por Geraldo Martins12. Os resultados da ANOVA de um fator indicaram não haver diferenças estatísticas significantes entre os grupos experimentais para as condições frequência de tags de resina (F = 0,75; p = 0,581) (Figura 8) e densidade de tags (F = 1,55; p = 0,261) (Figura 9). Contudo, houve diferença estatisticamente significante para a condição comprimento de tags (F = 5,71; p = 0,012) (Figura 10). Ao comparar os grupos entre si, detectou-se maior comprimento de tags para o grupo G1, no qual não houve contaminação, do que nos demais grupos experimentais (contaminados). Analisando-se as outras comparações pertinentes ao estudo, não se observou diferença entre os grupos contaminados, com todos apresentando tags de comprimento reduzido (Figura 10).
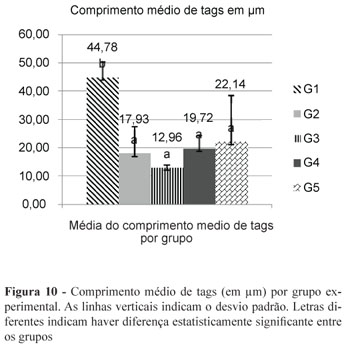
Discussão
A contaminação com sangue e saliva é uma questão importante durante o tratamento restaurador1,9, especialmente quando não é possível instalar o isolamento absoluto1,5,7,10,25,30,41. Preparos com margens subgengivais são considerados particularmente propensos a contaminação com sangue durante procedimentos clínicos21,22,24,28,31-33, o que pode levar à ocorrência de microinfiltração e cárie secundária7,10.
Autores1,11,24,25 postulam que o conteúdo proteico de alguns contaminantes pode impedir que os monômeros penetrem tanto nas retenções de esmalte, como na rede de colágeno de dentina exposta, prejudicando a formação da interface adesiva.
O tipo de sistema adesivo, o momento da contaminação, o tipo de substrato, o tipo de sangue (fresco ou com anticoagulante), bem como outros fatores de variação presentes nos estudos que investigam os efeitos da contaminação com sangue nas restaurações adesivas, dificultam as comparações entre os trabalhos, tornando o assunto complexo e não esclarecido5,10.
Os sistemas adesivos autocondicionantes tornaram-se muito populares devido à sua facilidade de aplicação3,36,38,41. Quando os preparos cavitários são restaurados sem o uso do isolamento absoluto, o sangramento gengival pode ocorrer após a lavagem do ácido fosfórico, que acidentalmente pode entrar em contato com a margem cavosuperficial do preparo, o que não ocorre quando se utiliza adesivo autocondicionante32.
Estudos experimentais comparativos de vários sistemas adesivos autocondicionantes demonstraram desempenho adesivo superior do Clearfil SE Bond em esmalte e dentina superficial ou profunda16.
A maioria dos estudos acerca da influência da contaminação com sangue na RU é realizada em esmalte e voltada para a adesão de brackets ortodônticos. Nesse contexto, Reynolds29 afirma que uma força de adesão de, no mínimo, 6 a 8 MPa seria capaz de suportar as forças ortodônticas. Entretanto, esses valores de MPa podem ser aplicados apenas para estudos em Ortodontia, fazendo com que os resultados não possam ser comparados com trabalhos na área de Dentística restauradora. Ressalta-se ainda que na área de Dentística existem poucos estudos7,17,42 sobre a contaminação com sangue, abrangendo especificamente adesivos autocondicionantes e, dada a importância desse tipo de adesivo na atualidade (devido à tendência de simplificar o procedimento adesivo37), faz-se necessária uma investigação mais detalhada sobre essas condiçoes específicas.
Os resultados obtidos neste estudo confirmam que a contaminação com sangue resulta em uma CH diferente, quando comparada à formada na ausência do contaminante, especialmente no que se refere ao tamanho dos tags de resina formados. Abdalla e Davidson1, em 1998, confirmaram esses resultados, observando relação direta entre redução de RU e formação de tags resinosos de menor comprimento. Outra suposição para os resultados observados reside no fato de as proteínas do sangue se depositarem sobre a dentina, prejudicando a permeação do sistema adesivo30.
Observou-se ainda neste trabalho que, quando a contaminação com sangue ocorreu após a fotopolimerização do bond (G4 e G5), resultados morfológicos diferentes foram observados, identificando-se a presença de falha na interface RF-SA, não observada nos demais grupos experimentais. Esses resultados diferentes podem estar relacionados com a menor espessura total do bond25 ou com a ruptura da superfície de oxigênio livre presente na camada não totalmente polimerizada do bond. Entretanto, o efeito da ruptura da camada não polimerizada não está completamente esclarecido30.
Assim, considera-se fundamental o controle da contaminação do campo operatório para a obtenção de restaurações adesivas de boa qualidade, pois, uma vez contaminado o substrato, nenhum dos tratamentos propostos foi capaz de reverter o prejuízo obtido pela presença do contaminante em relação à qualidade da CH formada.
Conclusões
A presença do sangue durante a realização do procedimento adesivo interferiu negativamente na formação da CH, independentemente do momento operatório em que ocorreu. O contaminante foi o responsável pela formação de tags de resina de menor comprimento quando foi utilizado um sistema adesivo autocondicionante.
Referências Bibliográficas
1. Abdalla AI, Davidson CL. Bonding efficiency and interfacial morphology of one-bottle adhesives to contaminated dentin surfaces. Am J Dent. 1998;11(6):281-5. [ Links ]
2. Barakat MM, Powers JM. In vitro bond strength of cements to treated teeth. Aust Dent J. 1986;31(6):415-9. [ Links ]
3. De Munck J, Van Landuyt K, Peumans M, Poitevin A, Lambrechts P, Braem M, et al. A critical review of the durability of adhesion to tooth tissue: methods and results. J Dent Res. 2005;84(2):118-32. [ Links ]
4. Dietrich T, Kraemer M, Lösche GM, Wernecke KD, Roulet JF. Influence of dentin conditioning and contamination on the marginal integrity of sandwich Class II restorations. Oper Dent. 2000;25(5):401-10. [ Links ]
5. Dietrich T, Kraemer ML, Roulet JF. Blood contamination and dentin bonding--effect of anticoagulant in laboratory studies. Dent Mater. 2002;18(2):159-62. [ Links ]
6. Duarte SJ, Lolato AL, de Freitas CR, Dinelli W. SEM analysis of internal adaptation of adhesive restorations after contamination with saliva. J Adhes Dent. 2005;7(1):51-6. [ Links ]
7. Eiriksson SO, Pereira PN, Swift EJ, Heymann HO, Sigurdsson A. Effects of blood contamination on resin-resin bond strength. Dent Mater. 2004;20(2):184-90. [ Links ]
8. el-Kalla IH, García-Godoy F. Saliva contamination and bond strength of single-bottle adhesives to enamel and dentin. Am J Dent. 1997;10(2):83-7. [ Links ]
9. Ernst CP, Brandenbusch M, Meyer G, Canbek K, Gottschalk F, Willershausen B. Two-year clinical performance of a nanofiller vs a fine-particle hybrid resin composite. Clin Oral Investig. 2006;10(2):119-25. [ Links ]
10. Faltermeier A, Behr M, Rosentritt M, Reicheneder C, Müssig D. An in vitro comparative assessment of different enamel contaminants during bracket bonding. Eur J Orthod. 200729(6):559-611. Fritz UB, Finger WJ, Stean H. Salivary contamination during bonding procedures with a one-bottle adhesive system. Quintessence Int. 1998;29(9):567-72. [ Links ]
12. Martins VRG. Análise do selamento marginal de restaurações realizadas após remoção de cárie radicular com o laser de Er, Cr:YSGG [Tese de Doutorado]. São Paulo: Universidade de São Paulo; 2007. [ Links ]
13. Hobson RS, Ledvinka J, Meechan JG. The effect of moisture and blood contamination on bond strength of a new orthodontic bonding material. Am J Orthod Dentofacial Orthop. 2001;120(1):54-7. [ Links ]
14. Johnson ME, Burgess JO, Hermesch CB, Buikema DJ. Saliva contamination of dentin bonding agents. Oper Dent. 1994;19(6):205-10. [ Links ]
15. Joynt RB, Davis EL, Schreier PH. Rubber dam usage among practicing dentists. Oper Dent. 1989;14(4):176-81. [ Links ]
16. Kaaden C, Powers JM, Friedl KH, Schmalz G. Bond strength of self-etching adhesives to dental hard tissues. Clin Oral Investig. 2002;6(3):155-60. [ Links ]
17. Kaneshima T, Yatani H, Kasai T, Watanabe EK, Yamashita A. The influence of blood contamination on bond strengths between dentin and an adhesive resin cement. Oper Dent. 2000;25(3):195-201. [ Links ]
18. Matos AB, Oliveira DC, Vieira SN, Netto NG, Powers JM. Influence of oil contamination on in vitro bond strength of bonding agents to dental substrates. Am J Dent. 2008;21(2):101-4. [ Links ]
19. Miles DA, Anderson RW, Pashley DH. Evaluation of the bond strength of dentin bonding agents used to seal resected root apices. J Endod. 1994;20(11):538-41. [ Links ]
20. Moretto SG. Análise morfológica e da resistência de união da superfície dentinária irradiada com os lasers de Er:YAG e Er,Cr:YSGG [Dissertação de Mestrado]. São Paulo: Universidade de São Paulo; 2009. [ Links ]
21. Oonsombat C, Bishara SE, Ajlouni R. The effect of blood contamination on the shear bond strength of orthodontic brackets with the use of a new self-etch primer. Am J Orthod Dentofacial Orthop. 2003;123(5):547-50. [ Links ]
22. Oztoprak MO, Isik F, Sayinsu K, Arun T, Aydemir B. Effect of blood and saliva contamination on shear bond strength of brackets bonded with 4 adhesives. Am J Orthod Dentofacial Orthop. 2007;131(2):238-42. [ Links ]
23. Pashley DH. Dentin bonding: overview of the substrate with respect to adhesive material. J Esthet Dent. 1991;3(2):46-50. [ Links ]
24. Pashley EL, Tao L, Mackert JR, Pashley DH. Comparison of in vivo vs. in vitro bonding of composite resin to the dentin of canine teeth. J Dent Res. 1988;67(2):467-70. [ Links ]
25. Peschke A, Blunck U, Roulet JF. Influence of incorrect application of a water-based adhesive system on the marginal adaptation of Class V restorations. Am J Dent. 2000;13(5):239-44. [ Links ]
26. Pinzon LM, Oguri M, OKeefe K, Dusevish V, Spencer P, Powers JM, et al. Bond strength of adhesives to dentin contaminated with smokers saliva. Odontology. 2010;98(1):37-43. [ Links ]
27. Powers JM, Finger WJ, Xie J. Bonding of composite resin to contaminated human enamel and dentin. J Prosthodont. 1995;4(1):28-32. [ Links ]
28. Reddy L, Marker VA, Ellis E 3rd. Bond strength for orthodontic brackets contaminated by blood: composite versus resin-modified glass ionomer cements. J Oral Maxillofac Surg. 2003;61(2):206-13. [ Links ]
29. Reynolds IR. A review of direct orthodontic bonding. Br J Orthod. 1975;2:171-8. [ Links ]
30. Sattabanasuk V, Shimada Y, Tagami J. Effects of saliva contamination on dentin bond strength using all-in-one adhesives. J Adhes Dent. 2006;8(5):311-8. [ Links ]
31. Sayinsu K, Isik F, Sezen S, Aydemir B. Light curing the primer-beneficial when working in problem areas? Angle Orthod. 2006;76(2):310-3. [ Links ]
32. Schattenberg A, Werling U, Willershausen B, Ernst CP. Two-year clinical performance of two one-step self-etching adhesives in the restoration of cervical lesions. Clin Oral Investig. 2008;12(3):225-32. [ Links ]
33. Sfondrini MF, Cacciafesta V, Scribante A, De Angelis M, Klersy C. Effect of blood contamination on shear bond strength of brackets bonded with conventional and self-etching primers. Am J Orthod Dentofacial Orthop. 2004;125(3):357-60. [ Links ]
34. Strydom C. Handling protocol of posterior composites Rubber Dam. SADJ. 2005;60(7):292-3. [ Links ]
35. Tao L, Pashely DH, Boyd L. Effect of different types of smear layers on dentin and enamel shear bond strengths. Dent Mater. 1988;4(4):208-16. [ Links ]
36. Tay FR, Pashley DH. Have dentin adhesives become too hydrophilic? J Can Dent Assoc. 2003;69(11):726-31. [ Links ]
37. Van Meerbeek B, De Munck J, Yoshida Y, Inoue S, Vargas M, Vijay P, et al. Buonocore memorial lecture. Adhesion to enamel and dentin: current status and future challenges. Oper Dent. 2003;28(3):215-35. [ Links ]
38. Van Meerbeek B, Perdigão J, Lambrechts P, Vanherle G. The clinical performance of adhesives. J Dent. 1998;26(1):1-20. [ Links ]
39. van Schalkwyk JH, Botha FS, van der Vyver PJ, de Wet FA, Botha SJ. Effect of biological contamination on dentine bond strength of adhesive resins. SADJ. 2003;58(4):143-7. [ Links ]
40. Xie J, Powers JM, McGuckin RS. In vitro bond strength of two adhesives to enamel and dentin under normal and contaminated conditions. Dent Mater. 1993;9(5):295-9. [ Links ]
41. Yazici AR, Tuncer D, Dayangaç B, Ozgünaltay G, Onen A. The effect of saliva contamination on microleakage of an etch-and-rinse and a self-etching adhesive. J Adhes Dent. 2007;9(3):305-9. [ Links ]
42. Yoo HM, Pereira PN. Effect of blood contamination with 1-step self-etching adhesives on microtensile bond strength to dentin. Oper Dent. 2006;31(6):660-5. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Adriana Bona Matos
Avenida Professor Lineu Prestes, 2.227 – Cidade Universitária
São Paulo/SP.
E-mail: bona@usp.br
Pesquisa realizada no Departamento de Dentística da Faculdade de Odontologia da USP e Instituto de Física da Universidade de São Paulo.
Recebido:04/06/10
Aceito:25/08/10













