Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RPG. Revista de Pós-Graduação
versão impressa ISSN 0104-5695
RPG, Rev. pós-grad. vol.19 no.1 São Paulo Jan./Mar. 2012
Artigo Original / Original Article
Queilite actínica: um estudo de 35 casos com destaque para os aspectos morfológicos
Actinic cheilitis: a study of 35 cases highlighting their morphological features
CALIANDRA PINTO ARAÚJOI; MANUELA TORRES ANDION VIDALII; CLARISSA ARAÚJO SILVA GURGELIII; EDUARDO ANTÔNIO GONÇALVES RAMOSIV; ARYON DE ALMEIDA BARBOSA JUNIORIV; LUCIANA MARIA PEDREIRA RAMALHOIII; JEAN NUNES DOS SANTOSIII
I Mestre em Odontologia pela Faculdade de Odontologia da Universidade Federal da Bahia (FOUFBA) – Salvador/BA
II Formada em Odontologia da Faculdade de Odontologia da Universidade Federal da Bahia (FOUFBA) – Salvador/BA
III Professor Doutor do Departamento de Propedêutica e Clínica Integrada da Faculdade de Odontologia da Universidade Federal da Bahia (FOUFBA) – Salvador/BA
IV Pesquisador do Centro de Pesquisa Gonçalo Moniz da Fundação Osvaldo Cruz (CPqGM/FIOCRUZ) – Salvador/BA
RESUMO
A queilite actínica (QA) é uma alteração crônica, pré-maligna, resultante da exposição solar frequente e prolongada. Afeta principalmente o lábio inferior de pessoas idosas, do sexo masculino e de pele clara. Sabendo- se que a QA é influenciada pela radiação solar e que ao nosso conhecimento não existem dados clínicos e histológicos dessa lesão no Nordeste do Brasil, o presente estudo analisou uma série de 35 casos de QA na população dessa região brasileira. As lâminas referentes a cada caso foram coradas pela técnica da hematoxilina e eosina (HE) e analisadas por microscopia de luz, sendo descritos os aspectos morfológicos das lesões. Os dados clínicos foram obtidos a partir das fichas de solicitação do exame anatomopatológico. Dos 35 casos de nossa amostra, 60% representou o sexo masculino. A idade média foi de 54,6 anos. A maioria dos pacientes era leucoderma. As lesões de QA caracterizavam-se por epitélio pavimentoso estratificado exibindo graus variáveis de queratinização. Elastose solar esteve presente em todos os casos. Quanto ao grau de displasia, 17 casos apresentavam displasia discreta, 13 eram de displasia moderada e 5 eram representados por displasia severa. Embora os casos desse estudo apresentassem displasia epitelial, estas não foram suficientemente severas para gerar uma neoplasia invasiva. Contudo, é importante que estudos dessa natureza sejam realizados em outras regiões do país para que políticas públicas sejam estabelecidas para evitar o aparecimento e malignização dessas lesões.
Descritores: Queilite. Displasia. Carcinoma de células escamosas.
ABSTRACT
Actinic cheilitis (AC) is a premalignant lesion that manifests as a diffuse lesion of the lower lip vermilion resulting from excessive exposure to sunlight. It is more frequent in elder, light-skinned men. AC is influenced by ultraviolet radiation and little is known about clinical and histolopathological features of this lesion in Brazil northeastern. Thus, the aim of the present study was to investigate a series composed of 35 cases of AC in a population of this region. Clinical data from biopsy records were revised, as well as microscopic slides corresponding to each case were assessed and their histological findings described. Of the 35 cases, 60% represented males. The mean age was 54.6 years. Most patients were Caucasian. Histologically, the lesions exhibited varying degrees of dysplasia and cellular atypia. All cases presented solar elastosis. Regarding the dysplasia degree, 17 cases showed mild dysplasia, 13 moderate and 5 severe. Although most cases of AC showed epithelial dysplasia, these were not severe enough to generate an invasive lesion. However, it is important that such studies be conducted in other regions of the country to which public politics are established to prevent the onset of malignant lesions.
Descriptors: Cheilitis. Dysplasia. Carcinoma, squamous cell.
INTRODUÇÃO
O termo queilite actínica (QA) vem do grego "cheilos" que significa inflamação dos lábios. Trata-se de uma alteração crônica, pré-maligna, resultante da exposição solar frequente e prolongada7,22,26,30. Afeta principalmente o lábio inferior de pessoas idosas, do sexo masculino, de pele clara e excessivamente expostas à luz solar2,8,18,30.
A diversidade estrutural e anatômica identificada pelas diferentes regiões do lábio, além de sua evidente posição, faz com que essa parte do corpo humano seja alvo de doenças inflamatórias, autoimunes, infecciosas, tumores benignos e até mesmo lesões malignas e pré-malignas, como é o caso da queilite actínica31. O vermelhão do lábio inferior, por causa de sua localização, recebe maior quantidade de raios ultravioleta do que o lábio superior, constituindo o principal sítio da QA21.
A exposição prolongada à luz solar representa um fator de risco importante tanto para o desenvolvimento de câncer de lábio13 como à queilite actínica, e a presença desta em áreas de carcinoma escamocelular (CEC) indica forte associação entre as duas lesões18,20,21,27,30. Estudos têm demonstrado que 60% dos CEC iniciam-se como queilites, e existe evidência histológica da continuidade da queilite em 97% das lesões de câncer10.
As características histopatológicas da QA podem apresentar variações, porém a lesão é caracterizada por atrofia do epitélio escamoso estratificado, com frequente produção de queratina. A hiperqueratose, paraqueratose e acantose são aspectos comuns das queilites actínicas. São observadas também áreas de hiperplasia, atrofia e graus variados de atipia que vão desde uma alteração discreta a carcinoma in situ e até invasivo8,21,22,27,31,33.
No Nordeste do Brasil, há um déficit hídrico durante quase sete meses do ano com consequente aumento da temperatura. Portanto, sabendo-se que a queilite actínica é diretamente influenciada pela radiação solar e que ao nosso conhecimento não existem dados clínicos e histológicos dessa lesão no Nordeste do Brasil, o presente estudo analisou uma série de 35 casos de QA nesta população brasileira.
OBJETIVOS
O objetivo desse trabalho foi analisar 35 casos de queilite actínica diagnosticados no Laboratório de Patologia Cirúrgica da Faculdade de Odontologia da Universidade Federal da Bahia (FOUFBA), caracterizando os seus aspectos histomorfológicos.
METODOLOGIA
Após aprovação do Comitê de Ética, 35 casos de queilite actínica diagnosticados no Laboratório de Patologia Cirúrgica da FOUFBA foram estudados.
Os dados clínicos referentes às lesões foram obtidos a partir das informações contidas nas fichas de pedido do exame anatomopatológico, contendo aspectos sobre idade, sexo, cor da pele e diagnóstico clínico.
Para análise morfológica dos casos, foram realizados cortes de 4 μm de espessura do material fixado em formol e incluído em parafina. As lâminas referentes a cada caso foram coradas pela técnica da hematoxilina e eosina (HE) e analisadas por microscopia de luz. Foram descritos os principais aspectos morfológicos representativos das lesões. Cada caso também foi reavaliado seguindo os critérios histológicos para definir displasia epitelial, bem como aqueles que estabeleceram parâmetros para definir o grau histológico de displasias para lesões epiteliais precursoras.
RESULTADOS
Dos 35 casos de nossa amostra, 21 (60%) representaram o sexo masculino e 14 (40%) o sexo feminino. Quanto à idade, a faixa etária variou entre 20 e 78 anos, com idade média de 54,6 anos. Quanto à cor da pele, 17 casos eram leucodermas, 10 faiodermas, e em 8 casos não havia informação quanto a esse aspecto.
As lesões de QA caracterizavam-se por epitélio pavimentoso estratificado, exibindo graus variáveis de queratinização, predominando os revestimentos epiteliais ortoqueratinizado e hiperparaqueratinizado. Exibiam também granulose e hipergranulose, assim como áreas de acantose ou de atrofia. Em dois casos, foi observada hiperplasia melanocítica e, em um dos casos, incontinência pigmentar. A lâmina própria era formada por estreita faixa de tecido conjuntivo denso vascularizado, separando extensa área de material amorfo fortemente basofílico (elastose solar), presente em todos os casos analisados. Essa faixa de tecido conjuntivo nem sempre era encontrada separando o tecido epitelial da área de elastose. Infiltrado inflamatório do tipo mononuclear e numerosos vasos sanguíneos tortuosos, por vezes dilatados, também estavam presentes (Tabela 1).
Quanto ao grau de displasia, 17 apresentavam displasia discreta (Figura 1), 13 casos eram de displasia moderada (Figura 2) e 5 casos eram representados por displasia severa (Figura 3). Dentre os parâmetros histológicos mais comumente observados, destacaram-se: perda de polarização das células do estrato basal, hiperplasia de células do estrato basal e projeções epiteliais em gota. Outras alterações também frequentes estão representadas na Tabela 1.
DISCUSSÃO
A queilite actínica é a lesão pré-maligna mais comum do lábio inferior, que se apresenta como uma lesão difusa, resultante da exposição excessiva à radiação solar, e exibe alterações histomorfológicas indicativas de desvio da diferenciação normal, podendo apresentar diferentes graus de displasia18,24,26,29,31. É uma lesão análoga à queratose solar, apresentando áreas de erosão e hiperqueratose, e pode se transformar em carcinoma escamocelular31. Critérios histomorfológicos não estão bem estabelecidos quanto à evolução entre a QA, queratose solar e carcinoma escamocelular. Essa transformação é dificilmente determinada, porque o limite entre queilite actínica e carcinoma escamocelular in situ não é claro2,20,22,30.
O presente estudo foi realizado em uma população da região Nordeste do Brasil, a qual apresenta os maiores índices de radiação ultravioleta desse país de clima tropical9. O objetivo foi associar o desenvolvimento da QA aos altos índices de radiação nessa região.

Neste trabalho, cada caso foi classificado de acordo com o grau de displasia epitelial, utilizando-se a classificação da OMS 20055, por ser um critério atual que caracteriza as lesões quanto a suas alterações citológicas (atipia) e arquiteturais, além de ser utilizado em estudos recentes8,26,28. Este sistema de gradação nos permite classificar os casos de queilite, exibindo displasia discreta, moderada e intensa. Existem também outros critérios para estabelecer o grau de atipia epitelial em lesões de boca1,4,11,14, contudo a interpretação individual é subjetiva embora os sistemas de gradação reconheçam detalhadamente os aspectos11,18.
Conforme De Rosa et al.12, Ackerman3 e Cockerell10, a queratose actínica pode ser considerada morfologicamente similar ao carcinoma escamocelular na sua fase inicial, mas biologicamente ainda representa uma lesão benigna. Abreu et al.2 observaram que similarmente aos tumores de pele originados de queratoses, os tumores de lábio oriundos de QA têm um melhor prognóstico, pois apresentam menor ocorrência de metástases. Então, para esses autores, a QA no tecido adjacente ao carcinoma escamocelular pode ser considerada um indicador de melhor prognóstico para aqueles que têm CEC de pele. Walther et al.38 também relataram que a presença de elastose actínica ao redor de carcinomas de células basais (CCB) sugere ser um fator protetor, embora acreditem ser necessárias maiores investigações para este dado, já que em outros estudos, como o de Kaskel et al.16, a elastose actínica não contribuiu para o prognóstico de pacientes com melanoma. Dessa forma, é difícil determinar o limite entre QA e carcinoma, já que ainda não é possível afirmar onde termina um, tampouco onde o outro se inicia26. Esses autores concordam com a associação entre essas lesões, mas não acreditam que ocorra necessariamente uma evolução linear de uma lesão para outra no processo de desenvolvimento neoplásico. Outros estudos devem ser realizados para tentar esclarecer esse aspecto.
O crescimento de células tumorais está associado com a presença de células inflamatórias na epiderme irradiada por UVB34,40. Berhane et al.6 examinaram queratoses actínicas, queratoses actínicas inflamadas e CEC de pele, e concluíram que a inflamação estava associada com a progressão da queratose para o CEC. Esses dados corroboram com os achados de Pimentel et al.28, que afirmam ser a presença de um infiltrado inflamatório intenso na QA um fator preditivo para o CEC invasivo.
Observamos no nosso estudo a presença de infiltrado inflamatório em 66% dos casos estudados, contudo não foi possível associar a sua presença aos diferentes graus de displasia da QA. Sluyter e Halliday34 afirmam que as células inflamatórias podem contribuir para o aumento de tumores por prover fatores de crescimento de modo parácrino, seja pela supressão da resposta imune efetora local ou pela ativação supressora e/ou reguladora das células T. Outros estudos mostram a presença de produção de citocinas e leucócitos inflamatórios na pele um a três dias após exposição à radiação UV, indicando um possível estímulo ao crescimento tumoral15,17. A interação de citocinas e seus receptores é importante em diversos processos relacionados a tumores, como crescimento de células tumorais, angiogênese, invasão local e metástases. Mediante a liberação de estímulo à angiogênese e proliferação celular, as citocinas estão diretamente envolvidas na transformação, sobrevida e crescimento de células tumorais36. Yang et al.39 relatam também que estímulos crônicos e excessivos por meio de citocinas em neoplasias promovem a transformação celular oncogênica.
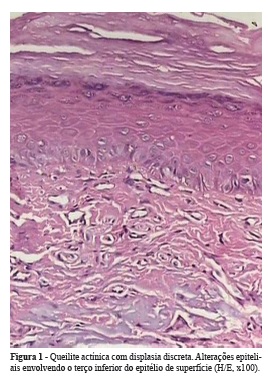
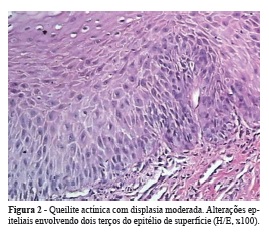
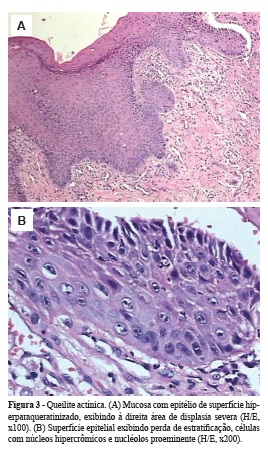
As características histopatológicas da QA apresentam pequenas variações. A lesão é caracterizada por atrofia do epitélio escamoso estratificado, muitas vezes demonstrando produção de queratina. A hiperqueratose, paraqueratose e acantose são aspectos universais das queilites actínicas. São observadas também áreas de hiperplasia, atrofia e graus variados de atipia que vão desde uma alteração discreta, a carcinoma in situ e até invasivo8,21,22,27,31,33. Ulceração superficial pode estar presente, e o epitélio adjacente é sempre atrófico. Em geral, existe desde leve a moderado infiltrado inflamatório composto predominantemente por linfócitos e ocasionais plasmócitos7,18,19,31. Sob a área ulcerada existe um infiltrado inflamatório disposto em faixa, cuja espessura é variável, estendendo-se em alguns casos até a submucosa7.
Estrato granuloso proeminente e degeneração basofílica amorfa das fibras elásticas e colágenas no tecido conjuntivo superficial são um achado constante. Essa alteração basofílica do tecido conjuntivo, causada pela substituição de colágeno por material basofílico amorfo, é denominada elastose solar8,10,22-24,30,31. Confirmando os dados da literatura, a elastose foi observada em todos os casos analisados no presente estudo. Perda de estratificação, hipercromatismo nuclear, presença de raras figuras de mitose e de células multinucleadas são outras alterações encontradas por Santos et al.31, assim como graus variáveis de alterações basofílicas dentro do tecido conjuntivo. Em nosso estudo, a perda de estratificação e o hipercromatismo nuclear foram achados histológicos frequentes, entretanto mitoses atípicas foram observadas em apenas três casos.
Na lâmina própria, é comum a presença de vasos sanguíneos dilatados, sendo a proeminência vascular decorrente do aumento de volume das células endoteliais e não de sua proliferação19. Os vasos sanguíneos nas regiões de alterações basofílicas estão usualmente dilatados25. Neste estudo, a vasodilatação foi encontrada em 91% das lesões estudadas.
Os achados histopatológicos das lesões de QA do presente estudo se enquadram naqueles que definem a QA8,18,22,26,31,33. A maioria das lesões apresentou epitélio ortoqueratinizado, exibindo graus variáveis de displasia, em cuja lâmina própria era comum a presença de degeneração basofílica (elastose) em maior ou menor extensão, bem como vasos sanguíneos tortuosos, por vezes congestos. Outras alterações encontradas referentes à atipia foram: perda de polarização, projeções epiteliais em gota, pleomorfismo celular e nuclear, acantose e atrofia. Alterações menos comuns, como hipercromatismo nuclear, perda de estratificação, raras figuras de mitoses e células multinucleadas, também foram observadas.
A QA afeta predominantemente homens de pele clara, fumantes de tabaco, com idade média de 61,8 anos, variando dos 40 aos 80 anos de idade7,8,18. Estes têm história de exposição solar crônica e excessiva21,22 ou fatores de maior susceptibilidade à exposição, como trabalhar sob o sol, morar em países de baixa altitude, ter pele clara e história de queimadura33. Apresentam também maiores riscos de desenvolver carcinoma de lábio27.
Nosso estudo confirma os dados epidemiológicos reportados na literatura. No presente estudo, o sexo masculino representou 60% dos casos. Quanto à idade, a faixa etária variou entre 20 e 78 anos, com ida de média de 54,6 anos. Em relação à cor da pele, a maioria dos casos era leucoderma. Os dados clínicos a respeito de hábitos dos pacientes estudados não foram avaliados, pois os prontuários estavam em sua maioria incompletos.
Existem duas formas clínicas de QA, uma aguda e outra crônica. A forma aguda é mais comum em indivíduos jovens e ocorre após exposição prolongada ao sol. Caracteriza-se clinicamente por edema e vermelhão nas formas mais moderadas, bem como fissuração e ulceração nas formas mais severas. Às vezes, podem aparecer vesículas que se rompem e causam erosão superficial. A forma crônica geralmente se manifesta como discreta elevação envolvendo toda extensão do lábio inferior até a comissura, podendo ocorrer em todas as estações do ano. Usualmente, observam-se alterações na cor e perda da plasticidade usual do lábio. Erosões e ulcerações resultantes de infecções secundárias podem estar presentes em alguns casos21,27,37.
A área de transição existente entre o vermelhão e a pele torna-se difusa, com perda do limite exato do lábio. Com a progressão da lesão, áreas ásperas, escamosas e secas surgem no vermelhão do lábio inferior. Essas áreas tornam-se espessas e leucoplásicas. O paciente relata que as escamas presentes no lábio destacam-se com certa dificuldade, e a pele renova-se em poucos dias21. Com a evolução da doença, úlceras crônicas se desenvolvem em um ou mais locais, especialmente onde há íntimo contato com o calor do cigarro nos fumantes.
Essas ulcerações podem durar meses e sugerem evolução para carcinoma de células escamosas18,21,22.
Diante da possibilidade de transformação maligna das QAs, alguns autores relacionam alguns aspectos clínicos que devem ser levados em consideração quando da análise dessas lesões: área elevada, endurecida, eritematosa, úlcera não cicatrizante e presença de placa branca21.
A biópsia é absolutamente indicada para lesões que apresentam aumento de volume ou ulceração, a fim de excluir alguma alteração maligna ou diagnosticar uma lesão oral pré-cancerizável35. Kaugars et al.18 afirmam a importância da biópsia na QA para avaliar o grau de extensão epitelial da lesão e assim instituir a melhor terapia para cada caso. Nico, Rivitti e Lourenço26 sugerem que uma única biópsia pode não prover todas as informações necessárias sobre a lesão em pacientes com QA difusa.
Os métodos de tratamento da queilite actínica podem ser divididos em dois tipos, cirúrgicos e não cirúrgico. O tratamento cirúrgico inclui excisão, criocirurgia, curetagem e cirurgia a laser32. Os tratamentos não cirúrgicos são: quimioterapia tópica, esfoliação e dermoabrasão22. Antes da escolha do tratamento, é imprescindível a realização da biópsia para avaliar atipias e possível malignidade37, pois a QA não deve ser tratada levando-se em consideração apenas o seu aspecto clínico.
CONCLUSÕES
A queilite actínica parece ser frequente no Nordeste do Brasil e, por apresentar capacidade de transformação maligna, seu diagnóstico precoce e tratamento são bastante relevantes. Embora os casos desse estudo apresentassem displasia epitelial, estas não foram suficientemente severas para gerar uma neoplasia invasiva. Dessa forma, é importante que estudos dessa natureza sejam realizados em outras regiões do país para que políticas públicas sejam estabelecidas para evitar o aparecimento dessas lesões.
REFERÊNCIAS
1. Abbey LM, Kaugars GE, Gunsolley JC, Burns JC, Page DG, Svirsky JA, et al. Intraexaminer and interxaminer reliability in the diagnosis of oral epithelial dysplasia. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1995;80(2):188-91. [ Links ]
2. Abreu MA, Silva OM, Neto Pimentel DR, Hirata CH, Weckx LL, Alchorne MM, et al. Actinic cheilitis adjacelt to squamous carcinoma of the lips as na indicator of prognosis. Braz J Otorhinolaryngol 2006;72(6):767-71. [ Links ]
3. Ackerman AB. Opposing views of 2 academies about the nature of solar keratosis. Cutis 2003;71(5):391-5. [ Links ]
4. Bánóczy J, Csiba A. Occurrence of epithelial dysplastic in oral mucosa. Oral Surg 1976;42(6):766-74. [ Links ]
5. Barnes L, Eveson JW, Reichart P, Sidransky D. World Health Organization Classification of Tumours. Pathology and Genetics of Head and Neck Tumours. Lyon: IARC Press; 2005. [ Links ]
6. Berhane T, Halliday GM, Cooke B, Barnetson RS. Inflammation is associated with progression of actinic keratoses to squamous cell carcinomas in humans. Br J Dermatol 2002;146(5):810-5. [ Links ]
7. Cataldo E, Doku HC. Solar cheilitis. J Dermatol Surg Oncol 1981;7(12):989-95. [ Links ]
8. Cavalcante AS, Anbinder AL, Carvalho YR. Actinic cheilitis: clinical and histological features. J Oral Maxillofac Surg 2008;66(3):498-503. [ Links ]
9. Centro de Previsão de Tempo e Estudos Climáticos (CPTEC). Situação mais recente do Índice Ultravioleta para o Brasil. [cited 2011 Sep 15]. Available from: http://www.cptec.inpe.br/ [ Links ]
10. Cockerell CJ. Pathology and pathobiology of the actinic (solar) keratosis. Br J Dermatol 2003;149(Suppl 66):34-6. [ Links ]
11. Cruz IB, Snijders PJ, Meijer CJ, Braakhuis BJ, Snow GB, Walboomers JM, et al. p53 expression above the basal layer in oral mucosa is an early event of malignant transformation and has predictive value for developing oral squamous cell carcinoma. J Pathol 1998;184(4):360-8 [ Links ]
12. De Rosa I, Staibano S, Lo Muzio L, Delfino M, Lucariello A, Coppola A, et al. Potentially malignant and malignant lesions of the lip. Role of silver staining nucleolar organizer regions, proliferating cell nuclear antigen, p53, and c-myc in differentiation and prognosis. J Oral Pathol Med 1999;28(6):252-8. [ Links ]
13. De Visscher JG, van der Waal I. Etiology of cancer of the lip. A review. Int J Oral Int J Oral Maxillofac Surg 1998;27(3):199-203. [ Links ]
14. Fischman SL, Ulmansky M, Sela J, Bab I, Gazit D. Correlative clinico- pathological evaluation of oral premalignancy. J Oral Pathol 1982;11(4):283-9. [ Links ]
15. Kang K, Gilliam AC, Chen G, Tootell E, Cooper KD. In human skin, UVB initiates early induction of IL-10 over IL-12 preferentially in the expanding dermal monocytic/ macrophagic population. J Invest Dermatol 1998;111(1):31-8. [ Links ]
16. Kaskel P, Sander S, Kron M, Kind P, Peter RU, Krähn G. Outdoor activities in childhood: a protective factor for cutaneous melanoma? Results of a case-control study in 271 matched pairs. Br J Dermatol 2001;145(4):602-9. [ Links ]
17. Katiyar SK, Challa A, McCormick TS, Cooper KD, Mukhtar H. Prevention of UVB-induced immunosupression in mice by the green tea polyphenol(-) epigallocatechin-3-gallate may be associated with alterations in IL-10 and IL-12 production. Carcinogenesis 1999;20(11):2117-24. [ Links ]
18. Kaugars GE, Pillion T, Svirsky JA, Page DG, Burns JC, Abbey LM. Actinic cheilitis: a review of 152 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999;88(2):181-6. [ Links ]
19. Koten JW, Verhagen AR, Frank GL. Histopathology of actinic cheilits. Dermatologica 1967;135(6):465-71. [ Links ]
20. Lebwohl M. Actinic keratosis: epidemiology and progression to squamous carcinoma. Br J Dermatol 2003;149(Suppl 66):31-3. [ Links ]
21. Main JH, Pavone M. Actinic cheilitis and carcinoma of the lip. J Can Dent Assoc 1994;60(2):113-6. [ Links ]
22. Markopoulos A, Albanidou-Farmaki E, Kayavis I. Actinic cheilitis: clinical and pathologic characteristics in 65 cases. Oral Dis 2004;10(4):212-6. [ Links ]
23. Marks VJ. Actinic keratosis. A premalignant skin lesion. Otolaryngol Clin North Am 1993;26(1):23-35. [ Links ]
24. Martinez Z, Brethauer U, Rojas IG, Spencer M, Mucientes F, Borlando J, et al. Expression of apoptotic and cell proliferation regulatory proteins in actinic cheilitis. J Oral Pathol Med 2005;34(5):257-62. [ Links ]
25. Murphy GF. Dermatopathology: a pratical guide to common disorders. Philadelphia: Saunders; 1995. [ Links ]
26. Nico MMS, Rivitti EA, Lourenço SV. Actinic cheilitis: histologic study of the entire vermilion and comparison with previous biopsy. J Cutan Pathol 2007;34(4):309-14. [ Links ]
27. Picascia DD, Robinson JK. Actinic cheilitis: a review of the etiology, differential diagnosis and treatment. J Am Acad Dermatol 1987;17(2 Pt 1):255-64. [ Links ]
28. Pimentel DRN, Michalany N, Alchorne M, Abreu M, Borra RC, Weckx L. Actinic cheilitis: histopathology and p53. J Cutan Pathol 2006;33(8):539-44. [ Links ]
29. Robinson JK. Actinic cheilitis. A prospective study comparing four treatment methods. Arch Otolaryngol Head Neck Surg 1989;115(7):848-52. [ Links ]
30. Rojas IG, Martínez A, Pineda A, Spencer ML, Jiménez M, Rudolph MI. Increased mast cell density and protease content in actinic cheilitis. J Oral Pathol Med 2004;33(9):567-73. [ Links ]
31. Santos JN, de Sousa SO, Nunes FD, Sotto MN, de Araújo VC. Altered cytokeratin expression in actinic cheilitis. J Cutan Pathol 2003;30(4):237-41. [ Links ]
32. Schwartz RA. Therapeutic perspectives in actinic and other keratoses. Int J Dermatol 1996;35(8):533-8. [ Links ]
33. Silva TA, Coelho G, Lorenzetti BA, Figueiredo CNF. Expression of apoptotic, cell proliferation regulatory, and structural proteins in actinic keratosis and their association with dermal elastosis. J Cutan Pathol 2007;34(4):315-23. [ Links ]
34. Sluyter R, Halliday GM. Enhanced tumor growth in UVirradiated skin is associated with an influx of inflammatory cells into the epidermis. Carcinogenesis 2000;21(10):1801-7. [ Links ]
35. Sober AJ, Burstein JM. Precursors to skin cancer. Cancer 1995;75(2 Suppl):645-50. [ Links ]
36. Tanaka T, Bai Z, Srinoulprasert Y, Yang BG, Hayasaka H, Miyasaka M. Chemokines in tumor progression and metastasis. Cancer Sci 2005;96(6):317-22. [ Links ]
37. Terezhalmy GT, Naylor GD. Actinic cheilitis. J Indiana Dent Assoc 1993;72(4):12-5. [ Links ]
38. Walther U, Kron M, Sander S, Sebastian G, Sander R, Peter RU, et al. Risk and protective factors for sporadic basal cell carcinoma: results of a two-centre case-control study in southern Germany. Clinical actinic elastosis may be a protective factor. Br J Dermatol 2004;151(1):170-8. [ Links ]
39. Yang TY, Chen SC, Leach MW, Manfra D, Homey B, Wiekowski M, et al. Transgenic expression of the chemokine receptor encoded by human herpesvirus 8 induces an angioproliferative disease resembling Kaposi's sarcoma. J Exp Med 2000;191(3):445-54. [ Links ]
40. Yano K, Kadoya K, Kajiya K, Hong YK, Detmar M. Ultraviolet B irradiation of human skin induces an angiogenic switch that is mediated by upregulation of vascular endothelial growth factor and by downregulation of thrombospondin-1. Br J Dermatol 2005;152(1):115-21. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Jean Nunes dos Santos
Avenida Araújo Pinho, 62 – Canela
CEP 40110-150 – Salvador/BA
e-mail: jeanunes@ufba.br
Recebido em: 26/9/11
Aceito em: 6/1/12













