Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RPG. Revista de Pós-Graduação
versão impressa ISSN 0104-5695
RPG, Rev. pós-grad. vol.19 no.2 São Paulo Abr./Jun. 2012
Relato de Técnica / Technical Report
Como preparar secções histológicas de tecidos não descalcificados com implantes metálicos? Descrição de técnica modificada
How to prepare histological sections of non-decalcified tissue with metal implants? Modified technique
GLADYS CRISTINA DOMINGUEZI; PRISCILLA CAMPANATTI CHIBEBE CATHARINOII; CELEY APARECIDA EUGENIO SILVEIRA CASADIOIII; LUIS ANTONIO PUGLIESI A. DE LIMAIV; ANDRÉ TORTAMANOV; CAMILLO MOREAVI
I Professora Associada do Programa de Pós-graduação em Ciências Odontológicas, Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP
II Doutora do Programa de Pós-Graduação em Ciências Odontológicas – Área de Concentração em Ortodontia, Universidade de São Paulo (USP) – São Paulo/SP
III Mestra em Ciências Médicas, Disciplina de Reumatologia, Faculdade de Medicina da Universidade de São Paulo (USP) – São Paulo/SP
IV Professor Associado da Disciplina de Periodontia, Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP
V Professor Doutor do Programa de Pós-graduação em Ciências Odontológicas, Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP
VI Pós-Doutor em Ortodontia pela Faculdade de Odontologia da Universidade de São Paulo (FOUSP) – São Paulo/SP
RESUMO
Tendo em vista a falta de detalhamento minucioso na literatura existente, este relato descreve uma metodologia modificada de preparo das amostras de osso contendo implantes metálicos, para análise por microscopia óptica, fluorescência ou polarização. Os fragmentos de osso contendo os implantes são fixados, desidratados e incluídos em resina metilmetacrilato para finalmente serem cortados. As secções obtidas são coladas em lâminas de acrílico e reduzidas à espessura desejada de 20 a 50 μm utilizando de lixas d'água para o desgaste e polimento da superfície. Esta técnica produz lâminas histológicas de excelente qualidade, sem danos à interface osso-implante, e que permite observação detalhada da arquitetura tecidual, dos tipos celulares presentes e dos fluorocromos. Stevenels blue contracorada por Alizarina red S31 são colorações descritas que permitem em microscopia óptica diferenciar tipos celulares e teciduais presentes no sítio do implante.
Descritores: Histologia. Osso e ossos. Implantes dentários. Polimetil metacrilato. Corantes.
ABSTRACT
Considering the lack of full details about the existing literature, this report describes an improved method of modified preparation for bone-containing metal implants for analysis by optical, fluorescence or polarization microscopy. The fragments of bone containing implants are fixed, dehydrated and embedded in methyl methacrylate resin to finally being cut. Sections obtained are glued on acrylic slides and reduced to the desired thickness of 20 to 50 micrometres, by sandpaper water for the grinding and polishing the surface. This technique produces histological slides of excellent quality, with no damage to the bone-implant interface, which allows detailed observation of tissue architecture, cell types present and fluorochromes. Stevenels blue staining counterstained by Alizarin red S31 described allows differentiating by light microscopy, cells types and tissue present on the site of implantation.
Descriptors: Histology. Bone and bones. Dental implants. Polimethyl methacrylate. Coloring agents.
INTRODUÇÃO
Com o avanço nas tecnologias dos biomateriais metálicos, implantes e/ou mini-implantes, é necessária a avaliação e conhecimento das reações teciduais circundantes. A microscopia tem sido utilizada com frequência, nas variadas áreas da saúde, com objetivo de se compreender as mudanças na estrutura óssea em nível celular1-4,8. A análise das lâminas histológicas pode ser qualitativa ou quantitativa, permitindo conhecer a cinética do turnover ósseo, visualizando tipos celulares correlacionados com a estrutura óssea presente em determinado momento e em reação a determinado estímulo1,3,8,9.
Secções podem ser necessárias para analisar a relação entre osso mineralizado8 e não mineralizado (osteoide)4. Resina metilmetacrilato (MMA) tem sido amplamente utilizada devido a sua dureza, como meio ideal para embeber osso não descalcificado, outros tecidos duros e tecidos com implantes1,4,5,7. Consequentemente, secções de osso mineralizados incluídos em resina metilmetacrilato constituem o método de eleição para estudos do metabolismo ósseo5,6,9.
A avaliação histológica do tecido ósseo tem sido limitada há muitos anos, principalmente devido às dificuldades técnicas de preparo dos espécimes. Donath e Breuner4 descreveram a primeira técnica de processamento histológico para amostras que continham materiais duros como os metais. Na busca de aprimoramento, diversas outras técnicas para material não descalcificado foram descritas2,7,8, apresentando cada uma suas particularidades. A presente técnica resulta da mistura da literatura citada e de várias outras experiências que foram aprimoradas ou corrigidas conforme as necessidades e erros. A técnica foi desenvolvida para a realização de estudo com implantes dentários e, posteriormente com mini-implantes ortodônticos inseridos em osso animal; sendo efetuada com sucesso. Assim, tendo em vista a falta de descrição minuciosa na literatura existente e consequentes dificuldades encontradas, este relato tem o objetivo de descrever detalhadamente a técnica para preparo de tecido ósseo de animais de experimentação contendo implantes metálicos, permitindo sua avaliação com excelência.
Fixação da peça
A primeira etapa do processamento é a fixação dos tecidos cujo objetivo é evitar a destruição das células por suas próprias enzimas ou por bactérias. Os espécimes de osso obtidos por meios cirúrgicos ou pós-eutanásia do animal devem ser imediatamente armazenados em formol a 4% durante três a sete dias, dependendo do tamanho da peça. O período de imersão da amostra no formol não deve ultrapassar uma semana, de forma a evitar uma leve descalcificação promovida pelo formol, a qual pode prejudicar sua posterior análise, no caso, por exemplo, de analisar fluorocromos6,9.
Alguns artigos2,7,8 relatam a utilização de formol a 10%, porém esta diferença é equivocada, uma vez que muitos pesquisadores utilizam formol comercialmente manipulado a 37% e o diluem em dez vezes, o que na verdade consiste em uma concentração de 3,7%, ou seja, aproximadamente 4% denominando-o inadequadamente.
O frasco selecionado para esta etapa deve ter boca larga porque a amostra após a fixação sofrerá enrijecimento, fato que poderá dificultar ou até mesmo impossibilitar a sua remoção. Além disso, o frasco deverá permitir o armazenamento da amostra em um volume de formol cerca de dez vezes o volume da peça.
Um detalhe a ser ressaltado é a identificação adequada das amostras com lápis, o qual, diferentemente da tinta da caneta, não será apagado pelo contato com o álcool que será utilizado numa próxima etapa. Decorrido o tempo da fixação, aconselhamos aparar as amostras para que eventuais resíduos sejam removidos na lavagem com água corrente.
Lavagem da peça
Esta etapa consiste na lavagem das amostras em água corrente por 24 horas com objetivo de eliminar o fixador (formol).
Desidratação das peças
A desidratação é realizada para promover a retirada de água do tecido, de forma que possibilite a posterior infiltração da resina, já que estes não são miscíveis. Novamente, o frasco deverá permitir o armazenamento da amostra em um volume de álcool cerca de dez vezes o volume da peça.
A concentração inicial de álcool utilizada na desidratação também varia conforme o autor da técnica. Iniciamos a desidratação com a concentração de 30%, pois remove pequena quantidade de água da amostra, evitando distorções dos tecidos por contração. Assim, as amostras devem permanecer dois dias em cada graduação alcoólica, devendo iniciar a desidratação com álcool 30% e trocar para as seguintes graduações crescentes: 40, 70, 95 e 100%. Finalizadas estas trocas devemos novamente realizar uma última imersão em novo álcool a 100% por mais dois dias.
Se o pesquisador, por alguma razão, precisar interromper o processo durante a desidratação, existem dois momentos para tal: primeiro, quando sua amostra tiver na concentração de álcool 70%, podendo permanecer por um período longo ou na concentração de álcool 100%, permitindo uma pequena pausa, já que as amostras armazenadas em geladeira não sofreriam alterações.
Diafanização da peça
O passo seguinte é a diafanização, ou seja, a remoção total de resíduos de água e álcool contidos na amostra até aqui. As amostras devem permanecer dois dias e, ainda, seguidos de uma nova troca por mais dois dias no xilol. Dessa forma, o uso do xilol, além de completar a desidratação, permite uma condição favorável à infiltração da resina.
Infiltração da resina
A infiltração é o período necessário para que a resina metilmetacrilato (MMA) seja dissipada por toda amostra preenchendo o tecido. A Infiltração da resina é constituída das fases A e B, sendo a inclusão da peça feita em uma fase C.
Na FASE A devemos preparar uma solução resinosa constituída por 85% de MMA (Merck C5H8O2 – nº 800590) e 15% de Dibutilfitalato (DF) (Merck C16H22O4 – nº 814157). Misturar as substâncias até que fiquem homogêneas, preferencialmente em capela de fluxo laminar, pois estes reagentes são voláteis. Assim, as amostras devem permanecer na geladeira nesta solução da FASE A por no mínimo dois dias, podendo variar o tempo conforme o tamanho da amostra.
Na FASE B devemos preparar uma solução com 85% de MMA, 15% de DF e 1 g de Peróxido de benzoíla (PB) (Sigma C14H10O4 B2030). Ao preparar a solução misture primeiro o PB lentamente ao MMA e só acrescente o DF no final; do contrário, a solução não ficará homogênea. Nesta solução, as amostras devem permanecer por no mínimo dois dias em geladeira.
Inclusão das peças
A inclusão é a etapa na qual a resina é vertida sobre a peça cobrindo-a totalmente com excesso de solução. Neste momento devemos selecionar os frascos a ser utilizados. O tamanho do frasco é importante, já que, se for muito grande em relação ao tamanho da amostra teremos um espaço vazio também muito grande, ou seja, se o espaço vazio for maior do que a metade do frasco isto acarreta em abundante volume de oxigênio em seu interior, inibindo consequentemente a polimerização. Se o frasco não permitir a polimerização verta mais solução de FASE C sobre a amostra ou troque o frasco. Do contrário, se o tamanho do frasco for muito próximo ao tamanho da amostra poderá ocasionar a produção de grande quantidade de bolhas. As bolhas são consideradas indesejáveis por prejudicarem a análise, gerando artefatos na imagem. Sempre que forem produzidas bolhas indesejáveis podemos quebrar o frasco e voltar a peça na FASE A, pois a solução FASE A dissolve o bloco de resina. Então, após a dissolução total do bloco repita todo o processamento novamente respeitando dois dias em FASE A, mais dois dias na FASE B e novamente inclusão em FASE C.
O frasco não necessita ser âmbar se for armazenado em estufa durante o período de polimerização. E ainda, não utilize os frascos que não promovem uma boa vedação da tampa, pois estes permitem a entrada de oxigênio, prejudicando a polimerização da resina. Após a seleção do frasco é necessário realizar uma camada de fundo com a resina na FASE C para que a amostra não fique em contato direto com a parede do frasco, o que poderia promover bolhas.
Na FASE C devemos preparar uma solução com 85% de MMA, 15% de DF e 3 g de PB. Então, novamente deve-se ter cuidado ao preparar a solução; misture primeiro o PB lentamente ao MMA e só acrescente o DF ao final, para a solução ficar homogênea. A solução da FASE C sofrerá polimerização em 3 dias quando armazenada em estufa a 37ºC (Figura 1) ou 7 dias em temperatura ambiente (27ºC) ou banho-maria.
Contudo, como a polimerização de metacrilato envolve uma reação exotérmica provoca, assim, alteração na atividade enzimática e na antigenicidade. Portanto, se o objetivo for realizar estudo imuno-histoquímico substitua o metacrilato por uma geração mais recente de metilmetacrilato, que apresente polimerização em baixa temperatura (-20ºC) como, por exemplo, o Technovit 91003,9.
Finalizada a polimerização da resina devemos cuidadosamente quebrar o frasco que serviu de molde para inclusão e aparar o excesso de resina do bloco, permitindo uma microtomia mais rápida (Figura 2).


Microtomia
A microtomia consiste na obtenção de finas secções ou cortes do bloco de resina permitindo a confecção de lâminas histológicas. Assim, utilizando um micrótomo com disco (Vari-cut da Leco® ou Isomet da Buehler®) ou uma fita de diamante (Exakt Cutting Systems da Exakt®) devemos posicionar o bloco conforme o plano de interesse. Nas amostras com implante, por exemplo, o bloco é posicionado de forma que o sentido do corte esteja de acordo com o longo eixo do implante. Estes equipamentos são de fácil manuseio, requerendo um pouco de experiência do operador para posicionar o plano de corte. O principal cuidado a ser tomado é o aperto do bloco na pinça do equipamento, pois qualquer movimentação do bloco pode empenar ou quebrar o disco ou a fita.
Os equipamentos que utilizam disco de diamante necessitam de calibração do peso que colocamos no braço e este parâmetro deve ser regulado, pois um peso leve acarreta em cortes demorados e com peso excessivo a resina esquenta durante o corte emplastando o disco, o que ocasiona perda do fio de corte.
O número de secções obtidas depende do tamanho da amostra. De um implante com pequeno diâmetro (1,4 mm) não é possível confeccionar mais do que dois cortes da porção central do implante obtendo duas metades (Figura 3).
A secção obtida apresenta cerca de 300 μm de espessura e deve ter a face de interesse polida, antes de ser colada na lâmina (Figura 4). Para isto, são utilizadas as lixas de granulometria 4000, que reduzem os riscos dessa superfície promovidos pelo corte. Lave em água corrente o corte para remover resíduos e seque bem. Neste momento, a secção é colada em lâminas de acrílico com cola à base de cianoacrilato (Superbonder, Loctite®, São Bernardo do Campo, Brasil).
Acabamento e polimento
A etapa seguinte é a de desbaste e polimento com objetivo de atingir a espessura desejada e reduzir ao máximo a presença de riscos. Podem ser utilizadas politriz metalográfica manual (Spectrum System 1000 da Leco®) ou uma automática (Exakt 400 CS da Exakt®) empregando- se lixas d'água de carbeto de silício de granulometria decrescente (1000, 1500, 2000, 2500 e 4000 mesh).
Se o objetivo final é uma lâmina de 50 μm devemos desgastar a lâmina inicialmente com as lixas 1000, 1500 e 2000, verificando a espessura que foi desgastada com auxílio de um paquímetro digital. Portanto, em média iremos desgastar 50 μm com a lixa 1000, 50 μm com a lixa 1500 e 50 μm com a lixa 2000. Assim, partindo da medida inicial de 300 μm de espessura quando colamos a lâmina após o acabamento teremos uma espessura de 150 μm iniciando neste momento o polimento. O polimento será realizado utilizando a lixa 2500 até obtermos a espessura de 100 μm e a finalização do polimento fica por conta da lixa 4000, chegando com ela até a espessura de 50 μm.
Alguns detalhes são importantes para que se obtenha a espessura final da lâmina desejada. Antes da colagem do corte sobre a lâmina, deve-se medir a espessura da lâmina e também a espessura do corte, separadamente. Isto é importante, pois no momento da colagem com o cianoacrilato se não aplicarmos uma pressão padronizada sobre o conjunto corte-lâmina a espessura de cola pode prejudicar a mensuração final. Calcule a espessura da cola e a considere durante a avaliação da espessura desejada.
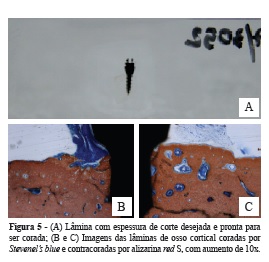
Portanto, concluído o polimento a lâmina está pronta para aplicarmos a coloração (Figura 5A).


Coloração
A coloração é um conjunto de etapas a que submetemos a lâmina histológica para observarmos com clareza diferentes contrastes, o que permitirá identificar e distinguir significativamente diferentes estruturas teciduais resultando em uma análise qualitativa e quantitativa da amostra1,6.
Finalizado o desgaste e polimento, a secção deve ser lavada em água corrente para remover os debris de desgastes.
Para garantir boa penetração do corante, é necessário fazer previamente uma suave descalcificação da superfície da lâmina. Deve-se aplicar sobre a secção ácido fórmico a 1% durante 1 minuto e meio, com objetivo de remover poucos micrômetros de cálcio da secção, permitindo melhor penetração do corante dentro do osso, atingindo desse modo a coloração almejada.
Esta metodologia é útil para corar superfícies de secções de osso (com ou sem implantes metálicos) embebidas em MMA polidas na espessura de 20 a 200 um, montadas em lâminas de acrílico transparentes. O MMA é muito hidrofóbico e somente certos corantes de baixo peso molecular realmente penetram no MMA; assim, para adequada coloração dos componentes teciduais mais delicados utilizamos o auxílio de calor ou soluções corantes alcalinas (pH 7 ‒ 9).
Esta técnica de coloração promove excelentes detalhes celulares e é comumente utilizada para se estudar a interface do osso com o implante metálico.
Preparo dos corantes
Azul de Stevenels:
• Solução D: 1 g azul de metileno + 75 mL de água destilada
• Solução E: 1,5 g de permanganato de potássio + 75 mL de água
Misturar bem cada uma das soluções individualmente para boa dissolução do pó. Depois, misturar as soluções D e E em um recipiente em banho- -maria, mexendo levemente até que o precipitado dissolva. Esta é uma fase crítica, pois se não for dissolvido completamente, pode resultar em falhas na coloração. Deixe a solução repousar e esfriar por 30 minutos e, então, filtre-a. Esta solução não necessita ser refiltrada periodicamente. E ainda, existe uma solução de Stevenels blue pronta para uso, comercializada pelo nome de Sandersons Rapid Bone Stain (Surgipath).
Alizarina Red S31:
• 100 mL de água destilada + 2 g de alizarina red S
Diluir o corante alizarina vermelha em água destilada morna (aproximadamente 45°C), misturando cuidadosamente. Quando estiver completamente diluído, deixe a solução atingir a temperatura ambiente e ajuste o pH para 4,1 à 4,3, com gotas de hidróxido de amônio diluído. A solução fica na cor de iodo intenso e se mantém estável por meses.
Procedimentos de coloração
As secções devem ser previamente coradas com Azul de Stevenels, e então contracoradas com a Alizarina red S, Van Grieson ou outro.
• O corante Azul de Stevenels deve estar preaquecido e mantido à temperatura de 55 – 60°C em banho-maria. Mergulhe a lâmina e mantenha por 15 minutos neste corante, tendo o cuidado de não encostar a superfície a ser corada nas paredes do recipiente.
• Enxaguar em água destilada aquecida a 60°C e secar com jatos leves de ar.
• Depois de corado com azul de Stevenels, pipete uma pequena quantidade de Alizarina red S na superfície da lâmina e, então, core por dois minutos em temperatura ambiente.
• Enxague abundantemente em água destilada para remover o excesso do corante. Assim, coloque a lâmina imersa em recipiente com água destilada mantendo por três minutos e, ainda, devemos realizar duas trocas de água. Esta etapa é necessária para evitar que fiquem pigmentos do corante em excesso no corte.
• Secar com jatos de ar leves.
No momento da análise das lâminas, é interessante colocar uma lamínula de vidro sobre a superfície do bloco a ser estudado, para evitar refração.
A alizarina vermelha é um corante que atua pela formação de complexos quelados com o cálcio e provê resultados confiáveis com sua deposição. Quando usada no pH 4,2, sendo específico para os sais de cálcio, torna evidente somente radicais de fosfato e carbonato fornecendo, assim, bons resultados ocasionados por depósitos pequenos e grandes de cálcio. Portanto, a Alizarina red S cora especificamente o cálcio nos tecidos mineralizados em tonalidades de laranja até roxo, dependendo do tempo de exposição ao corante. Entretanto, os demais tecidos permanecerão corados pelo azul de Stevenels que evidencia células e estruturas extracelulares em uma sutil graduação de tons de azul (Figuras 5B e C).
CONCLUSÕES
A técnica descrita viabiliza o estudo histológico de tecidos mineralizados com implantes metálicos permitindo a realização de microscopia com excelente qualidade de imagem o que, consequentemente, resulta em uma análise histomorfométrica mais fidedigna.
REFERÊNCIAS
1. Callis GM. Bone. In: Bancroft JD and Gamble M. Theory and practice of histological techniques. 6th ed. Elsevier Health Sciences; 2008. p. 333-63. [ Links ]
2. Chappard D, Alexandre C, Camps M, Montheard JP, Riffat G. Embedding iliac bone biopsies at low temperature using glycol and methyl methacrylates. Stain Technol 1983 Sep;58(5):299-308. [ Links ]
3. Chappard D, Palle S, Alexandre C, Vico L, Riffat G. Bone embedding in pure methyl methacrylate at low temperature preserves enzyme activities. Acta Histochem 1987;81(2):183-90. [ Links ]
4. Donath K, Breuner G. A method for the study of undecalcified bones and teeth with attached soft tissues The Säge- Schliff (sawing and grinding) technique. J Oral Pathol 1982;11(4):318-26. [ Links ]
5. Hand NM. Plastic Embedding for light microscopy. In: Bancroft JD and Gamble M. Theory and practice of histological techniques. 6th ed. Elsevier Health Sciences; 2008. p. 585-99. [ Links ]
6. Horobin RW. How do histological stains work? In: Bancroft JD and Gamble M. Theory and practice of histological techniques. 6th ed. Elsevier Health Sciences; 2008. p. 105-19. [ Links ]
7. Maniatopoulos C, Rodriguez A, Deporter DA, Melcher AH. An improved method for preparing histological sections of metallic implants. Int J Oral Maxillofac Implants 1986;1(1):31-7. [ Links ]
8. Schenk RK, Olah AJ, Herrmann W. Preparation of calcified tissues for light microscopy. In: Dickson GR (ed). Methods of calcified tissue preparation. Amsterdam: Elsevier; 1984. p 1-56. [ Links ]
9. Yang R, Davies CM, Archer CW, Richards RG. Immunohistochemistry of matrix markers in Technovit 9100 new embedded undecalcified bone sections. Eur Cell Mater 2003;6:57-71. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Priscilla C. Chibebe Catharino
Avenida Professor Lineu Prestes, 2227 – Cidade Universitária
CEP 05508-000 – São Paulo/SP
e-mail: prichibebe@hotmail.com
Recebido em: 6/2/12
Aceito em: 14/5/12













