Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RFO UPF
versão impressa ISSN 1413-4012
RFO UPF vol.15 no.2 Passo Fundo Mai./Ago. 2010
Avaliação in vitro do pH do hidróxido de cálcio usado como medicação intracanal em associação com clorexidina e racealfatocoferol
In vitro evaluation of intracanal medication pH of calcium hydroxide in association with chlorhexidine and racealfatocoferol
Milton Carlos KugaI; Maristella Oliveira PirollaII; Paula Christiane FreitasII; Arnaldo Sant'Anna JúniorIII; Juliane Maria Guerreiro-TanomaruIV; Marcus Vinicius Reis SóV
IProfessor doutor do Departamento de Odontologia Restauradora da Faculdade de Odontologia de Araraquara, Departamento de Odontologia Restauradora, Araraquara, SP, Brasil
IICirurgiãs-dentistas pela Funec, Santa Fé do Sul, SP, Brasil
IIIProfessor mestre de Endodontia da Funec, Santa Fé do Sul, SP, Brasil
IVProfessora doutora do Departamento de Odontologia Restauradora, Universidade Estadual Paulista, Araraquara, SP, Brasil
VProfessor adjunto do curso de Odontologia da Universidade Federal do Rio Grande do Sul, Faculdade de Odontologia, Departamento de Odontologia Conservadora, Endodontia, Porto Alegre, RS, Brasil
RESUMO
OBJETIVO: Este estudo avaliou o pH do hidróxido de cálcio (Calen®) associado ou não com clorexidina 0,4% e, quando associado à clorexidina, acrescido de 10% ou 20% de racealfatocoferol, em diversos períodos de tempo.
MÉTODOS: Quarenta tubos de dentina de 20 mm, devidamente padronizados, foram confeccionados a partir de raízes de dentes anteriores bovinos. Na sequência, uma perfuração foi realizada na face distal das raízes, a 7 mm da linha cervical radicular, com a broca carbide 1/2. Após a total impermeabilização da raiz, exceto no local da perfuração, os canais radiculares foram preenchidos com uma das seguintes associações: Grupo I - Calen®; Grupo II - Calen® com clorexidina a 0,4%; Grupo III - Calen® com clorexidina a 0,4% acrescida com 20% (em peso) de composto de racealfatocoferol; Grupo IV - Calen® com clorexidina a 0,4% acrescida com 10% (em peso) de composto de racealfatocoferol. Após o vedamento da porção cervical, as raízes foram imersas em água MiliQ e o pH, avaliado em 24h, 7, 14, 21, 28 e 45 dias.
RESULTADOS E CONCLUSÃO: Em todos os períodos testados o pH do hidróxido de cálcio (Calen®) assemelhou ao pH do hidróxido de cálcio (Calen®) associado com clorexidina 0,4% e 10% de racealfatocoferol (p > 0,05). Associação de 20% de racealfatocoferol sempre obteve menor pH que a associação com 10% (p < 0,05). O pH da associação com clorexidina foi semelhante ao hidróxido de cálcio puro (Calen®) somente após o 14º dia(p > 0,05). Porém, no 45º dia essa diferença voltou a ser significativa (p < 0,05).
Palavras-chave: Hidróxido de cálcio. Digluconato de clorexidina. Alfa-tocoferol.
ABSTRACT
OBJECTIVE: The aim of this study was to evaluate the pH of calcium hydroxide (CalenTM) when associated or not with chlorhexidine 0.4%, and when associated with chlorhexidine with the addition of 20% or 10% of alphatocopherol (AchéTM), assessed in several periods of time.
METHODS: Fourty dentine tubes 20 mm, properly standardized, were made from bovine anterior teeth roots. Following, a perforation was achieved in the roots distal face at 7 mm from the cervical radicular line by using a #1/2 carbide bur. After complete root sealing is made, except in the perforation local, the radicular canals were filled with one of the following associations: Group I - Calen®; Group II - Calen™ with chlorehxidine at 0.4%; Group III - Calen™ with chlorhexidine at 0.4% with the addition of 20% (weight) of alhatocopherol compound and Group IV - Calen™ with chlorhexidine at 0.4% with the addition of 10% (weight) alphatocopherol. After cervical sealing is accomplished, the roots were immersed in water MiliQ and the pH, assessed in 24h, 7, 14, 21, 28 and 45 days.
RESULTS AND CONCLUSION: In all periods tested, the pH of the calcium hydroxide (Calen™) was similar to the pH of the calcium hydroxide (Calen™) associated with chlorhexidine 0.4% and 10% alphatocopherol (p > 0.05). The association of 20% alphatocopherol obtained the pH lower than the association with 10% (p < 0.05). The pH of the association with chlorhexidine was similar to the pure calcium hydrocide (Calen™) after the 14th day (p > 0.05) only. Therefore, on the 45th day, this difference was significant again (p < 0.05).
Key words: Calcium hydroxide. Chlorhexidine gluconate. Alpha-tocopherol.
Introdução
A associação do hidróxido de cálcio a diversas substâncias na medicação intracanal em situações de polpas necróticas visa, principalmente, ao sinergismo de suas propriedades microbiológicas1-6. Ciente de que micro-organismos anaeróbios facultativos representam a maior população de bactérias presentes nas situações dos fracassos endodônticos7-9 e diante da favorável ação de redução de micro-organismos do canal radicular proporcionada pela irrigação endodôntica com a clorexidina10,11; vislumbra-se a possibilidade de seu emprego também como medicamento de uso intracanal12; puro ou associado a outros fármacos.
Entretanto, existem algumas inconveniências em relação à associação da clorexidina com o hidróxido de cálcio, dentre as quais a sua toxidade, quando empregada em elevadas concentrações13. Por outro lado, nesta associação também há a formação de radicais oxidativos14,15; que ocasionam danos à parede celular14; reduzindo, assim, a sua biocompatibilidade.
Objetivando atenuar a agressividade celular dessa associação, tem-se proposto a utilização da clorexidina a 0,4%16 na pasta de hidróxido de cálcio. Em contrapartida, há a indesejável redução do potencial antimicrobiano do curativo, pois a pasta na concentração de 0,2% de clorexidina apresenta uma significativa redução de ação sobre o Enterococcos faecalis, quando comparada ao hidróxido de cálcio com paramonoclorofenol canforado17.
A busca de associações que mantenham as propriedades antimicrobianas da clorexidina numa concentração adequada, contudo sem ocasionar danos celulares, ainda é indefinida. Neste propósito, o alfa-tocoferol pode ser uma alternativa, pois exerce ação protetora de membrana celular, interferindo na ação de radicais livres oxidativos18. Entretanto, apesar de esse raciocínio lógico ser viável, há carência de estudos comprobatórios de sua eficácia físico-química, biológica e microbiológica.
Assim, a avaliação do pH proporcionado pela medicação intracanal em diversos períodos de análise, associando o hidróxido de cálcio à clorexidina 0,4% acrescida de 20% ou 10%, em peso, em relação à pasta Calen®; avalia, inicialmente, a possível viabilidade desta composição, averiguando se há interferências sobre a liberação de íons hidroxila do hidróxido de cálcio.
Portanto, objetivou-se com o presente estudo avaliar o pH de combinações da pasta Calen® com clorexidina a 0,4% agregado ao racealfatocoferol em tubos de dentina padronizados com uma perfuração lateral, em diversos períodos de quantificação.
Materiais e método
Quarenta raízes de dentes anteriores bovinos com os ápices radiculares fechados e semelhantes foram seccionadas transversalmente ao longo eixo dental, mantendo-se o comprimento de 15 mm de extensão a partir do ápice radicular. O diâmetro interno do canal radicular foi ampliado em baixa rotação com a ponta diamantada KG95G (KG Sorensen, São Paulo - SP, Brasil), em peça de mão, penetrando de cervical para apical até 5 mm aquém do ápice radicular. O desgaste do canal radicular foi adequadamente controlado, de tal forma que a espessura dentinária em todo o seu perímetro permanecesse constante em 2 mm de espessura, conferida com um espessímetro.
Concluída a ampliação com uma broca carbide FG1/2 (KG Sorensen, São Paulo - SP, Brasil), confeccionou-se uma perfuração na face vestibular radicular até que se atingisse o canal radicular. Na sequência, toda a superfície externa, exceto o local da perfuração, foi impermeabilizada com duas camadas de isolante para telhas (Hydronorth, Londrina - PR, Brasil) e uma camada de esmalte de unhas convencional.
As raízes foram, então, separadas em quatro grupos experimentais com dez dentes cada, de acordo com o tipo de medicação intracanal empregada: GI - Pasta Calen® (SS White, São Paulo - SP, Brasil); GII - Pasta Calen® (SS White, São Paulo - SP, Brasil) com digluconato de clorexidina a 0,4%; GIII - Pasta Calen® (SS White, São Paulo - SP, Brasil) com digluconato de clorexidina a 0,4% associado ao composto de racealfatocoferol (Aché Laboratórios Farmacêuticos S.A., São Paulo - SP, Brasil), na proporção de 1,0g:200 mg, respectivamente, e GIV - Pasta Calen® (SS White, São Paulo - SP, Brasil) com digluconato de clorexidina a 0,4%, na proporção de 1,0g:100 mg, respectivamente. Os canais radiculares foram totalmente preenchidos com uma das combinações, utilizando o Sensipast® (FKG Dentaire, Suíça), conferido por meio de análise radiográfica nos sentidos mesiodistal e vestibulolingual.
Após o preenchimento, da porção cervical radicular, retiraram-se 2,0 mm da medicação e o local foi vedado com Coltosol® (Vigodent S.A. Ind. e Com., Rio de Janeiro - RJ, Brasil), impermeabilizado como anteriormente descrito, e imediatamente as raízes foram imersas em 10 mL de água MiliQ. Os frascos que as acondicionaram foram vedados e mantidos em temperatura de 37ºC, sem qualquer agitação, mantendo-se a mesma água durante todo o período experimental de análise.
O pH da água foi então medido com pHmetro Digimed DM22 (Digimed, São Paulo - SP, Brasil), devidamente calibrado, com temperatura ambiente em 25 ºC, nos períodos de 24h, 7, 14, 21, 28 e 45 dias. Os dados obtidos foram submetidos à análise de variância a um critério e ao teste de Tukey, em nível de significância de 5%, independentemente de cada período analisado.
Resultados
A Tabela 1 ilustra médias de valores de pH obtidos pelos grupos experimentais em função dos tempos de análise de 24h, 7, 14, 21, 28 e 45 dias. Em 24h, o Calen® apresentou maior pH que os grupos do Calen® com digluconato de clorexidina a 0,4%, e o do Calen® com digluconato de clorexidina a 0,4% com 20% de racealfatocoferol (p < 0,05). Idêntica situação ocorreu com o Calen® com digluconato de clorexidina a 0,4% associado a 10% de racealfatocoferol, sendo superior ao Calen® com digluconato de clorexidina a 0,4% associado ou não a 20% de racealfatocoferol (p < 0,05). Os grupos do Calen® puro e o Calen® com digluconato de clorexidina a 0,4% associado a 10% com racealfatocoferol assemelharam-se entre si (p > 0,05). Em sete dias, as médias de pH das pastas apresentaram o mesmo comportamento.
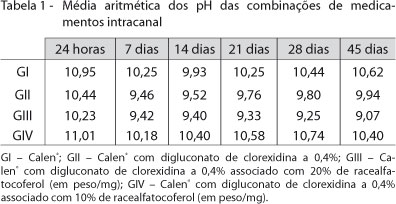
Em 14 dias, apenas a pasta Calen® com digluconato de clorexidina a 0,4% com 10% de racealfatocoferol apresentou pH significativamente maior que a associação da pasta com digluconato de clorexidina a 0,4% ou a combinada com 20% de racealfatocoferol (p < 0,05). Os demais grupos se assemelharam entre si (p > 0,05).
Em 21 dias, o perfil da combinação com 10% de racealfatocoferol se manteve semelhante aos 14 dias, porém o Calen® isoladamente demonstrou maior pH que a combinação do grupo de 20% de racealfatocoferol (p < 0,05). Semelhantes resultados foram mantidos para os 28 dias de análise.
Em 45 dias o Calen® manteve-se com maior pH que o grupo da combinação com 20% de racealfatocoferol e novamente diferiu do grupo Calen® associado à clorexidina a 0,4%. Neste momento, o Calen® com digluconato de clorexidina a 0,4% apresentou maior pH do que o grupo dos 20% de racealfatocoferol (p < 0,05). Outra peculiaridade é que o grupo do 10% de racealfatocoferol assemelhou-se ao do Calen® com digluconato de clorexidina a 0,4% (p > 0,05), diferindo apenas do grupo da combinação com 20% de racealfatocoferol.
Discussão
As ações satisfatórias do hidróxido de cálcio podem ser atribuídas à dissociação iônica de íons cálcio e hidroxila. A influência do pH no transporte e permeabilidade de nutrientes da membrana citoplasmática provavelmente explicaria a ação antimicrobiana dos íons hidroxila no controle da atividade enzimática bacteriana19. Portanto, ao selecionar um veículo para o hidróxido de cálcio, deve-se avaliar a viabilidade desta associação nesta reação química, bem como o benefício proporcionado pela associação.
Diversas combinações já foram propostas ao hidróxido de cálcio, porém o entusiasmo na utilização do digluconato de clorexidina advém do propósito de uma possível potencialização da ação antimicrobiana, principalmente sobre micro-organismos anaeróbios facultativos12,20; em especial o E. faecalis21. Entretanto, a compatibilidade biológica da clorexidina tem sido muito questionada, em razão dos seus efeitos deletérios celulares22. Esta toxidade tem sido frequentemente atribuída à presença da paracloroanilina, um subproduto residual da reação com o hipoclorito de sódio23. Sua presença ainda é questionável24; pois os estudos que não demonstram a sua existência foram conduzidos empregando a reação do hipoclorito de sódio com o acetato de clorexidina. Cita-se que o hidróxido de cálcio normalmente é associado ao digluconato de clorexidina.
Esperar-se-ia que tais fenômenos ocorressem quando combinados com a pasta de hidróxido de cálcio, porém nesta apresentação não se detecta a presença de paracloroanilina, encontrando-se apenas a presença de ROS (espécimes de radicais oxidativos)14,25. Ainda que o ROS (Reactive Oxygen Species) produzido por neutrófilos desempenhe um papel crítico na resposta do hospedeiro diante de presença de micro-organismos, é crítico na patogênse das doenças pulpares e periodontais26.
Assim, o ideal seria associar a pasta Calen® (hidróxido de cálcio) e clorexidina a 0,4% com algum fármaco capaz de interferir na síntese de radicais oxidativos, permitindo apenas as ações benéficas da pasta propriamente dita. Com esse propósito, algumas substâncias deveriam ser avaliadas, dentre as quais o racealfatocoferol, pois é um reconhecido inibidor de radicais livres.
O pH da associação com racealfatocoferol na proporção de 10% em peso foi maior que o da proporção a 20% em todos os períodos avaliados (p < 0,05) e também em relação ao Calen® com clorexidina a 0,4% (p < 0,05), exceto após 45 dias de análise (p > 0,05). Isso leva a crer que o racealfatocoferol em menores concentrações, nos períodos iniciais, provavelmente interfira na ação química da clorexidina, sugerindo que, primeiramente, haveria a combinação com o digluconato de clorexidina. Curiosamente, quando o racealfatocoferol (em 10%) é associado à pasta com a clorexidina, evita a interposição que esta promove sobre o pH. Destaca-se que a clorexidina a 0,4% retarda a alcalinização do meio proporcionado pelo Calen®; pois somente após o 14º dia de avaliação é que os pHs das combinações se equivaleram.
Entretanto, na proporção de 20% de racealfatocoferol o pH é menor que o proporcionado pelo Calen®; sendo significativo em quase todos os períodos de avaliação (p < 0,05). Provavelmente, isso tenha ocorrido em virtude de o racealfatocoferol apresentar alta viscosidade, e na proporção de 20% pode ter havido uma liberação mais lenta dos íons hidroxila, bem como uma menor difusibilidade dentinária. A situação é semelhante ao que ocorre quando comparados veículos hidrossolúveis com o óleo de oliva ou de maior densidade27,28.
Outra peculiaridade notável é o pH significativamente maior do Calen® quando comparado com o Calen® associado à clorexidina a 0,4%. Essa situação tende a permanecer até o 14º dia, momento em que as duas substâncias se igualam: porém, após 45 dias há novamente uma diferenciação, com o Calen® apresentando maior pH. Isso sugere que, provavelmente, cargas elétricas moleculares estejam envolvidas, pois o hidróxido de cálcio, ao liberar íon hidroxila, pode, inicialmente, combinar-se com a carga elétrica positiva da clorexidina, mantendo o pH em patamares inferiores ao do Calen® isoladamente.
Assim, apesar de necessitar de estudos complementares biológicos, o racealfatocoferol, em concentrações inferiores a 10% em peso, pode ser uma alternativa a fim de tornar a pasta de hidróxido de cálcio e clorexidina mais viável e aplicável clinicamente.
Conclusões
Diante do exposto no presente trabalho e averiguável por meio da metodologia empregada, pode-se concluir que:
- o racealfatocoferol, na proporção de 10% em peso, não interfere no pH da pasta Calen®;
- há interferência da clorexidina a 0,4%, isolada ou associada a 20% de racealfatocoferol, no pH do Calen® no período de até o 14ºdia (p < 0,05) e também no período do 45º dia (p < 0,05), demonstrando menor pH do que a pasta Calen® pura;
- a associação com o racealfatocofreol na proporção de 20% em peso, é prejudicial ao pH, mantendo-o significantemente mais baixo que os demais grupos.
Referências
1. Siqueira-Jr JF, Uzeda M. Intracanal medicaments: Evaluation of the antibacterial effects of chlorhexidine, metronidazole, and calcium hydroxide associated with three vehicles. J Endod 1997; 23(3):167-9. [ Links ]
2. Evans MD, Baumgartner JC, Khemaleelakul S, Xia T. Efficacy of calcium hydroxide: chlorhexidine paste as an intracanal medication in bovine dentin. J Endod 2003; 29(5):338-9. [ Links ]
3. Podbielski A, Spahr A, Haller B. Additive antimicrobial activity of calcium hydroxide and chlorhexidine on commom endodontic bacterial pathogens. J Endod 2003; 29(5):340-5. [ Links ]
4. Siqueira-Jr JF, Magalhães KM, Roças IN. Bacterial reduction in infected root canals treated with 2.5% NaOCl as an irrigant and calcium hydroxide/camphorated paramonochlorofenol paste as an intracanal dressing. J Endod 2007; 33(6):667-72. [ Links ]
5. Al-Nazhan S, Al-Obaida M. Effectiveness of a 2% chlorhexidine solution mixed with calcium hydroxide against Candida albicans. Aust Endod J 2008; 34(3):133-5. [ Links ]
6. Awawdeh L, Al-Beitawi M, Hammad M. Effectiveness of propolis and calcium hydroxide as a short-term intracanal medicament against Enterococcus faecalis: A laboratory study. Aust Endod J 2009; 35(2):52-8. [ Links ]
7. Gomes BPFA, Pinheiro ET, Jacinto RC, Zaia AA, Ferraz CCR, Souza-Filho FJ. Microbial analysis of canals of root-filled teeth with periapical lesions using polymerase chain reaction. J Endod 2008; 34(5):537-40. [ Links ]
8. Molander A, Reit C, Dahlén G, Kvist T. Microbial status of root-filled teeth with apical periodontitis. Int Endod J 1998; 31(1):1-7. [ Links ]
9. Roças IN, Siqueira-Jr JF, Santos KRN. Association of Enterococcus faecalis with different forms of perirradicular diseases. J Endod 2004; 30(5):315-20. [ Links ]
10. Leonardo MR, Tanomaru-Filho M, Silva LAB, Nelson-Filho P, Bonifácio KC, Ito IY. In vivo antimicrobial activity of 2% chlorhexidine used as root canal irrigating solution. J Endod 1999; 25(3):717-9. [ Links ]
11. Wang CS, Arnold RR, Trope M, Teixeira FB. Clinical efficiency of 2% chlorhexidine gel in reducing intracanal bacteria. J Endod 2007; 33(11):1283-9. [ Links ]
12. Krithkodotta J, Indira R, Dorothykolyani AL. Disinfection of dentinal tubules with 2% chlorhexidine, 2% metronidazole, bioactive glass when compared with calcium hydroxide as intracanal medicaments. J Endod 2007; 33(12):1473-6. [ Links ]
13. Silva RAB, Leonardo MR, Silva LAB, Faccioli LH, Medeiros AIM. Effect of a calcium hydroxide-based paste associated to chlorhexidine in RAW 264.7 macrophage cell line culture. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 106:e44-51. [ Links ]
14. Yeung SY, Huang CS, Chan CP, Lin HN, Lee PH, Jia HW, et al. Antioxidant and pro-oxidante properties of chlorhexidine and its interaction with calcium hydroxide solution Int Endod J 2007; 40(1):837-44. [ Links ]
15. Barbin LE, Saquy PC, Guedes DFC, Sousa-Neto MD, Estrela C, Pécora JD. Determination of para-chloroaniline and reactive oxygen species in chlorhexidine and chlorhexidine associated with calcium hydroxide. J Endod 2008; 34(12):1508-14. [ Links ]
16. Silva RAB, Leonardo MR, Silva LAB, Castro LMS, Rosa AL, Oliveira PT. Effects of the association between a calcium hydroxide paste and 0.4% chlorhexidine on the development of the osteogenic phenotype in vitro. J Endod 2008; 34(12):1485-9. [ Links ]
17. Sukawat C, Srisuwan T. A comparison of the antimicrobial efficacy of three calcium hydroxide formulations on human dentin infected with Enterococcus faecalis. J Endod 2002; 28(2):102-4. [ Links ]
18. Silva MG. efeitos histológicos e bioquímicos séricos do alfa-tocoferol na lesão de isquemia e reperfusào em membrana pélvica[Dissertação de Mestrado]. São Paulo: Escola Paulista de Medicina da Universidade Federal de São Paulo; 2004. [ Links ]
19. Estrela C, Sydney GB, Bamann LL, Felippe-Junior O. Mechanism of action of calcium and hydroxyl ions of calcium hydroxide on tissue and bacteria. Braz Dent J 1995; 6(2):85-90. [ Links ]
20. Zehnder M, Grawehr M, Hasselgren G, Waltino T. Tissue-dissolution capacity and dentin-disinfecting potential of calcium hydroxide mixed with irrigating solution. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003; 96(5):608-13. [ Links ]
21. Zerella JA, Fouad AF, Sapngberg LS. Effectiveness of a calcium hydroxide and hlorhexidine digluconate mixture as disinfectant during retreatment of falide endodontic cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 100(6):756-61. [ Links ]
22. Faria G, Celes MRN, De Rossi A, Silva LAB, Silva JS, Rossi MA. Evaluation of chlorhexidine toxicity inhected in the paw of mice and added to cultures L929 fibroblasts. J Endod 2007; 33(6):715-22. [ Links ]
23. Basrani BR, Manek S, Sodhi RNS, Fillery E, Manzur A. Interaction between sodium hypochlorite and chlorhexidine gluconate. J Endod 2007; 33(8):966-9. [ Links ]
24. Thomas JE, Sem DS. An in vitro spectroscopic analysis to determine whether para-chloroaniline is produced from mixing from sodium hypochlorite and chlorhexidine. J Endod 2010; 36(2):315-7. [ Links ]
25. Barbin LE, Saquy PC, Guedes DFC, Sousa-Neto MD, Estrela C, Pécora JD. Determination of para-chloroaniline and reactive oxygen species in chlorhexidine and chlorhexidine associated with calcium hydroxide. J Endod 2008; 34(12):1508-14. [ Links ]
26. Márton IJ, Balla G, Hegedüs C, Redl P, Szilágyi Z, Karmazsin L et al. The role of reactive oxygen intermediates in pathogenesis of chronic apical periodontitis. Oral Microb Immunol 1993; 8(4):254-7. [ Links ]
27. Lage-Marques JL, Conti R, Antoniazzi JH, Gutz I. Avaliação da velocidade de dissociação iônica do hidróxido de cálcio associado a diferentes veículos. Rev Odontol USP 1994; 8(2):81-7. [ Links ]
28. Estrela C, Sydney GB, Pesce HF, Fellipe-Junior O. Dentinal diffusion of hydroxyl ions of various calcium hydroxide pastes. Braz Dent J 1995a; 6(1):5-9. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Marcus Vinicius Só
Rua Souza Lobo, 62, casa 03
91320-320 Porto Alegre - RS
Fone: (51) 9967 8504
E-mail: endo-so@hotmail.com
Recebido: 02.03.2010
Aceito: 20.04.2010













