Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RFO UPF
versão impressa ISSN 1413-4012
RFO UPF vol.16 no.1 Passo Fundo Jan./Abr. 2011
Avaliação da biocompatibilidade de implantes de silicone gel em subcutâneo de ratos – estudo histomorfométrico
Evaluation of the biocompatibility of silicone gel implants on rat subcutaneous tissue – histomorphometric study
Diurianne Caroline Campos França*; Alvimar Lima de Castro**; Ana Maria Pires Soubhia***; Eurico Rosa****; Sandra Maria Herondina Coelho Ávila de Aguiar*****
* Aluna do curso de doutorado Odontopediatria, Faculdade de Odontologia Campus de Araçatuba, Unesp. Estomatologista do Centro Estadual de Odontologia para Pacientes Especiais; professora do Departamento de Estomatologia do Univag, Centro Universitário, Várzea Grande, MT, Brasil.
** Livre-docente, professor Titular do Departamento de Patologia e Propedêutica Clínica, Unesp, Faculdade de Odontologia Campus de Araçatuba, SP, Brasil.
*** Livre-docente, professora Adjunta do Departamento de Patologia e Propedêutica Clínica, Unesp, Faculdade de Odontologia Campus de Araçatuba, SP, Brasil.
**** Especialista, médico-cirurgião plástico, membro da Sociedade Brasileira de Cirurgia Plástica, SP, Brasil.
***** Livre-docente, professora Adjunta do Departamento de Odontologia Infantil e Social, Unesp, Faculdade de Odontologia Campus de Araçatuba, SP, Brasil.
RESUMO
Objetivo: Avaliar histomorfometricamente a compatibilidade biológica tecidual de implantes de silicone indicados para cirurgia plástica. Métodos: Trinta ratos albinos Wistar foram implantados subcutaneamente com silicone gel, da marca Silimed®, e de seu revestimento, sendo distribuídos aleatoriamente em seis grupos de cinco animais cada, de acordo com o tipo de material implantado e data dos sacrifícios. Oito áreas de 60,11 mm2 correspondentes às peças cirúrgicas obtidas foram analisadas, contando-se as células mesenquimais, inflamatórias mononucleares, eosinófilos e as células gigantes do tipo corpo estranho, para posterior análise estatística pelo teste de Tukey. Resultados: O silicone gel apresentou processo inflamatório ligeiramente maior em relação aos outros grupos, com reações tissulares de intensidade leve a moderada, cujo resultado foi uma cápsula fibrosa contornando o material que foi reconhecido pelo organismo como corpo estranho. Conclusão: Pode-se afirmar que o silicone gel apresentou níveis aceitáveis de biocompatibilidade, confirmada pela rara presença de células gigantes do tipo corpo estranho, e que, quando rompido, forma-se uma cápsula fibrosa ao redor do material, funcionando como barreira biológica e separando-o do organismo.
Palavras-chave: Géis de silicone. Prótese maxilofacial. Biocompatibilidade.
ABSTRACT
Objective: Histomorphometric study to evaluate the biological tissue compatibility of silicone implants suitable for plastic surgery. Methods: Thirty Wistar white rats received subcutaneous implants ande the revestiment of silicone gel Silimed, and randomized into six groups of five animals each, according to the type of implanted material and the time of sacrifice. Eight areas of 60.11 mm2 corresponding to the obtained surgical pieces were analyzed, counting mesenchymal cells, eosinophils, and foreign body giant cells, observing an acceptable biocompatibility in all implants, for subsequent statistical analysis by Tukey test. Results: Silicone gel showed inflammation slightly greater than for other groups, with tissue reactions varying from light to moderate, whose result was the formation of a fibrous capsule around the material, recognized by the organism as a foreign body. Conclusion: In general, it is possible to affirm that silicone gel had acceptable levels of biocompatibility, confirmed the rare presence of foreign body giant cells, and when of the rupture, formed a fibrous capsule around the material, separating the material of the organism.
Keywords: Silicone gels. Maxillofacial prosthesis. Biocompatibility.
Introdução
Os implantes de silicone gel para aumento e reconstrução das estruturas maxilofaciais foram introduzidos nos Estados Unidos em 1962. Porém, as perguntas sobre a segurança desses dispositivos médicos ainda permanecem, apesar de sua popularidade e disponibilidade1. São utilizados para a reconstrução de áreas corporais, corrigindo deformidades congênitas ou traumáticas e aumentando ou remodelando regiões por razões cosméticas. Os benefícios psicológicos desse procedimento são amplamente reconhecidos. No entanto, apesar do progresso tecnológico na confecção dessas próteses, os implantes de silicone podem provocar uma série de complicações significativas, como endurecimento e ruptura2, seroma, hematoma, fuga ou contratura capsular, este último um dos mais comuns, exigindo um novo procedimento cirúrgico3.
O silicone (polisiloxano) tem uma unidade repetida de monômero consistindo de um grupo de dimetilsiloxano, que é referido como polidimetilsiloxano (PDMS). Esse material tem sido extensivamente usado na área médica, numa variedade de produtos, como implantes de seio, lentes de contato, lubrificantes, selantes, tubos e válvulas artificiais cardíacas, catéteres uretral e sanguíneo, membranas para oxigenação do sangue, tubos de diálise, aplicações ortopédicas e em reconstruções faciais4,5.
O material ideal a ser utilizado para devolver volume aos tecidos moles deve ter características como possuir textura, distensibilidade e cor semelhante aos tecidos vizinhos, ser inerte, persistir no local de implantação, não transmitir ou causar doenças e se integrar com o hospedeiro. A resposta do tecido conjuntivo à implantação de um biomaterial é uma reação inflamatória de corpo estranho, o que determina a necessidade de o implante não ser tóxico nem antigênico, poroso, e ser de tamanho e forma apropriados, devendo ser implantado na forma correta para resistir à fragmentação. Todos esses fatores ajudam a diminuir a resposta natural do hospedeiro a um corpo estranho e, consequentemente, melhoram a biocompatibilidade6,7.
Sabe-se que a formação da cápsula fibrosa ao redor do implante é geralmente um fenômeno natural, resultado inevitável do mecanismo de defesa do organismo chamado de "reação de corpo estranho". Investigações têm sido feitas sobre essa reação em animais, constatando-se que consiste numa série de processos inter-relacionados cujo resultado final pode variar, dependendo da suscetibilidade do material estranho à fagocitose, da incorporação por células gigantes, da inflamação ou isolamento pela fibrose. O processo de formação da cápsula é similar nos modelos de animais e em humanos, sendo ainda desconhecida a etiologia do endurecimento anormal ao redor dos implantes humanos8-10.
Siggelkow et al.11 (2003), Mendes et al.12 (2008) e Palhares et al.13 (2009), por meio de estudos clínicos e histológicos, respectivamente, concluíram que a contratura capsular depende do tempo da implantação, do tipo de aumento, das características da superfície do implante, de idade do paciente, bem como de outros fatores, como hematoma, reação de corpo estranho e infecções subclínicas.
Tavazzani et al.14 (2005), analisando histologicamente o tecido ao redor de implantes de silicone gel, observaram inflamação crônica com as gotas do gel de silicone cercadas por células gigantes ou englobadas por macrófagos, área de fibrose e necrose.
Poveda et al.15 (2006), após implantação de substâncias cosméticas em humanos, dentre as quais o silicone gel, observaram histologicamente a reação de corpo estranho com células gigantes multinucleadas.
É proposta deste trabalho a observação histomorfométrica do tecido celular subcutâneo de ratos após a implantação de silicone gel de uso médico, o Silimed, separando-se o revestimento do conteúdo interno com vistas à biocompatibilidade dos tecidos ao material.
Material e métodos
Os experimentos relativos a esta pesquisa foram aprovados pela Comissão de Ética na Experimentação Animal da Faculdade de Odontologia do Câmpus de Araçatuba – Unesp/protocolo no 13/04, e foram desenvolvidos com a utilização de trinta ratos albinos Wistar, com idade média de noventa dias e peso inicialmente em torno de 250 g, clinicamente livres de qualquer entidade patológica, aleatoriamente divididos em seis grupos com cinco animais cada.
Para os procedimentos experimentais, os animais foram anestesiados por via intraperitonial com solução de cloridrato de Ketamina a 5%, associado a um relaxante muscular, analgésico e sedativo, Xilazina, na dosagem de 0,050 mL de anestésico e 0,050 mL do relaxante para cada 100 g de peso do animal. Após tricotomia da região dorsal média superior bilateral numa área de 10 cm2, realizou-se antissepsia do campo operatório com solução de PVPI (solução aquosa de polivinilpirrolidona a 10%).
Duas incisões longitudinais de 2 cm foram realizadas com lâmina de bisturi intercambiável no 15 acoplada em cabo Bard-Parker no 3, sendo uma de cada lado do dorso do animal e paralelas entre si, distantes 2 cm uma da outra, para evitar manipulação da região intermediária, objetivando, assim, diminuir a interferência sobre a resposta inflamatória. A divulsão da pele foi realizada bilateralmente no espaço subcutâneo com tesoura reta de ponta romba, de modo que fosse obtido um túnel para alojar os implantes do estudo, à distância aproximada de 1,5 cm da incisão. Os implantes utilizados consistiram de fragmentos com aproximadamente 1,0 cm x 1.0 cm x 0,5 cm, previamente autoclavados a 136 °C por 20 min. Nos grupos 1, 2 e 3 o silicone gel (Silimed®) foi introduzido do lado esquerdo e o lado direito serviu como controle. O mesmo procedimento foi feito nos grupos 4, 5 e 6, com exceção do material implantado, que neste caso foi o revestimento do implante de silicone gel do lado esquerdo, ficando o direito como controle da análise.
Após a implantação, ambas as feridas cirúrgicas foram suturadas e, decorridos os tempos pós-operatórios de sete dias (grupos 1 e 4), 15 dias (grupos 2 e 5) e 30 dias (grupos 3 e 6), os animais foram sacrificados e os tecidos subjacentes, retirados para processamento histopatológico e análise quali-quantitativa. O estudo histomorfométrico foi realizado em computador utilizando o software LEICA QWin, da Leica Imaging Systems Ltda., Cambridge, Inglaterra. Para a captura e padronização da análise dos cortes histológicos adotou-se como critério a seleção de oito áreas de cada animal, no tamanho de 60,11 mm2. A análise foi realizada utilizando-se objetiva de imersão de 100 vezes, iniciando na superfície adjacente à cavidade representada pelo implante. A contagem foi realizada por um único investigador, repetindo-se o procedimento duas vezes, com intervalo de três dias. Os resultados foram tratados estatisticamente pelo teste de Tukey.
Resultados
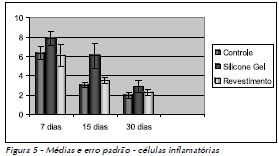
Na análise qualitativa, o grupo de controle, pela ausência do implante de material exógeno, apresentou aos sete dias completa reparação epitelial na área da incisão, mostrando discreta área de tecido de granulação, com predomínio de células inflamatórias mononucleares. Nesse mesmo tempo, ao observar o tecido neoformado ao redor dos implantes de silicone gel e de seu revestimento, verificouse um tecido de granulação cuja faixa mais próxima da área do implante exibia intensa celularidade, caracterizada por células mesenquimais, células inflamatórias mononucleares, algumas células multinucleadas e raros eosinófilos (Fig. 1A, B e C).
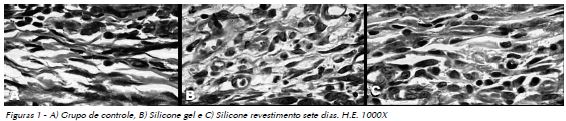
No período de 15 dias a regeneração epitelial mostrou-se completa no grupo de controle e também nos grupos tratados, onde o colágeno ainda apresentava discreto infiltrado inflamatório mononuclear e o conjuntivo subjacente, alguns fibroblastos jovens e poucas células inflamatórias mononucleares (Fig. 2A, B e C).
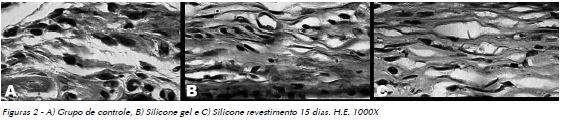
Aos trinta dias, todos os materiais estavam envolvidos por tecido neoformado que circunscrevia o material implantado, constituído por abundantes células fibroblásticas fusiformes dispersas em uma matriz colagenizada, contendo algumas células mononucleares (Fig. 3A, B e C).

A análise histológica quantitativa foi realizada por meio das médias das contagens realizadas em cada grupo e tempo estudados, objetivando a análise dos fenômenos em curto, médio e longo prazos, estabelecendo uma coincidência com os períodos de acompanhamento da cronologia do reparo das feridas cutâneas em ratos normais.
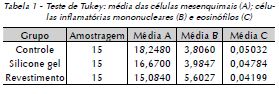
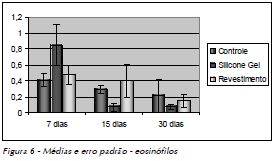
O teste de Tukey aplicado aos resultados observados nos três grupos estudados nos três tempos pós-operatórios demonstrou, quanto às células mesenquimais, que o grupo de controle e o de revestimento apresentaram diferenças significativas entre si (Tab. 1A), ao passo que o grupo do silicone gel não foi significativamente diferente dos outros dois. Em relação às células inflamatórias mononucleares, o revestimento do silicone gel apresentou diferenças significativas em relação aos grupos de controle e silicone gel (Tab. 1B). Os resultados dos eosinófilos não apresentaram diferenças significativas entre os grupos estudados (Tab. 1C).
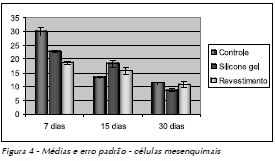
As médias das células identificadas nos respectivos tempos operatórios, os valores do desvio (DP) e erro padrão (EP) estão representados nas Figuras 4 a 6.
Discussão
A segurança e efetividade dos materiais para a utilização em prótese bucomaxilofacial incluem o conhecimento histopatológico da interface implante/ tecido e a possibilidade de ocorrer inflamação crônica e resposta granulomatosa a partir de estudos experimentais, visando-se obter a menor reação possível no hospedeiro, bem como a restauração dos tecidos1.
No presente estudo, o grupo de controle, pela ausência do implante de material exógeno, apresentou aos sete dias completa reparação epitelial na área da incisão, mostrando discreta área de tecido de granulação, com predomínio de células inflamatórias mononucleares. Nesse mesmo tempo, ao observar o tecido neoformado ao redor dos implantes de silicone gel e de seu revestimento, verificamos um tecido de granulação cuja faixa mais próxima da área do implante exibia intensa celularidade, caracterizada por células mesenquimais, células inflamatórias mononucleares, algumas células multinucleadas e raros eosinófilos.
No período de 15 dias a regeneração epitelial mostrou-se completa no grupo de controle e também nos grupos tratados, onde o colágeno ainda apresentava discreto infiltrado inflamatório mononuclear e o conjuntivo subjacente, alguns fibroblastos jovens e poucas células inflamatórias mononucleares.
Pôde-se observar também um infiltrado crônico no tempo inicial, que foi desaparecendo nos outros tempos pós-operatórios. A inclusão de silicone formou uma cápsula fibrosa composta por fibroblastos que se tornaram mais maduros a partir de 15 dias, em substituição ao tecido de granulação, com permanência de pouquíssimas células inflamatórias. Essa cápsula, cuja causa ainda não está clara, poderia ser hipoteticamente explicada pela pobre adesão da superfície do implante aos tecidos, eventualmente contraindo e impedindo a função do implante10,16.
No presente estudo observou-se aos 15 dias, nos animais implantados com silicone gel e com o seu revestimento, um tecido mais maduro, menos celularizado, porém com moderada quantidade de células inflamatórias mononucleares, linfócitos e plasmócitos, em processo de reparo mais retardado que o controle. Raramente se observaram células gigantes próximas à luz do material implantado, o que sugere a boa aceitação do material pelos tecidos implantados.
Aos trinta dias, nos grupos tratados, o tecido neo formado que circunscrevia o material implantado era constituído por abundantes células fibroblásticas fusiformes dispersas em uma matriz colagenizada, contendo algumas células mononucleares. Áreas focais que apresentavam depósito de fragmentos de silicone mostravam um infiltrado inflamatório mononuclear mais intenso, assemelhandose a uma reativação do processo inflamatório.
A observação clínica dos animais permitiu-nos verificar que o silicone é uma substância que não induz reação inflamatória aguda; além disso, não extravasou nem se deslocou do local de implantação, tornando possível o estudo morfométrico, que mostrou em quantificações diferentes para cada material a manutenção do processo reparacional por tempo mais prolongado do que se a reparação fosse sem implante.
Com relação às células inflamatórias e eosinófilos, não houve diferenças significativas nos grupos analisados. Após análise dos quatro parâmetros, concluiu-se que o silicone gel desencadeou um processo inflamatório ligeiramente maior em relação aos outros grupos, porém em níveis aceitáveis de biocompatibilidade, confirmada pela rara presença de células gigantes do tipo corpo estranho.
Aos trinta dias, o exame dos espécimes revelou decréscimo no número de vários tipos celulares, especialmente linfócitos e plasmócitos; os macrófagos foram vistos em poucos cortes histológicos, bem como as células gigantes de corpo estranho. Todos os materiais estavam envolvidos por uma estreita cápsula fibrosa reativa, constituída de fibrócitos, colágeno e vasos sanguíneos. Estudos experimentais em roedores têm definido importantes aspectos da resposta inflamatória de vários tipos de implantes. Aspectos histológicos e funcionais do tecido de granulação formado ao redor dos corpos estranhos são resultado da interação entre as propriedades dos implantes e a capacidade do tecido de reagir ao estímulo.
A geometria da forma, o estado físico, o tipo de superfície e a composição química do corpo estranho são fatores importantes que definem a quantidade e o tipo celular envolvido no processo. A forma geométrica serve como uma orientação espacial do posicionamento das células e da deposição do colágeno. O estado físico e a superfície do material (rugosa ou lisa) têm um importante papel na indução dos tipos celulares envolvidos na reação inflamatória. O tecido capsular formado ao redor de superfícies rugosas reduz a força contráctil dessa cápsula. Os vários tecidos parecem reagir ao mesmo corpo estranho com diferentes intensidades. A interação de todos esses fatores determinará o nível de resposta do tecido ao material implantado6,9.
Assim, considerando o aumento significativo de pessoas que recebem implantes de silicone gel para aumento ou reconstrução das áreas corporais, a literatura pertinente e os resultados obtidos neste trabalho, acreditamos que os materiais avaliados mereçam estudos adicionais, para que o seu emprego em humanos seja feito com bases biológicas mais seguras e confiáveis.
Conclusão
• Tanto o silicone como seu revestimento apresentaram reação inflamatória crônica aceitável, que não os diferenciaram significantemente do grupo controle.
• Em todos os grupos se observaram níveis aceitáveis de biocompatibilidade, confirmada pela rara presença de células gigantes do tipo corpo estranho.
Referências
1. Wang XY, Baba A, Taniguchi K, Hagio M, Miyazaki K. Study on rat subcutaneous reaction to experimental polyurethane elastomers. Dent Mater J 2004; 23(4):512-6. [ Links ]
2. Mortellaro C, Garagiola U, Lucchina AG, Grivetto F, Milone G, Pappalardo S et al. The use of silicon elastomer in maxillofacial rehabilitation as a substitute for or in conjunction with resins. J Craniofac Surg 2006; 17(1):152-62.
3. Bastos EM, Sabino Neto M, Ferreira LM, Garcia EB, Liebano RE, Han YA. Experimental model of capsular contracture in silicone implants. Acta Cir Bras [serial online] 2003 Vol 18 Special Edition.
4. Quatela VC, Chow J. Synthetic facial implants. Facial Plast Surg Clin North Am 2008; 16(1):1-10.
5. Chin T, Kobe K, Hyakusoku H, Uekusa K, Hirakawa K, Ohno Y. Experimental analysis of silicone leakage. J Nippon Med Sch 2009; 76(2):109-12.
6. Kelemen O, Hegedus G, Kollár L, Menyhei G, Seress L. Morphological analysis of the connective tissue reaction in linear hypertrophic scars treated with intralesional steroid or silicone-gel sheeting. A light and electron microscopic study. Acta Biol Hung 2008; 59(2):129-45.
7. Flassbeck D, Pfleiderer B, Klemens P, Heumann KG, Eltze E, Hirner AV. Determination of siloxanes, silicon, and platinum in tissues of women with silicone gel-filled implants. Anal Bioanal Chem 2003; 375(3):356-62.
8. Bal BT, Yılmaz H, Aydın C, Karakoca S, Tokman B. Histopathologic study of rat connective tissue responses to maxillofacial silicone elastomers. J Mater Sci Mater Med 2009; 20:1901-7.
9. Haddad Filho D, Zveibel DK, Alonso N, Gemperli R. Comparison between textured silicone implants and those bonded with expanded polytetrafluoroethylene in rats. Acta Cir Bras 2007; 22(3):187-94.
10. Kałuzny JJ, Jóźwicki W, Wiśniewska H. Histological biocompatibility of new, non-absorbable glaucoma deep sclerectomy implant. J Biomed Mater Res B Appl Biomater 2007; 81(2):403-9.
11. Siggelkow W, Faridi A, Spiritus K, Klinge U, Rath W, Klosterhalfen B.Histological analysis of silicone breast implant capsules and correlation with capsular contracture. Biomaterials. 2003 Mar; 24(6):1101-9.
12. Mendes FH, Viterbo F, DeLucca L. The influence of external ultrasound on the histologic architecture of the organic capsule around smooth silicone implants: experimental study in rats. Aesthetic Plast Surg 2008; 32(3):442-50.
13. Palhares A, Schellini SA, Pellizzon CH, Padovani CR, Dorsa P. Evaluation of low intensity laser's action on silicone mammary implant pseudocapsules in rats. Acta Cir Bras [serial on the Internet] 2009; 24(1):7-12.
14. Tavazzani F, Xing S, Waddell JE, Smith D, Boynton EL. In vitro interaction between silicone gel and human monocytemacrophages. J Biomed Mater Res A 2005; 72(2):161-7.
15. Poveda R, Bagán JV, Murillo J, Jiménez Y. Granulomatous facial reaction to injected cosmetic fillers--a presentation of five cases. Med Oral Patol Oral Cir Bucal 2006; 11(1):E1-5.
16. Passos AHR, Costa F, Marchese LT, Guimarães SAC, Oreini WA. Fibrosis in tubulized skin flaps in rats using silicon catheters of two different flexibility: experimental model. Acta Cir Bras 2008; 23(3):243-6.
 Endereço para correspondência:
Endereço para correspondência:
Sandra Maria Herondina Coelho Ávila de Aguiar Faculdade de Odontologia Campus de Araçatuba, Unesp Rua José Bonifácio, 1193, Bairro Vila Mendonça 16015-050 Araçatuba - SP
e-mail: saguiar@foa.unesp.br
Recebido: 05.03.2010
Aceito: 14.10.2010













