Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RFO UPF
versão impressa ISSN 1413-4012
RFO UPF vol.16 no.3 Passo Fundo Set./Dez. 2011
Avaliação microbiana da recontaminação de artigos odontológicos estéreis segundo o manuseio das embalagens
Evaluation of microbial recontamination of sterile dental articles according to the handling of packaging
Camilla Aparecida Silva de Oliveira*; Sidinei Miguel Costa**; Keli Bahia Felicíssimo Zocratto***; Kelly Moreira Grillo Ribeiro Branco****
* Acadêmica em Odontologia do Centro Universitário Newton Paiva, Faculdade de Ciências Biológicas e da Saúde, Belo Horizonte, MG, Brasil.
** Acadêmico em Odontologia do Centro Universitário Newton Paiva, Faculdade de Ciências Biológicas e da Saúde, Belo Horizonte, MG, Brasil.
*** Doutora em Saúde Pública, professora do curso de Odontologia do Centro Universitário Newton Paiva, Faculdade de Ciências Biológicas e da Saúde, Departamento de Saúde Coletiva, Belo Horizonte, MG, Brasil.
**** Doutora em Ciências Biológicas (Microbiologia); coordenadora do curso de Ciências Biológicas do Centro Universitário Newton Paiva, Faculdade de Ciências Biológicas e da Saúde, Departamento de Ciências Biológicas, Belo Horizonte, MG, Brasil.
RESUMO
Introdução: A manipulação dos materiais esterilizados é uma das variáveis que podem contribuir para a recontaminação do material odontológico durante o seu armazenamento. Este estudo teve como objetivo avaliar a presença de recontaminação de materiais odontológicos estéreis a partir do manuseio dos invólucros armazenados por sete dias na área de estocagem da Central de Material e Esterilização. Materiais e método: Foram utilizados 72 bastões de vidro como amostras, divididos em três grupos: Grupo de Controle (12 bastões de vidro esterilizados sem o invólucro); Grupo A (30 bastões de vidro envolvidos em embalagem autosselante armazenados em um armário lacrado, onde não era permitido o manuseio das amostras); Grupo B (30 bastões de vidro envolvidos em embalagem autosselante, armazenados em um armário onde era permitido o manuseio das amostras). Todas as amostras foram submetidas à análise microbiológica. Realizou-se análise descritiva e comparativa dos resultados. Resultados: O Grupo B apresentou um maior crescimento de colônias cremosas quando comparado ao Grupo A. Conclusões: Dessa forma, conclui-se que a manipulação é uma variável importante na recontaminação dos materiais por bactérias, por ser a mão a principal via de transmissão desses micro-organimos.
Palavras-chave: Esterilização. Microbiologia. Lavagem de mãos.
ABSTRACT
Introduction: The handling of sterilized materials is one of the variables that may contribute to recontamination of the dental material during storage. This study aimed to evaluate the presence of recontamination of sterile dental materials from the handling of envelopes stored for seven days in storage areas of Material and Sterilization Center. Materials and Method: 72 glass rods as samples, divided into three groups: control group (12 sterilized glass rods without the shell), Group A (30 glass rods involved in auto-sealing package stored in a locked cabinet where the handling of samples was not allowed) and Group B (30 glass rods involved in auto-sealing package stored in a cabinet where the handling of samples was allowed). All samples were subjected to microbiological analysis. A descriptive and comparative analysis of the results was accomplished. Results: Group B showed a higher growth of creamy colonies when compared to group A. Conclusions: Therefore, it is concluded that handling is an important variable in re-contamination of materials by bacteria, since hands are the main via of transmission of these microorganisms.
Keywords: Sterilization. Microbiology. Handwashing.
Introdução
A prevenção da infecção cruzada é um dos deveres do cirurgião-dentista estabelecidos no Código de Ética; por isso, esse profissional tem a obrigação moral, ética e legal de prestar o atendimento odontológico com parâmetros ideais que a impeçam1. Uma das medidas imprescindíveis para evitar a contaminação cruzada é prestar uma assistência de qualidade aos pacientes, incluindo a garantia da esterilidade de materiais odonto-médico-hospitalares e a sua posterior manutenção durante o armazenamento e o manuseio2-4. A responsabilidade de fornecer o material estéril às unidades assistenciais é da Central de Material e Esterilização, à qual cabe submeter o material ao expurgo, preparo, esterilização, armazenamento e distribuição desses artigos4-9.
A esterilização é o processo de destruição de todas as formas de micro-organismos, inclusive dos esporos, mediante a aplicação de agentes físicos ou químicos. Atualmente, a forma de esterilização mais segura e utilizada na odontologia é a de vapor saturado sob pressão por meio de autoclaves. Esse método de esterilização deve ser monitorado por meio de indicadores físicos, químicos e biológicos, os quais garantem a eficácia do mesmo3,6,10-13.
Tão importantes quanto o método de esterilização do material e os controles desse processo, são o local de armazenagem e a manipulação. Quando a armazenagem ou a manipulação é feita de forma inadequada, pode contribuir para a quebra da barreira asséptica, levando à contaminação do material. O local de armazenagem deve ser limpo, livre de umidade, fechado (com porta), com uma distância mínima de 20 cm do teto e 5 cm da parede, destinado apenas para esse fim. Os pacotes não devem ser dobrados ou amassados ao serem armazenados, a sua manipulação deve ser mínima, com muito cuidado e com as mãos limpas3,11,14,15.
Tanto os lugares onde os artigos são processados quanto as pessoas que os manuseiam podem se tornar fontes contaminantes12. As mãos são consideradas a principal via de transmissão de agentes infecciosos, pois a pele é um reservatório de diversos micro-organismos. Dessa forma, todos os profissionais que atuam na manipulação de material estéril devem, obrigatoriamente, realizar a higienização das mãos com água e sabão e com preparação alcoólica16.
Diversas variáveis estão envolvidas na questão da validade do material esterilizado. Dentre essas se destacam o tipo de embalagem, o número de vezes que esse pacote foi manuseado antes do uso, a manipulação dos pacotes, o armazenamento em prateleiras abertas ou fechadas e o uso de embalagens secundárias6 .
A manipulação dos materiais esterilizados é uma das variáveis que podem contribuir para a recontaminação do material odontológico durante o seu armazenamento. Dessa forma, o objetivo do presente estudo foi avaliar a presença de recontaminação de materiais odontológicos estéreis a partir do manuseio dos invólucros armazenados por sete dias na área de estocagem da Central de Material e Esterilização.
Materiais e método
O presente estudo foi realizado na Central de Material e Esterilização do curso de Odontologia de uma faculdade no município de Belo Horizonte - MG no ano de 2010. Foram utilizados 72 bastões de vidro como amostras. Esses bastões foram divididos em três grupos: Grupo de Controle (12 bastões de vidro esterilizados sem invólucro); Grupo A (30 bastões de vidro envolvidos em embalagem autosselante (Medstéril® -MS.: 80120340003 - São Paulo - SP - BR) armazenados em um armário lacrado, onde não era permitido o manuseio das amostras); Grupo B (30 bastões de vidro envolvidos em embalagem autosselante, armazenados em um armário onde era permitido o manuseio das amostras).
O empacotamento desses bastões de vidro foi realizado na área de preparo e acondicionamento, seguindo as normas universais17. Todas as amostras foram processadas em uma autoclave pré-vácuo tipo pulsante (Bawmer®, São Paulo, SP, BR), a uma temperatura de 134 C, pelo tempo de esterilização de 15min. Foram submetidas ao primeiro ciclo completo da autoclave, que teve duração de aproximadamente uma hora. Como controle do processo de esterilização foi realizado o teste Bowie & Dick (Diatest Brasil®, São Paulo, SP, BR), utilizando um ciclo próprio, prévio ao ciclo de processamento das amostras. Na parte externa de todos os invólucros existe um indicador químico da própria embalagem, que serviu para avaliar múltiplos parâmetros do processo. O indicador biológico padronizado com esporos de Bacillus stearothermophylus (EZ TEST®) também foi empregado nesse ciclo de esterilização e seu resultado serviu como o controle negativo deste estudo.
Após a realização do ciclo de esterilização as amostras foram resfriadas por 30min. Todas as amostras foram retiradas do rack da autoclave e armazenadas em dois armários da área de estocagem da CME. Esses armários possuíam seis divisórias cada, as quais foram previamente limpadas pela fricção de água e sabão, álcool 70% e posterior borrifo de ácido peracético. Cada divisória recebeu uma amostra do Grupo Controle e cinco amostras envolvidas na embalagem autosselante. Um dos armários recebeu um lacre em sua porta, que serviu como garantia de que permanecesse fechado pelos sete dias e, consequentemente, isento de manipulação. Esse lacre foi feito com uma folha de papel seda, pregada com cola quente nas extremidades da porta do armário. O outro armário permaneceu com a porta sem lacrar, sendo permitido que o funcionário o abrisse e fechasse de acordo com a rotina da CME, já que materiais de alunos estavam armazenados junto com essas amostras.
As amostras permaneceram armazenadas nos armários durante sete dias. Nesses sete dias de armazenamento realizou-se também a medição da temperatura e da umidade relativa do ar da área de estocagem da CME, utilizando-se um higrotermômetro (Minipa® /NP 241).
Transcorridos os sete dias de armazenamento, todas as amostras foram recolhidas e levadas para o laboratório de microbiologia. Usou-se ágar nutriente como meio para semeadura, que se deu em uma capela de fluxo laminar. Em seguida, as placas com o meio de cultura foram incubadas e, após esse período, realizaram-se a leitura e o registro das culturas levando em consideração se as colônias presentes eram cremosas ou filamentosas e o número de unidades formadoras de colônias (UFC). As placas que tiveram crescimento cremoso foram submetidas ao teste de Gram e analisadas no microscópico óptico com aumento de mil vezes.
Na análise estatística dos dados realizou-se análise descritiva através da distribuição das frequências e a análise comparativa de grupos pelo teste do qui-quadrado a um nível de significância de 5%.
Resultados
Todos os indicadores (físico, químico, biológico) utilizados no ciclo de esterilização deste estudo atestaram a eficácia do processo de esterilização. O controle biológico, que serviu como controle negativo do presente estudo, obteve uma resposta negativa após sua incubação por 48 horas.
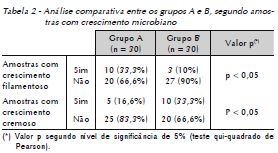
O Grupo A apresentou 15 (50%) amostras com crescimento positivo no ágar nutriente, das quais 10 (66,7%) apresentaram crescimento filamentoso e 5 (33,3%), crescimento cremoso. O total de unidades formadoras de colônia nesse meio de cultura foi de 26 (100%) colônias, sendo 18 (69,2%) colônias filamentosas e 8 (30,8%) colônias cremosas (Tab. 1). Na análise comparativa dos grupos houve significância estatística (p < 0,05) quando avaliado o número de amostras com crescimento filamentoso (Tab. 2).
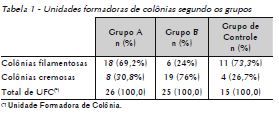
O Grupo B apresentou crescimento positivo no ágar nutriente em 12 (40%) amostras, das quais 2 (16,6%) apresentaram crescimento filamentoso, 9 (75%), crescimento cremoso e 1 (8,4%), crescimento filamentoso e cremoso. O total de unidades formadoras de colônias nesse meio de cultura foi de 25 (100%) colônias, sendo 6 (24%) colônias filamentosas e 19 (76%) colônias cremosas (Tab. 1). Ao realizar o teste do qui-quadrado, percebeu-se que houve significância estatística (p < 0,05) entre os grupos (Tab. 2).
No Grupo de Controle houve crescimento de colônias filamentosas (UFC = 11) e cremosas (UFC = 4). Nas colônias cremosas, identificou-se a presença de bactérias do tipo bacilos gram-positivos, cocos gram-positivos e estafilococos.
Durante os sete dias de armazenamento a temperatura na área de estocagem apresentou entre 26 a 29 °C e a umidade relativa do ar permaneceu entre 56 e 65%.
Discussão
A recontaminação de materiais odonto-médicohospitalares após a esterilização pode ocorrer em razão de diversos fatores, tais como o tipo embalagem utilizada, as condições de armazenagem e o manuseio6,12,15,16,18-21. No presente estudo observouse que o manuseio é uma variável importante na recontaminação de materiais previamente esterilizados, uma vez que houve maior crescimento de colônias bacteriformes no Grupo B quando comparado ao Grupo A.
A principal via de transmissão dos micro-organismos são as mãos, pois a pele está constantemente exposta ao ambiente e é colonizada por bactérias e fungos. A microbiota da pele das mãos pode ser classificada em residente ou transitória. Os microorganismos residentes têm a pele como habitat e nela se multiplicam. Nessa microbiota ocorre um predomínio de bactérias gram-positivas, que estão localizadas nas camadas mais profundas da pele, onde os lipídios e epitélio dificultam sua remoção. A baixa virulência desses micro-organismos raramente causa infecções, a não ser no caso em que os pacientes estejam imunodeprimidos, tenham passado por procedimentos invasivos, ou naqueles que utilizam próteses12,16,20-22. A microbiota transitória é composta por micro-organismos que se alojam na superfície da pele ocasionalmente e ali permanecem por um curto período de tempo, variando de horas a dias. As bactérias gram-negativas e os estafilococos são os micro-organismos mais encontrados nessa microbiota, os quais são os principais responsáveis pelas infecções hospitalares12,16,20-23. No presente estudo as bactérias encontradas no Grupo B coincidem com os micro-organismos pertencentes à microbiota transitória. A presença de bacilos gram-positivos, cocos gram-positivos e estafilococos enfatiza que as mãos realmente são uma provável fonte de recontaminação dos materiais esterilizados12,16,20-22.
Uma das condutas que podem contribuir para que ocorra uma diminuição da microbita transitória e, consequentemente, a redução da recontaminação dos materiais estéreis durante o seu manuseio é a lavagem das mãos. O recomendável é que as mãos sejam lavadas em intervalos regulares de uma hora, já que esse tempo é o suficiente para que ocorra a recolonização por bactérias transitórias. Para a realização da higienização das mãos devemse utilizar água e sabão por 30s, quando essas estiverem visivelmente sujas, e preparação alcoólica 70% por 40 a 60s, quando estiverem aparentemente limpas16,22,24-26. A limpeza das mãos é uma conduta simples, barata e eficaz na prevenção das infecções e diminui a probabilidade da contaminação dos artigos. No entanto, na maioria das vezes essa prática não é adotada pelos profissionais, sendo, então, preciso que os serviços de saúde utilizem estratégias de incentivo à adesão a essa técnica. Uma das formas de estimular esses profissionais é facilitar o acesso aos suprimentos necessários para realizar a higienização das mãos. Dessa forma, é essencial que exista uma pia ou dispersadores de álcool gel próximos à porta da entrada da área de armazenamento e distribuição das CME, proporcionando que os funcionários higienizem as mãos antes de entrar nesse ambiente. Outra conduta que poderia vir a reduzir a recontaminação desses materiais seria a utilização de luvas de procedimento durante o manuseio dos mesmos, no entanto não há consenso na literatura sobre essa prática7,16,22,24,27,28.
O Grupo A do presente estudo teve suas amostras armazenadas em um armário fechado e lacrado, onde o manuseio não era permitido. Este grupo apresentou uma menor quantidade de colônias cremosas e maior quantidade de colônias filamentosas, as quais apresentavam características macroscópicas compatíveis a de fungos.
Os fungos filamentosos são micro-organismos muito abundantes na natureza, que sofrem variações em sua incidência de acordo com a localidade, estação do ano, umidade relativa do ar, temperatura, hora do dia, velocidade e direção dos ventos, climatização dos ambientes e presença da atividade humana29-30. Nos países tropicais a elevação da temperatura e da umidade estimula a proliferação de uma microbiota farta e diversificada30. A temperatura é um fator importante para o crescimento de fungos. Pode-se dizer que a elevação da temperatura durante os sete dias de armazenamento das amostras deste estudo foi um dos fatores contribuintes para a proliferação desses micro-organismos. A temperatura ideal na área de estocagem deve permanecer entre 18 e 22 °C7,28,31; no entanto, encontraram- se temperaturas entre 26 e 29 °C. Outro fator que influencia na proliferação dos fungos e que deve ser avaliado é a umidade relativa do ar, que na presente pesquisa ficou entre 56 e 65%. Existe controvérsia na literatura relacionada a essa medida. Para alguns autores, o ideal é que a umidade relativa desse ambiente esteja entre 35 e 70%7,28,31, o que estaria em consenso com os valores encontrados no presente trabalho. No entanto, outros relatam que o ideal é uma umidade relativa do ar entre 30 e 60%; medidas acima dessas poderiam contribuir para a contaminação dos materiais armazenados na CME29. Dessa maneira, a umidade relativa do ar encontrada no presente estudo estaria acima do ideal, o que, provavelmente, contribuiu para a proliferação dos fungos e posterior contaminação das amostras. Associado aos dois fatores mencionados (temperatura e umidade do ar), deve-se considerar que a falta de limpeza e de ventilação de armários fechados contribui para a permanência de fungos nesses ambientes30. A limpeza periódica tem a capacidade de reduzir a carga microbiana a níveis considerados toleráveis32; a diminuição da população de fungos evita a recontaminação dos materiais estéreis durante o seu período de armazenamento. Considerando que o armário do Grupo A permaneceu fechado por sete dias, sem a entrada de correntes de ar, sem a realização de limpezas rotineiras de manutenção e exposto a temperaturas elevadas e a umidade relativa do ar aumentada, pode-se dizer que, provavelmente, esses conjunto de fatores contribuiu para a maior proliferação dos fungos nesse grupo quando comparado ao Grupo B.
São diversas as variáveis que podem ter contribuído para a recontaminação das amostras do Grupo A por fungos. A temperatura, a umidade relativa do ar, as estações do ano, o local de armazenamento, incluindo a limpeza e arejamento desses ambientes, são fatores contribuintes para a colonização e proliferação dos mesmos. Essas variáveis são difíceis de serem controladas, pois não dependem exclusivamente dos funcionários do centro de material e esterilização. O manuseio foi a principal fonte de contaminação dos materiais do Grupo B. Essa variável pode ser controlada pela conscientização dos recursos humanos da central de esterilização quanto à importância da higienização das mãos. O simples ato de lavar as mãos e utilizar a preparação alcoólica pode vir a reduzir a contaminação dos invólucros por bactérias, já que a maioria das encontradas pertence à microbiota transitória e pode ser eliminada ou reduzida com esse procedimento.
Conclusão
A manipulação dos invólucros foi uma variável importante na recontaminação dos materiais por bactérias, por ser a mão a principal via de transmissão desses micro-organimos. As alterações no ambiente de armazenamento, principalmente a falta de limpeza e de ventilação dos armários, provavelmente, foram os principais fatores contribuintes para o crescimento de colônias filamentosas nos armários fechados.
Referências
1. Prado, MEM, Santos SSF. Avaliação das condições de esterilização de materiais odontológicos em consultórios na cidade de Taubaté. Rev Biocienc 2002; 8(1): 61-70. [ Links ]
2. Moriya GGA, Graziano KU. Sterelity maintenance assessment of moist/ wet material after steam sterilization and 30 day sorage. Rev Latino Am Enfermagem 2010; 18(4):786- 91.
3. Vier FVP, Só MVR, Gremelmaier L, Bozetti R, Pelisser A. Avaliação da esterilização da esterilização em autoclaves odontológicas através do monitoramento biológico. Rev Fac Odontol Porto Alegre 2008; 49(2):5-10.
4. Costa, EAM. Estudo de custo-benefício de embalagens para esterilização. Rev SOBECC 2004; 9(4):38-43.
5. Souza MCB, Ceribelli MIPF. Enfermagem no centro de material esterilizado – a prática da educação continuada. Rev. Latino- Am Enfermagem 2004;12(5):767-74.
6. Brito MFP, Galvão CM, Françolin L, Rotta CSG. Validação do processo de esterilização de artigos médicos –hospitalares segundo diferentes embalagens. Rev Bras Enferm 2002; 55(4):414-19.
7. Possari JP. Centro de Material e Esterilização: planejamento e gestão. 3. ed. São Paulo: Iátria; 2007.
8. Tipple AFV, Souza ACS, Nakatani AYK, Carvalho MVC, Faria RS, Paiva EMMO. Processamento de artigos odontológicos em centros de saúde de Goiânia. Robrac 2005; 14(37):15-20.
9. Sancinetti TR, Gatto MAF. Parâmetros de produtividade de um centro de material e esterilização. Rev Esc Enferm USP 2007; 41(2): 264-70.
10. Pinter MG, Gabrielloni MC. Validação de embalagens de algodão duplo e papel grau cirúrgico – relato de experiência. Acta Paul Enf 2000; 12(especial):94-5.
11. Serratine ACP, Rocha MJC. Avaliação da esterilização realizada por meio de estufas (forno de Pasteur) em consultórios odontológicos da grande Florianópolis. Rev Alcance 1998; 5(4):53-8.
12. Santos IBC, Oliveira TL, Nogueira MJF. A embalagem para esterilização sob a ótica assistencial do enfermeiro. Rev SOBECC 2002; 7(1):7-20.
13. Grzesiuk MJ, Gasparetto A, Ramos AL. Qual embalagem você tem usado para autoclavar os seus materiais?. Rev Clín Ortodon Dental Press 2006; 5(5):27-32.
14. Krieger D, Bueno RE, Gabardo MCL. Perspectivas de Biossegurança em Odontologia. Ver Gestão & Saúde 2010; 1(2):1-10.
15. Padoveze MC, Nakamura, MHY, Blanco VLO, Calusni ALR, Ceribelli MIPF. Recontaminação microbiana em artigos processados por autoclave e embalados em tecido e papel grau cirúrgico. Rev SOBECC 2001; 6(3):24-7.
16. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Higienização das mãos. Brasília: 2010.
17. Kavanagh CMG. Elaboração de manual de procedimentos em central de materiais e esterilização. São Paulo: Atheneu; 2007.
18. Butt WE, Bradley DV, Mayhew RB, Schwartz RS. Evaluation of the shelf life of sterile instrument packs. Oral Surgery, Oral Medicine Oral Pathology 1991;72(6):650-54.
19. Joan LSP, Norhashimawati, Khor S. Time versus eventrelated sterility: Linen & Pouch packaging remain sterile over a year of storage and handling. Nurs J Singapore 2010; 37(1):34-42.
20. Custódio J, Alves JF, Silva F M, Dolinger EJO, Santos, JGS; Brito DD. Avaliação microbiológica das mãos de profissionais da saúde de um hospital particular de Itumbiara. Rev Cien Med 2009; 18(1):7-11.
21. Oliveira DGM, Souza PR, Watanable E, Andrade D. Avaliação da higiene das mãos na perspectiva microbiológica. Rev Panaman Infectol 2010; 12(3):28-32.
22. Felix CCP, Miyadahira AMK. Avaliação da técnica de lavagem das mãos executada por alunos do curso de graduação em enfermagem. Rev Esc Enf USP 2009; 43(1):139 -45.
23. Almeida RCC, Kuaye AY, Serrano AM, Almeida PF. Avaliação do controle da qualidade microbiológica de mãos de manipuladores de alimentos. Rev Saúde Pública 1995; 29(4):290-94.
24. Tipple AFV, Aguilari HT, Souza ACS, Pereira MS, Mendonça ACC, Silveira C. Equipamentos de proteção em centros de material e esterilização: disponibilidade, uso e fatores intervenientes à adesão. Cienc Cuid Saude 2007; 6(4):441-8.
25. Tipple FV, Sá AS, Mendonça AM, Souza KS,Custódia A, Santos SLV. Técnica de higienização simples das mãos: a prática entre acadêmicos da enfermagem. Cienc Enferm 2010; 16(1):49-58. 26. Ceni MGC, KalinkeLP, Paganini, MC. Higieniz
ação das mãos: um constante aliado na prevenção da infecção hospitalar. Boletim de Enfermagem 2009; 2(3):48-61.
27. Rodrigues AB. Central de Material Esterilizado: rotinas técnicas. Belo Horizonte: Health, 1995.
28. Souza NC. Uma aplicação do custeio baseado em atividades na central de materiais esterilizados de hospitais. Rev Multiface 2007; 1(2):56-66.
29. Martins SCS, Soares JB. Avaliação da eficiência de antisépticos na limpeza das mãos. B Ceppa 1993; 11(1):65-70.
30. Carmo ES, Belém LF, Catão,RMR, Lima, EO, Silveira IL, Soares LHM. Microbiota fúngica presente em diversos setores de um hospital público em Campina Grande - PB. Revista Brasileira de Análises Clínicas 2007; 39(3): 213-6.
31. Guadagnin, SVT, Primo, MGB, Tipple AFV, Souza ACS. Centro de Material e Esterilização: padrões arquitetônicos e o processamento de artigos. Rev Eletrônica de Enfermagem 2005; 7(3): 285-93.
32. Andrade D, Ferrazere MVG, Santos LS, Moraes M, FREIRE E, Ito IY. Uso de sabões e detergentes em serviços de saúde: novos contextos, outros olhares?. Rev Panam Infectol 2006; 8(4):33-7.
 Endereço para correspondência:
Endereço para correspondência:
Keli Bahia Felicíssimo Zocratto
Rua Tenente Anastácio de Moura, 740/202
30240390 Belo Horizonte - MG
e-mail: kelibahia.prof@newtonpaiva.br
Recebido: 08.06.2011
Aceito: 27.10.2011













