Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RFO UPF
versão impressa ISSN 1413-4012
RFO UPF vol.17 no.1 Passo Fundo Jan./Abr. 2012
Métodos de caracterização de materiais para pesquisa em odontologia
Materials characterization methods in dentistry research
José Renato Cavalcanti de QueirozI; Susana Salazar MarochoII; Paula BenettiII; Rubens Nisie TangoIII; Lafayette Nogueira JuniorIII
IAluno de pós-doutorado em Física, Instituto Tecnológico de Aeronáutica, São José dos Campos, São Paulo, Brazil; Doutor em Odontologia Restauradora (área de concentração em Prótese Dentária) pela Faculdade de Odontologia de São José dos Campos/Unesp; mestre em Ciência e Engenharia de Materiais pela Universidade Federal do Rio Grande do Norte.
IIDoutora em Odontologia Restauradora (área de concentração em prótese dentária) pela Faculdade de Odontologia de São José dos Campos, UNESP.
IIIProfessor do Departamento de prótese e materiais dentários da Faculdade de Odontologia de São José dos Campos, UNESP.
RESUMO
Esta revisão tem por finalidade esclarecer alguns pontos relevantes a respeito de algumas técnicas utilizadas em odontologia para caracterização dos materiais. Após um levantamento bibliográfico de 2006/2011 na base de dados PubMed, a microscopia eletrônica de varredura e a espectroscopia no infravermelho por transformada de Fourier foram as técnicas mais utilizadas para cada método de caracterização (microscopia e espectroscopia). Porém, outras técnicas têm sido utilizadas na caracterização dos materiais na pesquisa em odontologia.
Palavras-chave: Análise química. Espectroscopia. Microscopia.
ABSTRACT
The objective of this study is to understand some relevant aspects about the spectroscopic and microscopic techniques analysis used in dentistry. After a literature review (2006-2011) in PubMed database, the scanning electron microscopy and Fourier transform infrared spectroscopy were the most common techniques used for each characterization method (microscopy and spectroscopy). Therefore, other techniques have been used to perform material characterization in dental research.
Keywords: Chemical analysis. Spectroscopy. Microscopy.
Introdução
A "caracterização do material" é uma área da ciência responsável por prever o comportamento ou elucidar fenômenos físicos, químicos ou biológicos característicos de cada material, sejam de natureza orgânica ou inorgânica. Entre tantas análises (análises térmicas, análises tomográficas, ensaios mecânicos, análises de biocompatibilidade...), este estudo fez uma revisão de duas classes bem difundidas de caracterização dos materiais em odontologia: a microscopia e a espectroscopia.
As técnicas microscópicas e espectroscópicas são amplamente utilizadas na caracterização dos diversos materiais, disponibilizando informações complementares, importantes para comprovação dos resultados obtidos em ensaios laboratoriais.
Geralmente, tais informações são produzidas através de um sensor que capta sinais (elétron, vibração química, radiação) emitidos do material, ocasionados pela colisão de um feixe primário (elétron, luz visível, raios X, infravermelho, laser) direcionado à superfície, podendo revelar detalhes da estrutura química (composição, informação do estado químico, identificação de fases), bem como auxiliar o estudo dos defeitos, topografia e estrutura da superfície1.
Como exemplo, podemos citar as técnicas cujo feixe principal é composto por elétrons. À medidaque este incide na amostra, os elétrons que penetram deixam de seguir sua direção original e passam a se difundir aleatoriamente. Entre outros fatores, a tensão de aceleração (energia), o número atômico dos elementos que compõe o material em análise, bem como suas propriedades elétricas (condutor, semicondutor e não condutor), a distância de trabalho e a pressão utilizada na câmara de análise durante a interação feixe/matéria determinarão o perfil de penetração do feixe (profundidade, espalhamento), influenciando na qualidade e quantidade da informação proveniente da matéria. A completa análise do material em estudo dependerá de diversas técnicas a serem aplicadas na captação dessas informações1.
Metodologias científicas forneceriam muito mais informações se os pesquisadores estivessem atentos e preocupados em dissecar todas as possíveis caracterizações relevantes ao estudo. A partir do conhecimento dessas técnicas microscópicas e espectroscópicas, pode-se escolher qual a mais apropriada quando se quer avaliar a concentração de um elemento químico em relação à profundidade da amostra, identificar ligações químicas específicas, visualizar o relevo superficial, identificar fases, investigar os defeitos, analisar uma superfície de fratura, entre outros.
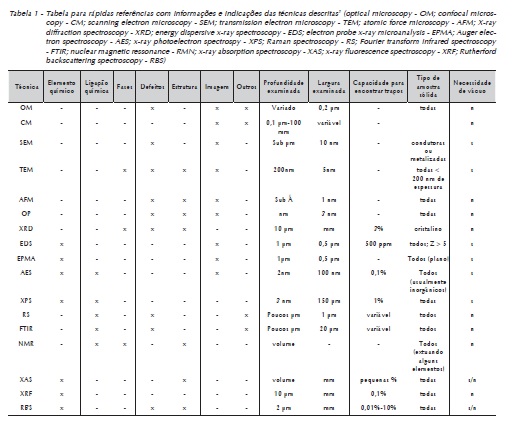
Este estudo visa relatar algumas técnicas (Tabela 1) de caracterização dos materiais para a odontologia, fornecendo informações básicas e gerais que podem ser usadas pelo pesquisador para enriquecer as informações colhidas durante o processo de produção científica e na escolha da técnica a ser empregada na metodologia da pesquisa.
Materiais e método
Os métodos de caracterização inseridos neste artigo foram extraídos de levantamento bibliográfico usando à base de dados do PubMed (limitado a revistas odontológicas). Para cada técnica analisada, a busca foi feita utilizando a sigla ou o nome da técnica por extenso (ambas em inglês), considerando o período de 2006 até novembro de 2011.
Utilizando a palavra microscopia e espectroscopia, foram encontrados 3.181 e 1.364 artigos, repectivamente, para cada classe de análise.
Com relação às técnicas microscópicas, a microscopia eletrônica de varredura foi a mais utilizada (1.998 artigos). Outras técnicas, como as microscopias confocal (402 artigos), ótica (397 artigos), de transmissão de elétrons (248 artigos), de força atômica (146 artigos) e perfilometria ótica (37 artigos) também foram utilizadas.
Com relação às análises espectroscópicas, uma variedade enorme de técnicas estão disponíveis para análise dos materiais. Para selecionar as análises aqui relatadas, foram consideradas as principais técnicas utilizadas para análise de elemento químico (espectroscopia de energia dispersiva de raios X), da ligação química (espectroscopia no infravermelho por transformada de Fourier) e da estrutura de fases (espectroscopia por difração de raios X). Ainda, possíveis técnicas que possam substituir estas principais técnicas ou ainda fornecer dados complementares também foram consideradas. Dessa forma, por exemplo, para análise de ligações químicas, a espectroscopia no infravermelho por transformada de Fourier (FTIR) foi apresentado juntamente com as técnicas de espectroscopia Raman e Ressonânica Magnética Nuclear. Utilizando os parâmetros de inclusão citados para espectroscopias, a do infravermelho por transformada de Fourier foi a mais encontrada (319 artigos). Dessa forma, espectroscopias como de difração de raios X (246 artigos), de energia dispersiva de raios X (176 artigos), Raman (99 artigos), de fotoelétrons de raios X (63 artigos), de ressonância magnética nuclear (60 artigos), de sonda de elétrons para microanálise de raios X (30 artigos), de elétrons auger (22 artigos), de retroespalhamento de Rutherford (10 artigos), de fluorescência de raios X (7 artigos) a as por absorção de raios X (2 artigos) também serão aqui exploradas.
Revisão de literatura
Técnicas microscópicas
a) Microscopia ótica (optical microscopy - OM):
A microscopia ótica, também chamada por alguns de "fotônica", baseia-se na observação por contrastes. O microscópio permitirá ao observador identificar diferentes padrões de contraste relativos às ondas luminosas, como amplitude, frequência (cor), fase e polarização2.
Essa técnica pode ser utilizada desde a observação de tecidos vivos, como cultura de células, a tecidos minerais, como a desmineralização em raiz dentária. Pode ser usada para visualização de modos de fratura e para observações preliminares. Ainda, é essencialmente empregada para revelar diferenças de altura e inclinação de relevo que induzem à diferença de fase do feixe refletido3,4. É particularmente sensível a degraus bruscos na superfície da amostra, sendo uma técnica importante para visualização de defeitos superficiais. O exame por luz refletida gera informações qualitativas, porém com aproveitamento quantitativo complexo2. O microscópio pode ainda estar equipado com lentes que possibilitam a visualização em 3D, também chamado de "estereomicroscópio".
A preparação da amostra quando necessária é relativamente simples, tendo um maior cuidado quando a técnica de luz polarizada for a escolhida2. A técnica em si não é destrutiva, porém pode ser necessária a remoção de material da superfície da amostra durante sua preparação1.
O microscópio pode estar acoplado a um computador e gerar visualização digitalizada das imagens colhidas (que também podem ser armazenadas) ou por meio da visualização direta, e sua resolução normalmente é de 2 μm1. Observações que necessitem uma maior precisão no aumento, o observador deve recorrer a outras técnicas. Outra desvantagem é a dificuldade de foco em superfícies irregulares, onde a presença de picos e vales dificultam a visualização precisa das estruturas em estudo.
b) Microscopia confocal (confocal microscopy - CM):
É um dos mais úteis e versáteis instrumentos em microscopia biológica, podendo formar imagens 2D ou 3D, como na visualização de interfaces adesivas a bactérias gengivais5,6. Uma pequena fonte luminosa é direcionada a um ponto da amostra e os sinais emitidos são coletados por um detector de ponto. Pelo movimento da amostra, são gravadas imagens de diferentes partes, realizando um mapeamento destas, dando origem à imagem da amostra7. Quando realizadas em diversos planos, como uma tomografia, combinada com programa de computador acoplado ao microscópio, a imagem é gerada em alta definição2. Isso só ocorre devido a uma menor interferência das áreas fora de foco na formação dessa imagem e a uma máscara com um pinhole colocada à frente do detector para diminuir o ruído provocado pelo espalhamento da luz, vantagens desse sistema que permite a formação da imagem 3D8. Microscopia confocal pode ser operada em diferentes modos, como microscopia confocal de campo claro, de fluorescência, com escaneamento por fibra ótica, entre outros, e para cada modalidade operacional exige uma preparação específica da amostra.1
c) Microscopia eletrônica de varredura (scanning electron microscopy - SEM):
Essa técnica é utilizada para obtenção de imagens tanto de superfícies polidas como rugosas, com grande profundidade de campos e alta resolução2. O modo de análise pela captação de elétrons secundários provenientes do material analisado permite a visualização superficial em grande aumento de estruturas biológicas à análise de biomateriais4,9,10. Já com a utilização do modo de análise que capta os elétrons retroespalhados da matéria, a técnica permite identificar a orientação cristalina e a diferenciação de fases, variando através de contrastes de tons de cinza em razão do número atômico médio Z2.
Cada um dos sinais produzidos pelo feixe de elétrons ao interagir com a matéria (elétrons secundários, retroespalhados, fótons, raios X, calor) requer um detector apropriado para aquisição e transformação em sinais elétricos2. Assim como a microscopia ótica, também possui a indicação de observação superficial e visualização de defeitos, mas com um poder de resolução muito maior, alguns alcançando trezentas mil vezes com resolução de ordem nanométrica1.
As amostras precisam ser resistentes ao vácuo e, quando não condutoras, precisam ser recobertas (carbono ou ouro) antes do escaneamento1. Para as amostras biológicas ou hidratadas, existe a opção do microscópio eletrônico de varredura ambiental onde as amostras são analisadas sob pressão atmosférica ou submetidas a pequenas variações de pressão. Porém, o ar presente entre o colimador (componente estrutural da SEM que origina o feixe primário) e a amostra serviria como uma barreira para o feixe de elétrons primários, reduzindo a qualidade do sinal captado, refletido numa superfície com menor detalhamento topográfico e com dificuldade de foco em grandes aumentos. A redução da qualidade dependerá do tipo de amostra analisada, bem como da qualidade do microscópio eletrônico utilizado.1
d) Microscopia eletrônica de transmissão (transmission electron microscopy - TEM):
A análise por esta técnica se baseia na leitura dos elétrons que transpassam a matéria. Assim, um bombardeio de feixe de elétrons que atravessa uma amostra fina (< 200 nm de espessura) tem seus sinais captados e fornecem dados sobre a estrutura atômica e defeitos presentes no material pela análise sistemática de imagens1, além de análise microestrutural de materiais sólidos, como em estudo da formação de cristais11. Também poderão ser utilizadas no estudo de tecido animal bactérias, células e patologias, gerando imagens em nível celular ou de organização tecidual7,12. O problema apontado pelos estudos com TEM é a dificuldade na preparação das amostras em razão da sua fina espessura, tendo de ser realizada por um técnico com experiência.
e) Microscopia de força atômica (atomic force microscopy - AFM):
A AFM funciona como um perfilômetro com resolução atômica, mapeando a topografia da superfície em 3D com riqueza de detalhes gerando imagens de alta resolução2. A técnica não é destrutiva (relacionada à amostra) com resolução vertical e lateral de 0,01 Å e em nível atômico, respectivamente1. Como desvantagem, podemos citar a relativa demora na obtenção de uma imagem, bem como uma área restrita de leitura. Deverá ser utilizada quando as características morfológicas precisam ser mais bem detalhadas sem haver grandes variações dessas ao longo da superfície. Nesses termos, a técnica possui grande aplicabilidade em estudos de rugosidade e deteriorização superficial13,14. O microscópio de modulação de força é uma variante da AFM que permite a determinação do módulo de elasticidade da amostra mesmo em materiais compósitos, ondeé dado o módulo de cada fase que o compõe2.
f) Perfilometria ótica (optical profilometry - OP):
Também conhecida como "perfilometria digital" ou "perfilometria sem contato" (non-contact profilometry). Para essa técnica, uma fonte luminosa incide sobre a amostra. A luz refletida de um espelho de referência (feixe de referência), em combinação com a luz refletida da superfície da amostra (feixe de medição), produz franjas de interferência. Esses sinais de intensidade de interferência vindos da superfície da amostra são captados por uma câmera quadro a quadro. Os dados de intensidade a partir de um determinado pixel desses quadros formam um interferograma para os pontos da superfície com resolução vertical de 3 nm1. Esta técnica é muito útil para análise de rugosidade, pois, mesmo tendo uma resolução vertical e horizontal menor que a AFM, é mais simples, fornecendo dados de rugosidade de áreas maiores (milimétricas), o que confere maior representatividade dos dados coletados na amostra.
Técnicas espectroscópicas
a) Espectroscopia de energia dispersiva de raios X (energy dispersive X-ray spectroscopy - EDS):
A EDS é um aparelho acoplado a outros instrumentos que detecta e processa raios X, convertendo-os em dados expressos em um histograma. Este espectro (gráfico de raios X) consiste numa série de picos que representam o tipo e a quantidade de cada elemento presente na amostra15. As amostras podem ser tanto sólidas quanto líquidas, pós e compósitos também podem ser avaliados e as amostras dependerão do aparelho a qual a EDS está acoplada (microscópio eletrônico de varredura ou transmissão, aparelho de fluorescência de raios X ou sonda eletrônica para microanálise raios X). Dependendo do programa de computador para leitura e interpretação dos dados, pode fornecer análises pontuais, em linha (técnica scanline) ou, ainda, imagens do mapeamento químico elementar para quase todos os aparelhos em que estiver acoplado1.
Alguns espectrômetros para identificação e quantificação de raios X podem captar a dispersão de comprimento de onda dos raios X (wavelenght dispersive X-ray spectrometer - WDS) ao invés da energia dispersiva realizado pela EDS. O WDS é capaz de fornecer resultados mais precisos com menor nível de ruído nos gráficos. A vantagem da EDS sobre o WDS se deve ao fato de que todos os elementos são contados ao mesmo tempo na EDS. Desse modo, obtém-se rapidamente uma visão geral da composição da amostra. No WDS o detector deve ser posicionado no ângulo adequado para cada elemento presente, levando tempo maior para a contagem total dos elementos da amostra. Outra desvantagem do WDS é a natureza da amostra que deve ser metalograficamente preparada, enquanto na EDS a amostra pode ter as características rugosas usuais para observação na SEM2.
A técnica não produz confiabilidade nos resultados (não está indicada) para detecção de pequenas concentrações (< 2%), como eventuais inpurezas presentes na amostra, ou para detecção de elementos químicos com peso molecular inferior ao sódio (como, por exemplo, o oxigênio, o nitrogênio e o carbono, principais elementos da química orgânica). Alguns elementos químicos (hidrogênio, hélio, lítio, berílio) não são detectados por esta técnica espectroscópica.
b) Fluorescência de raios X (X-ray fluorescence spectroscopy - XRF):
Tem as indicações similares à EDS, porém com maior resolução. A radiação de fluorescência normalmente é difratada por um cristal sob diferentes ângulos para separar os comprimentos de ondas dos raios X e identificar cada elemento químico1. As concentrações são determinadas pela intensidade dos picos16. A fluorescência de raios X também pode auxiliar na determinação da espessura de filmes finos1.
c) Sonda de eletrons para microanálise de raio X (electron probe X-ray microanalysis - EPMA):
A EPMA é uma técnica de caracterização que quantifica elementos químicos com base em informações específicas de raios X, fornecidas por um feixe de elétrons de alta intensidade17. Sua vantagem sobre a EDS ou WDS é a resolução mínima de cem partes por milhão (ppm) e, assim como os outros, também pode produzir imagem através de um mapeamento da distribuição elementar na amostra1.
d) Espectroscopia de fotoelétrons de raios X (X-ray photoelectron spectroscopy - XPS):
Essa é uma técnica muito utilizada para análise química, identificando todos os elementos químicos (exceto o hidrogênio e o hélio) presentes na amostra, bem como a concentração elementar nos 10 nm mais externos da amostra18. Esta análise também é útil na obtenção de dados sobre as combinações químicas existentes, bem como suas variações resultantes de uma mudança no ambiente químico8, como a presença de contaminantes na superfície, avaliação dos procedimentos de limpeza de uma superfície, processos de oxidação e corrosão dos materiais, análise de filmes finos, estudo da adesão e das falhas adesivas, análise química de superfícies submetidas ao desgaste e quantificação da efetividade de tratamentos de superfície.1
e) Espectroscopia de elétrons Auger (Auger electron spectroscopy - AES):
Os elétrons Auger fornecem dados sobre a composição elementar da matéria15, podendo, em alguns casos, informar a fórmula de compostos químicos. Quando utilizados com um jateamento iônico (íon sputtering), que removerá gradualmente camadas da superfície, a espectroscopia de elétrons Auger pode caracterizar a amostra em profundidade1,sendo uma vantagem sobre o XPS (ambas as técnicas possuem indicação semelhante). A técnica de elétrons Auger possui resolução mais precisa que o XPS (X-ray photoelectron spectroscopy), sendo, portanto, a técnica mais indicada dentre as duas para análise de superfícies finas, porém não sendo apropriada pela análise de grandes áreas. É também usado para dados de composição química de materiais inorgânicos. Pode ser utilizado também sobre interfaces e para estudo de transformação de fases na superfície8.
f) Espectroscopia de retroespalhamento de Rutherford (Rutherford backscattering spectroscopy - RBS):
A análise por RBS faz parte de um grupo de métodos nucleares espectroscópicos, mais conhecidos como análise por feixe iônico. Esta técnica fornece dados quantitativos de elementos químicos em relação à profundidade da amostra, concentração elementar (átomos/cm2) e qualidade e defeitos em grades cristalinas1. Dessa forma, o RBS é amplamente usado na avaliação da composição química de filmes finos, avaliando sua composição ao longo de sua espessura (profundidade)19. Para isso, um feixe nuclear, geralmente H+ ou He++, acelerado com alta energia (MeV), colide na amostra transferindo energia desses íons incidente para os átomos, sendo depois retroespalhado e identificados por um detector que lhes mede a energia. A profundidade analisada é limitada pela energia dos íons, geralmente não ultrapassando alguns μm1.
g) Espectroscopia raman (Raman spectroscopy - RS):
Essa espectroscopia fornece dados baseados na frequência vibracional de ligações químicas1,20. A interação da capacidade de polarização com a radiação penetrante induz um momento dipolo na molécula e a radiação emitida por esta indução é observada pelo espectroscópio ou microespectroscópio Raman21,22. Pode ser usado em amostras líquidas, gasosas ou sólidas, assim como em materiais policristalinos, pós e filmes finos1 e geralmente não exige preparação da amostra. Os picos apresentados no espectro identificam grupos funcionais, tipo de ligações, e concentração destas presentes na amostra. Porém, essa técnica não está indicada para a análise de ligas metálicas (ligações metálicas não produzem esse tipo de vibração química). Quando associado ao um microscópio, pode fornecer mapeamento dos grupos funcionais na superfície da amostra.
h) Espectroscopia no infravermelho por transformada de Fourier (fourier transform infrared spectroscopy - FTIR):
A FTIR baseia-se na informação da absorção de luz por moléculas que possuam a mesma energia vibracional que essa radiação eletromagnética, fornecendo dados sobre a frequência vibracional das moléculas existentes na amostra1. Como a RS, esta técnica também é capaz de identificar grupos funcionais, tipos de ligações e concentração dessas presentes na amostra23. Assim como a espectroscopia raman, esta técnica permite a identificação de variação nas ligações químicas de um material submetido a diferentes condições, como o grau de polimerização de uma resina submetida a diferentes condições, ou o grau de evaporação de um solvente de um agente de união. Mesmo não sendo necessário quando se tem os acessórios adequados, geralmente esta técnica exige a preparação da amostra, que deve ser triturada e incluída (sólidos) ou diluí da (líquidos) em pastilhas de brometo de potássio (KBr).
i) Ressonância magnética nuclear (nuclear magnetc resonance - NMR):
Esta técnica explora a interação de momentos magnéticos nucleares com ondas eletromagnéticas na região de ondas de frequência de rádio. O espectro obtido identifica a presença de átomos e sua concentração relativa, além de identificação de fases1, propriedades químicas e estruturais das ligações2 e grau de conversão24. Se ao invés do spin do núcleo atômico, a avaliação for do spin do elétron, passa a ser chamada de "ressonância do spin eletrônico" e serve para identificação de radicais livres em moléculas orgânicas1.
j) Difração de raio X (X-ray Diffraction - XRD):
Esta técnica se baseia na leitura do padrão de raios X difratados de uma amostra para identificar fases cristalinas e medir suas propriedades estruturais, além da identificação de arranjos atômicos, mudanças de fase e estresse residual12,25,26. A versatilidade da técnica ainda permite a caracterização de defeitos, a determinação de diferentes camadas para materiais amorfos e multilaminados, bem como a concentração e espessuras dos filmes. Não é uma técnica destrutiva para a maioria dos materiais, contudo, é difícil, a partir de seu uso, identificar elementos químicos de baixo peso molecular1.
l) Espectroscopia por absorção de raios X (X-ray absorption spectroscopy - XAS):
A XAF se baseia no monitoramento do processo de fotoabsorção da amostra irradiada por um feixe monocromático de raios X. Disponibiliza informações sobre as ligações interatômicas, como distância, número de coordenação, tipo de átomo e desordens estruturais1,27. Geralmente fornece informações complementares às técnicas de difração (XRD), porém tem a vantagem de poder ser utilizado em materiais amorfos e soluções, além dos materiais cristalinos. Ao contrário de outros métodos para sua análise química da superfície (AES, XPS), esta técnica não necessita de vácuo. Assim, pode ser elucidativa para o estudo da forma de adsorção de átomos e moléculas numa superfície.1
Considerações finais
A microscopia elêtronica de varredura e a espectroscopia no inframermelho por transformada de Fourier são as técnicas microscópica e espectroscópica, respectivamente, mais usadas em odontologia nos últimos seis anos. Porém, essas análises podem ser complementadas por diversos outros métodos de caracterização dos materiais.
Referências
1. Brundle CR, Evans CA, Wilson S. Encyclopedia of materials characterization: surfaces, interfaces and thin films., Stoneham: Butterworth-Heinemann; 1992. [ Links ]
2. Mannheimer WA. Microscopia dos materiais., Rio de Janeiro: E-paper; 2002. [ Links ]
3. Kunze M, Huber A, Krajewski A, Lowden E, Schuhmann N, Buening H, et al. Efficient gene transfer to periodontal ligament cells and human gingival fibroblasts by adeno-associated virus vectors. J Dent 2009; 37:502-8. [ Links ]
4. Sarafianou A, Seimenis I, Papadopoulos T. Effectiveness of different adhesive primers on the bond strength between an indirect composite resin and a base metal alloy. J Prosthet Dent 2009; 99:377-87. [ Links ]
5. Foxton RM, Melo L, Stone DG, Pilecki P, Sherriff M, Watson TF. Long-term durability of one-step adhesive-composite systems to enamel and dentin. Oper Dent 2008; 33:651-7. [ Links ]
6. Dabija-Wolter G, Cimpan MR, Costea DE, Johannessen AC, Sørnes S, Neppelberg E, et al. Fusobacterium nucleatum enters normal human oral fibroblasts in vitro. J Periodontol 2009; 80:1174-83. [ Links ]
7. Egerton RF. Physical principles of electron microscopy: an introduction a TEM, SEM and AEM., Nova Iorque Springer; 2005. [ Links ]
8. Gu M. Principles in three dimensional imaging in confocal microscope. Londres: Word Cientific Publishing Co; 1996. [ Links ]
9. Tannure PN, Barcelos R, Portela MB, Gleiser R, Primo LG.. Histopathologic and SEM analysis of primary teeth with pulpectomy failure. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 108:e29-e33. [ Links ]
10. Ercoli C, Rotella M, Funkenbusch PD, Russell S, Feng C. In vitro comparison of the cutting efficiency and temperature production of ten different rotary cutting instruments. Part II: Electric handpiece and comparison with turbine. J Prosthet Dent 2009; 101:319-31. [ Links ]
11. Changa MC, Delonga R. Calcium phosphate formation in gelatin matrix using free ion precursors of Ca2+ and phosphate ions. Dent Mater 2009; 25:261-8. [ Links ]
12. Schulz M, von Arx T, Altermatt HJ, Bosshardt D.. Histology of periapical lesions obtained during apical surgery. J Endod 2009; 35:634-42. [ Links ]
13. Tholt de Vasconcellos B, Miranda-Júnior WG, Prioli R, Thompson J, Oda M. Surface roughness in ceramics with different finishing techniques using atomic force microscope and profilometer. Oper Dent 2006; 31:442-9. [ Links ]
14. Topuz O, Aydin C, Uzun O, Inan U, Alacam T, Tunca YM.. Structural effects of sodium hypochlorite solution on RaCe rotary nickel-titanium instruments: an atomic force microscopy study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105:661-5. [ Links ]
15. Bonaccorso A, Schäfer E, Condorelli GG, Cantatore G, Tripi TR. Chemical analysis of nickel-titanium rotary instruments with and without electropolishing after cleaning procedures with sodium hypochlorite. J Endod 2008; 34:1391-95. [ Links ]
16. Gandolfi MG, Sauro S, Mannocci F, Watson TF, Zanna S, Capoferri M, et al. New tetrasilicate cements as retrograde filling material: an in vitro study on fluid penetration. J Endod 2007; 33:742-5. [ Links ]
17. Asgary S, Shahabi S, Jafarzadeh T, Amini S, Kheirieh S. The properties of a new endodontic material. J Endod 2008; 34:990-3. [ Links ]
18. Yang B, Lange-Jansen HC, Scharnberg M, Wolfart S, Ludwig K, Adelung R, et al. Influence of saliva contamination on zirconia ceramic bonding. Dent Mater 2008; 24:508-13. [ Links ]
19. Heuer W, Elter C, Demling A, Neumann A, Suerbaum S, Hannig M. Analysis of early biofilm formation on oral implants in man. J Oral Rehab 2007; 34:377-82. [ Links ]
20. FellowsCM, Thomas GA. Determination of bound and unbound water in dental alginate irreversible hydrocolloid by nuclear magnetic resonance spectroscopy. Dent Mater 2009; 25:486-93. [ Links ]
21. Lewis IR, Edwards H G M. Handbook of RAMAN spectroscopy: from the research laboratory to the process line. Nova Iorque: Science; 2001. [ Links ]
22. Miletic V, Santini A, Trkulja I. Quantification of monomer elution and carbon – carbon double bonds in dental adhesive systems using HPLC and micro-Raman spectroscopy. J Dent 2009; 37:177-84.
23. Chang MC, Delong R. Calcium phosphate formation in gelatin matrix using free ion precursors of Ca2+ and phosphate ions. Dent Mater 2009; 25:261-8. [ Links ]
24. Zainuddin N, Karpukhina N, Hill RG, Law RV. A long-term study on the setting reaction of glass ionomer cements by 27Al MAS-NMR spectroscopy. Dent Mater 2009; 25:290-5. [ Links ]
25. Cattell MJ, Chadwick TC, Knowles JC, Clarke RL. The crystallization of an aluminosilicate glass in the K2O–Al2O3–SiO2 system. Dent Mater 2005; 21:811–22.
26. Iijima M, Brantley WA, Guo WH, Clark WA, Yuasa T, Mizoguchi I. X-ray diffraction study of low- temperature phase transformations in nickel–titanium orthodontic wires. Dent Mater 2008; 24:1454-60.
27. Matsunaga T, Ishizaki H, Tanabe S, Hayashi Y. Synchrotron radiation microbeam X-ray fluorescence analysis of zinc concentration in remineralized enamel in situ. Arch Oral Biol 2009; 54:420-3. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
José Renato Cavalcanti de Queiroz
Av. Juvenal Lamartine, 326, Apto 903 II, Tirol
59020-280 Natal - RN
e-mail: joserenatocq@hotmail.com
Recebido: 08/09/2011
Aceito: 22/03/2012













