Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RFO UPF
versão impressa ISSN 1413-4012
RFO UPF vol.20 no.3 Passo Fundo Set./Dez. 2015
Avaliação da irradiação com laser infravermelho (808nm) na cicatrização de feridas cutâneas de ratos
Assessment of (808 nm) infrared laser irradiation in the healing of cutaneous wounds in rats
Renan Ribas Formighieri I; Ricardo Koempfer I; Rodrigo Alberto Cenci II; Rogério Miranda Pagnoncelli II; Eden Cavalcanti Cunha Lima III
I Graduando em Odontologia, Universidade Comunitária da Região Oeste de Santa Catarina – Unochapecó, Chapecó, SC, Brasil
II Doutorandos em Odontologia, Laser Center, Pontifícia Universidade Católica do Rio Grande do Sul – PUCRS, Porto Alegre, RS, Brasil
III Professor especialista em Patologia, Universidade Comunitária da Região Oeste de Santa Catarina, Chapecó, SC, Brasil
Resumo
Objetivo: este estudo tem como objetivo avaliar a terapia com laser de baixa potência com onda infravermelha, que é mais utilizada para tecidos ósseos, observando suas repercussões na cicatrização de feridas cutâneas de ratos. Métodos: dezessete ratos Wistar foram selecionados aleatoriamente e distribuídos em dois grupos: grupo experimental (GE), com nove animais, e grupo controle (GC), com oito animais. Foram realizados ferimentos padrões na pele da calvária de todos os animais. No pós-operatório, o GE recebeu terapia com laser de baixa potência, comprimento de onda 808 nm (infravermelho), potência 100 mW, densidade de energia 10J/cm², aplicação pontual contínua a cada 48 horas, por um período de dez dias. Para a obtenção de resultados, foram mensuradas as feridas macroscopicamente diariamente e microscopicamente (histomorfométrica e histomorfológica) no décimo dia. Resultados: comparando os dois grupos, não há diferenças histopatológicas marcáveis, ambos exibem processo reparativo com mesmo aspecto morfológico, mesma resposta fibroblástica e disposição fibrosa. Quanto à reepitelização, o GE demonstrou-se inferior ao GC (p = 0,002), assim como a dimensão macroscópica (p <0,05). Conclusão: o protocolo infravermelho pode retardar o processo de reepitelização de feridas cutâneas, portanto, segundo estudos, o que é favorável para reparação de tecidos duros pode retardar cicatrização em tecidos moles adjacentes ao tecido duro alvo.
Palavras-chave: Laser. Histopatologia. Cicatriz.
Abstract
Objetive: This study aimed to assess low-level laser therapy with infrared waves, which is mostly used for bone tissue, observing its effects on the healing of cutaneous wounds in rats. Methods: 17 Wistar rats were randomly selected and distributed into two groups: the experimental group (EG) containing 9 animals, and the control group (CG) containing 8 animals. Standard wounds were performed on the calvaria skin of all the animals. In the postoperative period, the EG received low-level laser therapy, 808 nm wavelength (infrared), 100 mW power, 10 J/cm² energy density, and timely and constant application every 48 hours for 10 days. For the achievement of results, the wounds were macroscopically measured daily and microscopically (histomorphometric and histomorphologic) measured at day 10. Results: Comparing both groups, there are no marked histopathological differences, both show a reparative process with the same morphology, and the same fibroblastic response and fibrous disposition. As for reepithelialization of the EG, it was lower than the CG (p = 0.002), as well as macroscopic scale (p <0.05). Conclusion: The infrared protocol may slow down the reepithelialization process of cutaneous wounds, therefore according to studies, what is favorable for repairing hard tissues may slow down healing in soft tissues adjacent to the target hard tissue.
Keywords: Laser. Histopathology. Scar.
Introdução
Cicatrização em tecidos é um processo complexo, pois pode sofrer influência de fatores locais e sistêmicos, além de envolver várias células, enzimas e fatores de crescimento1. Durante esse período, pacientes submetidos à cirurgia bucal podem apresentar dor, trismo e edema, que, além de promover maior desconforto pós-operatório e atraso na reparação tecidual, podem prejudicar o retorno do paciente a suas atividades diárias2.
Nesses casos, o uso de terapia com laser de baixa potência atua melhorando o processo de reparo em tecidos biológicos por sua capacidade biomoduladora ³, atuando positivamente na cicatrização de tecidos moles por favorecer a angiogenese, com o aumento de células como os fibroblastos, acarretando em aumento da síntese de colágeno e na proliferação de células epiteliais4,5. Em tecidos ósseos, essa terapia atua pelo aumento na atividade osteoblástica, na organização das fibras colágenas e na vascularização6. Além disso, também promove efeito analgésico, pois ocorre aumento da endorfina circulante e do efeito anti-inflamatório por meio da quebra de mastócitos, aumento na histamina e provoca vasodilatação, o que acarreta no aumento da permeabilidade vascular e atua na ciclo-oxigenase, inibindo as prostaglandinas sobre ácido araquidônico7,8.
Contudo, a literatura ainda é muito contraditória em relação ao modo de tratamento, comprimento de onda (infravermelho/vermelho), densidade de energia, dose, número e frequência de exposição do laser, além da duração do tratamento para cada tipo de tecido9. Estudos realizados em animais, principalmente em ratos, demonstram que a maioria dos resultados positivos para cicatrização de tecidos moles é obtida com uso de laser vermelho (onda visível)10-14 e para tecidos duros com uso de infravermelho (onda invisível)15-18.
O objetivo deste estudo é avaliar a terapia com laser de baixa potência com onda infravermelha, que é mais utilizada em tecidos ósseos, observando suas repercussões na cicatrização de feridas cutâneas de ratos.
Métodos
Este estudo é do tipo experimental em animais. Todos os experimentos deste trabalho estão de acordo com as Resoluções Normativas do Conselho Nacional de Controle de Experimentação Animal. O projeto de pesquisa foi aprovado pela Comissão de Ética do Uso dos Animais da Universidade Comunitária da Região Oeste de Santa Catarina, sob número de protocolo de aprovação 011/2014.
Assim, dezessete ratos (Rattus norvegicus albinus, Rodentia mammalia), da família Wistar, saudáveis, do sexo masculino, pesando de 150g a 250g e com sessenta dias de vida, foram selecionados aleatoriamente e distribuídos em dois grupos: grupo experimental (GE), com nove animais, e grupo controle (GC), com oito animais. Ambos os grupos foram acomodados em gaiolas plásticas com cobertura metálica e assoalho forrado com maravalha, mantidas em condições adequadas de temperatura (25°C), umidade e ventilação, alimentação ad libitum e água autoclavada, com ciclo dia/noite.
O procedimento cirúrgico consistiu em sedação profunda dos animais, por meio de injeção intraperitoneal de cloridrato de xilazina 5mg/kg associado a cloridrato de ketamina 100mg/kg, e anestesia local com Lidocaína 10mg/ml. Em seguida, os animais foram submentidos à tricotomia na região da pele calvária e antissepsia com digluconato de clorexidina a 2%.
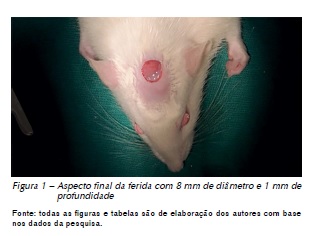
Foram realizados ferimentos padrão na pele da calvária de todos os animais, utilizando bisturi circular (punch) para melhor delimitação da área atingida, representado por uma largura de 8 mm da lâmina e profundidade de 1 mm (Figura 1).
No período pós-operatório, o grupo experimental recebeu aplicação de laser de baixa potência fosfato de índio-gálio-alumínio (In-Ga-Al-P) THERAPY XT®, (DMC®, São Carlos, SP, Brasil), contendo seu comprimento de onda infravermelha de 808 nm ± 10 nm e potência 100 mW, devidamente calibrado.
As irradiações foram iniciadas imediatamente após o procedimento cirúrgico, seguido de mais quatro sessões com intervalo de 48 horas para cada aplicação, dose selecionada em J (joules). A densidade de energia aplicada foi entre a relação da potência (100 mW) x tempo (segundos), resultando em 1 J/cm² aplicado a cada 10 segundos. A aplicação foi pontual e contínua no centro do ferimento com distância de 1 cm da lesão.
O GE recebeu densidade de energia de 10 J/cm², e o GC recebeu simulação de aplicação da irradiação, ou seja, com aparelho desativado, no mesmo período de tempo do grupo experimental, a fim de submeter todos os animais ao mesmo nível de estresse, de modo que não interfira nos resultados da pesquisa.
A cada 24 horas após a cirurgia, foram realizadas mensurações das feridas em milímetros de todos os animais por meio de paquímetro, do diâmetro dos bordos cicatrizados nos sentidos latero-lateral e crânio-caudal.
As peças amostrais foram obtidas no décimo dia, quando os ratos submetidos ao experimento foram eutanasiados com barbitúrico, Tiopental 40mg/kg x 3=120mg/kg, três vezes a dose anestésica habitual, e anestésico local com Lidocaína 10mg/ml. Posteriormente, foi biopsiada toda a lesão da pele calvária em forma de elipse, com profundidade próxima ao osso da calota craniana e um espaço de aproximadamente 10 mm além do ferimento, tendo uma margem de segurança de modo que não danificasse a peça. O material removido foi fixado em solução formalina tamponada a 10% por 24 horas.
O processamento histopatológico foi realizado de acordo com a rotina para inclusão em parafina, submetidos à microtomia e destinados à coloração histológica HE. As carcaças dos animais foram armazenadas em sacos plásticos próprios para esse fim, congelados em freezer (-21°C) e encaminhados para incineração.
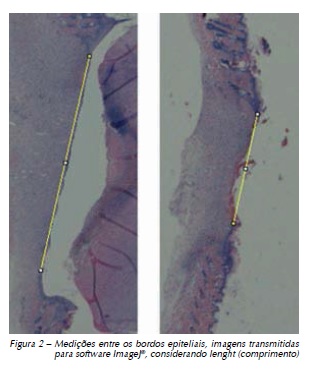
As imagens histopatológicas foram obtidas em microscópio óptico Carl Zeiss®, modelo AXIO Imager. A1m® (Zeiss, São Paulo, SP, Brasil), gerando aumentos de 0.8x para análise histomorfométrica referentes às medições na distância entre as margens do epitélio, imagens transmitidas para programa ImageJ® e ferramenta Straight, sendo considerados os números fornecidos pelo programa em relação à medida Lenght (comprimento) em mm/pixels, calibrados por meio da mensuração de 1 mm de uma régua milimetrada (Figura 2). Com microscópio da marca Olympus, modelo CX21® (Olympus, São Paulo, SP, Brasil), aumento 40x, foram realizadas as análises histomorfológicas (descritivas) do epitélio e derme, comparando a neoformação tecidual entre os grupos.
Os dados coletados foram transferidos para o programa Microsoft Office Excel 2010, e, posteriormente, analisados estatisticamente pelo software SPSS, versão 17.0.
Resultados
Análise histomorfológica Resultados descritivos dos cortes histopatológicos em coloração HE demonstram que o grupo controle (GC) mostra achados microscópicos semelhantes, lesões cutâneas com fundo contendo escasso tecido de granulação e restos celulares; na porção mais profunda da lesão (derme profunda), havia moderada proliferação fibroblástica com disposição fibrosa de tipo cicatricial. Em uma amostra do grupo controle há reepitelização completa da ferida (Figura 3A).
Os resultados histopatológicos do grupo experimental (GE) demonstraram achados microscópicos muito semelhantes ao grupo controle, não havendo maior proliferação fibroblástica ou disposição fibrosa. Também se observa que em nenhuma das amostras há reepitelização total da ferida (Figura 3B).
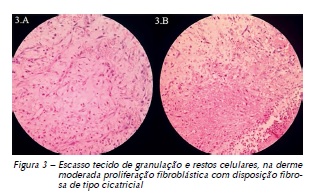
Comparando os dois grupos, não há diferenças microscópicas marcáveis, ambos exibem processo reparativo com o mesmo aspecto morfológico, mesma resposta fibroblástica e disposição fibrosa.
Análise histomorfométrica
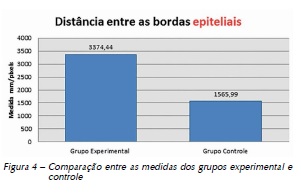
Determinou-se a diferença entre as medidas do comprimento sobre processo de reparo das feridas (as bordas epiteliais), entre os grupos controle e experimental. O GC apresentou menor distanciamento entre os bordos epiteliais no período de dez dias, demonstrando diferença estatística (p = 0,002) (Figura 4).
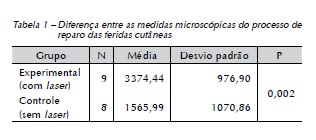
Análise macroscópica
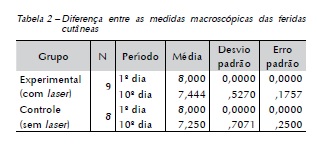
Após mensurações diárias das feridas, em milímetros, de animais de ambos os grupos, os resultados crânio caudal (CC) e latero lateral (LL) foram tabelados e foi criada uma média diária para cada animal, também em milímetros, comparando-se estatisticamente o grupo experimental e o de controle (Figura 5). Pôde-se observar que houve diferença estatisticamente significante entre os grupos (p <0,05) (Tabela 2).
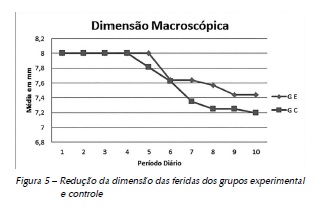
Conforme o apresentado na Figura 5, observa-se a redução da dimensão das feridas de ambos os grupos. O GE após o quinto dia, reduzindo 0,56 mm, e o GC após o quarto dia, reduzindo 0,75 mm, ambos até o final da pesquisa.
Discussão
O presente estudo demonstrou a utilização da terapia com laser de baixa potência, com uso do protocolo mais utilizado na literatura para tecidos ósseos, avaliando sua repercussão sobre tecidos moles. Estudos confirmam que o protocolo infravermelho atua biomodulando positivamente a cicatrização cicatrização óssea em animais e pode ser empregado em casos de implantodontia17, distração osteogênica18, expansão maxilares19 e fraturas ósseas20. Enquanto isso, o protocolo vermelho apresenta resultados positivos de reparação de feridas em tecidos moles10-14.
Entretanto, a literatura é escassa quanto à repercussão de protocolos infravermelhos em tecidos moles. Um estudo21 utilizou laser infravermelho comprimento de onda 780 nm, potência 70 mW, densidade de energia 3,8J/cm², com intervalo de 48 horas por um período de dez dias, a fim de avaliar cicatrização cutânea em ratos e qual processo de cicatrização tecidual do grupo experimental foi acelerado. Isso não vai ao encontro dos resultados deste estudo, que utilizou protocolo infravermelho comprimento de onda 808 nm, potência 100 mW e variação da densidade de energia para 10J/cm², no mesmo período de tempo de aplicação. Portanto, o aumento do comprimento de onda, da potência e da dose pode ter sido prejudicial para aceleração na cicatrização em tecidos moles.
A terapia é afetada pelo comprimento de onda, potência e dose19. Estudos in vitro em culturas celulares de fibroblastos demonstram que densidades de energia baixas (2J/cm²) são estimulantes, enquanto maiores (16J/cm²) podem ser prejudiciais22. Segundo Almeida Lopes et al.23 (2001), células irradiadas com laser infravermelho apresentaram crescimento significante maior do que o das células irradiadas com laser vermelho. No caso deste estudo, aplicando tais condições em tecido mole de modelo animal, não foi verificado aumento no crescimento celular do GE quando comparado ao GC.
A cicatrização das feridas ocorre em várias etapas com parâmetros característicos diários, no período de oito a doze dias. O exame histopatológico apresenta formação de nova epiderme, que ocorre com diferenciação diária, e inicia o fechamento da derme, acompanhada por formação de tecidos de granulação24, o que demonstra que, com os achados histopatológicos deste estudo, no período de dez dias, apresentou fundo contendo tecido de granulação; na porção mais profunda da lesão (derme profunda) havia moderada proliferação fibroblástica com disposição fibrosa de tipo cicatricial e reepitelização da ferida.
Os resultados histopatológicos do GE demonstraram achados microscópicos semelhantes ao GC, não havendo maior proliferação fibroblástica ou disposição fibrosa, o que corrobora com os resultados de Anneroth et al.25 (1988), que avaliaram a cicatrização em ratos, tanto histopatológico quanto macroscopicamente; após aplicação de laser infravermelho, demonstrando que não houve diferença significativa entre as feridas tratadas e não tratadas, o que difere de estudos realizados com laser vermelho, em que o grupo experimental (irradiado) apresenta biomodulação positiva, que atua acelerando o processo de angiogene e o aumento na resposta fibroblástica26.
Quando o epitélio sofre lesão, a borda livre do epitélio tende a migrar até entrar em contato com a margem oposta, esse fenômeno ocorre devido à proliferação das células germinativas27. A reparação tecidual faz-se pela reepitelização dos anexos epiteliais ou epitélio derivado da pele adjacente não acometida28. A reepitelização do GC apresentou-se com menor distanciamento dos bordos epiteliais em relação ao GE, em nenhuma das amostras do GE houve reepitelização total da ferida, enquanto que no GC uma amostra foi observada. Resultados de Poli29 (2010), utilizando laser vermelho 685 nm, potência 35 mW, com diferentes densidades de energias (16J, 8J, 4J), no período de nove dias, mostrando que cinco de onze amostras apresentaram reepitelização total da ferida. Outro estudo, utilizando laser vermelho 660 nm, 100 mW e 10 J/cm², em doze animais, mostrou que todos apresentaram reepitelização total ou quase completa10.
A cicatrização das feridas pode ocorrer de dois modos: na primeira intenção, os bordos são lineares e aproximados; na segunda intenção, os bordos são irregulares e separados. Quando, por segunda intenção, o processo de reparo torna-se mais complicado, pois há uma grande falha que deve ser aproximada entre as margens30. Utilizando-se as médias das medidas macroscópicas, foi evidenciado que o GC apresentou menor dimensão que o GE. Isso não corrobora com Rodrigues et al.21 (2009), que, com protocolo de aplicação infravermelho no período de dez dias e com aplicações a cada 48 horas depois da cirurgia, evidenciaram diferença estatisticamente significativa na redução da ferida do grupo que recebeu terapia com laser de baixa potência.
Conclusão
Com base nos resultados deste estudo, podemos concluir que o protocolo infravermelho comprimento de onda 808 nm, potência 100 mW, densidade de energia 10J/cm², pode retardar o processo de reepitelização de feridas cutâneas, portanto esse protocolo pode atrasar a cicatrização em tecidos moles adjacentes aos tecidos duros.
Referências
1. Mendonça RJ, Netto JC. Aspectos celulares da cicatrização. An Bras Dermatol 2009; 84(3):257-62. [ Links ]
2. Van Wijk AJ, Kieffer JM, Lindeboom JH. Effect to third molar surgery on oral health-related quality of life in the first postoperative week using dutch version of oral Health Impact Profile-14. J Oral Maxillofac Surg 2009; 67(5):1026-31.
3. Karu T. Photobiological fundamentals of low-power laser therapy. IEEE J Quant Electron 1987; 23(10):1703-17.
4. Silva JAN, Pinheiro AL, Oliveira MG, Weismann R, Ramalho LM, Nicolau RA. Computerized morphometric assessment of the effect of low-level lasertherapy on bone repair: an experimental animal study. J Clin Laser Med Surg 2001; 20(2):83-7.
5. Medrado AP, Soares AP, Santos ET, Reis SR, Andrade ZA. Influence of laser photobiomodulation upon connective tissue remodeling during wound healing. J Photochem Photobiol 2008; 92(3):144-52.
6. Ozawa Y, Shimizu N, Kariya G, Abiko Y. Low-energy laser irradiation stimulates bone nodule formation at early stages of cellculture in rat calvarial cells. Bone 1998; 22(4):347-54.
7. Genovese WJ. Laser de baixa intensidade: aplicações terapêuticas em odontologia. São Paulo: Lovise; 2000.
8. Merli LAS, Santos MT, Genovese WJ, Faloppa F. Effect of Low-Intensity laser irradiation on the process of bone repair. Photomed Laser Surg 2008; 23(2):212-5.
9. Woodruff LD, Bounkeo JM, Brannon WM, Dawes KS, Bharam CD, Waddell DL, et al. The efficacy of laser therapy in wound repair: a meta-analysis of the literature. Photomed Laser Surg 2004; 22(3):241-7.
10. Calisto FCFS, Calisto SLS, Souza AP, França CM, Ferreira APL, Moreira MB. Use of low-power laser to assist the healing of traumatic wounds in rats. Acta Cir Bras 2015; 30(3): 204-8.
11. De Melo VA, Dos Anjos DCS, Albuquerque Júnior R, Melo DB, Carvalho FUR. Effect of low level laser on sutured wound healing in rats. Acta Cir Bras 2011; 26(2):129-34.
12. Gál P, Vidinsky B, Toporcer T, Mocry M, Mozes T, ek Longauer F et al. Histological assessment of the effect of laser irradiation on skin wound healing in rats. Photomed Laser Surg 2006; 24(4):480-8.
13. Nascimento DG, Fernandes CAM, Sartoretto JL, Breuschi LC, Cuman RKN, Silva FP. Efeitos da irradiação com laser hene 632.8nm sobre a cicatrização de feridas em ratos. Ciênc Cuid Saúde 2006; 5(2): 229-35.
14. Dall Agnol MA, Nicolau RA, Lima CJ, Munin E. Comparative analysis of coherent light action (laser) versus non-coherent light (light-emitting diode) for tissue repair in diabetic rats. Lasers Med Sci 2009; 24(6):909-16.
15. Marques L, Holgado LA, Francischone LA, Ximenez JP, Okamoto R, Kinoshita A. New LLLT protocol to speed up the bone healing process – histometric and immunohistochemical analysis in ratcalvarial bone defect. Lasers Med Sci 2015; 30(4):1225-30.
16. Batista JD, Sargenti-Neto S, Dechichi P, Rocha FS, Pagnoncelli RM. Low-level laser therapy on bone repair: is there any effect outside the irradiated field? Lasers Med Sci 2015; 30(5):1569-74.
17. Mayer L, Gomes FV, Baraldi CE, Weber JBB, Oliveira MG. Assessment of LLLT systemic effects on thyroid hormones function after dental titanium implant installation: an experimental rabbit model. Natural Science 2013; 5(8):933-40.
18. Cenci RA, Silveira VS, Mayer L, Olveira HW, Moraes JFD, Oliveira MG. Analysis by means of cone-beam computed tomography, bone density and X-ray beam attenuation of rabbit mandibles subjected to low-level laser therapy during distraction osteogenesis. Rev Ciênc Méd Biol 2015; 14(1):30-5.
19. Altan AB, Bicakci AA, Avunduk MC, Esen H. The effect of dosage on the efficiency of LLLT in new bone formation at the expanded suture in rats. Lasers Med Sci 2015; 30(1):255-62.
20. Sella VR, do Bomfim FR, Machado PC, da Silva Morsoleto MJ, Chohfi M, Plapler H. Effect of low-level laser therapy on bone repair: a randomized controlled experimental study. Lasers Med Sci 2015; 30(3):1061-8.
21. Rodrigues SSMFG, Maior BSS, Aquino DR, Anbinder AL. Effects of low-level laser therapy under different protocols on skin wound healing in rats. Clipe Odonto Unitau 2009; 1(1):31-7.
22. Walsh L. The current status of low level laser therapy in dentistry. Part 1. Soft tissue applications. Aust Dent J 1997; 42(4):247-54.
23. Almeida-Lopes L, Rigau J, Zangaro RA, Guidugli-Neto J, Jaeger MM. Comparison of the low level laser therapy effects on cultured human gingival fibroblastos proliferation using different irradiance and same fluence. Laser Surg Med 2001; 29(2):179-84.
24. Braiman-Wiksman L, Solomonik L, Spira R, Tennenbaum T. Novel insights into wound healing sequence of events. Toxicol Pathol 2007; 35(777):767-79.
25. Anneroth G, Hall G, Rydén H, Zetterqvist L. The effect of low-energy infra-red laser radiation on wound healing in rats. Br J Oral Maxillofac Surg 1988; 26(1):12-7.
26. Medrado AP, Soares AP, Santos ET, Reis SR, Andrade ZA. Influence of laser photobiomodulation upon connective tissue remodeling during wound healing. J Photochem Photobiol B 2008; 92(3):144-52.
27. Hupp JR, Ellis III E, Tucker MR. Cirurgia oral e maxilofacial contemporânea. 4. ed. São Paulo: Elsevier; 2005.
28. Mandelbaum SH, Santis EP, Mandelbaum MHSA. Cicatrização: conceitos atuais e recursos auxiliares. An Bras Dermatol 2003; 78(4):393-410.
29. Poli VD. Análise do tempo e da influência da LLLT no processo de reparo de feridas em dorso de ratos [Tese de Doutorado]. Porto Alegre: Pontifícia Universidade Católica do Rio Grande do Sul; 2010.
30. Robbins SL, Cotran RS, Kumar VY. Patologia básica. 5. ed. Rio de Janeiro: Guanabara Koogan; 2003.
 Endereço para correspondência:
Endereço para correspondência:
Renan Ribas Formighieri
Rua Fernando Machado, 1.835E
89814-211 Chapecó, SC
e-mail: renanribasf@gmail.com
Recebido: 23/10/15
Aceito: 07/01/16













