Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RFO UPF
versão impressa ISSN 1413-4012
RFO UPF vol.21 no.2 Passo Fundo Mai./Ago. 2016
Elementos contribuintes para a aplicação da Odontologia baseada em evidências: parte II
Contributing elements for the application of Evidence-Based Dentistry: part II
Luana Zanella I; Carla Regina Serraglio II; Sinval Adalberto Rodrigues Junior III
I DDS, mestranda no Programa de Pós-Graduação em Ciências da Saúde, Universidade Comunitária da Região de Chapecó, Chapecó, SC, Brasil
II DDS, cirurgiã-dentista em Bom Jesus, SC, Brasil
III DS, MsC, PhD, professor titular do curso de Odontologia e do Programa de Pós-Graduação em Ciências da Saúde, Universidade Comunitária da Região de Chapecó, Chapecó, SC, Brasil
Resumo
Visando aplicar o modelo da Odontologia baseada em evidências (OBE) no dia a dia, o profissional precisa conhecer alguns conceitos de epidemiologia clínica e bioestatística. Objetivos: este estudo traz os elementos envolvidos na geração quantitativa da evidência com base na análise de estudos primários, na avaliação do risco de viés desses estudos e na determinação da qualidade da evidência gerada. Revisão de literatura: ensaios clínicos controlados randomizados (ECCRs) representam o melhor modelo de estudo para determinar a eficácia terapêutica de tecnologias em saúde, gerando dados que permitem calcular a diferença média entre grupos terapêuticos, o risco relativo ou o odds ratio (razão de chance). Essas medidas de tamanho de efeito, juntamente com seus intervalos de confiança, são geradas em revisões sistemáticas pela metanálise e permitem determinar a alternativa terapêutica mais indicada para a situação clínica a ser resolvida. A metanálise também gera informações quanto à heterogeneidade dos dados obtidos. Revisões sistemáticas devem também sintetizar a qualidade da informação provida pelos estudos primários e da evidência gerada. Isso é feito com instrumentos como o da Colaboração Cochrane, para avaliação do risco de viés, e o GRADE, que permite avaliar a qualidade da evidência gerada centrada no desfecho. Considerações finais: estes estudos visaram instrumentalizar estudantes e profissionais de odontologia para o vislumbre da prática clínica sob o modelo da OBE, apresentando elementos da construção e análise de revisões sistemáticas e ECCRs. Este estudo focou nos elementos relativos à análise dos dados e na qualificação da evidência gerada.
Palavras-chave: Epidemiologia. Odontologia baseada em evidências. Prática clínica baseada em evidências.
Abstract
Aiming to apply the Evidence-Based Dentistry (EBD) model in daily practice, the dental professional should know some concepts of clinical epidemiology and biostatistics. Objective: This study presents the elements involved in the quantitative generation of evidence from the analysis of primary studies, assessment of risk of bias of such studies, and determination of the quality of evidence produced. Literature review: Randomized controlled clinical trials (RCCTs) represent the best study design to determine the therapeutic effectiveness of health technologies, producing data that allow calculating the mean difference among therapeutic groups, relative risk, or odds ratio. Such measures of size effect along with their confidence intervals are produced in systematic reviews through meta-analysis and allow determining the most recommended therapeutic alternative for each clinical situation. Meta-analysis also produces information on the heterogeneity of data obtained. Systematic reviews should also synthetize the quality of information provided by primary studies and of the evidence produced. This is possible with instruments such as the Cochrane Collaboration for assessing risk of bias, and GRADE. The latter allows assessing the quality of evidence produced, focused on the outcome. Final considerations: This series of two studies aimed to equip students and Dentistry professionals to visualize their practice under the EBD model, presenting elements of the construction and analysis of systematic reviews and RCCTs. This study focused on elements related to data analysis and quality assessment of the evidence produced.
Keywords: Epidemiology. Evidence-Based Dentistry. Evidence-Based Clinical Practice.
Introdução
A OBE requer de quem a aplique no cotidiano, além do conhecimento específico na área em estudo, o conhecimento de elementos fundamentais da configuração de estudos epidemiológicos e de estatística. Assim, identificado algum estudo com potencial de atestar a eficácia de uma intervenção terapêutica em odontologia, ou seja, um ensaio clínico controlado randomizado (ECCR), o próximo desafio é interpretá-lo. Igualmente, quando o estudo identificado é uma revisão sistemática cujos substratos são os ECCRs, a organização e a síntese dos dados podem causar algum susto em um primeiro contato.
Diante do exposto, esta segunda etapa do estudo tem por objetivo apresentar elementos necessariamente envolvidos na estrutura de revisões sistemáticas de literatura, visando colaborar com a interpretação desses estudos.
Revisão da literatura
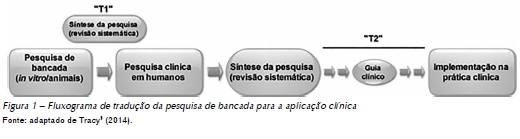
Tecnologias em saúde têm um ciclo de vida composto por fases relativas ao seu desenvolvimento e à sua aplicação no mercado. A primeira fase envolve pesquisas básicas e aplicadas e teste de protótipos e é seguida pela incorporação da tecnologia no mercado e por sua obsolência1. Alguns autores afirmam que o primeiro passo desse ciclo, ou seja, a tradução da pesquisa básica e sua aplicabilidade clínica, pode demorar, em média, dezessete anos, e que esse tempo pode impactar no custo do tratamento2,3. Desse modo, a Avaliação de Tecnologias em Saúde tem um papel primordial de subsídio para a tomada de decisão de profissionais e gestores em saúde acerca da gestão das tecnologias em saúde1.
O processo decisório sobre o uso de determinada tecnologia em saúde depende de evidências acerca de domínios econômicos, técnicos e clínicos, entre outros campos1. No domínio clínico, elementos como eficácia, efetividade, eficiência e segurança são avaliados. A efetividade refere-se aos resultados de intervenções em saúde dentro de condições reais. Para o Committee on Quality of Health Care in America4, a efetividade é baseada no uso de evidências adquiridas para determinar se uma intervenção em específico traz melhores resultados do que outras, ou do que não fazer nada. Já a eficiência diz respeito à relação entre o custo e o impacto das intervenções sobre a saúde da população. A eficiência também pode ser definida como a relação entre o impacto real de uma intervenção (efetividade) e seu custo5.
A eficácia e a segurança de determinada tecnologia são os parâmetros avaliados nos ensaios clínicos controlados randomizados, pois dizem respeito aos resultados alcançados sob condições controladas nas quais, idealmente, o único fator de variação entre o grupo que recebe a intervenção alternativa e o grupo controle é a própria intervenção6; também são os primeiros parâmetros clínicos a serem avaliados quando da introdução de novas tecnologias em saúde.
Análise dos resultados de um ECCR
A análise da eficácia de uma intervenção terapêutica depende de como a variável em análise (ou desfecho) é mensurada. De modo geral, estatisticamente, as variáveis podem ser numéricas contínuas e categóricas dicotômicas. O primeiro tipo expressa uma variável passível de mensuração com significado quantitativo, como a altura de um indivíduo (em metros), seu peso (em quilos) ou a concentração de cortisol salivar (em U/ml), etc. Já o segundo expressa categorias mutuamente excludentes, como sucesso/ fracasso, masculino/feminino, tratado/não tratado, etc.
O resultado de variáveis numéricas contínuas é expresso na forma de uma medida de tendência central e de uma medida de dispersão, ou seja, média e desvio padrão (ex.: a altura dos acadêmicos do curso de Odontologia é, em média, 1,68 m ± 8,5 m); já o desfecho de variáveis categóricas dicotômicas é observado como o número de eventos relativo ao total de sujeitos em cada grupo de tratamento (ex.: a frequência de falha do tratamento endodôntico foi de 12 em 100 tratamentos, 12%).

O Quadro 1 representa a forma como os dados dicotômicos podem ser organizados para a obtenção de parâmetros que expressem o efeito das intervenções. O fator 'exposição' (expostos/não expostos) representa, nesse caso, as alternativas terapêuticas às quais os sujeitos são expostos, enquanto a presença ou ausência de desfecho indica o número de sujeitos que apresentaram ou não a doença ou a condição após os tratamentos.
Medidas de efeito são utilizadas para sumarizar o efeito das intervenções tanto para variáveis contínuas quanto para variáveis dicotômicas. Segundo Coe7 (2002), o 'tamanho do efeito' quantifica a diferença entre dois grupos, permitindo avançar do simplista 'Funciona ou não?' para 'Quão melhor dada intervenção funciona em uma variedade de contextos?'. Dentro da imensa variedade de medidas de tamanho de efeito existente, as medidas pertencentes à família d expressam a diferença entre grupos e podem ser usadas tanto com variáveis contínuas (diferença média) quanto com variáveis dicotômicas (risco relativo ou razão de risco e razão de chance ou odds ratio)8.
Imagine um ensaio clínico controlado randomizado fictício concebido para avaliar a eficácia de duas alternativas terapêuticas (A e B) de tratamento de bolsas periodontais, sendo A o tratamento padrão e B o tratamento alternativo. O ganho do nível de inserção clínica com o tratamento A foi de 1,2 mm ± 0,2 mm, enquanto que com o tratamento B foi de 1,6 mm ± 0,3 mm. O tamanho do efeito (d) é calculado como: [média do grupo experimental – média do grupo controle]/desvio padrão. O desvio padrão adotado pode ser o do grupo controle (uma vez que o populacional dificilmente é conhecido) ou o valor combinado de ambos os grupos7; assim, o cálculo do tamanho do efeito para o referido estudo é d = (1,6-1,2)/0,2 = 2, e reflete a superioridade média do ganho de nível de inserção que um sujeito aleatoriamente escolhido no grupo B terá em relação a um sujeito do grupo A8.
Agora, imagine um ECCR fictício concebido para avaliar a eficácia de duas alternativas terapêuticas (A e B) para reduzir a sensibilidade dentária. Os resultados são expressos como o número de casos de sensibilidade dentária observados após o tratamento A (padrão) e o tratamento B (alternativo) e podem ser organizados em uma tabela de contingência (Quadro 2).
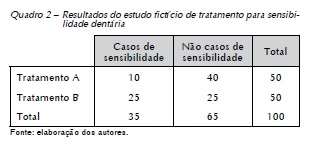
Para esse caso, há duas alternativas de medida de tamanho de efeito: a razão de risco ou risco relativo (RR) e a razão de chance ou odds ratio (OR). Ambas as medidas são calculadas a partir dos dados do Quadro 2. O RR representa a razão entre o risco de desenvolver sensibilidade dentária no grupo que recebe o tratamento A e o risco de desenvolver a doença no grupo que recebe o tratamento B, sendo calculado conforme segue:
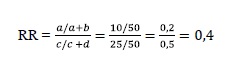
Com base no cálculo apresentado, o risco de manifestar sensibilidade sendo utilizado o tratamento A é de 20%, ao passo que com o tratamento B, o risco é de 50%. Já o RR de 0,4 indica que o risco de desenvolver sensibilidade dentária sendo utilizado o tratamento A é 60% menor que com o tratamento B.
O OR é usado como medida de tamanho de efeito em estudos retrospectivos, em especial o de caso -controle, no qual não pode ser determinado o risco9, mas também pode ser usado em metanálises de intervenções. O OR é calculado conforme segue:
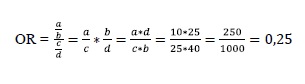
Um OR igual a 1 indica a mesma chance de ocorrência de sensibilidade dentária para o tratamento A e para o tratamento B (1:1). Valores menores do que 1 indicam que a chance de o evento ocorrer no primeiro grupo é menor, ao passo que valores maiores do que 1 representam que a chance de o evento ocorrer no segundo grupo é menor. Dessa forma, o valor calculado de 0,25 indica proteção pelo tratamento A com relação ao tratamento B (0,25:1 ou 1:4).
Análise dos resultados de uma revisão sistemática
A análise dos dados das revisões sistemáticas pode ou não envolver a metanálise (análise da análise) estatística, que combina o resultado de vários estudos independentes produzindo uma única estimativa de efeito acerca da intervenção baseada nos dados dos sujeitos dos estudos incluídos. Dentre os pressupostos para a execução da metanálise, os estudos precisam ser suficientemente homogêneos quanto às intervenções, aos participantes e aos desfechos10. Qualquer técnica estatística pode ser aplicada em metanálises, dependendo da natureza dos dados e dos objetivos do estudo11. Há dois elementos a serem observados na metanálise: a estimativa combinada do tamanho do efeito, expressa como diferença média, risco relativo ou odds ratio, acompanhados pelos respectivos intervalos de confiança, e a heterogeneidade entre os estudos.
O intervalo de confiança é uma estimativa da variabilidade do tamanho do efeito nos estudos e é representado nos gráficos de metanálise pelas linhas horizontais associadas ao ponto de estimativa do efeito12 (Figura 1). O intervalo de confiança representa uma faixa dentro da qual o efeito verdadeiro do tratamento possivelmente está localizado. O mais comumente adotado em metanálise é o intervalo de confiança de 95% (IC95%), o que significa que se um experimento qualquer for repetido 100 vezes, em 95 deles o intervalo de confiança incluirá o verdadeiro valor do efeito13.
A heterogeneidade entre os estudos incluídos em uma metanálise é uma característica inerente a esse tipo de análise, uma vez que um estudo nunca será igual ao outro, mesmo tendo sido realizado pelo mesmo grupo de pesquisa. Variações clínicas e metodológicas são responsáveis pela heterogeneidade entre os estudos; as primeiras podem envolver variações entre sujeitos, intervenções, desfechos, etc., enquanto as segundas dependem de variações no desenho dos estudos e dos métodos utilizados.
Estatisticamente, a heterogeneidade entre estudos é identificada com as análises de I2 e chi2. Tipicamente, heterogeneidades expressas pelo I2 acima de 50% são consideradas heterogeneidades significativas, indicando a necessidade de identificar as possíveis causas por meio de análises de subgrupos que possam isolar características dos sujeitos, intervenções ou outras possíveis fontes de variação.
A metanálise pode se basear em dois modelos: o modelo de efeito fixo e o modelo de efeito randômico. O modelo de efeito fixo assume que há um único efeito verdadeiro entre os estudos envolvidos e que as diferenças observadas entre eles são devidas a erros no processo de amostragem. Caracteristicamente, o modelo de efeitos fixos é menos conservador quanto à significância estatística do efeito do tratamento e permite que estudos com maior poder estatístico tenham maior peso na metanálise14. Já o modelo de efeitos randômicos assume que o efeito verdadeiro da intervenção pode variar de estudo para estudo, uma vez que pode haver variação das características dos participantes e das intervenções de cada um. O modelo de efeitos randômicos assume a existência de heterogeneidade entre os estudos e valoriza a contribuição de estudos menores; sua significância estatística é mais conservadora, aumentando o intervalo de confiança da média do tamanho do efeito14.
Quando não é possível analisar quantitativamente os dados, a opção é por sua descrição de modo narrativo. Porém, considerando a perspectiva da elaboração de um guia clínico com base nos dados compilados das várias revisões sistemáticas sobre um dado tratamento, a síntese quantitativa dos dados de uma revisão sistemática é preferível, sempre que possível. A Figura 1 mostra os elementos expressos no gráfico de uma metanálise fictícia.
Qualidade metodológica e de relato dos estudos primários e secundários
Ensaios clínicos controlados randomizados, quando concebidos, executados e relatados de forma adequada, representam o estudo padrão-ouro para avaliar a eficácia de intervenções em saúde. Entretanto, a falta de rigor metodológico nesses estudos pode gerar resultados equivocados devido à indução de vieses metodológicos que podem ser de seleção, informação, aferição, etc15. Os leitores desses estudos devem ser capazes de avaliá-los criticamente quanto ao risco de indução de vieses, o que nem sempre é possível, devido à falta de transparência e rigor no seu relato. Visando solucionar os problemas observados nos ECCRs, o guia CONSORT (Consolidated Standards of Reporting Trials) foi criado em 1996 e revisado cinco anos depois15. Sua última versão data de 2010 (www.consort-statement.org) e sugere 25 itens a serem contemplados em um ECCR, além de um fluxograma do estudo.
Já quando os ECCRs são avaliados quanto à sua qualidade metodológica dentro de uma revisão sistemática, o instrumento sugerido é o The Cochrane Collaboration´s tool for assessing risk of bias (Instrumento da Colaboração Cochrane para avaliação do risco de viés), que contempla os domínios geração de sequência de alocação aleatória, sigilo de alocação, cegamento dos participantes, pesquisadores e coletores de resultados, completude da descrição dos desfechos, publicação seletiva dos desfechos e outras fontes de viés10. O instrumento permite classificar o estudo em: 'risco de viés baixo', 'risco de viés alto' e 'risco de viés incerto' a partir do seu relato para cada domínio. Estudos com risco de viés alto nos domínios-chave (geração da sequência de alocação aleatória, sigilo de alocação e cegamento) impactam a capacidade de gerar evidência acerca do desfecho estudado. O Quadro 3 apresenta os critérios para a classificação do risco de viés dos ECCRs nos domínios-chave.

Enquanto o referido instrumento permite avaliar o risco de viés dos ECCRs em uma revisão sistemática, os critérios do GRADE (Grading of Recommendations Assessment, Development and Evaluation) permitem avaliar a qualidade da evidência gerada pelos estudos primários na revisão10. O GRADE é um sistema de avaliação da qualidade da evidência gerada nas revisões sistemáticas transparente, estruturado e centrado no desfecho, que considera cinco critérios de avaliação: risco de viés dos estudos primários, inconsistência, evidência indireta, imprecisão e viés de publicação16,17.
Por fim, o relato de uma revisão sistemática deve conter elementos importantes para atestar sua qualidade metodológica e permitir sua reprodução, caso se compreenda essa necessidade. A exemplo do CONSORT para os ECCRs, o guia PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses: www.prisma-statement.org) orienta a elaboração e o relato de revisões sistemáticas, apresentando uma lista de 27 itens a serem contemplados no estudo18.
Discussão
Apesar de a adoção da OBE ou da saúde baseada em evidências (SBE) ser quase uma unanimidade entre os profissionais da saúde como forma de dispor a melhor prática de cuidado com a saúde, ela está longe de ser universalmente colocada em prática, principalmente porque os profissionais se sentem despreparados para sua adoção na prática clínica19,20. Verifica-se a falta da compreensão do conceito de evidência, extrapolando o aplicado no jargão de cursos técnicos e livros publicados e se referindo à crítica da informação apresentada nos estudos. Ainda, observa-se a falta das ferramentas de epidemiologia clínica e bioestatística para exercer essa avaliação crítica.
Aplicar a OBE no contexto clínico vai além da simples leitura de artigos, demandando uma avaliação crítica da qualidade metodológica e dos resultados apresentados por esses estudos21. Vários estudos apontam a necessidade de desenvolver habilidades de avaliação crítica e pensamento crítico em estudantes da área da saúde a fim de que um cuidado otimizado, pautado na SBE, seja disponibilizado21,22.
No entanto, vários obstáculos são identificados para a implementação efetiva da SBE no meio acadêmico, entre eles, a falta de tempo, das habilidades necessárias ao corpo docente, de treinamento, de recursos e de preparo do corpo discente20,22-24. Quando perguntados sobre a percepção acerca da implementação da OBE no currículo de graduação de uma escola de Odontologia norte-americana, seus membros apontaram barreiras como tempo, conhecimento e recursos para fazê-lo, embora considerassem a OBE importante no contexto do atendimento odontológico20. Já acadêmicos de Odontologia norte-americanos afirmaram, enfaticamente, que a OBE deveria fazer parte de modo integral no currículo de graduação25. Segundo Werb e Matear23 (2004), a falta de compreensão dos docentes de Odontologia é uma das barreiras mais comuns à disseminação do modelo da OBE.
Em estudo recente, estudantes de Odontologia afirmaram sentir-se confiantes em determinar se achados de um determinado estudo podem ser generalizados, em determinar o peso dos achados de um estudo publicado e em verificar a adequação do tamanho da amostra ao objetivo proposto. Contudo, eles se sentem pouco confiantes em examinar e aplicar adequadamente testes estatísticos25. Os elementos apontados constituem o corpo de conhecimento relativo à epidemiologia necessário à tomada de decisão nos moldes da OBE.
Demarco e Pordeus26 (2013) destacam que o cenário de ensino da epidemiologia nos cursos de Odontologia ainda está longe de condizer com o preconizado pelas Diretrizes Curriculares Nacionais (DCNs), dada a discrepância de dedicação a esse assunto em comparação com temas clínicos que visam ao aperfeiçoamento da técnica operatória. Mesmo assim, os autores destacam a necessidade de mudança desse perfil e o desafio imposto à pós-graduação efetivamente para atuar nessa mudança.
Por fim, o caráter colaborativo da OBE como modelo gera materiais, processos, guias e softwares gratuitos e acessíveis a quem tiver interesse em se aprofundar no tema, além da integração de profissionais da saúde entre si e com profissionais de outras áreas, de modo consonante com o que as DCNs preconizam.
Considerações finais
Esta revisão de literatura apresentou elementos necessários para análise e interpretação de dados resultantes de ECCRs e revisões sistemáticas de literatura com desfecho terapêutico. Também foram abordados alguns dos instrumentos utilizados na avaliação do risco de viés de estudos primários e da qualidade da evidência final, com vistas à tomada de decisão clínica.
Referências
1. Brasil. Ministério da Saúde. Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Ciência e Tecnologia. Diretrizes metodológicas: elaboração de estudos para avaliação de equipamentos médico-assistenciais/ Ministério da Saúde, Secretaria de Ciência, Tecnologia e Insumos Estratégicos, Departamento de Ciência e Tecnologia. Brasília: Ministério da Saúde; 2013. 96 p. (Série A: Normas e Manuais Técnicos). [ Links ]
2. Morris ZS, Wooding S, Grant J. The answer is 17 years, what is the question: understanding time lags in translational research. J R Soc Med 2011; 104(12):510-20.
3. Tracy SL. From bench-top to chair-side: how scientific evidence is incorporated into clinical practice. Dent Mater 2014; 30(1):1-15.
4. Institute of Medicine of the National Academies (IOM). Committee on Quality of Health Care in America. Crossing the Quality Chasm: a new health system for the 21st century. Washington: National Academies Press; 2001.
5. Donabedian A. The seven pillars of quality. Arch Pathol Lab Med 1990; 114(11):1115-8.
6. Ribeiro EAW. Eficiência, efetividade e eficácia do planejamento dos gastos em saúde. Hygeia 2006; 2(2):27-46.
7. Coe R. It´s the effect size, stupid. Education-line [periódico on-line] 2002 [citado 2002 Sept. 25]. Disponível em URL: http://www.leeds.ac.uk/educol/documents/00002182.htm. 8. Ellis PD. The essential guide to effect sizes: statistical power, meta-analysis, and the interpretation of research results. Cambridge: Cambridge University Press; 2010.
9. Fletcher RH, Fletcher SW. Epidemiologia clínica. 4. ed. Porto Alegre: Artmed; 2006.
10. Higgins JPT, Green S, editors. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Disponível em URL: www.cochrane-handbook.org.
11. Luiz AJB. Meta-análise: definição, aplicações e sinergia com dados espaciais. Cadernos de Ciência e Tecnologia 2002; 19(3):427-8.
12. Serraglio CR, Zanella L, Dalla-Vecchia KB, Rodrigues-Junior SA. Efficacy and safety of over-the-counter whitening strips as compared to home-whitening with 10% carbamide peroxide gel – Systematic review of RCTs and metanalysis. Clinical Oral Investigations 2016; 20(1):1-14.
13. Guyatt GH, Oxman AD, Kunz R, Brozek J, Alonso-Coello P, Rind D, et al. GRADE guidelines 6. Rating the quality of evidence – imprecision. J Clin Epidemiol 2011; 64(12):1283-93.
14. Borenstein M, Hedges LV, Higgins JPT, Rothstein HR. Introduction to meta-analysis. West Sussex: John Wiley & Sons; 2009.
15. Moher D, Hopewell S, Schulz KF, Montori V, Gøtzsche PC, Devereaux PJ, et al. CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomized trials. Brit Med J 2010; 340:c869. DOI:10.1136/bmj.c869.
16. Guyatt GH, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, et al. GRADE guidelines: 1. Introduction – GRADE evidence profiles and summary of findings tables. J Clin Epidemiol 2011; 64(4):383-94.
17. Brasil. Ministério da Saúde. Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Ciência e Tecnologia. Diretrizes metodológicas: Sistema GRADE – manual de graduação da qualidade da evidência e força de recomendação para tomada de decisão em saúde/ Ministério da Saúde, Secretaria de Ciência, Tecnologia e Insumos Estratégicos, Departamento de Ciência e Tecnologia. Brasília: Ministério da Saúde; 2014. 72p. (Série A: Normas e Manuais Técnicos).
18. Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JPA, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate healthcare interventions: explanation and elaboration. Brit Med J 2009; 339:b2700.
19. Chang A, Levin RF. Tactics for teaching evidence-based practice: improving self-efficacy in finding and appraising evidence in a Master's Evidence-Based Practice Unit. Worldviews on Evidence-Based Nursing 2014; 11:266-9.
20. Marshall TA, Straub-Morarend CL, Qian F, Finkelstein MW. Perceptions and practices of dental school faculty regarding evidence-based dentistry. J Dent Educ 2013; 77:146-51.
21. Jelsness-Jorgensen LP. Does a 3-week critical research appraisal course affect how students perceive their appraisal skills and the relevance of research for clinical practice? A repeated cross-sectional survey. Nurse Education Today 2014; 35:e1-e5.
22. Buchanan H, Siegfried N, Jelsma J, Lombard C. Comparison of an interactive with a didactic educational intervention for improving the evidence-based practice knowledge of occupational therapists in the public health sector in South Africa: a randomized controlled trial. Trials 2014; 15:216.
23. Werb SB, Matear DW. Implementing evidence-based practice in undergraduate teaching clinics: a systematic review and recommendations. J Dent Educ 2004; 68(9):995-1003.
24. Sabounchi SS, Nouri M, Erfani N, Houshmand B, Khoshnevisan HM. Knowledge and attitude of dental faculty members towards evidence-based dentistry in Iran. Eur J Dent Educ 2013; 17(3):127-37.
25. Straub-Morarend CL, Wankiiri-Hale CR, Blanchette DR, Lanning SK, Bekhuis T, Smith BM, et al. Evidence-based practice knowledge, perceptions, and behavior: a multi-institutional, cross-sectional study of a population of U.S. dental students. J Dent Educ 2016; 80(4):430-8.
26. Demarco FF, Pordeus IA. O ensino da epidemiologia na educação odontológica. In: Antunes JLF, Peres MA. Epidemiologia da saúde bucal. 2. ed. São Paulo: Santos; 2013. p. 593-612.
 Endereço para correspondência:
Endereço para correspondência:
Sinval Adalberto Rodrigues-Junior
Universidade Comunitária da Região de Chapecó
Área de Ciências da Saúde – Caixa postal 1.141
Av. Senador Atílio Fontana, 591-E Efapi
89809-000 Chapecó, SC, Brasil
e-mail: rodriguesjunior.sa@unochapeco.edu.br
Recebido: 07/07/2016
Aceito: 09/09/2016













