Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RFO UPF
versão impressa ISSN 1413-4012
RFO UPF vol.21 no.3 Passo Fundo Set./Dez. 2016
Mecanismo de ação da clorexidina sobre as enzimas metaloproteinases e sua repercussão clínica: um estudo de revisão
Mechanism of action of chlorhexidine on metalloproteinase enzymes and their clinical impact: a review study
Valdeci Elias dos Santos Junior I ; Julia Dantas Gomes Lyra II ; Marília Bizinoto Silva III; Mônica Vilela Heimer IV ; Aronita Rosenblatt V
I Pós-Doutor, Doutor e Mestre em Odontopediatria pela Universidade de Pernambuco – FOP/UPE
II Aluna do curso de graduação da Faculdade de Odontologia da Universidade de Pernambuco – FOP/UPE
III Mestre em Ciências da Saúde pela Universidade de Brasília - UnB
IV Doutora e Mestre em Odontopediatria e Professora Adjunta da Faculdade de Odontologia de Pernambuco – FOP/UPE – Departamento de Saúde Pública
V Pós-Doutora, Doutora e Mestre em Odontopediatria e Professora titular da Universidade de Pernambuco – FOP/UPE – Departamento de Odontopediatria
RESUMO
Objetivo: analisar o mecanismo de ação da clorexidina sobre as enzimas matrizes metaloproteinases (MMPs) e sua repercussão clínica. Materiais e método: a estratégia de busca incluiu as bases de dados Medline, Lilacs e Pubmed. A seleção dos artigos foi feita com base nos seguintes critérios: ter sido escrito em inglês, espanhol ou português, no formato de artigo original, com resumos disponíveis, abordar aspectos que relacionem as MMPs aos sistemas adesivos e/ou a influência da clorexidina sobre estas enzimas, e ter sido publicado entre os anos de 2005 a 2015. Resultados: foram encontrados 34 artigos, porém, após a análise crítica dos resumos, apenas 18 estudos foram incluídos. Considerações finais: o uso da clorexidina como primer terapêutico após o condicionamento ácido previne a ativação da enzima metaloproteinase que degrada a rede de colágeno causando falhas em restaurações adesivas. Logo, o uso de tal substância deve ser estimulado para evitar falhas em restaurações adesivas, aumentando o tempo de vida útil dessas.
Palavras-chaves: Clorexidina. Colágeno. Dentina. Restauração.
ABSTRACT
Objective: to analyze the mechanism of action of chlorhexidine on the matrix metalloproteinases (MMPs) enzymes and their clinical impact. Materials and method: the search strategy included Medline, Lilacs, and Pubmed databases. The articles were selected based on the following criteria: be written in English, Spanish, or Portuguese, be formatted as an original article, have abstracts available, address issues that relate MMPs to adhesive systems and/or the influence of chlorhexidine on these enzymes, and be published between 2005 and 2015. Results: 34 articles were found, but only 18 studies were included after the critical analysis of abstracts. Final considerations: the use of chlorhexidine as a therapeutic primer after acid etching prevents activating the metalloproteinase enzyme that degrades the collagen network, causing failure in adhesive restorations. Therefore, the use of this substance must be encouraged to avoid adhesive failure in restorations, increasing their lifetime.
Keywords: Chlorhexidine. Collagen. Dentin. Restoration.
Introdução
A dentina humana é composta por tecido mineralizado envolto por uma matriz extracelular. Além do colágeno tipo I, proteínas não colagenosas compõem essa matriz e, dentre essas, há de se destacar as matrizes metaloproteinases (MMPs)1-4. As MMPs encontradas na dentina são produzidas pelos odontoblastos durante a produção da matriz extracelular e, após a calcificação da dentina, essas enzimas permanecem em sua forma inativa3,4. Entretanto, podem ser reativadas durante o processo carioso, devido à acidez do meio, propiciando a degradação da rede de colágeno1,2,5-12.
Assim como o desenvolvimento do processo carioso, a atuação de condicionadores ácidos para o emprego de sistemas adesivos, seja nos sistemas de condicionamento ácido total ou auto condicionantes, também pode ativar as MMPs3,4,7-9, possibilitando a degradação da matriz de colágeno. A consequência dessa degradação é a falha na adesividade de restaurações em resina composta13-17. Portanto, na tentativa de evitar estas falhas, alguns inibidores de MMPs têm sido incorporados tanto à camada híbrida quanto aos sistemas adesivos, sendo a clorexidina a substância considerada mais promissora1-4,18.
Dessa forma, o objetivo do estudo foi verificar, por meio de uma revisão da literatura, o mecanismo de ação da clorexidina sobre as enzimas metaloproteinases (MMPs) e sua repercussão clínica sobre a adesividade de restaurações em resina compostas.
Materiais e método
A estratégia de busca para a realização desta revisão incluiu artigos indexados na Medical Literature Analysis and Retrieval System Online (Medline), Literatura Latino-Americana de Ciências da Saúde (Lilacs), e no National Library of Medicine (Pubmed). Utilizou-se os seguintes descritores: "chlorhexidine", "metalloproteinase", "adhesive", "clorexidina", "metaloproteinase", "adesivo", reconhecidos pelo vocabulário DeCS/MeSH. Em seguida, foram feitos os cruzamentos dos descritores.
Os critérios de inclusão foram: ter sido escrito em inglês, espanhol ou português, com resumos disponíveis nas bases de dados, no período de 2005 a 2015 e que abordassem aspectos que relacionassem as MMPs aos sistemas adesivos e/ou à influência da clorexidina sobre essas enzimas. Excluiu-se dessa seleção os artigos que se encontravam em duplicata nas bases de dados e estudos que não se apresentavam em formato de artigo, como guidelines, cartas, editoriais, teses e dissertações (Figura 1).
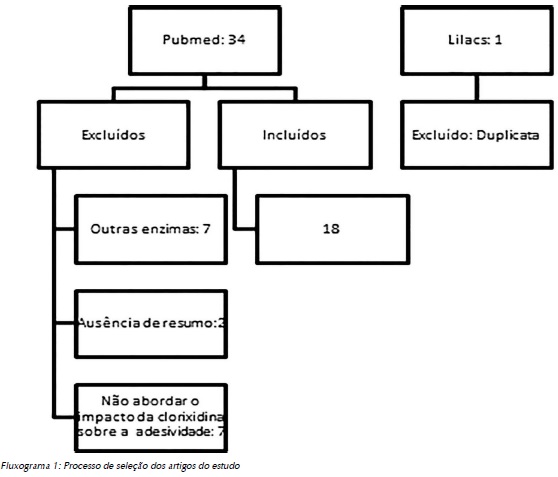
Resultados
Foram encontrados 34 estudos elegíveis, dos quais apenas 18 preencheram os critérios de inclusão. Sete artigos foram excluídos por abordar a influência da clorexidina sobre outras enzimas que não as metaloproteinases, sete foram excluídos por não abordar a influência da clorexidina sobre as restaurações adesivas, dois por não possuir um resumo disponível e/ou não conter informações suficientes e um por estar em duplicata quando se comparou as bases de dados.
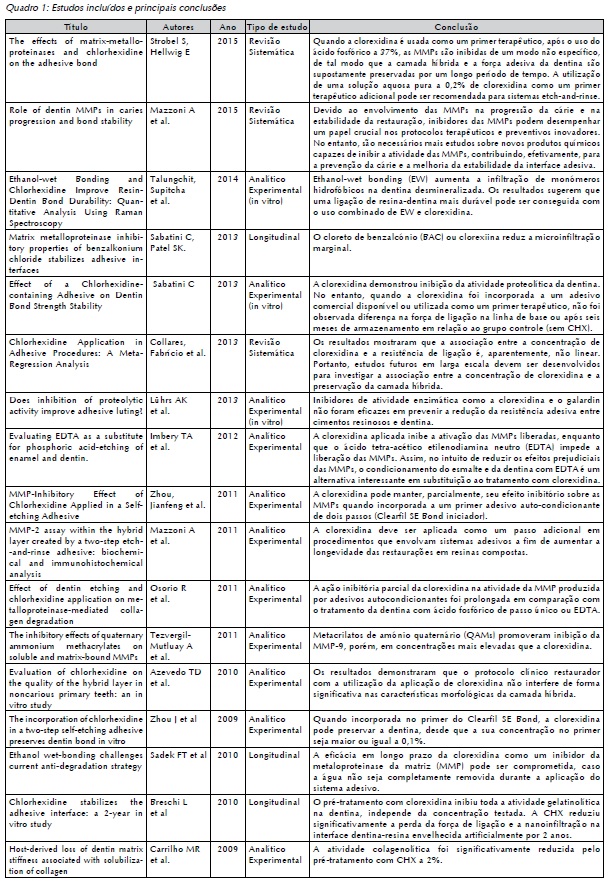
No Quadro 1, pode-se observar os estudos incluídos e suas principais conclusões.
Discussão
Mecanismo de ação das MMP sobre a degradação do colágeno
A dentina contém uma variedade de enzimas que podem interferir na adesão de materiais restauradores, destacando-se as metaloproteinases (MMPs) descritas pela primeira vez em 1962 por Gross & Lapiere19. As MMPs são retidas na matriz extracelular da dentina mineralizada durante o desenvolvimento dos dentes3,4 e pertencem ao grupo das endopeptidases20. Atualmente, já foram descritas 24 MMPs na espécie humana21.
As MMPs participam de importantes mecanismos biológicos, como o processamento de fatores de crescimento, e em diversos processos patológicos22. Além disso, as MMPs têm papel fundamental no desenvolvimento e remodelação dos tecidos orais. Há um consenso de que as MMPs da matriz da dentina são fundamentais para a dentinogênese5,6,23. Por outro viés, essas enzimas também são responsáveis pela degradação dos componentes extracelulares da dentina após uma variação de pH tecidual. Depois da mineralização da matriz de colágeno, as formas inativas de MMPs permanecem presas dentro da matriz calcificada22, porém podem ser re-expostas e, potencialmente, ativadas durante o processo carioso. O ambiente ácido criado pelas bactérias pode facilitar a ativação das MMPs endógenas. Logo, indivíduos que mostram maior suscetibilidade à cárie e à erosões dentinárias apresentam grandes concentrações de MMPs na saliva21. A ativação das metaloproteinases MMP-2, MMP-8 e MMP-9 desempenham um importante papel na degradação do colágeno em lesões cariosas, incluindo colágeno fibrilar e não-fibrilar, fibronectina, laminina e glicoproteínas da membrana basal.
Mesmo após o uso de sistemas adesivos, as MMPs ativadas são capazes de degradar a matriz de colágeno da dentina desmineralizada. Ácidos fracos são conhecidos por ativar MMPs na dentina24. Esse fato ocorre comumente porque todos os sistemas adesivos, seja, autocondicionante ou convencional24,25, têm a capacidade de reativar gelatinases (MMP-2 e MMP-9) e colagenases na dentina desmineralizada26.
Durante o estabelecimento da camada híbrida, a remoção do conteúdo mineral da superfície da dentina, além de expor fibrilas de colágeno, também libera proteases aprisionadas no processo de mineralização do tecido dentinário, como as MMPs18. Essas enzimas hidrolisam o colágeno não protegido pelo sistema adesivo no interior da camada híbrida27, levando à redução da resistência de adesão entre a restauração adesiva e a dentina28. Essa degradação é um fator de risco à integridade da interface dente-restauração2,12,24,25.
Não obstante, as MMPs podem contribuir para o desenvolvimento de algumas doenças e má formação dos tecidos bucais. A MMP-8 é conhecida por estar envolvida em doenças periodontais e a MMP- 20 participa do desenvolvimento da fluorose e amelogênese imperfeita4,29.
Uso da clorexidina na inativação das MMPs e seu impacto na adesividade de restaurações em resina composta
A degradação de matrizes de colágeno pode ocorrer após os procedimentos restauradores, mas pode ser impedida pela aplicação de uma protease sintética inibidora, como a clorexidina (CHX)12. A CHX atua como inibidor não específico das MMPs, ao alterar a estrutura tridimensional dessas enzimas e quelar os íons metálicos (Ca2+, Zn2+) que são necessários para a ativação de sua função enzimática9. A CHX é capaz de inativar todas as MMPs existentes na dentina mesmo em baixa concentração (0,02%). Além disso, esta substância tem a vantagem de possuir elevada substantividade12, propriedade que permite que tal substância permaneça na cavidade bucal por um tempo adequado.
Estudos experimentais in vitro30 e in vivo31 comprovaram que a aplicação da clorexidina após o condicionamento ácido, reduz a velocidade de degradação da ligação entre o dente e o sistema adesivo, proporcionando, dessa forma, a manutenção do selamento dentinário e uma adequada resistência da adesão por um período de tempo mais prolongado.
A concentração mínima de CHX que promove inibição completa da atividade da MMP-9 é de 0,002%, no entanto, a atividade da MMP-2 é muito mais sensível, sendo inibida por uma concentração de 0,0001%, contudo, a MMP-8 pode ser inibida por uma concentração maior (0,02%). Entretanto, a atividade colagenolítica da dentina pode ser inibida com a aplicação de clorexidina a 0,2% durante 60 segundos30.
A clorexidina deve ser aplicada por meio de solução aquosa pura, ao invés da sua solução convencional, que, geralmente, contêm conservantes, podendo, assim, afetar, negativamente, a ligação adesiva. Essa solução deve ser aplicada com o auxílio de uma pelota de algodão, após a remoção completa do ácido fosfórico a 37%, permanecendo no local por 60 segundos. Após esse passo, o excesso de umidade da cavidade, provocado pelo uso da clorexidina, é removido com suaves jatos de ar e o adesivo inserido 12,32.
O álcool contido no adesivo não dissolve a CHX, que, por sua vez, não prejudicar as propriedades de ligação da interface dente-restauração e permitir a formação de uma camada híbrida regular12. A força de união adesiva imediata não é alterada pela aplicação da CHX, porém essa ligação adesiva se perpetua por um período de tempo maior, pois há uma redução no processo de nanoinfiltração28,31. Vale ressaltar, que o tempo máximo de avaliação da maioria dos estudos é curto, logo, pouco se sabe sobre o período de tempo limite que a CHX pode manter o seu efeito inibidor sobre as MMPs, sendo necessário mais estudos sobre o assunto para elucidar esse aspecto.
Atualmente, há tentativas de integrar a CHX ao ácido fosfórico ou ao agente de ligação3,16, pois esses agentes teriam a grande vantagem de, durante o processo de restauração, não necessitar de alguma substância adicional excluindo um passo do trabalho necessário para a criação de uma ligação adesiva. Por exemplo, um estudo experimental in vitro33 mostrou que a incorporação de 2% de CHX a 37% do ácido fosfórico tem resultados semelhantes aos obtidos com a utilização de CHX como primer terapêutico. Em ambas as formas de aplicação da CHX, a ligação adesiva à dentina manteve-se estável durante os primeiros seis meses, enquanto que no grupo-controle (sem a utilização de CHX) os sinais de desintegração da camada híbrida já eram reconhecíveis28.
Conclusão
O uso da clorexidina, após o condicionamento ácido, previne a ativação da enzima metaloproteinase que degrada a rede de colágeno, causando falhas em restaurações adesivas. Porém, ensaios clínicos randomizados devem ser realizados de modo que se obtenha melhores evidencias científicas quanto à dose, tempo de exposição e efetividade na redução da microinfiltração marginal.
Referências
1. Talungchit S, Jessop JL, Cobb DS, Qian F, Geraldeli S, Pashley DH et al. Ethanol-wet bonding and chlorhexidine improve resin-dentin bond durability: quantitative analysis using raman spectroscopy. J Adhes Dent 2014;16(5):441-50. [ Links ]
2. Breschi L, Mazzoni A, Nato F, Carrilho M, Visintini E, Tjäderhane L et al. Chlorhexidine stabilizes the adhesive interface: a 2-year in vitro study. Dent Mater 2010; 26(4):320-5.
3. Zhou J, Tan J, Yang X, Xu X, Li D, Chen L. MMP-inhibitory effect of chlorhexidine applied in a self-etching adhesive. J Adhes Dent 2011;13(2):111-5.
4. Zhang SC, Kern M. The role of host-derived dentinal matrix metalloproteinases in reducing dentin bonding of resin adhesives. Int J Oral Sci 2009;1(4):163-76.
5. Strobel S, Hellwig E. The effects of matrix-metallo- proteinases and chlorhexidine on the adhesive bond. Swiss Dent J 2015;125(2):134-45.
6. Sabatini C. Effect of a chlorhexidine-containing adhesive on dentin bond strength stability. Oper Dent 2013;38(6):609-17.
7. Imbery TA, Kennedy M, Janus C, Moon PC. Evaluating EDTA as a substitute for phosphoric acid-etching of enamel and dentin. Gen Dent 2012;60(2):e55-61.
8. Mazzoni A, Carrilho M, Papa V, Tjäderhane L, Gobbi P, Nucci C et al. MMP-2 assay within the hybrid layer created by a two-step etch-and-rinse adhesive: biochemical and immunohistochemical analysis. J Dent 2011;39(7):470-7.
9. Osorio R, Yamauti M, Osorio E, Ruiz-Requena ME, Pashley D, Tay F et al. Effect of dentin etching and chlorhexidine application on metalloproteinase-mediated collagen degradation. Eur J Oral Sci 2011;119(1):79-85.
10. Tezvergil-Mutluay A, Agee KA, Uchiyama T, Imazato S, Mutluay MM, Cadenaro M et al. The inhibitory effects of quaternary ammonium methacrylates on soluble and matrix-bound MMPs. J Dent Res 2011;90(4):535-40.
11. Lührs AK, De Munck J, Geurtsen W, Van Meerbeek B. Does inhibition of proteolytic activity improve adhesive luting? Eur J Oral Sci 2013;121(2):121-31.
12. Carrilho MR, Tay FR, Donnelly AM, Agee KA, Tjäderhane L, Mazzoni A et al. Host-derived loss of dentin matrix stiffness associated with solubilization of collagen. J Biomed Mater Res B Appl Biomater 2009;90(1):373-80.
13. Mazzoni A, Tjäderhane L, Checchi V, Di Lenarda R, Salo T, Tay FR et al. Role of dentin MMPs in caries progression and bond stability. J Dent Res 2015;94(2):241-51.
14. Sabatini C, Patel SK. Matrix metalloproteinase inhibitory properties of benzalkonium chloride stabilizes adhesive interfaces. Eur J Oral Sci 2013;121(6):610-6.
15. Sadek FT, Braga RR, Muench A, Liu Y, Pashley DH, Tay FR. Ethanol wet-bonding challenges current anti-degradation strategy. J Dent Res 2010;89(12):1499-504.
16. Zhou J, Tan J, Yang X, Cheng C, Wang X, Chen L. Effect of chlorhexidine application in a self-etching adhesive on the immediate resin-dentin bond strength. J Adhes Dent 2010;12(1):27-31
17. Collares FM, Rodrigues SB, Leitune VC, Celeste RK, Borba de Araújo F, Samuel SM. Chlorhexidine application in adhesive procedures: a meta-regression analysis. J Adhes Dent 2013;15(1):11-8.
18. Azevedo TD, Bezerra AC, Faber J, de Toledo OA. Evaluation of chlorhexidine on the quality of the hybrid layer in noncarious primary teeth: an in vitro study. J Dent Child (Chic) 2010;77(1):25-31.
19. Gross J, Lapiere CM. Collagenolytic activity in amphibian tissues: a tissue culture assay. Proc Natl Acad Sci U S A 1962;15(48):1014-22.
20. Mazzoni A, Nascimento FD, Carrilho M, Tersariol I, Papa V, Tjäderhane L et al. MMP activity in the hybrid layer detected with in situ zymography. J Dent Res 2012;91(5):467-72.
21. Chaussain C, Boukpessi T, Khaddam M, Tjaderhane L, George A, Menashi S. Dentin matrix degradation by host matrix metalloproteinases: inhibition and clinical perspectives toward regeneration. Front Physiol 2013;1(4):308.
22. Fonceca AS. Odontologia Estética: Respostas às Dúvidas mais Frequentes. Artes Medicas; 2014.
23. Martin-De Las Heras S, Valenzuela A, Overall CM. The matrix metalloproteinase gelatinase A in human dentine. Arch Oral Biol 2000;45(9):757-65.
24. Nishitani Y, Yoshiyama M, Wadgaonkar B, Breschi L, Mannello F, Mazzoni A et al. Activation of gelatinolytic/collagenolytic activity in dentin by self-etching adhesives. Eur J Oral Sci 2006;114(2):160-6.
25. Mazzoni A, Pashley DH, Nishitani Y, Breschi L, Mannello F, Tjäderhane L et al. Reactivation of inactivated endogenous proteolytic activities in phosphoric acid-etched dentine by etch-and-rinse adhesives. Biomaterials 2006;27(25):4470-6.
26. Mazzoni A, Mannello F, Tay FR, Tonti GA, Papa S, Mazzotti G et al. Zymographic analysis and characterization of MMP-2 and -9 forms in human sound dentin. J Dent Res 2007;86(5):436-40.
27. Hebling J, Pashley DH, Tjäderhane L, Tay FR. Chlorhexidine arrests subclinical degradation of dentin hybrid layers in vivo. J Dent Res 2005;84(8):741-6.
28. De Munck J, Van Meerbeek B, Yoshida Y, Inoue S, Vargas M, Suzuki K et al. Four-year water degradation of total-etch adhesives bonded to dentin. J Dent Res 2003;82(2):136-40.
29. Hannas AR, Pereira JC, Granjeiro JM, Tjäderhane L. The role of matrix metalloproteinases in the oral environment. Acta Odontol Scand 2007;65(1):1-13.
30. Pashley DH, Tay FR, Yiu C, Hashimoto M, Breschi L, Carvalho RM et al. Collagen degradation by host-derived enzymes during aging. J Dent Res 2004;83(3):216-21.
31. Carrilho MR. Can exogenous protease inhibitors control dentin matrix degradation? J Dent Res 2012;91(12):1099-102.
32. Tay FR, Pashley DH, Loushine RJ, Weller RN, Monticelli F, Osorio R. Self-etching adhesives increase collagenolytic activity in radicular dentin. J Endod 2006;32(9):862-8.
33. Stanislawczuk R, Amaral RC, Zander-Grande C, Gagler D, Reis A, Loguercio AD. Chlorhexidine-containing acid conditioner preserves the longevity of resin-dentin bonds. Oper Dent 2009;34(4):481-90.
 Correspondence address:
Correspondence address:
Valdeci Elias dos Santos Junior
Rua São Sebastião 417 apto 101 Piedade
Jaboatão dos Guararapes-PE Brasil
e-mail: valdeciodonto@gmail.com
Recebido: 21/01/2016
Aceito: 19/01/2017













