Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Arquivos em Odontologia
versão impressa ISSN 1516-0939
Arq. Odontol. vol.47 no.3 Belo Horizonte Jul./Set. 2011
Atividade antifúngica e antiaderente do óleo essencial de Rosmarinus officinalis sobre Candida
Antifungal and antiadherent activity of the essential oil from Rosmarinus officinalis on Candida
Yuri Wanderley CavalcantiI; Leopoldina de Fátima Dantas de AlmeidaII; Wilton Wilney Nascimento PadilhaIII
I Bolsista de Iniciação Científica (PIBIC/UFPB/CNPq), Curso de Odontologia, Universidade Federal da Paraíba (UFPB), João Pessoa,PB, Brasil
II Programa de Pós-Graduação em Odontologia, Universidade Federal da Paraíba (UFPB), João Pessoa, PB, Brasil
III Departamento de Clínica e Odontologia Social, Curso de Odontologia, Universidade Federal da Paraíba (UFPB), João Pessoa, PB, Brasil
Contato: yuri.wanderley@yahoo.com.br, leopoldinalmeida@hotmail.com, wiltonpadilha@yahoo.com.br
RESUMO
Objetivo: Avaliar a atividade antifúngica e antiaderente do óleo essencial de Rosmarinus officinalis (Alecrim) sobre Candida albicans (ATCC289065) e C. tropicalis (ATCC40042). Materiais e Métodos: Determinou-se a atividade antifúngica pela Concentração Inibitória Mínima (CIM) e Concentração Fungicida Mínima (CFM), obtidas através das técnicas de microdiluição e de esgotamento, respectivamente. Os produtos foram avaliados da concentração inicial de 72mg/mL até 0,5625mg/mL. A atividade antiaderente foi avaliada segundo as concentrações CIM, 2CIM e 4CIM. Em tubos de vidro estéreis, foram adicionados: 1 corpo de prova de resina acrílica estéril; 2mL de Caldo Sabouraud-Dextrose estéril; 0,2mL do inoculo fúngico e 2mL do óleo essencial de R. officinalis nas concentrações testadas, ou água destilada estéril (Controle de Crescimento), ou nistatina (100.000UI/mL – Controle Positivo). Os produtos testados foram adicionados em duas condições: junto aos demais componentes do dispositivo de aderência (t=0h); e após 24h da inserção desses componentes (t=24h). Os microrganismos que aderiram aos corpos de prova foram dispersos, diluídos 10 e 100 vezes em água destilada estéril e transferidos, em triplicata, para placas de agar Sabouraud Dextrose 4%. Após 48 horas de incubação a 37ºC, o número de Unidades Formadoras de Colônia por mililitro (UFC/ mL) foi determinada para cada espécime. Aplicaram-se os testes Mann Whitney e ANOVA (pós-testes de Tukey e Dunnet). Resultados: A CIM e CFM foram determinadas na concentração 0,5625mg/mL. Quando comparado ao controle de crescimento, o óleo essencial de R. officinalis provocou inibição da aderência em todas as concentrações testadas, porém com efeito inferior à nistatina. Observou-se maior atividade antiaderente para t=24h (p<0,001) e maior concentração do produto natural (p<0,05). Conclusão: O óleo essencial de R. officinalis exerceu atividade antifúngica e antiaderente sobre C. albicans e C. tropicalis. Melhor desempenho foi observado para concentração 2,25mg/mL (4CIM) do óleo essencial de R. officinalis.
Descritores: Óleos voláteis. Produtos biológicos. Candidíase bucal. Produtos com ação antimicrobiana.
ABSTRACT
Aim: The objective of this study was to evaluate the antifungal and antiadherent activity of the essential oil from Rosmarinus officinalis (Rosemary) on Candida albicans (ATCC289065) and C. tropicalis (ATCC40042). Materials and Methods: The antifungal activity was determined by means of Minimum Inhibitory Concentration (MIC) and Minimum Fungicidal Concentration (MFC), which were obtained through microdilution and exhaustion techniques, respectively. The products were evaluated at an initial concentration of 72mg/ mL to 0.5625mg/mL. The antiadherent activity was evaluated according to the concentrations of MIC, 2MIC, and 4MIC. Inserted in sterile glass tubes were: one sterile acrylic resin specimen; 2mL of sterile Sabouraud Dextrose broth, 0.2mL of fungal inoculums, and 2mL of the essential oil from R. officinalis at tested concentrations, or sterile distilled water (Growth Control), or nystatin (100.000UI/ mL - Positive Control). The evaluated products were added under two conditions: (1) with the other members of the adherent's device (t=0h) and (2) 24h after the insertion of these components (t=24h). The microorganisms that adhered to the specimens were dispersed, diluted 10 and 100 times in sterile distilled water, and transferred, in triplicate, to Sabouraud Dextrose 4% agar plates. After 48 hours of incubation at 37°C, the number of Colony Forming Units per milliliter (CFU/mL) was determined for each specimen. The Mann Whitney and ANOVA tests (Tukey post-test) were also applied. Results: The MIC and MFC were determined at a concentration of 0.5625mg/mL. When compared to the growth control, the essential oil from R. officinalis inhibited adherence in all concentrations, but with a lower effect than with nystatin. A greater antiadherent activity could be observed for t=24h (p<0.001) and at a higher concentration of the natural product (p <0.05). Conclusion: The essential oil of R. officinalis exerted antifungal and antiadherent activity on C. albicans and C. tropicalis. Greater inhibition of C. albicans and of C. tropicalis could be observed for the concentration of 2.25mg/mL (4MIC) of the essential oil from R. officinalis.
Uniterms: Oils, volatile. Biological products. Oral candidiasis. Products with antimicrobial action.
INTRODUÇÃO
A candidíase bucal é uma das infecções humanas de natureza fúngica mais comum; sendo descrita como uma infecção oportunista, frequentemente envolvida com a alteração da microbiota bucal, doenças sistêmicas e redução da imunidade do hospedeiro1,2. Entre as cepas envolvidas com o desenvolvimento da candidíase bucal, a Candida albicans é a espécie mais prevalente e de maior patogenicidade1,3. C. tropicalis, C. krusei, C. parapsilosis e C. guilliermondii também fazem parte do curso da doença e, junto a C. albicans, chegam a representar mais de 80% dos isolados clínicos1,3.
Segundo Rex et al.4 e Khan et al.5, as espécies de Candida têm se mostrado resistentes diante da utilização de alguns medicamentos antifúngicos sintéticos. Com o objetivo de identificar substâncias alternativas ao uso de medicamentos tradicionais, foram desenvolvidos estudos sobre a atividade antimicrobiana de óleos essenciais6-9.
Desta forma, a busca de produtos naturais que apresentem uma ação antifúngica eficiente frente a microrganismos resistentes se mostra uma alternativa necessária para o controle da candidíase bucal6,9. A atividade fungiostática do óleo essencial de Rosmarinus officinalis (Alecrim) foi apontada por Lima et al.6, Fontenelle et al.7 e Pozzatti et al.8, os quais empregaram diferentes técnicas. Segundo Fontenelle et al.7, o óleo essencial de R. officinalis apresenta atividade antifúngica sobre Candida em baixas concentrações. Porém, não foram identificados estudos sobre a atividade antiaderente deste produto natural. Assim, verificase a necessidade de aprofundar as investigações sobre a atividade antifúngica desses produtos, com o objetivo de justificar e validar o uso clínico dos óleos essenciais.
Esta pesquisa se justifica pela necessidade de produzir novas informações sobre os efeitos fungiostático, fungicida e antiaderente dos óleos essenciais sobre Candida. O objetivo deste estudo foi avaliar a atividade antifúngica e antiaderente do óleo essencial de Rosmarinus officinalis (Alecrim) sobre Candida albicans e Candida tropicalis.
MATERIAIS E MÉTODOS
Realizou-se um estudo de abordagem indutiva, com procedimento comparativo descritivo e técnica de documentação direta em laboratório10.
Microrganismos utilizados
As cepas de referência utilizadas no estudo foram Candida albicans (ATCC 289065) e C. tropicalis (ATCC 40042). Os microrganismos foram obtidos do Laboratório de Materiais de Referência do Instituto Nacional de Controle de Qualidade em Saúde (Fundação Oswaldo Cruz – FIOCRUZ, Rio de Janeiro - RJ, Brasil). As cepas foram reativadas em Caldo Sabouraud-Dextrose (DIFCO®, Detroit, Michigan, EUA), a 37ºC e estocadas em Àgar Sabouraud-Dextrose 4% (DIFCO®, Detroit, Michigan, EUA) no Laboratório de Microbiologia Oral – Núcleo de Medicina Tropical do Centro de Ciências da Saúde da Universidade Federal da Paraíba. Para condução do estudo, suspensões fúngicas dos microrganismos foram preparadas em solução salina, sob a concentração 1,5x106 microrganismos/mL, equivalente ao tubo 106 da Escala de MacFarland.
Produtos testados
Para avaliação antiaderente in vitro foi utilizado o óleo essencial de Rosmarinus officinalis (alecrim), obtido da empresa Ferquima® (Ind. e Com. Ltda. Vargem Grande Paulista-SP, Brasil), a qual cedeu Laudo Técnico com especificações. Utilizou-se o lote 141 do óleo essencial de R. officinalis (Alecrim), isento de impurezas, oriundo da Tunísia e com densidade 0,912g/mL (20ºC). Os principais componentes identificados foram 1,8 Cineol, limoneno, para-cimeno, α-pineno e Cânfora.
Confecção dos corpos de prova
Para montagem dos dispositivos de aderência fúngica, foram confeccionados corpos de prova de resina acrílica incolor quimicamente polimerizável (Vipi Flash, VIPI Produtos Odontológicos Ltda., Pirassununga-SP, Brasil), com dimensões 10x10x5mm. Os espécimes foram preparados de acordo com as instruções do fabricante (temperatura de 25ºC, em igual proporção de pó e líquido, sem incorporação de bolhas de ar), e posteriormente imersos em água destilada por 24h, a 37ºC, para liberação de monômero residual. As superfícies dos corpos de prova foram submetidas ao acabamento e polimento com lixas d'água de granulação 200, 400 e 600 (3M-ESPE, Campinas-SP, Brasil) e posteriormente limpas com aparelho ultra-sônico. Todos os espécimes foram armazenados em tubo de vidro com água destilada e esterilizados em autoclave (121ºC durante 20 minutos) para posterior utilização.
Ensaio da avaliação antifúngica de R. officinalis sobre C. albicans e C. tropicalis
O óleo essencial utilizado neste estudo foi inicialmente diluído em água destilada estéril e Tween 80 (Farmafórmula Farmácia de Manipulação, João Pessoa-PB, Brasil), obtendo-se a concentração 16%, considerada a solução-padrão inicial para todos os produtos avaliados. Para obtenção dessas diluições, considerou-se a densidade do produto igual a 0,9 g/mL, conforme especificações do fornecedor. Utilizou-se o método de diluição descrito por Lima et al.6 e Aligiannis et al.11 e, no qual foram adicionados em tubos de vidro estéril: 0,8 mL do óleo essencial; 0,05 mL de Tween 80; e 4,2 mL de água destilada estéril. O conjunto foi agitado durante 5 minutos em aparelho agitador de soluções tipo Vortex (Mod. AP56, Phoenix, Araraquara-SP, Brasil) e a concentração final obtida foi de 16%, equivalente a 144 mg/mL. Para avaliação da Concentração Inibitória Mínima (CIM), os óleos essenciais foram diluídos de forma seriada, mediante emprego da técnica da microdiluição9,11.
A determinação da CIM foi realizada em placas de microdiluição com 96 poços (ALAMAR®, Diadema, São Paulo, Brasil), dispostos em 12 colunas (1 a 12) e 8 linhas (A a H). Cada uma dessas placas destinou-se a análise de um microrganismo. Em cada um dos poços das placas de microdiluição foram inseridos 100μL de caldo Sabouraud-Dextrose duplamente concentrado. Em seguida, inseriu-se 100μL da emulsão do óleo essencial de R. officinalis, obtendo-se a concentração inicial de 8% (72 mg/ mL) na primeira linha da placa de microdiluição9,11. As concentrações subseqüentes dos óleos essenciais foram obtidas após diluição seriada dos produtos naturais na placa de microdiluição, partindo-se da concentração inicial de 8% (Linha A) até 0,0625% (Linha H), pela transferência de 100μL do conteúdo ao poço subseqüente11. Para os poços da linha H, foram dispensados 100μL do conteúdo, de modo a igualar o volume total dos poços.
De modo a validar a metodologia empregada neste estudo, empregou-se o Controle Positivo (nistatina - suspensão comercial - 100.000 UI/mL); o Controle de Crescimento (suspensão fúngica em desenvolvimento, sem adição de antifúngicos); e o Controle de Esterilidade (Meio de cultura estéril, sem adição de antifúngicos ou suspensões de microrganismos)
Posteriormente, foram inseridos 10μL da suspensão fúngica de C. albicans ou de C. tropicalis (1,5x106 microrganismos/mL) em todos os poços, exceto à coluna correspondente ao Controle de Esterilidade. As placas foram incubadas em estufa bacteriológica a 37º, por 48h. A CIM correspondeu à última diluição dos óleos essenciais na qual não foi verificada a presença de precipitado fúngico ou turvação no meio de cultura após o período de incubação8,11.
A Concentração Fungicida Mínima (CFM) foi obtida por meio da semeadura, em Ágar Sabouraud-Dextrose, de alíquotas de 10μL das diluições correspondentes a CIM e duas imediatamente anteriores (2CIM e 4CIM)8,9. Após a semeadura dos conteúdos dos poços das placas de microdiluição, as placas de petri foram incubadas em estufa bacteriológica a 37º, por 24h. A CFM foi considerada a menor concentração substância que impediu o crescimento visível do subcultivo ou a formação de até três Unidades Formadoras de Colônia (UFC)8. Os ensaios para determinação da CIM e CFM foram realizados em triplicata.
Ensaio da avaliação antiaderente de R. officinalis sobre C. albicans e C. tropicalis
A atividade antiaderente do óleo essencial de R. officinalis sobre C. albicans e C. tropicalis foi avaliada separadamente, segundo a técnica descrita por Carreto et al.12. O óleo essencial de R. officinalis foi avaliado nas concentrações correspondentes a CIM e duas imediatamente superiores (2CIM e 4CIM). Em tubos de vidro estéril foram adicionados: um corpo de prova de resina acrílica estéril; 0,2mL da suspensão fúngica de C. albicans ou de C. tropicalis; 2mL de Caldo Sabouraud-Dextrose estéril; 2mL da diluição do óleo essencial de R. officinalis ou água destilada estéril (controle de crescimento) ou nistatina 100.000UI/mL (controle positivo)12. Os tubos foram tampados e incubados em estufa bacteriológica a 37ºC por 48h. O controle de esterilidade do meio de cultura e dos corpos de prova foi verificado pela ausência de turvação do meio nos tubos sem a adição do inoculo e dos produtos testados.
A atividade antiaderente do óleo essencial de R. officinalis e do controle positivo foi avaliada em duas condições: o produto foi inserido junto aos demais componentes do dispositivo de aderência (t=0h); e o produto foi inserido após 24h da inserção dos demais componentes (t=24h). Na primeira condição, prevalece o estado planctônico das células; enquanto na segunda situação se verifica a formação de agregados celulares, a secreção de matriz extracelular e adesão13. Dessa forma, nos tubos correspondentes a condição t=24h, o óleo essencial de R. officinalis ou a nistatina 100.000UI/ mL (controle positivo) foram inseridos somente após 24h do processo de incubação.
Após a incubação por 48h, os corpos de prova foram transferidos para tubos de ensaio contendo 1mL de solução fisiológica estéril (NaCl 0,85%), e agitados em um agitador de tubos (Vortex) por 60 segundos. Os microrganismos que aderiram aos corpos de prova foram dispersos, diluídos 10 e 100 vezes em água destilada estéril e transferidos, em triplicata, para placas de agar Sabouraud Dextrose 4%12. Após 48 horas de incubação a 37ºC, o número de Unidades Formadoras de Colônia por mililitro (UFC/mL) foi determinada para cada espécime. As placas escolhidas para a contagem foram aquelas que apresentaram entre 30 e 300 colônias12. Placas com mais de 300 colônias foram consideradas incontáveis.
Análise estatística
Para a avaliação da atividade antifúngica, as diluições seriadas nas quais se observou CIM e/ ou CFM foram analisadas descritivamente. Para avaliação da atividade antiaderente, o número de UFC/mL consistiu nas unidades de comparação estatística. Os resultados, expressos em UFC/mL, foram analisados segundo a concentração do óleo essencial de R. officinalis (CIM, 2CIM, ou 4CIM) e segundo o estado de desenvolvimento microbiano (t=0h – estado planctônico; t=24h – estado de agregação).
Os dados foram tabulados no programa GraphPad Prism 5.0 (Programa GraphPad for Windows, San Diego, CA - USA), sendo adotado nível de significância de 5%. Para avaliação antifúngica, obteve-se a média aritmética das concentrações correspondentes a CIM e a CFM9. Para avaliação antiaderente e comparação da concentração do óleo essencial de R. officinalis foi empregada análise de variância ANOVA e pósteste de Tukey7. O efeito provocado pelas diferentes concentrações do óleo essencial de R. officinalis, nos tempos t=0h e t=24h, foi comparado com o Controle de Crescimento das cepas de C. albicans e de C. tropicalis, bem como com o efeito provocado pela nistatina, sendo aplicado o teste ANOVA e pós-teste de Dunnet. Na comparação da atividade antiaderente segundo o estado de desenvolvimento microbiano foi empregado o teste Mann Whitney.
RESULTADOS
Considerando a avaliação antifúngica do óleo essencial de R. officinalis, a metodologia empregada neste estudo foi validada pela ausência de crescimento fúngico para o Controle de Esterilidade e Controle Positivo (nistatina - 100.000 UI/mL), bem como pela presença de crescimento fúngico para o controle de crescimento. A CIM e a CFM do óleo essencial de R. officinalis frente as cepas C. albicans (ATCC289065) e C. tropicalis (ATCC40042) foi igual a 0,5625mg/ mL. Conforme os resultados obtidos para a CIM e CFM do óleo essencial de R. officinalis sobre C. albicans e C. tropicalis, os valores de CIM, 2CIM, 4CIM foram iguais a, respectivamente, 0,5625mg/ mL; 1,125mg/mL e 2,25mg/mL.
Observou-se ausência de aderência fúngica para os corpos de prova correspondentes ao Controle Positivo (nistatina - 100.000UI/mL) e para o Controle de Esterilidade, bem como pela presença de aderência fúngica para o Controle de Crescimento. A Tabela 1 apresenta os resultados da ação antiaderente do óleo essencial de R. officinalis sobre C. albicans e C. tropicalis segundo a concentração (CIM, 2CIM, ou 4CIM) e segundo o estado de desenvolvimento microbiano (t=0h – estado planctônico; t=24h – estado de agregação).Considerando o estado planctônico (t=0h) das cepas C. albicans e C. tropicalis, as concentrações 1,125mg/mL (2CIM) e 2,25mg/mL (4CIM) apresentaram maior atividade antiaderente do que a concentração 0,5625mg/ mL (CIM), sendo esta diferença estatisticamente significante (p<0,05). Para o estado de agregação celular (t=24h), as concentrações 0,5625mg/mL e 2,25mg/mL apresentaram maior inibição da aderência de C. albicans e C. tropicalis do que a concentração 1,125mg/mL, sendo observada diferença estatisticamente significante (p<0,05). Comparando-se os resultados obtidos para t=0h e t=24h, observou-se maior atividade antiaderente para t=24h, sendo esta diferença estatisticamente significante (p<0,001).
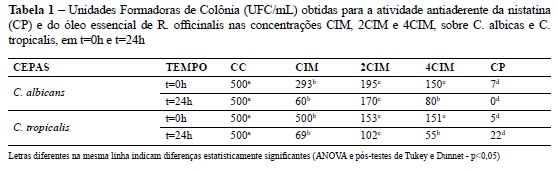
Realizou-se também a comparação do efeito provocado pelo óleo essencial de R. officinalis, nos tempos t=0h e t=24h, com o Controle de Crescimento das cepas de C. albicans e de C. tropicalis, bem como com o efeito provocado pela nistatina. Para os tempos t=0h e t=24h observou-se diferença estatisticamente significante (p<0,01) entre o controle de crescimento de C. albicans e C. tropicalis e o efeito provocado pelo óleo essencial de R. officinalis e pela nistatina. Para t=0h e para t=24h também foi observada diferença estatisticamente significante entre o efeito provocado pela nistatina e a atividade antiaderente do Óleo Essencial de R. officinalis nas concentrações CIM, 2CIM e 4CIM.
A partir das análises estatísticas verificou-se que, para t=0h e t=24h, a concentração de 2,25mg/ mL (4CIM) provocou maior inibição da aderência de C. albicans e C. tropicalis. Quando comparados ao controle de crescimento das cepas testadas, o óleo essencial de R. officinalis (nas concentrações CIM, 2CIM e 4CIM) provocou redução significativa do total de Unidades Formadoras de Colônias por mililitro. Quando comparadas à nistatina, as concentrações testadas do óleo essencial provocaram menor inibição da aderência de C. albicans e de C. tropicalis
DISCUSSÃO
As técnicas para determinação da CIM e CFM empregadas neste estudo foram baseadas nos protocolos descritos por Aligiannis et al.11 e Castro & Lima9, os quais representam modificação das normas estabelecidas pelo National Comitte for Clinical Laboratory Standard (NCCLS)14. O método de referência para técnica de microdiluição e determinação da sensibilidade de leveduras à terapia antifúngica (M7-A2), descrita por NCCLS14, considera a avaliação de antifúngicos sintéticos, a utilização do meio de cultura RPMI-1640 e a padronização da concentração inicial das substâncias testadas em 64μg/mL ou 16 μg/mL.
O presente estudo foi desenvolvido em condições diferentes das estabelecidas por NCCLS14. Segundo Nascimento et al.15, a normatização M7- A2 proposta pelo NCCLS não pode ser seguida à risca quando da avaliação antimicrobiana de óleos essenciais. Considera-se que as propriedades químicas desses produtos naturais diferem daquelas apresentadas pelas substâncias para qual a norma foi padronizada, ou seja, a normatização do NCCLS não atende às especificidades dos óleos essenciais15. Dessa forma, foi reproduzido o protocolo descrito por Aligiannis et al.11 e por Castro & Lima9, no qual foi empregado o meio de cultura Caldo Sabouraud-Dextrose, a nistatina como controle positivo, a diluição seriada dos produtos testados e a incorporação de emulsificante (Tween 80) na preparação dos óleos essenciais.
Os óleos essenciais são substâncias voláteis, que apresentam insolubilidade em água e complexidade química, o que dificulta a padronização de técnicas confiáveis, que possam ser reproduzidas e validadas, de modo a alcançar resultados seguros9,15,16. Dessa forma, para minimizar a inconsistência dos resultados obtidos, foi empregada a técnica de microdiluição em caldo, com o objetivo de proporcionar maior contato entre os produtos testados e as células fúngicas. Utilizouse também um agente emulsificante (Tween 80) para permitir a diluição dos óleos essenciais em meio aquoso. Essas medidas contribuem para redução de viés metodológico e comparação entre os produtos naturais testados9,16. Ao comparar as técnicas de disco-difusão e microdiluição para avaliação da atividade antifúngica de produtos naturais, Scorzoni et al.16 identificaram que a microdiluição foi mais sensível para determinação da CIM.
O Controle Positivo (nistatina - suspensão comercial - 100.000 UI/mL), o Controle de Esterilidade e o Controle de Crescimento foram empregados de modo a validar a técnica utilizada neste estudo e permitir a comparação com os resultados do óleo essencial. O Controle de Esterilidade confirmou a ausência de contaminação extrínseca do meio de cultura e dos corpos de prova. O Controle de Crescimento comprovou a viabilidade das cepas que não recebeu tratamento antifúngico. A ausência de crescimento fúngico diante da nistatina (100.000 UI/mL) evidenciou a susceptibilidade das amostras frente a um antifúngico sintético. No entanto, as diferenças entre a natureza química do óleo essencial e do Controle Positivo não permitem comparar os resultados obtidos por essas substâncias15.
Os resultados deste estudo apontaram que o melhor desempenho do óleo essencial de R. officinalis foi observado para concentração de 2,25mg/mL (4CIM). Entretanto, o efeito provocado pela nistatina na redução do total de UFC/mL das cepas testadas foi estatisticamente superior ao apresentado pelo produto natural (p<0,01). Portanto, considerou-se que o óleo essencial de R. officinalis, nas concentrações testadas, apresentou atividade antiaderente menos efetiva que a nistatina.
A atividade antifúngica do óleo essencial de R. officinalis foi demonstrada por Lima et al.6 e Packer & Luz17, os quais utilizaram a técnica de difusão em agar e identificaram ação fungiostática em concentrações superiores a 8%. Segundo Fontenelle et al.7, o óleo essencial de R. officinalis frente C. albicans e C. tropicalis apresentou CIM entre 0,62mg/mL e 2,5mg/mL, e CFM entre 1,25mg/ mL e 2,5mg/mL, determinados pela técnica de microdiluição. Dessa forma, os resultados deste estudo corroboram os achados de Fontenelle et al.7. Não foram encontradas na literatura estudos sobre a atividade antiaderente do óleo essencial de R. officinalis.
Para determinação das concentrações do óleo essencial de R. officinalis a serem utilizadas no ensaio de atividade antiaderente, a metodologia empregada neste estudo considerou os resultados do ensaio para determinação da CIM e CFM. Conforme observado neste estudo, o óleo essencial de R. officinalis provocou efeito antiaderente na concentração 0,5625mg/mL, o que corrobora os achados da literatura quanto a atividade antifúngica7. Porém, melhores resultados foram observados para a concentração de 2,25mg/mL, na qual o óleo essencial de R. officinalis inibiu a aderência de ambas cepas de C. albicans e C. tropicalis nos estados planctônico (t=0h) e de agregação (t=24h).
Segundo Chandra et al.13, as células de Candida tem a capacidade de realizarem coagregação e excretar matriz extracelular, o que contribui para a aderência a superfícies acrílicas e poliméricas. Os resultados de Chandra et al.13 demonstraram que as células de C. albicans, quando em estado planctônico, são mais susceptíveis a ação de antifúngicos. Os autores consideraram que a secreção de matriz extracelular e o estado de agregação contribuíram para maior resistência antifúngica.
Os resultados deste estudo evidenciaram diferenças entre a ação dos produtos testados na fase planctônica (t=0h) e no estado de agregação (t=24h). Verificou-se que a ação antiaderente do óleo essencial de R. officinalis, sob todas as concentrações testadas, foi menor em t=0h do que em t=24h. Assim, este estudo demonstrou que o estado de agregação celular foi mais sensível à ação dos produtos testados, o que contraria a hipótese levantada por Chandra et al.13.
Nas condições deste estudo, verificou-se que o óleo essencial de R. officinalis apresentou atividade antifúngica e antiaderente sobre C. albicans e C. tropicalis. A interação de C. albicans e C. tropicalis com outros microrganismos na constituição do biofilme oral também pode contribuir para maior susceptibilidade desta cepa à ação de antifúngicos18. Estudos posteriores devem considerar a ação deste produto sobre cepas clínicas e outras linhagens padronizadas, através de técnicas que considerem a influência da saliva humana, e interação com outros microrganismos orais.
CONCLUSÃO
Concluiu-se que o óleo essencial de R. officinalis exerceu atividade antifúngica e antiaderente sobre C. albicans e C. tropicalis. As cepas testadas apresentaram inibição do crescimento quando expostas a concentração 0,5625mg/mL do óleo essencial de R. officinalis. O estado de agregação celular (t=24h) e a maior concentração do produto natural contribuíram para maior atividade antiaderente do produto natural. Melhor desempenho foi observado para concentração 2,25mg/mL (4CIM) do óleo essencial de R. officinalis, sendo o efeito antifúngico inferior ao apresentado pela nistatina.
REFERÊNCIAS
1. Akpan A, Morgan R. Oral candidiasis. Postgrad Med J. 2002; 78:455-9. [ Links ]
2. Corrêa EM, Andrade ED. Tratamento odontológico em pacientes HIV/AIDS. Rev Odonto Ciênc. 2006; 20:281-9.
3. Nikawa H, Nishimura H, Hamada T, Yamashiro H, Samaranayake LP. Effects of modified pellicles on Candida biofilm formation on acrylic surfaces. Mycoses. 1999; 42:37-40.
4. Rex JH, Walsh TJ, Sobel JD, Filler SG, Pappas PG, Dismukes WE, et al. Practice guidelines for the treatment of candidiasis. J Infect Dis. 2000; 30:662-78.
5 Khan R, Islam B, Akram M, Shakil S, Ahmad AA, Ali SM, et al. Antimicrobial activity of five herbal extracts against multi drug resistant (MRD) strains of bacteria and fungus of clinical origin. Mol Cells. 2009; 14:586-97.
6. Lima IO, Oliveira RAG, Lima EO, Farias NMP, Souza EL. Atividade antifúngica de óleos essenciais sobre espécies de Candida. Rev Bras Farmacogn. 2006; 16:197-201.
7. Fontenelle ROS, Morais SM, Brito EHS, Kerntopf MR, Brilhante RSN, Cordeiro RA, et al. Chemical composition, toxicological aspects and antifungal activity of essential oil from Lippia sidoides Cham. J Antimicrob Chemother. 2007; 59:934-40.
8. Pozzatti P, Loreto ES, Lopes PGM, Athayde ML, Santurio JM, Alves SH. Comparison of the susceptibilities of clinical isolates of Candida albicans and Candida dubliniensis to essential oils. Mycoses. 2009; 53:12-5.
9. Castro RD, Lima EO. Atividade antifúngica in vitro do óleo essencial de Eucalyptus globulus L. sobre Candida spp. Rev Odontol UNESP. 2010; 39:179-84.
10. Lakatos EM, Marconi MA. Fundamentos da Metodologia Científica. São Paulo: Atlas; 2009.
11. Aligiannis N, Kalpoutzakis E, Mitaku S, Chinou JB. Composition and antimicrobial activity of the essential oils of two origanum species. J Agric Food Chem. 2001; 49:4168-70.
12. Carreto CFP, Navas EAFA, Paradella TC, Oliveira LD, Junqueira JC, Jorge AOC. Efeitos do chá de tomilho sobre a aderência in vitro de Streptococcus mutans ao esmalte dentário e Candida albicans à resina acrílica. Rev Odontol UNESP. 2007; 36:281-6.
13. Chandra J, Mukherjee PK, Leidich SD, Faddoul FF, Hoyer JJ, Douglas LJ, Ghannoum MA. Antifungal resistance of candidal biofilms formed on denture acrylic in vitro. J Dent Res. 2001; 80:903-8.
14. NCCLS. Método de referência para testes de diluição em caldo para a determinação da sensibilidade a terapia antifúngica das leveduras. Norma M27-A2 do NCCLS. Pensylvânia: NCCLS; 2002.
15. Nascimento PFC, Nascimento ALC, Rodrigues CS, Antoniolli AR, Santos PO, Barbosa-Júnior AM, et al. Atividade antimicrobiana dos óleos essenciais: uma abordagem multifatorial dos métodos. Rev Bras Farmacogn. 2007; 17:108-13.
16. Scorzoni L, Benaducci T, Almeida AMF, Silva DHS, Bolzani VS, Mendes-Giannini MJS. Comparative study of disk diffusion and microdilution methods for evaluation of antifungal activity of natural compounds against medical yeasts Candida spp and Cryptococcus sp. Rev Ciênc Farm Básica Apl. 2007; 28:25-34.
17. Packer JF, Luz MMS. Método para avaliação e pesquisa da atividade antimicrobiana de produtos de origem natural. Rev Bras Farmacogn. 2007; 17:102-7.
18. Thein ZM, Samaranayake YH, Samaranayake LP. Effect of oral bacteria on growth and survival of Candida albicans biofilms. Arch Oral Biol. 2006; 51:672-80.
 Autor correspondente:
Autor correspondente:
Yuri Wanderley Cavalcanti
Av. Des. Hilton Souto Maior, 6701. Qd. 765, Lt. 117, Portal do Sol
CEP: 58046-600 - João Pessoa – PB - Brasil
E-mail: yuri.wanderley@yahoo.com.br
Recebido em 10/02/2011 – Aceito em 24/05/2011













