Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Arquivos em Odontologia
versão impressa ISSN 1516-0939
Arq. Odontol. vol.48 no.2 Belo Horizonte Abr./Jun. 2012
ARTIGO ORIGINAL
Influência do armazenamento do instrumental odontológico na manutenção da esterilidade
The effects of dental instrument storage as regards the maintenance of sterility
Sarah Christina Rodrigues Meira ReisI; Iara Júnia Marques RamosI; Keli Bahia Felicíssimo ZocrattoII; Kelly Moreira Grillo Ribeiro BrancoIII
ICirurgiã-dentista
IICurso de Odontologia, Centro Universitário Newton Paiva, Belo Horizonte, MG, Brasil
IIICurso de Ciências Biológicas, Centro Universitário Newton Paiva, Belo Horizonte, MG, Brasil
Contato: sarahrmeira@yahoo.com.br, iara.odonto@yahoo.com.br, kelibahia.prof@newtonpaiva.br, kellygrillobranco@gmail.com
RESUMO
Objetivo: Comparar dois ambientes bastante utilizados por acadêmicos de odontologia para armazenamento de materiais estéreis (escaninho dos alunos e armários da Central de Material de Esterilização-CME), bem como descrever suas características.
Materias e Métodos: A fim de analisar as condições de armazenamento do material clínico estéril presente nos dois locais supracitados, foram utilizados 40 bastões de vidro. Destes, armazenaram-se quinze nos escaninhos e outros quinze nos armários da CME. Cada ambiente recebeu mais cinco amostras como controle positivo. Após 7 dias de armazenamento, as amostras foram recolhidas para análise laboratorial. Aferiram-se a temperatura e a umidade da CME, utilizando um relógio Termo-Higrômetro. Além disso, foi aplicado um questionário estruturado relacionado às condições de armazenamento do material clínico estéril para 15 alunos do 8º período de um curso de graduação em Odontologia. Os dados foram analisados por meio das análises uni e bivariada, com nível de significância de 5%.
Resultados: A CME, de fluxo contínuo e unidirecional, apresentou-se com ventilação natural e armários de madeira com revestimento. A temperatura no local oscilou entre 27,5 e 29,6ºC. A umidade do ar variou de 56,0 a 65,0%. A maioria dos alunos relatou armazenar materiais estéreis na CME (60%). Quanto à limpeza do escaninho, 6,7% dos acadêmicos relataram realizá-la. Na análise microbiológica, observou-se crescimento de colônias cremosas e filamentosas, com predomínio dessas em ambos os ambientes. Ao compará-los, observouse que o crescimento de ambas as colônias foi maior nos escaninhos, sendo a diferença estatisticamente significativa (p<0,05).
Conclusão: Considerando-se que na CME houve menor crescimento das colônias bacterianas e sua estrutura física se aproxima às exigências do Conselho Federal de Odontologia, o local
apresentou-se mais apropriado ao armazenamento de material estéril.
Descritores: Armazenagem de produtos. Esterilização. Odontologia. Contaminação.
ABSTRACT
Aim: To compare two environments (students' bins and cabinets of the Central Sterilization Material (CME)) commonly used by dental students in the storage of sterile materials and to describe their characteristics.
Materials and Methods: Forty glass rods were used in an attempt to analyze the storage conditions of the sterile clinical material present in the two locations mentioned above. Of these, fifteen were stored in the bins and another fifteen in the CME cabinets. Each environment received five additional samples as positive controls. After 7 days of storage, the samples were collected for laboratory analysis. Both the temperature and humidity of the CME were measured using a Thermo-Hygrometer Clock. In addition, a structured questionnaire regarding the storage conditions of sterile clinical material was applied to 15 students from the 8th period of an undergraduate dental course. The data were assessed by means of uni and bivariate analyses, with a significance level of 5.0%.
Results: The CME, of continuous and unidirectional flow, presented natural ventilation and coated wooden cabinets. The temperature ranged from 27.5ºC to 29.6ºC, with a humidity of between 56.0% and 65.0%. The majority of participants reported having stored sterile materials in the CME (60.0%), while 6.7% of the students reported that they had cleaned their own bins. The microbiological analysis showed the growth of the creamy and filamentous colonies, which proved to be predominant in both environments. Upon comparison, it could be observed that the growth of both colonies was higher in the bins, presenting a statistically significant difference (p<0.05).
Conclusion: onsidering that a lesser growth of the bacterial colonies could be observed in the CME and that its physical structure is in line with the demands set forth by the Federal Dental Association, the location appeared to be more appropriate for the storage of sterile materials.
Uniterms: Product storage. Sterilization. Dentistry. Contamination.
INTRODUÇÃO
O processo de esterilização envolve a lavagem e o empacotamento dos materiais, a distribuição dos materiais nos esterilizadores e o armazenamento das embalagens estéreis. Para a manutenção da esterilidade do material, todas as etapas desse processo devem ser corretamente executadas1-2. Tão importante quanto o processo de esterilização em si e seu controle, é a armazenagem apropriada do material. Quando feita de forma inadequada, pode acontecer a quebra da "cadeia de esterilidade"3-4. De acordo com a Agência Nacional de Vigilância Sanitária (ANVISA)5, para se garantir a esterilidade dos artigos empacotados, os mesmos devem ser: armazenados em área seca, longe de umidade, em armários com portas e não devem ser dobrados ou amassados. Na distribuição dos pacotes esterilizados deve-se ter o cuidado de manipulá-los com mãos limpas, com cuidado e o mínimo possível.
Com intuito de exercer a função de recepção, expurgo, preparo, esterilização, guarda e a distribuição dos materiais surgiram as Centrais de Material Esterilizado (CME)6. A área física da CME deve apresentar características que propiciem o controle da esterilidade do material. Para isso, ela deve ser de material fosco, não-poroso, o mais liso possível e de revestimento de fácil limpeza. Os cantos devem ser arredondados e as paredes com o mínimo de saliências e reentrâncias. As janelas devem ser amplas e teladas, com exceção da área de armazenagem do material estéril, onde devem ficar fechadas. A umidade relativa ambiental requerida é de 30,0 a 60,0% e a temperatura ambiente deve estar abaixo de 25ºC. Recomenda-se, ainda, ventilação artificial por exaustores e condicionadores de ar (com sistema de filtragem), devido ao superaquecimento ambiental provocado pelos esterilizadores. É indicado o uso de iluminação natural, No caso de luz artificial, deve-se utilizar luz fluorescente que permita boa iluminação em toda a área.
Ainda em relação à CME, determina-se que seja uma área com circulação restrita de pessoas, que devem utilizar equipamentos de proteção individual (EPI): avental, gorro, pro pés e máscara. Além do EPI, na CME, é necessário o uso de roupa especial, como uniforme ou avental de uso exclusivo no local, para evitar que um pacote entre em contato com a roupa do funcionário. Para evitar que as pessoas se afastem da unidade durante o expediente, é necessário que haja vestiário com banheiro anexo e também um local específico para o lanche dos funcionários7-8. O fluxo de material deve ser contínuo e unidirecional, para evitar o cruzamento entre material sujo e limpo. Além disso, destaca-se também que a entrega dos artigos pode ser feita através de janelas-guichê, caso esteja localizado no mesmo pavimento, ou através de montacarga, quando localizado em pavimento superior ou inferior7-8. Segundo Possari8, todas as superfícies verticais e horizontais, mobiliário e equipamentos da CME, devem ser limpos uma vez na semana, a fim de retirar a sujidade e reduzir a população microbiana e a possibilidade de contaminação ambiental.
A CME pode ser centralizada ou descentralizada. A centralizada apresenta várias vantagens: otimização de recursos humanos e materiais, maior produtividade, e maior segurança para o paciente e para a equipe de funcionários. Já a descentralizada, embora possua a vantagem de diluir as atividades entre os setores, torna difícil a segurança, o controle do estoque e a padronização da qualidade do preparo8. Nas faculdades de Odontologia, a CME comumente adotada é a descentralizada, ficando a cargo dos alunos as etapas de expurgo, preparo e armazenamento9-12. No que se refere ao acondicionamento do material estéril, recomenda-se que este fique em armários com prateleiras que garantam sua integridade7 e que sejam limpas semanalmente2. De acordo com a ANVISA5, esses armários devem estar a uma distância mínima de 20 cm do chão, 50 cm do teto e 5 cm da parede. Devem ser de superfície não metálica (preferencialmente madeira com revestimento) para evitar que o vapor residual se condense nos pontos de contato e torne o material no invólucro úmido, possibilitando a sua contaminação8. Segundo Jorge2, os armários que acondicionam material estéril devem ser desinfetados semanalmente. As superfícies exteriores de pacotes esterilizados podem se tornar contaminadas durante o armazenamento e essa contaminação pode ser transferida para o conteúdo no interior do invólucro13. Neste sentido, o local de armazenamento do material estéril pode influenciar na sua esterilidade. Por isso a literatura enfatiza a necessidade do local ser limpo, protegido do meio externo e utilizado exclusivamente para essa finalidade 2-3,13. O presente estudo objetivou comparar dois ambientes bastante utilizados por acadêmicos de odontologia para armazenamento de materiais estéreis (escaninho dos alunos e armários da CME), bem como descrever suas características.
MATERIAIS E MÉTODOS
Foi realizado um estudo transversal em uma faculdade de odontologia de Belo Horizonte no ano 2011. Foram utilizados dois ambientes: os armários da CME e os escaninhos dos alunos do 8º período da instituição de ensino em questão. A fim de analisar as condições de armazenamento do material clínico estéril presente nos dois locais supracitados, foram utilizados 40 bastões de vidro. Desses, armazenaram-se quinze nos escaninhos e outros quinze nos armários da CME. Cada ambiente recebeu mais cinco amostras como controle positivo. Após 7 dias de armazenamento, as amostras foram recolhidas para análise laboratorial. Aferiram-se a temperatura e a umidade da CME, utilizando um relógio Termo-Higrômetro. Além disso, foi aplicado um questionário estruturado para 15 alunos do 8º período do curso. Esse período foi escolhido porque neste momento do curso os alunos possuem três momentos de atividade clínica semanal, o que sugere uma maior utilização de materiais esterilizados e dos ambientes para o armazenamento dos mesmos. Os alunos que consentiram participar do estudo, após a entrega e assinatura do termo de consentimento livre e esclarecido foram sorteados aleatoriamente. Não participaram do sorteio aqueles alunos do 8º período que não estavam matriculados em disciplinas de atividade clínica. O questionário foi adaptado de um instrumento previamente validado14, abordando questões relacionadas às condições de armazenamento dos materiais estéreis pelos alunos (processo de limpeza e tipos de materiais que compartilham os mesmos ambientes).
Cada aluno recebeu uma amostra estéril (bastão de vidro envolto em Spunbonded Meltblown Spunbonded-SMS) para ser armazenada no seu escaninho. Dentre os 15 alunos participantes, cinco alunos foram sorteados aleatoriamente e receberam mais uma amostra estéril. Essas foram armazenadas dentro dos escaninhos dos alunos, sem o invólucro de SMS. Serviram como controle positivo. Outras 15 amostras foram distribuídas aleatoriamente em quinze armários da CME. Dentre esses 15 armários, 5 foram sorteados aleatoriamente para acondicionar os controles positivos.
As amostras permaneceram nos armários da CME e nos escaninhos dos alunos sob condições normais de rotina de trabalho e manuseio, durante 7 dias. Para assegurar que os invólucros não fossem violados e/ou substituídos, foram utilizados marcadores personalizados. Durante 5 dias, no horário de funcionamento da CME, foram aferidas a temperatura e a umidade local, utilizando-se um relógio termo-higrômetro (Minipa, MT-241 Shanghai, China). Transcorridos 7 dias de armazenamento das amostras nos locais, dois pesquisadores treinados, recolheram-nas utilizando, para cada uma, luva de plástico estéril. Após isso, colocaram-nas, individualmente, dentro de um invólucro de grau cirúrgico estéril, o qual foi lacrado e transportado para o laboratório de microbiologia – onde os bastões de vidro seriam submetidos à análise - dentro de uma embalagem plástica previamente higienizada com água e sabão, e depois com ácido peracético.
Devidamente paramentados, os pesquisadores, previamente calibrados (Kappa=0,82) e sob supervisão de um técnico em microbiologia, iniciaram a fase laboratorial. Dentro de uma Capela de fluxo laminar vertical, as amostras foram abertas. Com o auxílio de uma pinça estéril, cada bastão foi colocado em um tubo de ensaio com 10 ml de caldo simples. Posteriormente, os tubos de ensaio foram agitados durante 1 minuto com o auxílio do aparelho Vortex (modelo QL 901, Lapa, São Paulo, Brasil). Após essa etapa, acendeu-se um Bico de Bunsem para iniciar o plaqueamento nos Ágar. Com o auxílio de uma pipeta automática, munida de ponteira estéril, foi pipetado 1 ml do caldo simples para plaquear no Ágar Nutriente (AN), e a mesma quantidade, para plaquear no Ágar Sabouraud (AS). As placas foram abertas próximas à chama e ao líquido inoculado. Então procedeu-se a distribuição uniforme com a alça Drigalski (Alça em L). Após realizar esse procedimento, o AN foi armazenado, por 48 horas, em uma estufa com temperatura constante a 37°C. No mesmo local foi armazenado o restante do caldo simples. Já o AS foi armazenado por cinco dias à temperatura ambiente. Após o tempo de armazenamento de cada meio de cultura, foi realizada análise macroscópica, a fim de analisar o crescimento de Unidades Formadoras de Colônias (UFC) nos Ágar e a ocorrência de turvação do caldo, que é um indicativo de crescimento microbiano. O número de UFC presentes foi contado e nas colônias cremosas, foi realizado o método de Gram.
Os dados foram analisados por meio das análises uni e bivariada, com nível de significância de 5%.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa com protocolo CAAE 0038.0.273.000-10.
RESULTADOS
Dos quinze alunos que participaram da pesquisa, 67,0% eram do sexo feminino, com uma média de idade de 24,3 (± 4,3 anos). Em relação ao local de armazenamento, 60,0% dos participantes relataram armazenar o material estéril no armário da CME, e os demais nos seus próprios escaninhos. No que diz respeito às condições de armazenamento e de limpeza dos escaninhos, os alunos relataram armazenar vários objetos relacionados à prática odontológica, tais como gesso e materiais de moldagem (46,7%); materiais clínicos e cirúrgicos não estéreis (40,0%); maletas odontológicas (26,3%); e luvas de lavar materiais e de limpeza do equipo (13,4%). Além disso, constatou-se que a maioria dos alunos (66,7%) respondeu que os materiais estéreis entram em contato, no escaninho, com materiais contaminados. Apenas 6,7% dos alunos relataram realizar limpeza do seu escaninho e utilizarálcool 70,0% para tal finalidade.
Em relação à descrição dos ambientes, observou-se que, na CME, existe uma separação entre a área limpa e a contaminada, e o sistema de entrega dos materiais é por janelas-guichê. O local não possui vestiário com banheiro anexo e nem um local específico para o lanche dos funcionários. A ventilação é natural, apresentando janelas tipo retrovisor no alto de uma das laterais. Porém, permanecem fechadas. A ventilação do ambiente se dá pela abertura da janelaguichê. Para a armazenagem dos materiais estéreis, existem dois armários nas laterais - afastados 75 cm da parede - e um ao centro. Todos eles distanciandose em 57 cm em relação ao teto, e em 12 cm, em relação ao chão. São de madeira com revestimento e apresentam portas de vidro e, internamente, várias prateleiras agrupadas de seis em seis.
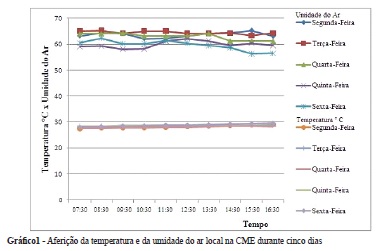
A temperatura da CME registrada oscilou entre 27,5 e 29,6ºC. Do total de aferições realizadas, 66,0% delas referiram-se às temperaturas entre 28,1 a 28,9ºC, com uma média de 28,6ºC (± 0,2) por dia. A umidade do ar variou de 56,0% a 65,0%, com uma média de 61,9 por dia (± 0,5) (Gráfico 1).
Em relação aos armários/escaninhos dos alunos, os mesmos se localizam em um corredor de grande circulação de pessoas, de frente a área limpa da CME. Este corredor possui janelas tipo retrovisor em uma das laterais, como também na parede de fundo: todas ficam abertas para melhorar a ventilação no local. Os escaninhos dos alunos são metálicos e estão dispostos em três alturas. O mais alto está a 70 cm do teto e o mais baixo a 13 cm do chão. A distância dos mesmos em relação à parede é de 3 cm.
Quanto à análise microbiológica, observouse que não aconteceu a turvação do Caldo Simples. Os controles positivos, em Ágar, apresentaram contaminação por colônias cremosas e filamentosas. Todos os controles armazenados nos escaninho dos alunos e três controles armazenados na CME contaminaram-se. Das quinze amostras dos escaninhos dos alunos, 8 apresentaram crescimento microbiano no AN (53,4%): em 2 amostras cresceram colônias filamentosas, em outras 4 houve crescimento de colônias cremosas e nas duas restantes cresceram tanto colônias cremosas quanto fi lamentosas. Nove amostras tiveram crescimento microbiano no AS (60,0%): em 7 amostras cresceram colônias filamentosas e em 2, colônias cremosas.
Nas 15 amostras presentes na CME, detectou-se crescimento microbiano no AN em 7 delas (46,7%): houve crescimento de colônias filamentosas e cremosas em 4 e 3 amostras, respectivamente. No AS aconteceu crescimento de colônias filamentosas em todas as 6 amostras (40,0%). Na contagem total de colônias, foram observadas 259 UFC nas amostras dos escaninhos dos alunos. Cresceram 40 colônias filamentosas e 7 colônias cremosas no AN e 207 colônias filamentosas e 5 colônias cremosas no AS. Cresceram 13 UFC nas amostras dos armários da CME (4 colônias fi lamentosas e 3 colônias cremosas no AN e 6 colônias filamentosas no AS) (Gráfico 2). Houve portanto, um predomínio de colônias filamentosas (fungos) tanto nos escaninhos dos alunos (95,7%) quanto na CME (77,0 %). Ao comparar-se os dois ambientes, observou-se que houve maior crescimento destas colônias no escaninho dos alunos, sendo a diferença estatisticamente significativa (p<0,05). Resultado semelhante foi encontrado em relação às colônias cremosas. Foi observado maior crescimento dessas no escaninho dos alunos, sendo essa diferença estatisticamente significativa (p<0,05). Com o auxílio da Técnica de Gram, observou-se, microscopicamente, que as colônias cremosas eram formadas apenas por bactérias do tipo cocos, estafilococos e bacilos.

DISCUSSÃO
As amostras armazenadas nos dois ambientes apresentaram contaminação por colônias cremosas e filamentosas, sendo que a quantidade de UFC e o número de colônias formadas foram mais expressivos nos escaninhos dos alunos. Partindo da premissa que as etapas de expurgo, preparo e esterilização foram realizadas corretamente, verificamos que a etapa de armazenamento apresentou falhas. Tais falhas foram evidenciadas nos escaninhos dos alunos, uma vez que esses locais apresentaram variáveis físicas e locais associadas à conduta dos alunos frente ao manuseio do material estéril e à utilização dos escaninhos que favoreceram esta contaminação
Os fungos e as bactérias fazem parte da microbiota presente no ar, na poeira e em lugares úmidos15. Desta forma, estes microrganismos podem ser encontrados em diversos locais. Pacheco16 observou que no ambiente odontológico, durante a atividade clínica, existe um maior crescimento de cocos, seguido de bacilos e fungos. No entanto, a presença, em níveis esperados, destes microrganismos no ambiente não é fator que, isoladamente, interfere no processo de manutenção da esterilidade dos materiais. Outros fatores, tais como o tipo de invólucro, o manuseio e condições de armazenagem também devem ser considerados12. Neste sentido, ressalta-se a importância de se cumprir as normas de estocagem do material estéril preconizadas pela ANVISA5, Conselho Federal de Odontologia7 e Possari8.
Ao comparar os ambientes, CME e corredor onde estão localizados os escaninhos dos alunos, percebeu-se que a estrutura física da CME apresenta uma maior proximidade com o que é recomendado pelo CFO7, principalmente no que tange ser uma área de circulação restrita de pessoas e possuir janelas fechadas, o que evita a entrada de pó. No entanto, na CME, foi observado que não existe sistema de ventilação artificial, já que não possui ar condicionado e nem exaustores. As janelas ficam fechadas e a ventilação natural ocorre apenas pela abertura da janela-guichê. Isso favorece uma temperatura acima dos padrões estabelecidos, o que, segundo Pacheco16, facilita o crescimento de UFC. Tal fato pode ser comprovado no estudo de Filho et al.17 que descreveram uma redução significativa no crescimento UFC após a climatização de uma clínica odontológica. No presente estudo, a umidade elevada presente na CME pode ser considerada outro fator que influenciou no crescimento dos microorganismos no local17. Em relação às distâncias das paredes, os resultados mostraram que os dois ambientes (armários e escaninhos) necessitam de ajustes para se enquadrarem nas referências estabelecidas pela ANVISA5. Já em relação ao material em que foram confeccionados, apenas o material dos escaninhos dos alunos, por ser metal, é contra indicado pelo CFO7.
Quanto à exclusividade dos ambientes para armazenar materiais estéreis, os escaninhos dos alunos contrariaram as normas estabelecidas pela ANVISA5: os participantes relataram acondicionar vários tipos de materiais (gesso, materiais de moldagem, materiais clínicos e cirúrgicos não estéreis, dentre outros) juntamente com outros estéreis. Tipple et al.18 observaram comportamento similar em graduandos de odontologia que afirmaram utilizar os armários para depositar diferentes tipos de artigos como jaleco, gorro, máscaras, escova e sabão líquido, bem como, luvas grossas para lavagem de artigos e materiais de consumo. Outros estudos corroboram essa informação mostrando que o armazenamento do material estéril nos armários dos alunos é prática comum, sendo os escaninhos utilizados também para o armazenamento de outros artigos odontológicos12,18.
A contaminação das amostras aboratorialmente observadas revelou que, nos dois ambientes, ouve crescimento microbiano. Entretanto, foi no escaninho dos alunos que se verificou um maior número de amostras contaminadas, como também uma maior quantidade de UFC. Ao compararem-se os dois ambientes de armazenagem, no que tange ao tipo de colônia, observou-se que nos escaninhos dos alunos houve maior presença tanto de colônias cremosas (bactérias) quanto filamentosas (fungos). De acordo com Pimenta et al.19, dentre os vários microrganismos presentes no ambiente, os fungos são os mais dispersos e disseminados na natureza. Tal afirmativa corrobora a predominância de fungos dentre as amostras contaminadas, principalmente no escaninho dos alunos. Os fungos, juntamente com as bactérias, estão presentes na microbiota da pele, sendo encontrados nas mãos, principalmente, entre os dedos e nas dobras destes. Desse modo, o manuseio é uma variável importante a ser considerada na avaliação de contaminação destas amostras15. No escaninho dos alunos, o manuseio pode ter favorecido uma maior contaminação das amostras armazenadas, uma vez que a manipulação dos invólucros pode acontecer com maior freqüência neste local, por não ser um ambiente exclusivo para o armazenamento de material estéril. Considerando que as modificações sobre a esterilidade do material ocorrem independentes da forma de armazenamento, torna-se importante ressaltar a necessidade de outros estudos para se avaliar variáveis tais como tipo de invólucro e manuseio, importantes na manutenção da esterilidade.
Apesar dessas limitações, o presente estudo enfatiza a necessidade de se controlar o local de armazenamento de materiais estéreis, especialmente em instituições de ensino de odontologia. É prática rotineira dos alunos armazenarem seus materiais estéreis em escaninhos, juntamente com outros objetos, e não realizarem a limpeza adequada do ambiente.
CONCLUSÕES
A CME e os escaninhos dos alunos se mostraram diferentes em relação à estrutura física: a CME apresentou um maior número de características que se enquadraram às normas estabelecidas para o ambiente de armazenagem.
Na análise comparativa dos dois ambientes, constatou-se um maior crescimento de colônias cremosas e filamentosas nas amostras oriundas dos escaninhos dos alunos. Neste sentido, a CME se apresentou, portanto, como o local mais adequado para o armazenamento do material estéril.
REFERÊNCIAS
1. Serratine AC, Gonçalves CS, Luçolli IC. Influência do armazenamento e da embalagem na manutenção da esterilidade do instrumental odontológico. Rev Eletrônica Enferm. 2009; 11:158-64. [ Links ]
2. Jorge AO. Princípios de biossegurança em odontologia. Rev Biociênc. 2002; 8:7-17. [ Links ]
3. Krieger D, Bueno R, Gabardo MC. Perspectivas de biossegurança em odontologia. Rev Gestão Saúde. 2010; 1 1-10. [ Links ]
4. Prado ME, Santos SS. Avaliação das condições de esterilização de materiais odontológicos em consultórios na cidade de Taubaté. Rev Biociênc. 2002; 8:61-70. [ Links ]
5. Agência Nacional de Vigilância Sanitária. Ministério da Saúde. Serviços odontológicos: prevenção e controle de riscos. Brasília: ANVISA; 2006. [ Links ]
6. Centenaro A, Marister P. Fluxograma de pessoal e material na central de material de esterilização. In: Seminário Nacional Estado e Políticas Sociais no Brasil II, 2005 out 13-15; Cascavel. p. 1-18. [ Links ]
7. Conselho Federal de Odontologia. Manual de biossegurança. Brasília: CFO; 1999. [ Links ]
8. Possari JF. Centro de material e esterilização: Planejamento e Gestão. 3ª ed. São Paulo: Látria; 2007. [ Links ]
9. Centro Universitário Newton Paiva. Manual de controle de infecção de clínicas e laboratórios específicos. Belo Horizonte: 2010. [ Links ]
10. Centro Universitário da Fundação de Barretos. Fundação Educacional. Manual de biossegurança da clínica odontológica. Barretos; 2009. [ Links ]
11. São Paulo. Secretária Municipal de Saúde de Ribeirão Preto. Manual de qualificação de esterilização em autoclaves. Ribeirão Preto: São Paulo. 2009. [ Links ]
12. Cardoso AC, Martins DA. Reprocessamento de instrumental odontológico: análise dos procedimentos e da qualidade. Rev Sobecc. 2007; 12:26-30. [ Links ]
13. Standard PG, Mackel DC, Mallison GF. Microbial penetration of muslin and paper wrapped sterile packs stored on open shelves and in closed cabinets. Appl Microbiol. 1971; 22:432-7. [ Links ]
14. Joan LS, Norhashimawati AV, Khor S. Time versus event-related sterility: linen & pouch packaging remain sterile over a year of storage and handling. Singapore Nurs J. 2010; 37. [ Links ]
15. Burton GR, Engelkirk PG. Microbiologia para as ciências da saúde. 7ª ed. Rio de Janeiro: Guanabara Koogan; 2005. [ Links ]
16. Pacheco AB. Avaliação da resistência dos microrganismos colhidos no ambiente de clínica odontológica a diferentes antibióticos [tese]. Piracicaba (SP): Faculdade de Odontologia Piracicaba; 2000. [ Links ]
17. Filho TR, Groppo FC, Pacheco AB, Motta RH. Influência da climatização da clínica odontológica sobre o número de microrganismos dispersos no ar. Rev Lecta. 2002; 20:171-6. [ Links ]
18. Tipple AF, Souza AC, Paiva EM, Pereira MS, Moriya TM. Processamento de artigos em uma instituição de ensino odontológico: discutindo a qualidade. Rev Sobecc. 2004; 9:14-7. [ Links ]
19. Pimenta FC, Maggi PS, Naves PL, Ribeiro EL, André AR, Ferreira WM, et al. Avaliação de microbiota fúngica do ar da clínica de periodontia - FO/UFG. Robrac. 1999; 8:43-4. [ Links ]
 Autor correspondente:
Autor correspondente:
Keli Bahia Felicíssimo Zocratto
Rua Tenente Anastácio de Moura, 740/202 - Santa Efigênia
CEP: 30240 390 - Belo Horizonte - MG - Brasil
e-mail:kelibahia@yahoo.com.br
Recebido em 06/06/2011 – Aceito em 25/10/2012













