Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Arquivos em Odontologia
versão impressa ISSN 1516-0939
Arq. Odontol. vol.48 no.3 Belo Horizonte Jul./Set. 2012
REVISÃO DE LITERATURA
Odontologia baseada em evidência: etapas e métodos de uma revisão sistemática
Evidence-based dentistry: steps and methods of a systematic review
Lívia Guimarães ZinaI; Suzely Adas Saliba MoimazII
ICurso de Odontologia, Centro Universitário Newton Paiva, Belo Horizonte, MG, Brasil
IIDepartamento de Odontologia Infantil e Social, Faculdade de Odontologia de Araçatuba, Universidade Estadual Paulista (UNESP), Araçatuba, SP. Brasil
RESUMO
A ciência baseada em evidência utiliza modelos de estudos epidemiológicos com a finalidade de aplicar o conhecimento científico nas decisões em saúde. O objetivo deste artigo foi descrever e discutir a Odontologia Baseada em Evidência (OBE) e metodologia das revisões sistemáticas, destacando as etapas para a sua realização, como a formulação de estratégias de busca, definição de critérios de inclusão e exclusão, extração, análise e síntese dos dados, incluindo a meta-análise. A OBE é compreendida como uma abordagem para o serviço de saúde odontológico que requer integração da evidência científica com a experiência do profissional e as necessidades da população. Como contribuição, a OBE introduziu métodos que geram evidência de qualidade, ferramentas estatísticas utilizadas para sintetizar e analisar a evidência (revisões sistemáticas e meta-análise) e modos de acessar (bancos de dados eletrônicos) e aplicar a evidência (decisões em saúde baseadas em evidências). Por fim, a abordagem baseada em evidência permite avaliar o conhecimento científico por sua validade, impacto e aplicabilidade, eliminando a lacuna entre pesquisa e realidade dos serviços de saúde. É necessário que esforços continuem sendo empregados no sentido de estimular avanços qualitativos na pesquisa epidemiológica, fazendo com que a OBE alcance cada vez mais seu espaço concreto nos processos de planejamento e execução das ações em saúde.
Descritores: Prática clínica baseada em evidências. Odontologia baseada em evidências. Epidemiologia. Metanálise como assunto. Revisão. Metodologia.
ABSTRACT
Evidence-based science uses epidemiological study models with the aim of applying scientific knowledge in health decisions. As such, the present study aimed to describe and discuss Evidence-Based sDentistry (EBD) and the methodology of systematic reviews, highlighting the steps needed to execute these, such as the formulation of search strategies, the definition of inclusion and exclusion criteria, data abstraction, as well as analysis and synthesis, including meta-analysis. The EBD is understood as an approach to oral health care that requires the integration of scientific evidence with the professional's expertise and the population's needs. As a contribution, the EBD has introduced methods which generate evidence of quality, statistical tools used to synthesize and analyze the evidence (systematic reviews and meta-analysis), in addition to ways of accessing (electronic databases) and applying the evidence (evidence-based health decisions). Finally, the evidence-based approach allows for the evaluation of the scientific knowledge through its validity, impact, and applicability, eliminating the gap between research and the reality of health services. It is necessary that efforts continue to be employed in an attempt to stimulate qualitative advances in epidemiological research in the oral health field, in turn helping EBD reach a broader space within the processes of planning and implementation of healthcare actions.
Uniterms: Evidence-based practice. Evidence-based dentistry. Epidemiology. Meta-analysis as a topic. Review. Methodology.
INTRODUÇÃO
Todos os dias o profissional da saúde enfrenta inúmeros desafios e questionamentos, como diagnosticar a doença de seu paciente e propor o melhor tratamento, determinar a causa dessas doenças, especificar o tempo necessário para o retorno desse paciente, propor formas de prevenção e controle das doenças, entre tantas outras questões. Diante dos avanços tecnológicos na área da saúde, da quantidade e rapidez na disseminação de informações científicas, de novas técnicas e materiais, o profissional dos tempos atuais passou a questionar a sua prática clínica e suas escolhas em todas as suas vertentes. Diferentemente de décadas passadas, quando parecia haver uma certeza absoluta na medicina e áreas afins, hoje o que prevalece é a incerteza quanto à eficácia e qualidade das intervenções. A prática baseada em evidência parece ser, assim, uma alternativa viável e segura para quem deseja ter um conduta clínica eficiente e honesta. Este estudo tem o objetivo de descrever e discutir a Odontologia Baseada em Evidência e as etapas para a condução de uma revisão sistemática. Por tratar-se de um artigo de revisão enão envolver a participação de seres humanos, não houve a necessidade de aprovação deste trabalho pelo Comitê de Ética em Pesquisa. Este estudo não apresenta conflito de interesses.
ODONTOLOGIA BASEADA EM EVIDÊNCIA
O termo "Medicina Baseada em Evidência" (MBE) é relativamente novo1. Pesquisadores da Universidade McMaster começaram a usar o termo na década de 1990, estabelecido por David Sackett como a "utilização criteriosa, explícita e conscienciosa da melhor evidência disponível, para tomar decisões sobre o atendimento clínico de cada paciente individualmente"2. A ciência baseada em evidência tem suas raízes em séculos passados, mas foi a partir de 1970 que a chamada fase moderna da medicina baseada em evidência começou a se desenvolver de forma definitiva1. Antes disso, o conhecimento científico estava pautado quase que exclusivamente no uso de livros-textos e referências à opinião de especialistas. O advento da tecnologia de informação, com a produção em larga escala de computadores,softwares de banco de dados e desenvolvimento da internet, permitiu o armazenamento de uma grande quantidade de dados científicos, facilitando assim a busca por novos estudos na literatura, a atualização das pesquisas científicas e o acesso a inúmeros bancos de dados e informações.
Em 1993, foi criada a Colaboração Cochrane sob a liderança do Serviço de Pesquisa Nacional Britânico e Programa de Desenvolvimento, Universidade de Oxford e Universidade de MacMaster (Canadá), em homenagem ao epidemiologista britânico Archie Cochrane, o qual durante a década de 1970 chamou a atenção da comunidade científica para a grande lacuna no conhecimento sobre os efeitos dos cuidados em saúde3. Esta organização internacional tem como princípios e objetivos ajudar as pessoas a fazerem escolhas bem informadas sobre cuidados em saúde ao preparar, manter e assegurar o acesso a revisões sistemáticas de efeitos de intervenções de cuidados em saúde. As revisões sistemáticas realizadas pelos Grupos de Revisão Cochrane são publicadas e disponbilizadas online na biblioteca Cochrane (http://www.thecochranelibrary.com). Desde sua criação até janeiro de 2012, encontram-se cadastrados na Cochrane 8.038 protocolos e revisões sistemáticas, sendo 122 na área de saúde bucal, abordando tratamentos e prevenção.
A MBE tem se tornado possível devido, principalmente, ao desenvolvimento de estratégias para a busca por evidências (por sua validade e relevância), à criação de revisões sistemáticas sobre o efeito de cuidados em saúde (com o auxílio da Colaboração Cochrane); à criação de revistas de estudos de evidência de publicação secundária e serviços de sintetização de evidência científica como o "Clinical Evidence"4. Esse movimento começou a destacar-se na Odontologia na década de 1990, e foi definida pela Associação Americana Odontológica como a "abordagem para o serviço odontológico que requer integração criteriosa de avaliações sistemáticas da evidência científica relevante para a prática clínica, relacionada à história médica e à condição bucal do paciente, com a experiência clínica do dentista e com as necessidades e preferências do paciente"5.
A Odontologia Baseada em Evidência (OBE) tem como objetivo encorajar o clínico geral, em suas atividades de cuidado primário em saúde, a procurar e fazer sentido a evidência disponível com o intuito de aplicá-la no dia-a-dia dos problemas clínicos6. A sua prática baseia-se em converter a necessidade por determinada informação (como prevenção, diagnóstico, prognóstico, terapia, causa) em uma questão que possa ser respondida e na procura pela melhor evidência com a qual será possível responder a essa questão. A validade, impacto e aplicabilidade dessa evidência deve ser avaliada e integrada com a experiência clínica do profissional e com as características biológicas e expectativas do paciente, buscando maneiras de melhorar a efetividade e eficiência do profissional em tratar o seu paciente2.
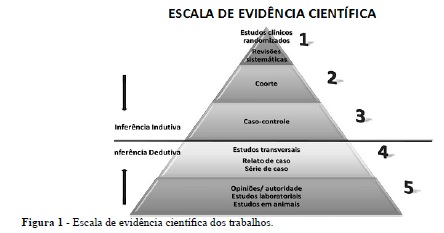
A grande disponibilidade de pesquisas exige uma avaliação criteriosa da qualidade de sua evidência científica7. Com o intuito de contribuir para a análise da qualidade dos trabalhos publicados, foram classificados os níveis de evidência, baseados de acordo com o desenho e características dos estudos4,8 (Figura 1). O padrão-ouro para a melhor evidência são revisões sistemáticas e estudos experimentais randomizados, seguidos por estudos longitudinais controlados, como estudos de coorte e caso-controle9,10. Os estudos de caso e opiniões de especialistas são considerados o nível de evidência mais baixa. A Figura 1 apresenta graficamente a escala de evidência desses estudos. O pensamento racional depende do raciocínio dedutivo ou de experimentos sistemáticos, dentre os quais se destacam hoje como rotineiros na pesquisa clínica os estudos de caso-controle, coorte e ensaios clínicos randomizados. Ao contrário do pensamento dedutivo, cujas associações são sempre verdadeiras ou falsas, tais verdades absolutas não podem ser totalmente alcançadas com experimentos sistemáticos, pois as conclusões baseadas nestes estudos controlados estão sempre cercadas de um certo grau de incerteza, uma limitação frustrante no universo dos clínicos que rotineiramente devem fazer escolhas decisivas10. A seguir apresentaremos em detalhes as características da revisão sistemática.
REVISÃO SISTEMÁTICA
Define-se revisão sistemática como a aplicação de estratégias científicas que limitam o viés na seleção sistemática, na avaliação crítica e na síntese de todos os estudos relevantes em um tópico específico. A revisão sistemática é uma revisão planejada para responder a uma pergunta específica e que utiliza métodos explícitos e sistemáticos para identificar, selecionar e avaliar criticamente os estudos publicados na literatura científica, evitando o viés em cada uma de suas etapas. Os métodos estatísticos - como a metaanálise, utilizada na revisão sistemática para integrar os resultados dos estudos incluídos - podem ou não ser utilizados na análise e na síntese dos resultados dos trabalhos8,11-16.
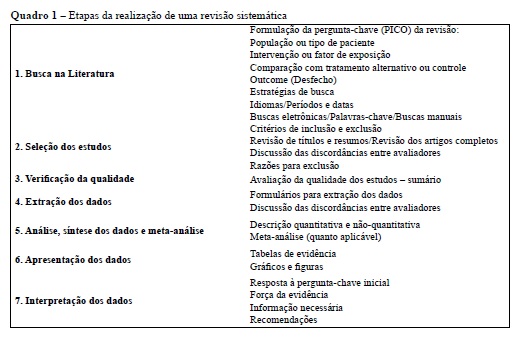
No Quadro 1 são enumerados os passos para a realização de uma revisão sistemática, seguindo as recomendações de uma das principais publicações da área - o Manual da Cochrane para Revisões Sistemáticas de Intervenções17, produzido pela Colaboração Cochrane, e o CRD Report, produzido pelo Centro de Revisões e Disseminação/Universidade de York (NHS Centre for Reviews and Dissemination)11.
1. Busca na literatura
Para realizar uma revisão sistemática,é necessário primeiramente definir a questão (PICO question) a ser respondida4,10. Essa pergunta deve responder aos quatro elementos metodológicos fundamentais: P= População; I= Intervenção; C= Grupo controle ou sem intervenção e O= Desfecho (outcome). População corresponde ao total de pessoas que participam da pesquisa. Intervenção corresponde ao fator de exposição ao qual um grupo de pessoas que faz parte da população de estudo foi submetido. Grupo controle, como o próprio nome diz, se refere ao grupo de pessoas, dentro da população de estudo, que não foi submetido ao fator de exposição; seria o grupo oposto ao grupo Intervenção. Desfecho corresponde à doença ou condição avaliada, e é representada por alguma medida desta doença, como perda de osso alveolar para doença periodontal, cavidade no dente para cárie dentária, dentre outros.
Após definida a pergunta que responda aos quatro elementos do PICO question, parte-se para a procura das palavras-chave e estabelecimento da estratégia de busca. Os unitermos científicos – os descritores Mesh - são determinados pela Biblioteca Nacional de Medicina dos Estados Unidos e usados para indexar artigos no Index Medicus e MEDLINE.Esses termos fazem parte do vocabulário utilizado para representação dos documentos da base de dados MEDLINE. A consulta dos unitermos em inglês pode ser feita no site do Pubmed (http://www.ncbi.nlm.nih.gov/mesh) ou com tradução para o português no site da Bireme, na base Decs - Descritores em Saúde (http://decs.bvs.br). Os unitermos ou grupo de palavras podem ser combinados de diferentes formas para modificar o resultado da pesquisa, formando assim uma estratégia de busca adequada para os objetivos do seu estudo. Os operadores lógicos de pesquisa ou operadores booleanos ("AND", "OR", e "NOT") relacionam os unitermos ou grupos de palavras no processo de elaboração da pesquisa, combinando-os entre si. Além dos operadores booleanos, é possível utilizar códigos específicos junto com o unitermo ou descritor utilizado na estratégia da pesquisa. Informações detalhadas sobre a utilização de tais códigos podem ser encontradas no site do Pubmed, em PUBMED HELP – Search field descriptions and tags (http://www.ncbi.nlm.nih.gov/books/NBK3827/#pubmedhelp.Search_Field_Descrip). Além disso, a busca pode ser limitada por idade do grupo, idioma, tipo de publicação, data, estudos em humanos/animais, dentre outros limites encontrados nos sites de busca.
Dentre os principais sites de busca de trabalhos científicos podem ser citados: PUBMED (http://www.pubmed.gov) – inclui MEDLINE; ISI WEB OF SCIENCE (http://www.isiknowledge.com), COCHRANE (http://www.thecochranelibrary.com) e EMBASE (http://www.embase.com). Sites secundários, mas igualmente importantes, devem ser pesquisados para complementar a busca: Current Controlled Trials (http://www.controlledtrials.com): banco de dados de trabalhos clínicos randomizados; Clinical Trials - US National Institute of Health (http://www.clinicaltrials.gov): banco de dados de trabalhos clínicos randomizados; ProQuest Dissertation Abstracts and Thesis database (http://proquest.umi.com): banco de dados de resumos e arquivos completos de dissertações e teses; National Institute for Health and Clinical Excellence (http://www.nice.org.uk): banco de pesquisas clínicas sobre saúde; Biblioteca Virtual em Saúde (www.bireme.br): site nacional englobando diversos bancos de dados, como LILACS (Literatura Latino-Americana de Ciências da Saúde), BBO (Biblioteca Brasileira de Odontologia) e MEDLINE (biblioteca internacional em saúde, mesma base incluída no PUBMED); Scielo (http://www.scielo.org): banco de dados de trabalhos completos, incluindo umas das principais revistas de saúde nacionais e internacionais da América Latina. Há ainda outras bases importantes na área, e sua escolha depende em grande parte dos objetivos da pesquisa e das características dos estudos a serem incluídos na revisão.
2. Seleção dos estudos
Na avaliação crítica dos estudos, são estabelecidos critérios de exclusão e inclusão para determinar quais estudos farão parte da revisão11,17. Os critérios de inclusão e exclusão devem ser explicitamente utilizados durante todo o processo de seleção dos artigos. Não há como generalizar tais critérios, já que eles dependem dos objetivos de cada revisão sistemática. Uma forma eficaz e muito útil é classificar primeiramente os estudos de acordo com o PICO question, ou seja, para cada estudo seria determinado a População, Intervenção, Grupo Controle e Desfecho. Inicialmente, após realizada a busca sistematizada nas bases de dados, devem ser lidos todos os resumos e títulos dos estudos encontrados. Dentre estes, serão selecionados aqueles que se enquadram nos critérios de inclusão. Em alguns estudos não é possível preencher todos os critérios, pela falta de informação, como no caso de estudos os quais apresentam somente o título. Neste caso, a inclusão ou exclusão dos artigos é feita baseada apenas no título. Após concluída a busca por estudos potencialmente relevantes, cópias dos estudos completos devem ser separadas e avaliada a sua relevância de acordo com a questão estabelecida para a revisão. Aqueles que corresponderem aos critérios de inclusão serão finalmente incluídos no trabalho. O processo de seleção deve ser explícito e conduzido de tal maneira a minimizar os riscos de erro de julgamento.
A seguir, um exemplo de critérios de inclusão e exclusão para uma revisão sistemática (Quadro 2).

3. Verificação da qualidade
A verificação da qualidade das pesquisas em uma revisão sistemática envolve a análise da validade interna e externa de um estudo, até que grau o desenho do estudo, sua condução e análise minimizaram os possíveis vieses ou erros18. Inicialmente, pode ser usada para determinar um mínimo de qualidade (desenho do estudo) para a seleção de estudos primários a serem incluídos na revisão. A análise da qualidade em profundidade é então realizada com os estudos incluídos para explorar as diferenças de qualidade como uma explicação para a heterogeneidade entre os resultados dos estudos. Este processo objetiva a interpretação dos resultados e permite a geração de inferências para futuras recomendações quanto à prática clínica e pesquisa19.
Listas e escalas de qualidade para diferentes desenhos de estudos estão disponíveis, ou podem ser desenvolvidas. Seus componentes devem capturar tanto aspectos metodológicos gerais quanto específicos para a área que está sendo avaliada. As listas e escalas mais utilizadas são: Delphi, Jadad, PEDro, CONSORT, Moose, Newcastle-Ottawa e as recomendações da Colaboração Cochrane. Veja abaixo a relação das principais listas disponíveis:
Escalas e guias para estudos clínicos randomizados:
• Chalmers TC, Smith H, Blackburn B, Silverman B, Schroeder B, Reitman D, et al. A method for assessing the quality of a randomized control trial. Control Clin Trials. 1981; 2:31–49.
• Downs SH, Black N. The feasibility of creating a checklist for the classification of the methodological quality both of randomised and nonrandomised studies of health care interventions. J. Epidemiol. Community Health. 1998; 52:377-84.
• Emerson JD, Burdick E, Hoaglin DC, Mosteller F, Chalmers TC. An empiric study of the possible relation of treatment differences to quality scores in controlled randomized trials. Control Clin Trials. 1990; 11:339-52.
• Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, et al. Assessing the quality reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996; 17:1-12.
• Maher CG, Sherrington C, Herbert RD, Moseley AM, Elkins M. Reliability of the PEDro scale for rating quality of randomized controlled trials. Phys Ther. 2003; 83:713-21.
• Moher D, Jadad AR, Nichol G, Penman M, Tugwell P, Wash S. Assessing the quality of randomized controlled trials: an annotated bibliography of scales and checklists. Control Clin Trials. 1995; 16:62-73.
• Moher D, Schulz KF, Altman DG. The CONSORT statement: revised recommendations for improving the quality of reports of parallel-group randomized trials. J Am Podiatr Med Assoc. 2001;91:437-42. Informação disponível online: http://www.consort-statement.org/
• Sindhu F, Carpenter L, Seers K. Development of a tool to rate the quality classification of randomized controlled trials using a Delphi technique. J Adv Nurs. 1997; 25:1262-8.
• Verhagen AP, de Vet HC, de Bie RA, Kessels AG, Boers M, Bouter LM, et al. The Delphi list: a criteria list for quality classification of randomized clinical trials for conducting systematic reviews developed by Delphi consensus. J Clin Epidemiol. 1998; 51:1235-41.
• Zaza S, Aguero LKW, Briss PA, Truman BI, Hopkins DP, Henessy MH, et al. Data Collection Instrument and Procedure for Systematic Reviews in the Guide to Community Preventive Services. Am J Prev Med 2000; 18(1S):44–74.
Escalas e guias para estudos longitudinais:
• Fleiss JL, Gross AJ. Meta-analysis in epidemiology, with special reference to studies of the association between exposure to environmental tobacco smoke and lung cancer: a critique. J Clin Epidemiol. 1991; 44:127-39.
• Levine M, Walters S, Lee H, Haines T, Holbrook A, Moyer V, et al. User's guide to the medical literature. IV: How to use an article about harm. JAMA. 1994; 271:1615-9.
• STROBE Initiative. Vandenbroucke JP, von Elm E, Altman DG, Gotzsche PC, Mulrow CD, Pocock SJ et al. Strengthening the Reporting of Observational Studies in Epidemiology (STROBE): Explanation and Elaboration. Epidemiology. 2007; 18:805-35. Informação disponível online: http://www.strobe-statement.org/index.html
• Stroup DF, Berlin JA, Morton SC, et al. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of Observational Studies in Epidemiology (MOOSE) group. JAMA. 2000; 283:2008-12.
• Wells GA, Shea B, O'Connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Research programs. Ottawa Health Research Institute. Informação disponível online: http://www.ohri.ca/programs/clinical_epidemiology/oxford.htm
Além dessas, escalas e recomendações gerais foram criadas para avaliação da qualidade de revisões sistemáticas e meta-análise:
• AHRC. Agency for Healthcare Research and Quality. Systems to Rate the Strength of Scientific Evidence. Evidence Report/Technology Assessment n. 47. 2002.
• Auperin A, Pignon JP, Poynard T. Review article: critical review of meta-analyses of randomized clinical trials in hepatogastroenterology. Alimentary Pharmacol Ther. 1997; 11:215-25.
• Barnes DE, Bero LA. Why review articles on the health effects of passive smoking reach different conclusions. JAMA. 1998; 279:1566-70.
• Cook DJ, Sackett DL, Spitzer WO. Methodologic guidelines for systematic reviews of randomized control trials in health care from the Potsdam Consultation on Meta-Analysis. J Clin Epidemiol. 1995; 48:167-71.
• Cranney A, Tugwell P, Shea B, Wells G. Implications of OMERACT outcomes in arthritis and osteoporosis for Cochrane metaanalysis. J Rheumatol. 1997; 24:1206-7.
• de Vet HCW, de Bie RA, van der Heijden GJMG, Verhagen AP, Sijpkes P, Kipschild PG. Systematic reviews on the basis of methodological criteria. Physiotherapy. 1997; 83:284-9.
• Harbour R, Miller J. A new system [Scottish Intercollegiate Guidelines Network (SIGN)] for grading recommendations in evidence based guidelines. BMJ 2001; 323:334-6.
• Irwig L, Tosteson AN, Gatsonis C, et al. Guidelines for meta-analyses evaluating diagnostic tests. Ann Intern Med. 1994; 120:667-76.
• Moher D, Cook DJ, Eastwood S, Olkin I, Rennie D, Stroup DF. Improving the quality of reports of meta-analyses of randomised controlled trials: the QUOROM statement. Quality of Reporting of Metaanalyses. Lancet. 1999; 354:1896-1900.
• National Health and Medical Research Council (NHMRC). How to Use the Evidence: Assessment and Application of Scientific Evidence. Canberra, Australia: NHMRC; 2000.
• Oxman AD, Cook DJ, Guyatt GH. Users' guides to the medical literature. VI. How to use an overview. Evidence-Based Medicine Working Group. JAMA. 1994; 272:1367-71.
• Oxman AD, Guyatt GH. Validation of an index of the quality of review articles. J Clin Epidemiol. 1991; 44:1271-8.
• Pogue J, Yusuf S. Overcoming the limitations of current meta-analysis of randomised controlled trials. Lancet. 1998; 351:47-52.
• Shea BJ, Bouter LM, Peterson J, Boers M, Andersson N, Ortiz Z, Ramsay T, Bai A, Shukla VK, Grimshaw JM. External validation of a measurement tool to assess systematic reviews (AMSTAR). PLoS ONE. 2007 26; 2:e1350.
• Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, Porter AC, Tugwell P, Moher D, Bouter LM. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol. 2007; 7:10.
• Sutton AJ, Abrams KR, Jones DR, Sheldon TA, Song F. Systematic reviews of trials and other studies. Health Technol Assess. 1998; 2:1-276.
• Vlayen J, Aertgeerts B, Hannes K, Sermeus W, Ramaekers D. A systematic review of appraisal tools for clinical ractice guidelines: multiple similarities and one common deficit. Int J Qual Health
Care. 2005; 17:235-42.
4. Extração dos dados
A extração dos dados é o processo no qual os revisores obtêm a informação que eles precisam a partir do que é reportado pelos pesquisadores primários10,11,17. Para minimizar os erros desse processo subjetivo, opta-se pela elaboração a priori de um formulário de extração que deve conter todos os itens a serem extraídos dos estudos, exemplificados posteriormente nessa seção.
Os formulários, ou fichas de extração, de um modo geral, são similares em estrutura e podem ser adaptados de uma revisão para outra, levando em consideração os diferentes objetivos de cada projeto20. Preconiza-se a criação de critérios e códigos, o que aumenta a consistência da revisão. Os formulários devem ser testados pelos examinadores em uma amostra dos estudos selecionados, identificando assim informações que ficaram de fora e precisariam ser incluídas, ou informações desnecessárias e que deveriam ser descartadas, além de verificar a aplicabilidade dos critérios e códigos designados. Isto irá garantir que os revisores extraiam toda a informação necessária de cada estudo, de um modo uniforme. É interessante que os dados sejam extraídos independentemente por, pelo menos, dois revisores, evitando assim que se perca algum dado importante e se reforce a concordância entre avaliadores. Os dados extraídos são, então, comparados e qualquer dúvida sanada por meio de discussão entre os revisores13.
Todas as variáveis dos estudos devem ser observadas, descritas e resumidas. Os componentes-chave de um formulário incluem:
Informação geral – data da extração dos dados; título do estudo, autores, periódico, ano, detalhes da publicação, identificação do revisor;
Informação específica – Características do estudo: elegibilidade do estudo (conferir novamente se o estudo se encaixa nos critérios de inclusão), desenho do estudo, características da população avaliada, local de condução da pesquisa, qualidade metodológica do estudo, forma e tipo de intervenção, desfecho. Medidas de desfecho e resultados: número de pessoas em cada grupo, duração do acompanhamento (quando aplicável), drop-outs, dados ausentes, dados discretos (evento, número total, p-valores), dados contínuos (médias, desvio-padrão, erro-padrão, números, p-valores), análise de sobrevivência, medidas de efeito, fatores que podem afetar a validade do estudo, etc.
Códigos e critérios para preenchimento da ficha:
Algumas vezes será necessário entrar em contato com os autores dos estudos para pedir-lhes informações mais detalhadas. Durante o processo de revisão, diversas reuniões entre avaliadores devem ser feitas para verificar o progresso das atividades e reavaliar os critérios.
5. Análise, síntese dos dados e meta-análise
Os objetivos da síntese dos dados em uma revisão sistemática é coletar e resumir os achados dos estudos primários incluídos na revisão. Isto pode ser feito por meio de uma descrição quantitativa ou não-quantitativa, complementada pelo uso de técnicas estatísticas formais, como a meta-análise16,21.
1. Descrição não-quantitativa: seu objetivo é coletar e apresentar os dados extraídos de modo que a informação sobre as características (população, intervenção, desfecho e qualidade metodológica) e resultados dos estudos incluídos na revisão sejam resumidos de um modo apropriado e compreensível. A melhor opção é a tabulação dos dados, a qual permite ao leitor verificar a evidência, o rigor metodológico e as diferenças entre os estudos.
Esse processo deve ser explícito e conduzido com muito cuidado. A decisão por quais dados devem ser agrupados, tabulados e comparados - tais como, quem foram os grupos de exposição e grupos controle, quais fatores de confundimento foram ajustados, quais índices foram utilizados, etc - deve ser feita baseada nas questões que a revisão engloba. Os resultados encontrados em um estudo podem diferir sobremaneira quando comparados com outros estudos. Os elementos-chaves para uma abordagem descritiva da síntese dos dados podem incluir os seguintes itens: referência bibliográfica do estudo – população - intervenção ou fator de exposição - local ou situação onde a intervenção foi aplicada - fatores ambientais, sociais e culturais que podem influenciar os resultados/desfechos - natureza das medidas de desfecho avaliadas, sua importância relativa e seu poder de detectar a condição/ doença - validade da evidência - tamanhos da amostra e resultados dos estudos. A partir de uma análise crítica e comparativa dos dados, deve ser possível analisar qualitativamente se há diferenças entre os estudos baseadas nas características dos participantes, intervenção/exposição ou medidas de desfecho (heterogeneidade clínica), no desenho dos estudos e qualidade (heterogeneidade metodológica) e nos efeitos reportados (heterogeneidade estatística).
2. Descrição quantitativa: baseada na semelhança entre os estudos, como perfil dos sujeitos da pesquisa e tipo de intervenção, estes serão agrupados para a meta-análise. Esta identifica e explica inconsistências entre os resultados dos diversos estudos sobre um mesmo problema15. Frequentemente, o número de estudos incluídos na meta-análise é menor que os incluídos na revisão sistemática. A meta-análise não é possível de ser realizada quando os dados necessários para esta análise não podem ser obtidos e não deve ser apropriada quando os dados são esparsos ou quando os estudos são muito heterogêneos para serem sensivelmente combinados13.
Há três tipos de dados comumente encontrados em revisões sistemáticas9,11,21:
a) Dados dicotômicos ou binários são aqueles em que os sujeitos podem estar em uma ou outra categoria, como vivos ou mortos, com doença ou sem doença. Tais dados podem ser sumarizados utilizando medidas de risco. Dentre essas, as mais comumente utilizadas são o Risco Relativo (RR) e a razão de chances (OR – Odds ratio). O tamanho do RR e OR podem variar entre zero e o infinito. O intervalo de confiança contém o verdadeiro RR/OR com certa probabilidade pré-determinada (geralmente, 95%). Importante observar nos estudos o intervalo de confiança dessas medidas; quando o intervalo engloba o valor 1,0, significa que a medida não é estatisticamente significativa9. Estima-se que para estudos de caso-controle e coorte, as medidas mínimas esperadas para que se possa observar um grau de evidência aceitável são entre 3,0 e 4,0 (RR/OR=3,0 ou 4,0)10.
b) Dados contínuos são desfechos resumidos por médias, verificadas por meio de medições ou uso de escalas de medidas, e são sumarizados nas revisões sistemáticas como diferenças nas médias, ou diferenças padrões nas médias (tamanho do efeito).
c) Dados de sobrevivência são normalmente encontrados em estudos sobre terapia para câncer e em outras áreas, nos quais o desfecho do principal interesse é o tempo de ocorrência de um evento; são utilizadas medidas como hazard ratios. Há outros resultados que não se encaixam nessa classificação; nestes casos, geralmente utiliza-se dicotomizar os dados e tratá-los como binários.
É importante ressaltar que estudos individuais, devido a tamanhos pequenos de amostras, podem não ser capazes de estimar precisamente os efeitos de uma intervenção. Ao combinar os resultados de diversos estudos, a meta-análise adquire o poder estatístico necessário para aumentar a precisão da estimativa do efeito16.
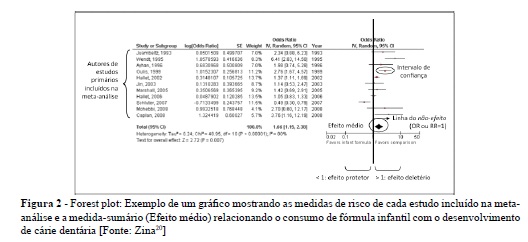
Há várias abordagens para a metaanálise15,16,22. Uma delas é calcular a média ponderada dos estudos. A estimativa do efeito geral representa uma média ponderada de todos os estudos incluídos na meta-análise (medida-sumário). O peso de cada estudo individual está na proporção inversa de sua variância, um método que oferece um peso maior para os estudos com amostras maiores e um peso menor para os estudos com amostras menores. A apresentação da medida-sumário, da distribuição das medidas de risco e peso dos estudos incluídos em uma meta-análise pode ser visualizada por meio de um gráfico específico, o forest plot (Figura 2), o qual apresenta os efeitos individuais de cada estudo com seus respectivos intervalos de confiança como linhas horizontais, o quadrado no meio da linha horizontal representando o efeito médio. Na parte inferior do gráfico encontra-se a medida-sumário e seu intervalo de confiança. Uma linha vertical corta a abscissa do gráfico no valor de efeito nulo (1 no caso de RR/OR, e zero no caso de uma diferença entre médias). O forest plot serve para mostrar visualmente os resultados de uma meta-análise, fazendo uma estimativa visual da quantidade de variação entre os estudos17.
A combinação e a síntese dos resultados em uma meta-análise podem ser feitas utilizando-se tanto modelos estatísticos fixos quanto aleatórios. O "modelo de efeito fixo" considera o efeito de uma exposição como único e as diferenças observadas entre os resultados dos vários estudos devem-se a uma variação aletatória na amostragem ao redor de um efeito fixo; este modelo estima a medida de efeito metanalítica mais uma fonte de variabilidade, que é a variabilidade dentro de cada estudo (variância intraestudo)12,13,22. Já o "modelo de efeito aleatório" considera que os estudos mensuraram efeitos distintos e que as diferenças entre os resultados devem-se, além da variação aleatória, a diferenças reais entre os efeitos observados nos estudos; assume uma diferença no efeito para cada estudo e leva em consideração uma fonte adicional de variação, o que leva a um intervalo de confiança mais amplo do que o observado no modelo de efeito fixo. Os efeitos são considerados como aleatoriamente distribuídos, e o ponto central dessa distribuição é o foco da estimativa dos efeitos combinados. Este modelo considera duas fontes de variabilidades, a variabilidade dentro dos estudos (variância intraestudo) e a variabilidade entre os estudos (variância interestudos). O modelo fixo é recomendado quando há pouca heterogeneidade entre os estudos, e nos casos em que a heterogeneidade é grande recomenda-se utilizar o modelo de efeito aleatório. Este último não remove os efeitos da heterogeneidade, o que pode ser explicado pelas diferenças na metodologia e população de estudo. Enquanto o método de efeito fixo simplesmente estima o efeito médio do tratamento/intervenção/exposição e seu intervalo de confiança, o modelo de efeito aleatório estima um efeito médio de tratamento/intervenção/exposição, seu intervalo de confiança associado, e a variância observada dos efeitos do tratamento/intervenção/exposição entre os estudos (assumindo que eles tenham uma distribuição normal)11,23.
A heterogeneidade entre os estudos pode ser avaliada por meio de testes estatísticos, como o teste de I-quadrado estatístico24. Quando a heterogeneidade estatisticamente significativa é detectada ou quando tal heterogeneidade é suspeitada na visualização gráfica, as diferenças nos estudos ou outros fatores devem ser investigados como possíveis explicações. Estas diferenças podem ser descritas,ou preferencialmente estimadas e avaliadas. Em análises estratificadas, as meta-análises podem ser realizadas com subgrupos de estudos divididos de acordo com características particulares. O significado de diferenças nas estimativas gerais nos subgrupos indica heterogeneidade. Nestes casos, é possível investigar a influência de diferenças na população e intervenção, assim como diferenças na definição e medidas dos desfechos. As metarregressões podem ser utilizadas para investigar os efeitos das diferenças das características dos estudos na estimativa do efeito do tratamento/intervenção/exposição25. Estes métodos são mais bem utilizados quando as características investigadas são medidas em uma escala contínua. Eles efetivamente encaixam-se em análises de regressão linear para cada covariável, pesando cada estudo de acordo com a precisão da estimativa do efeito do tratamento/intervenção/exposição. Tais análises são bem realizadas utilizando modelos de efeito aleatório.
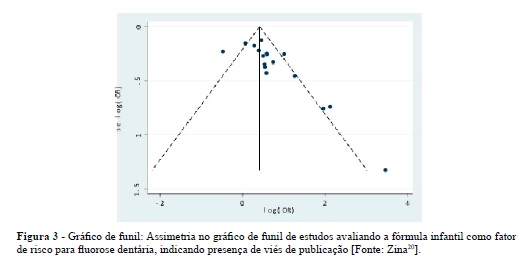
Além da heterogeneidade, o viés de publicação pode ser formalmente avaliado e estimado, incorporando tal processo à análise, conclusões e inferências da revisão14. O viés de publicação é aquele no qual a probabilidade de publicação de um estudo é influenciada pela significância dos seus resultados. Por exemplo, estudos que relatam uma intervenção que não é efetiva têm menos chance de serem publicados do que aqueles que mostram resultados positivos sobre a intervenção. As revisões sistemáticas que não conseguem identificar tais estudos com resultados "nulos", ou seja, sem significância estatística, podem superestimar o verdadeiro efeito da intervenção. Uma série de métodos estatísticos estão disponíveis para lidar com o viés de publicação na meta-análise, como o método "fail-safe N", "funnel plot" (gráfico de funil), método rank de correlação, método de regressão linear, e alguns modelos complexos de modelagem, dentre outros. Os métodos estatísticos baseados na análise da simetria do gráfico de funil26 são os mais utilizados. O gráfico de funil mostra a distribuição do tamanho do efeito, de acordo com o tamanho da amostra (ou inverso da variância) (Figura 3). Espera-se que os pontos (que representam os estudos individualmente) preencham a forma do funil (ou triângulo), havendo maior variabilidade nos tamanhos de efeitos relatados para estudos menores. Falhas grandes no funil indicam um possível grupo de publicações "faltando" ou "ausentes". Estes estudos que faltam são geralmente estudos pequenos com estimativas de ponto sugerindo um efeito diferente daqueles disponíveis e são improváveis de estarem faltando por acaso. No entanto, há necessidade de cautela ao interpretar tal informação, já que a forma de um gráfico de funil é dependente de medidas selecionadas para estimar efeito e precisão.
6. Apresentação dos dados
Os dados podem ser apresentados de forma descritiva e/ou, preferencialmente, por meio de tabelas de evidência, gráficos e figuras. As tabelas são organizadas de forma a apresentar as informações básicas extraídas dos estudos (descritas no capítulo anterior, em descrição não-quantitativa), tais como população, intervenção ou fator de exposição, natureza das medidas de desfecho avaliadas, etc, de acordo com cada estudo incluído na revisão. Tais tabelas são bastante comuns em revisões sistemáticas.
A análise da qualidade dos estudos também pode ser apresentada na forma de tabelas, nas quais as colunas representam cada item da qualidade avaliado(de acordo com a escala ou lista utilizada) e as linhas representam os estudos (ou vice-versa). Quando a escala utilizada permite obter uma média para cada estudo, tal resultado pode ser incluído na tabela geral de evidência; no entanto, é interessante que a revisão apresente os detalhes da análise da qualidade para que o leitor tenha acesso aos itens avaliados e possa verificar os pontos fortes e fracos dos estudos.
A análise quantitativa dos dados pode ser apresentada por meio de gráficos e figuras, representativos de testes estatísticos, tais como o forest plot e o gráfico de funil, já descritos no capítulo anterior. Há uma série de outros gráficos que podem ser utilizados, de acordo com a necessidade e análise utilizada, como os gráficos de dispersão (tais como o gráfico L'Abbé plot). Estes gráficos podem ser úteis para apresentar visualmente os dados dos estudos incluídos em uma revisão sistemática e permitem avaliar a heterogeneidade entre os estudos dessa revisão, como também podem ser úteis para apresentar os resultados de uma meta-regressão, utilizada para investigar os efeitos das diferenças nas características dos estudos na estimativa do efeito, seja ele tratamento, intervenção ou exposição. Independente do tipo de gráfico/figura/tabela a ser utilizada, é importante que se destaque a capacidade dessas representações em facilitar a compreensão dos dados analisados na revisão, permitindo ao leitor o entendimento global dos principais achados da pesquisa.
7. Interpretação dos dados
Nesta fase determina-se a força da evidência encontrada, a aplicabilidade dos resultados, verificando-se as informações sobre custo ao comparar os achados com o tratamento padrão, e analisando-se os limites entre os benefícios e os riscos27.
O formato da descrição da conclusão pode apontar para posicionamentos distintos, por isso é necessário um cuidado excessivo para evitar um viés na interpretação dos resultados. Se não há presença de evidências e não houve estudos selecionados, pode-se concluir que não existem evidências sobre a pergunta inicial. Uma vez que os estudos foram incluídos, deve-se determinar se estes são adequados ou inadequados para recomendar a utilização ou não de uma intervenção ou a determinação de uma associação positiva ou não, dependendo sobre o que está sendo avaliado na revisão. Isto é analisado por meio da qualidade dos estudos e do poder estatístico. Se os estudos são de boa qualidade e possuem poder estatístico (detectaram-se diferenças entre os grupos), a recomendação será de utilizar ou não a intervenção de acordo com o grupo que se beneficiou ou afirmar que existe evidência para a associação verificada. No caso das evidências encontradas serem inadequadas, observar-se-á a falta de evidência para o tema, surgindo a partir dos resultados encontrados a recomendação para a realização de novos estudos, com desenhos mais apropriados, e discussões sobre as implicações clínicas12,16.
Após concluída a revisão, faz-se necessária a elaboração do relatório final de todo o processo. Na discussão e recomendações da revisão, é preciso considerar os efeitos benéficos e maléficos da intervenção (se for o caso); explorar a variação entre os efeitos relativos e suas causas; explorar se os efeitos relativos (benéficos e maléficos) podem variar com o risco ou a severidade da doença e grupo controle e comparar os benefícios e danos. As implicações práticas para os clínicos e administradores de saúde devem ser discutidas, além das perguntas não respondidas e as implicações para as pesquisas futuras28.
Uma vez publicada, a revisão sofrerá críticas e receberá sugestões que devem ser incorporadas às edições subsequentes, caracterizando uma publicação viva, e ainda ser atualizada cada vez que surgirem novos estudos sobre o tema.
CONSIDERAÇÕES FINAIS
A adoção da prática clínica, com base em resultados comprovados cientificamente quanto a sua eficácia, utiliza modelos de estudos epidemiológicos com a finalidade de aplicar o conhecimento científico nas decisões em saúde. Com a procura crescente pela eficiência e uma relação adequada entre custobenefício, há a necessidade de expandir o processo da OBE para todos os aspectos do cuidado odontológico. Isso é particularmente importante em vista do papel de destaque que têm recebido os processos de planejamento e avaliação de ações em saúde. Tanto pacientes quanto serviços de saúde e profissionais sentir-se-ão muito mais seguros ao promover ações e oferecer procedimentos odontológicos que são embasados por evidência, podendo produzir resultados positivos a longo prazo.
AGRADECIMENTOS
Esta pesquisa foi financiada pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES - Brasil) por meio do Programa de Doutorado no País com Estágio no Exterior – PDEE. Agradecemos aos professores Dr. Philippe P. Hujoel e Dra. Joana Cunha-Cruz, da Universidade de Washington (EUA), pela oportunidade de formação em OBE e participação em aulas e seminários.
REFERÊNCIAS
1. Claridge JA, Fabian TC. History and Development of Evidence-based Medicine. World J Surg. 2005; 29:547-53. [ Links ]
2. Sackett DL, Rosenberg WM, Gray JA, Haynes RB, Richardson WS. Evidence based medicine: what it is and what it isn't. BMJ. 1996; 312:71-2. [ Links ]
3. Cochrane AL. 1931-1971: a critical review, with particular reference to the medical profession. In: Feeling-Smith G, Wells N, editors. Medicines for the year 2000. London: Office of Health Economics; 1979. p. 1-11. [ Links ]
4. Forrest JL, Miller SA, Newman MG. Introduction to Evidence-Based Decision Making. In: Newman MG, Takei HH, Klokkevold PR, Carranza FA (editors). Carranza's Clinical Periodontology. 10thed. Philadelphia: Saunders Elsevier; 2006. p. 12-21. [ Links ]
5. American Dental Association. ADA Policy on evidence-based dentistry. definition of evidencebased dentistry. Chicago: ADA; 2008. [ Links ]
6. Ballini A, Capodiferro S, Toia M, Cantore S, Favia G, De Frenza G, et al. Evidence-based dentistry: what's new? Int J Med Sci. 2007; 4:174-8. [ Links ]
7. Richards D. Which journals should you read to keep up to date? Evid Based Dent. 1998; 1:22-5. [ Links ]
8. Straus SE, Richardson WS, Glasziou P, Haynes RB. Evidence-based medicine: how to practice and teach EBM. 3rded. Philadelphia: Elsevier Churchill Livingstone; 2005. [ Links ]
9. Koepsell TD, Weiss NS. Epidemiologic methods: studying the ocurrence of illness. New York: Oxford University Press; 2003. [ Links ]
10. Hujoel PP. Assessing evidence. In: Newman MG, Takei HH, Klokkevold PR, Carranza FA, editors. Carranza's clinical periodontology. 10thed. Philadelphia: Saunders Elsevier; 2006. p. 22-35. [ Links ]
11. Khan KS, Riet G, Glanville J, Sowden AJ, Kleijnen J. Undertaking Systematic reviews of research on effectiveness. CRD report number 4. 2nded. York: York Publishing Services; 2001. [ Links ]
12. Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ. 2003; 327:557-60. [ Links ]
13. Armitage P. Statistical methods in medical research. 4th ed. Malden: Blackwell Science; 2001. [ Links ]
14. Egger M, Smith GD. Bias in location and selection of studies. BMJ. 1998; 316:61-6. [ Links ]
15. Egger M, Smith GD, Phillips AN. Meta-analysis: principles and procedures. BMJ. 1997; 315:1533-7. [ Links ]
16. Olkin I. Statistical and theoretical considerations in meta-analysis. J Clin Epidemiol. 1995; 48:133-46. [ Links ]
17. Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions version 5.1.0. [internet]. [updated 2011 Mar; cited 2012 Jan 16]. Available from: http://www.cochrane-handbook. org/. [ Links ]
18. Juni P, Altman DG, Egger M. Systematic reviews in health care: Assessing the quality of controlled clinical trials. BMJ. 2001; 323:42-6. [ Links ]
19. Lawrence A. Building up the quality process. Evid Based Dent. 1999; 1:2. [ Links ]
20. Zina LG. Evidências científicas da associação entre fórmula infantil, fluorose e cárie dentária [tese]. Araçatuba (SP): Faculdade de Odontologia de Araçatuba; 2009. [ Links ]
21. Wolf FM. Meta-analysis: quantitative methods for research synthesis. Beverly Hills (CA): Sage; 1986. [ Links ]
22. DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986; 7:177-88. [ Links ]
23. Rosner BA. Fundamentals of biostatistics. Belmont, London: Duxbury Press; 1995. [ Links ]
24. Higgins JP, Thompson SG. Quantifying heterogeneity in a meta-analysis. Stat Med 2002; 21:1539-58. [ Links ]
25. Berkey CS, Hoaglin DC, Mosteller F, Colditz GA. A random-effects regression model for metaanalysis. Stat Med. 1995; 14:395-411. [ Links ]
26. Biljana M, Jelena M, Branislav J, Milorad R. Bias in meta-analysis and funnel plot asymmetry. StudHealth Technol Inform. 1999; 68:323-8. [ Links ]
27. Moher D, Schulz KF, Altman DG. The CONSORT statement: revised recommendations for improving the quality of reports of parallelgroup randomized trials. Lancet. 2001; 357:1191-4. [ Links ]
28. Clarkson J, Worthington H, Chalmers I. Reducing harm and maximizing benefit. Evid Based Dent. 1999; 1:4-5. [ Links ]
 Autor correspondente:
Autor correspondente:
Lívia Guimarães Zina
Av. Prudente de Morais, 70/1403 – Cidade Jardim
CEP: 30380-002 - Belo Horizonte -MG – Brasil
e-mail:liviazina@yahoo.com.br
Recebido em 17/01/2012 – Aceito em 09/04/2012













