Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Arquivos em Odontologia
versão impressa ISSN 1516-0939
Arq. Odontol. vol.51 no.1 Belo Horizonte Jan./Mar. 2015
Tratamento do biofilme intracanal de Enterococcus faecalis com suspensões de diferentes nanopartículas e irrigantes convencionais
Treatment of the Enterococcus faecalis root canal biofilm with nanoparticle suspensions and conventional irrigants
Josiane de Almeida I; Gabriela V. Santos I; Morgana T. Orsi I; Bruna C. Cechella I; Anarela V. Bernardi I; Wilson T. Felippe I
I Departamento de Endodontia, Universidade Federal de Santa Catarina, Florianópolis, SC, Brasil
Contatos: dealmeidajosiane@hotmail.com, gabrielavieira.ds@gmail.com, morganaorsi@hotmail.com, bru_casa@hotmail.com, anarela.bernardi@ hotmail.com, wtfelippe@hotmail.com
RESUMO
Objetivo: O objetivo deste estudo foi avaliar e comparar a efetividade das soluções de hipoclorito de sódio (NaOCl) 1% e 5%, clorexidina (CHX) 2%, suspensões de nanopartículas de prata (Np Ag) 1% e nanopartículas de óxido de zinco (Np ZnO) 26% contra o biofilme de E. faecalis. Material e Métodos: Setenta e seis dentes humanos unirradiculados foram modelados, montados em um aparato específico e esterilizados. Após, 100 μL de uma suspensão de E. faecalis foi inserida nos canais, sendo renovada diariamente por 7 dias. Quatro segmentos radiculares foram analisados por meio de microscopia eletrônica de varredura (MEV) para confirmar a presença do biofilme. Os segmentos radiculares remanescentes foram divididos aleatoriamente em 6 grupos (n = 12), de acordo com a solução irrigadora empregada: G1) solução salina 0,85% (controle); G2) NaOCl 1%; G3) NaOCl 5%; G4) CHX 2%; G5) suspensão de Np Ag 1%; e G6) suspensão de Np ZnO 26%. Concluída a irrigação, a susceptibilidade do biofilme às soluções irrigadoras (n = 10) foi determinada pelo método de plaqueamento e contagem de unidades formadoras de colônias (UFC). Uma análise por meio de MEV foi conduzida em 2 segmentos de cada grupo para visualização da estrutura do biofilme. O conjunto de dados, representados pelos valores médios de UFC para cada grupo, foi analisado estatisticamente pelos testes Kruskal-Wallis e Mann- Whitney (p < 0,05). Resultados: A efetividade das soluções de NaOCl 5% e Np Ag 1% contra o biofilme intracanal de E. faecalis foi superior comparada à solução salina 0,85% (p < 0,05). NaOCl 5% reduziu 100% das UFC comparado ao grupo controle, seguido pela suspensão de Np Ag 1% (97,6%), Np ZnO 26% (96,1%), NaOCl 1% (94,1%) e CHX 2% (93,1%). Conclusão: Com base na metodologia aplicada, as soluções de NaOCl 5% e Np Ag 1% apresentaram excelente efetividade contra o biofilme de E. faecalis estabelecido no canal radicular.
Descritores: Biofilmes. Desinfecção. Enterococcus faecalis. Nanopartículas metálicas.
ABSTRACT
Aim: The aim of this study was to evaluate and compare the effectiveness of 1% and 5% sodium hypochlorite (NaOCl), 2% chlorexidine (CHX), 1% silver nanoparticles (Np Ag) suspension, and 26% zinc oxide nanoparticles (Np ZnO) suspension against E. faecalis biofilm. Methods: Seventy-six extracted human teeth were biomechanically prepared, mounted in a specific apparatus, and sterilized. Next, 100 μL of an E. faecalis suspension was inoculated into the root canals, and was replaced every 24 h for 7 days. Four teeth were analyzed by scanning electron microscopy (SEM) to confirm the presence of biofilm. The remaining teeth were randomly divided in 6 groups (n = 12) according to the irrigation solution: G1) 0.85% saline (control), G2) 1% NaOCl, G3) 5% NaOCl, G4) 2% CHX, G5) 1% Np Ag suspension, and G6) 26% Np ZnO suspension. After the irrigation protocol, the biofilm susceptibility to disinfecting solutions (n=10) was determined by colony-forming unit (CFU) quantification. SEM was also performed in 2 root segments to view the biofilm structure. Data, represented by the mean number of CFU for each group, were analyzed by means of the Kruskal- Wallis and Mann-Whitney post hoc tests (p < 0.05). Results: The effectiveness of 5% NaOCl and 1% Np Ag against E. faecalis biofilm was superior compared to 0.85% saline solution (p < 0.05). 5% NaOCl was able to reduce 100% of CFU when compared to the control, followed by 1% Np Ag (97.6%), 26% Np ZnO (96.1%), 1% NaOCl (94.1%), and 2% CHX (93.1%). Conclusion: Based on the methodology used, 5% NaOCl and 1% Np Ag showed excellent effectiveness against intracanal E. faecalis biofilm.
Uniterms: Biofilms. Disinfection. Enterococcus faecalis. Metal nanoparticles.
INTRODUÇÃO
Micro-organismos persistentes ou provenientes da cavidade oral são capazes de recontaminar o sistema de canais radiculares e originar uma organização ecológica denominada biofilme, a qual influencia diretamente o sucesso do tratamento endodôntico1. Apesar da infecção ser de natureza polimicrobiana2, o Enterococcus faecalis é a espécie bacteriana mais frequentemente isolada, presente na maioria dos canais com necessidade de retratamento3. Além da complexidade anatômica do sistema de canais radiculares, a dificuldade de eliminação do E. faecalis também está relacionada à sua alta resistência às substâncias químicas utilizadas durante a terapia endodôntica3.
Além disso, o E. faecalis possui a habilidade de penetrar os túbulos dentinários, se aderir fortemente às paredes de dentina4 e, principalmente, se organizar na forma de biofilme5.
Na tentativa de aumentar o nível de desinfecção do sistema de canais e consequentemente o índice de sucesso dos tratamentos, diversas substâncias químicas são utilizadas como auxiliares do preparo mecânico. Merecem destaque o hipoclorito de sódio (NaOCl) de 1% a 6%6,7 e a clorexidina (CHX)7.
Em suas diversas concentrações, o NaOCl tem demonstrado maior poder de eliminação do biofilme de E. faecalis quando comparado a outras soluções irrigadoras8. Contudo, mesmo após a realização do tratamento endodôntico convencional sob irrigação com NaOCl e aplicação de hidróxido de cálcio como medicação intracanal, micro-organismos e biofilmes viáveis ainda podem ser detectados na complexidade do sistema de canais radiculares9,10.
A CHX possui um espectro antimicrobiano amplo e de longa duração, principalmente contra o E. faecalis11. Apesar de ser uma alternativa ao uso do NaOCl, a CHX não é capaz de erradicar as bactérias do canal radicular, mesmo quando associada ao uso de aparelhos ultrassônicos12.
Devido à limitada ação de desinfecção promovida pelas diversas manobras endodônticas, novas alternativas de tratamento têm sido propostas. O uso de nanopartículas em Endodontia, como as nanopartículas de prata (Np Ag) e de óxido de zinco (Np ZnO), tem sido recomendado principalmente em razão da excelente ação antimicrobiana promovida13-15.
Recentemente, tem sido demonstrado que a incorporação de Np Ag a diferentes produtos odontológicos proporciona atividade antimicrobiana e antibiofilme aos materiais16-18. Na forma de nanopartícula, a prata tem se mostrado um potente agente antimicrobiano19, inclusive quando empregada como medicação intracanal ou solução irrigadora13.
Há muitos anos, o zinco tem sido utilizado como principal constituinte dos cimentos endodônticos, os quais demonstram resultados positivos em relação ao efeito antimicrobiano14. O uso de Np ZnO, na forma de suspensão, também tem proporcionado excelente resultado quanto à eliminação e desagregação da estrutura do biofilme intracanal de E. faecalis20.
Tendo em vista o potencial antimicrobiano das Np Ag e Np ZnO, o objetivo deste estudo foi avaliar e comparar a efetividade das soluções de NaOCl 1%, NaOCl 5%, CHX 2%, Np Ag 1% e Np ZnO 26% contra um biofilme de E. faecalis estabelecido no canal radicular. A hipótese que determinou o delineamento da investigação foi que as suspensões de nanopartículas são mais eficientes contra o biofilme de E. faecalis quando comparadas aos irrigantes endodônticos convencionais.
MATERIAIS E MÉTODOS
Preparo dos espécimes
O projeto de pesquisa foi aprovado pelo Comitê de Ética em Pesquisa com Seres Humanos da Universidade Federal de Santa Catarina, sob o parecer de número 359.070.
Foram selecionados 76 dentes humanos, unirradiculados, com canais únicos e retos. Em seguida, as coroas foram removidas de forma a se obter segmentos radiculares de aproximadamente 12 mm de comprimento. Com o auxílio de uma lima K #10 (Dentsply Maillefer, Ballaigues, Switzerland) foi estabelecida a patência apical. Após, os canais foram limpos e modelados no sentido coroaápice por meio de brocas Gates-Glidden #3 e #2, seguidas de limas Flexofile (Dentsply Maillefer). O stop apical foi confeccionado com limas Flexofile #35. Um reservatório de 3 mm de profundidade foi confeccionado na porção cervical do canal com broca Gates-Glidden #4. Durante o preparo foi realizada uma irrigação com NaOCl 1% a cada troca de instrumento. A irrigação final foi realizada com EDTA 17% por 3 min e NaOCl 1% por 3 min.
Com exceção à entrada do canal, a superfície externa dos segmentos, incluindo o forame apical, foi impermeabilizada com duas camadas de adesivo epóxi (Araldite de presa rápida, Ciba-Geigy AS, Taboão da Serra, SP, Brasil). Após a secagem do adesivo, os segmentos radiculares foram inseridos em pequenos orifícios produzidos em tampas de borracha. Concluído o processo de esterilização com gás de óxido de etileno (ACECIL, Central de Esterilização Com. Ind. Ltda., Campinas, SP, Brasil), as tampas de borracha foram posicionadas em recipientes de vidro estéreis, de forma a manter os segmentos radiculares na posição vertical durante todo o experimento.
Formação do biofilme
Inicialmente, o número de unidades formadoras de colônias (UFC)/mL do inóculo utilizado no experimento foi determinado. O inóculo foi preparado a partir de uma única colônia de E. faecalis (ATCC 29212) em Trypticase Soy Broth (TSB) (Difco Laboratories, Becton Dickinson and Company, Franklin Lakes, NJ, USA). Com o auxílio de um espectrofotômetro, a densidade óptica da cultura overnight de E. faecalis foi ajustada a 0.5. Após, alíquotas de 50 μL foram plaqueadas em Agar Mueller Hinton, as placas incubadas por 48 h e o número de UFC/mL determinado [≈108 UFC/ mL].
Em condições assépticas, alíquotas de 0,1 mL da cultura de E. faecalis suplementada com sacarose 0,4% foram introduzidas nos canais radiculares com o auxílio de seringas e agulhas estéreis. As alíquotas foram renovadas diariamente durante 7 dias. Os dispositivos contendo os segmentos radiculares foram incubados a 37ºC durante o período experimental. Para confirmar a formação de biofilme, 4 segmentos radiculares foram preparados para a análise em microscópio eletrônico de varredura (MEV). Inicialmente, os segmentos foram fixados em glutaraldeído 2,5% tamponado com cacodilato 0,2 M durante 12 h a 4ºC e seccionados longitudinalmente. Em seguida, foram lavados em tampão cacodilato 0,2 M durante 1 h com duas trocas, desidratados (em concentrações ascendentes de álcool etílico - 25%, 50%, 75% e 95% por 20 min cada, e 100% por 1 h), montados em stubs e recobertos com ouro (300Å). Finalmente, os segmentos foram observados por meio de MEV (Philips, SEM XL 30), operando a 10 kW, em aumentos de 1.000x a 5.000x.
Nanopartículas de prata e de óxido de zinco
As partículas contidas nas suspensões de Np Ag (TNS Nanotecnologia Ltda, Florianópolis, SC, Brasil) e Np ZnO (Nanum Nanotecnologia S.A., Belo Horizonte, MG, Brasil) apresentam tamanho médio de aproximadamente 10 nm e 45 nm, respectivamente. O teor de nanopartículas na suspensão de Np Ag foi estabelecido após a realização de experimentos piloto e análise de imagens obtidas por meio de MEV. A menor concentração de Np Ag na suspensão capaz de promover considerável efetividade antimicrobiana foi de 1%. O teor de nanopartículas na suspensão de Np ZnO (26%) foi previamente estabelecido pelo fabricante.
Grupos experimentais e soluções irrigadoras
Os segmentos radiculares foram divididos aleatoriamente em 6 grupos experimentais (n = 12), de acordo com a solução irrigadora empregada: G1) solução salina 0,85% (controle); G2) NaOCl 1%; G3) NaOCl 5%; G4) CHX 2% G5) suspensão de Np Ag 1%; e G6) suspensão de Np ZnO 26%. O procedimento de irrigação foi realizado com o auxílio de seringa e agulha estéreis. A agulha, calibrada em 10 mm, foi introduzida no espaço do canal radicular. Com movimentos de vai e vem, 5 mL da solução foram injetados durante 5 min (1 mL/min). De forma similar aos procedimentos descritos anteriormente, 2 segmentos radiculares de cada grupo foram preparados e observados por meio de MEV.
Contagem de UFC
Imediatamente após a irrigação, 3 cones de papel absorvente calibre #35 foram inseridos consecutivamente no interior do canal radicular, de forma a tocar todas as paredes, e mantidos por 1 min. Em seguida, os 3 cones foram transferidos à um tubo Eppendorf estéril contendo 1 mL de solução salina. O tubo foi submetido à vibração em vortex por 30 segundos a fim de promover a remoção das bactérias e agregados bacterianos aderidos aos cones de papel. A partir desta suspensão bacteriana inicial foram feitas diluições decimais sucessivas. Uma alíquota de 100 μL foi removida dos tubos correspondentes às diluições de 100x e 1.000x, e plaqueada em triplicata em Agar Mueller Hinton. As placas foram incubadas a 37ºC por 48 h e após este período foi realizada a contagem de UFC.
Análise estatística
O teste de normalidade Shapiro-Wilk demonstrou uma distribuição não-normal. O conjunto de dados, representados pelos valores médios de UFC para cada grupo, foi analisado estatisticamente pelo teste não paramétrico Kruskal-Wallis e posteriormente, para comparações múltiplas, pelo teste Mann- Whitney post hoc. Um nível de significância de 5% foi adotado. Os testes foram realizados com o auxílio do software Sigma Stat 3.5.
RESULTADOS
A análise por meio de MEV, realizada após o período de incubação de 7 dias, confirmou a presença de biofilme no interior do canal radicular. Os dados referentes aos resultados da contagem de UFC após o uso de cada solução estão expressos no gráfico 1.
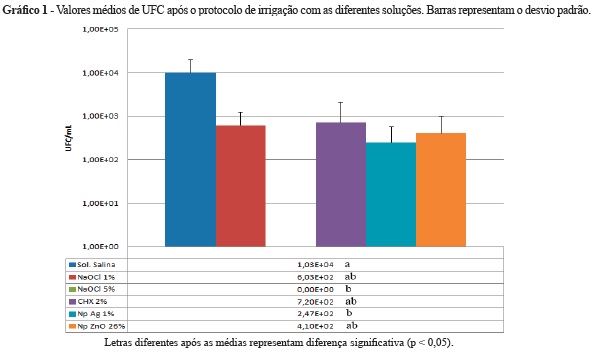
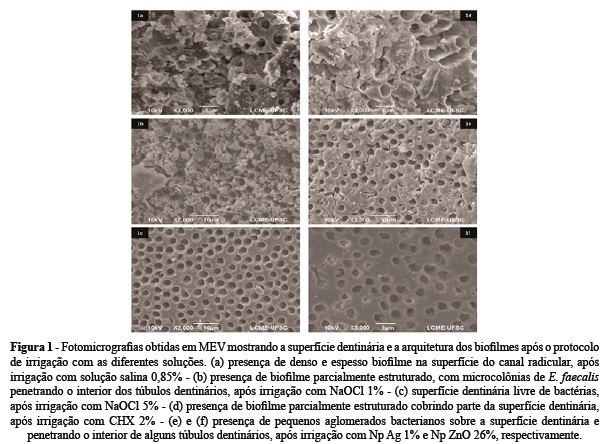
As soluções de NaOCl 5% e Np Ag 1% apresentaram efetividade contra o biofilme de E. faecalis significativamente superior à da solução salina (Mann-Whitney post hoc, p < 0,05). De maneira geral, o NaOCl 5% demonstrou melhor efetividade reduzindo 100% das UFC comparado ao grupo controle, seguido pela suspensão de Np Ag 1% (97,6%), Np ZnO 26% (96,1%), NaOCl 1% (94,1%) e CHX 2% (93,1%). A figura 1 (a - f) demonstra a estrutura do biofilme após o tratamento com as diferentes soluções irrigadoras.
DISCUSSÃO
Além da instrumentação, a desinfecção do sistema de canais radiculares está diretamente relacionada à capacidade antimicrobiana das soluções irrigadoras, as quais assumem importância fundamental no prognóstico do tratamento endodôntico3.
No presente estudo, a solução de NaOCl 5% demonstrou excelente efetividade contra o biofilme de E. faecalis, eliminando a totalidade de UFC. Investigações prévias concordam com o achado e demonstram que o NaOCl em altas concentrações é capaz de promover significativa desinfecção dos canais radiculares21,22. É provável que a erradicação bacteriana promovida pelo NaOCl 5% esteja relacionada à alta concentração de ácido hipocloroso (HClO) não dissociado na solução, o que resulta em uma maior ação antimicrobiana23.
Por sua vez, o NaOCl 1% não foi capaz de eliminar totalmente o biofilme. Outros estudos também demonstraram que a ação antibiofilme do NaOCl 1% não é 100% eficaz8,24. Sua eficiência reduzida, quando utilizado como única manobra de desinfecção, pode estar relacionada à presença estruturada e organizada do biofilme de E. faecalis, que confere aos microorganismos maior resistência frente aos agentes químicos8. Outra possível explicação pode estar relacionada à concentração da solução. Uma vez que a concentração de HClO liberado é diretamente proporcional à concentração da solução, o uso de NaOCl em baixas concentrações, como 1%23, compromete sua eficácia antimicrobiana.
Embora sem diferença significativa, a solução de CHX 2% apresentou menor efetividade contra o biofilme de E. faecalis quando comparada às demais soluções experimentais. Achados de estudos prévios também demonstram sua ação limitada21,24. É sabido que a ação antimicrobiana desempenhada pela solução de CHX 2% está relacionada à ligação eletrostática entre as suas moléculas catiônicas e a carga negativa da parede celular bacteriana, o que causa alterações no equilíbrio osmótico e perda de componentes intracelulares25. No entanto, frente ao biofilme, a CHX apresenta penetração limitada e seu maior efeito antimicrobiano ocorre apenas nas camadas mais externas26.
Neste estudo, a irrigação dos canais com a suspensão de Np Ag 1% reduziu significativamente as UFC viáveis comparada ao grupo controle. Resultados satisfatórios também foram demonstrados em outros estudos, nos quais Np Ag foram utilizadas na forma de solução irrigadora13,15 ou gel intracanal13. Soluções de Np Ag foram capazes de desinfetar tubos de dentina de forma semelhante ao NaOCl 2,5%15, assim como o gel de Np Ag foi capaz de desagregar significativamente a estrutura do biofilme de E. faecalis e promover uma redução no número de células viáveis13.
O excelente resultado proporcionado pelas Np Ag 1% pode estar relacionado ao pequeno tamanho das partículas, uma vez que o efeito antimicrobiano da prata é dependente da superfície de contato27. Quanto menor for o tamanho da partícula, maior será o contato da prata com os micro-organismos. As Np Ag se ligam à membrana celular e levam a um aumento da permeabilidade bacteriana, afetando o sistema de transporte através da membrana plasmática. Assim, íons Ag+, liberados em decorrência da oxidação das nanopartículas após a ligação com a membrana celular, são capazes de penetrar o interior da bactéria e reagir com proteínas específicas, acarretando o distúrbio no metabolismo e a inibição dos sistemas enzimáticos vitais, tais como o processo respiratório e a divisão celular, resultando na morte bacteriana27,28.
A suspensão de Np ZnO 26% eliminou 96,1% das UFC viáveis, resultado aproximado ao obtido após a irrigação com as Np Ag 1%. Ainda que diferença significativa não tenha sido observada em relação às diferentes soluções testadas, a suspensão de Np ZnO 26% promoveu uma redução bacteriana de aproximadamente 2 log quando comparada à solução salina. Resultados de investigações prévias também demonstram eficácia antibacteriana das Np ZnO contra o E. faecalis14,20. De forma semelhante às Np Ag, este resultado também pode estar relacionado ao pequeno tamanho das nanopartículas de ZnO empregadas. A ligação das Np ZnO à membrana celular bacteriana pode levar à alterações na permeabilidade e perda de componentes intracelulares, ocasionando a morte da bactéria29,30. Além disso, as Np ZnO também são capazes de induzir a geração de espécies reativas de oxigênio (ROS)31, as quais modificam e danificam a membrana celular32.
Uma possível explicação para a incompleta eliminação do biofilme de E. faecalis após a irrigação com as soluções de Np Ag 1% e Np ZnO 26% pode estar relacionada à própria resistência dos microorganismos quando estruturados na forma de biofilme. Nessa organização, os micro-organismos apresentamse fenotipicamente e fisiologicamente diferentes dos planctônicos33, exigindo maiores concentrações de antimicrobianos34. Ainda, a matriz extracelular polimérica produzida pelas células microbianas durante o processo de maturação do biofilme35 pode ter servido como uma barreira química36 e dificultado a difusão das nanopartículas no interior das células bacterianas37. Uma vez que a difusão é o mecanismo de transporte dominante nos biofilmes, a mobilidade e a biodisponibilidade das nanopartículas irão depender, em grande parte, do coeficiente de difusão, o qual está relacionado ao tamanho das partículas e às características físico-químicas, assim como da natureza do biofilme38. Além disso, uma inadequada interação entre as nanopartículas e a parede celular bacteriana durante o período de 5 min em que os canais foram irrigados pode ter dificultado a eficiente ação das nanopartículas13. Um estudo recente demonstrou que, mesmo após 24 h de tratamento do biofilme de E. faecalis com Np ZnO, um total de 10.000 a 100.000 bactérias vivas foram observadas após quantificação microbiológica20.
Apesar do efeito antimicrobiano apresentado pelas suspensões de nanopartículas na forma de irrigante endodôntico, é necessário cautela, tendo em vista a possibilidade de toxicidade às células humanas. Numerosos estudos têm investigado os efeitos citotóxicos das nanopartículas15,39,40. Entretanto, controvérsias permanecem em razão das propriedades físicas e químicas apresentadas pelos variados tipos de nanopartículas, como o tamanho das partículas e as características da superfície41. Além disso, variações na citotoxicidade são observadas em decorrência do tempo em que as nanopartículas são empregadas42, do tipo de célula humana testada e da quantidade de metal liberada no interior da célula43.
Diante dos resultados obtidos, abre-se a perspectiva de uso das Np Ag 1% e Np ZnO 26% como solução irrigadora. Ainda assim, outros experimentos são necessários, a fim de avaliar a efetividade das nanopartículas contra um biofilme multiespécies, como também suas propriedades biológicas.
CONCLUSÃO
Com base na metodologia aplicada e levando em consideração as limitações do estudo, as soluções de NaOCl 5% e Np Ag 1% apresentaram excelente efetividade contra o biofilme de E. faecalis estabelecido no canal radicular.
REFERÊNCIAS
1. Nair PNR, Henry S, Cano V, Vera J. Microbial status of apical root canal system of human mandibular first molars with primary apical periodontitis after ''one-visit'' endodontic treatment. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2005;99:231–52.
2. Anderson AC, Hellwig E, Vespermann R, Wittmer A, Schmid M, Karygianni L, et al. Comprehensive analysis of secondary dental root canal infections: a combination of culture and culture-independent approaches reveals new insights. Plos One. 2012;7:e49576.
3. Portenier I, Waltimo TMT, Haapasalo M. Enterococcus faecalis – the root canal survivor and 'star' in post-treatment disease. Endod. Topics. 2003;6:135-59.
4. Sedgley CM, Lennan SL, Appelbe OK. Survival of Enterococcus faecalis in root canals ex vivo. Int. Endod. J. 2005;38:735–42.
5. Love RM. Enterococcus faecalis: a mechanism for its role in endodontic failure. Int. Endod. J. 2001;34:399-405.
6. Chávez de Paz LE, Bergenholtz G, Svensäter G. The effects of antimicrobials on endodontic biofilm bacteria. J. Endod. 2010;36:70-7.
7. Wang Z, Shen T, Haapasalo M. Effectiveness of endodontic disinfecting solutions against young and old Enterococcus feacalis biofilms in dentin canals. J. Endod. 2012;38:1376-9.
8. Case PD, Bird PS, Kahler WA, George R, Walsh LJ. Treatment of root canal biofilms of Enterococcus faecalis with ozone gas and passive ultrasound activation. J. Endod. 2012;38:523-6.
9. Nair PN, Henry S, Cano V, Vera J. Microbial status of apical root canal system of human mandibular first molars with primary apical periodontitis after 'one-visit' endodontic treatment. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2005;99:231-52.
10. Ricucci D, Siqueira JF, Jr. Biofilms and apical periodontitis study of prevalence and association with clinical histopathologic findings. J. Endod. 2010;36:1277-88.
11. Gomes BP, Vianna ME, Zaia AA, Almeida JFA, Souza-Filho FJ, Ferraz CCR. Chlorhexidine in endodontics. Braz Dent J. 2013;24:89-102.
12. Shen Y, Stojicic S, Qian W, Olsen I, Haapasalo M. The synergistic antimicrobial effect by mechanical agitation and two chlorexidine preparations on biofilm bacteria. J. Endod. 2010;36:100-4.
13. Wu D, Fan W, Kishen A, Gutmann JL, Fan B. Evaluation of the antibacterial efficacy of silver nanoparticles against Enterococcus faecalis biofilm. J. Endod. 2014;40:285-90.
14. Kishen A, Shi Z, Shrestha A, Neoh KG. An investigation on the antibacterial and antibiofilm efficacy of cationic nanoparticulates for root canal disinfection. J. Endod. 2008;34:1515-20.
15. Sivieri-Araujo G, Santos LMS, Queiroz IOA, Wayama MT, Martins CM, Dezan-Júnior E, et al. Avaliação das nanopartículas de prata como solução irrigadora. Dent. Press Endod. 2013;3:16- 23.
16. Zhang K, Melo MA, Cheng L, Weir MD, Bai Y, Xu HH. Effect of quaternary ammonium and silver nanoparticle-containing adhesives on dentin bond strength and dental plaque microcosm biofilms. Dent. Mater. 2012;28:842-52.
17. Cheng L, Weir MD, Xu HH, Antonucci JM, Kraigsley AM, Lin NJ, et al. Antibacterial amorphous calcium phosphate nanocomposites with a quaternary ammonium dimethacrylate and silver nanoparticles. Dent. Mater. 2012;28:561-72.
18. Melo MAS, Cheng L, Zhang K, Weir MD, Rodrigues LK, Xu HH. Novel dental adhesives containing nanoparticles of silver and amorphous calcium phosphate. Dent. Mater. 2013;29:199-210.
19. Rai M, Yadav A, Gade A. Silver nanoparticles as a new generation of antimicrobials. Biotechnol. Adv. 2009;27:76-83.
20. Shrestha A, Shi Z, Neoh KG, Kishen A. Nanoparticulates for antibiofilm treatment and effect of aging on its antibacterial activity. J. Endod. 2010;36:1030-5.
21. Dunavant TR, Regan JD, Glickman GN, Solomon ES, Honeyman AL. Comparative evaluation of endodontic irrigants against Enterococcus faecalis biofilm. J. Endod. 2006;32:527-31.
22. Del Carpio-Perochena AE, Bramante CM, Duarte MA, Cavenago BC, Villas-Boas MH, Graeff MS, et al. Biofilm dissolution and cleaning ability of different irrigant solutions on intraorally infected dentin. J Endod. 2011;37:1134-8.
23. Vianna ME, Gomes BP, Berber VB, Zaia AA, Ferraz CC, Souza, FJ Filho. In vitro evaluation of the antimicrobial activity of chlorhexidine and sodium hypochlorite. Oral Surg Oral Med Oral Pathol Oral. Radiol. Endod. 2004;97:79-84.
24. Stojicic S, Shen Y, Qian W, Johnson B, Haapasalo M. Antibacterial and smear layer removal ability of a novel irrigant, QMiX. Int. Endod. J. 2012;45:363-71.
25. Fardal O, Turnbull RS. A review of the literature on use of chlorhexidine in dentistry. J. Am. Dent. Assoc. 1986;112:863-9.
26. Zaura-Arite E, Van Marle J, Ten Cate JM. Confocal microscopy study of undisturbed and chlorhexidine-treated dental biofilm. J. Dent. Res. 2001; 80:1436–40.
27. Morones JR, Elechiguerra JL, Camacho A, Holt K, Kouri JB, Ramírez JT, et al. The bactericidal effect of silver nanoparticles. Nanotechnology. 2005;16:2346–53.
28. Feng QL, Wu J, Chen GQ, Cui FZ, Kim TN, Kim JO. Mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus. J. Biomed. Mater. Res. 2000;52:662-8.
29. Rabea EI, Badawy ME, Stevens CV, Smagghe G, Steurbaut W. Chitosan as antimicrobial agent: applications and mode of action. Biomacromolecules. 2003;4:1457–65.
30. Jung BO, Kim CH, Choi KS, Lee YM, Kim J-J. Preparation of amphiphilic chitosan and their antimicrobial activities. J. Appl. Polym. Sci. 1999;72:1713-19.
31. Padmavathy N, Vijayaraghavan R. Enhanced Bioactivity of ZnO nanoparticles: an antimicrobial study. Sci. Technol. Adv. Mater. 2008;9:4-11.
32. Lovrić J, Cho SJ, Winnik FM, Maysinger D. Unmodified cadmium telluride quantum dots induce reactive oxygen species formation leading to multiple organelle damage and cell death. Chem. Biol. 2005;12:1227-34.
33. Johnson SA, Goddard PA, Iliffe C, Timmins B, Rickard AH, Robson G, et al. Comparative susceptibility of resident and transient hand bacteria to para-chloro-meta-xylenol and triclosan. J. Appl. Microbiol. 2002;93:336-44.
34. Dunne WM Jr, Mason EO Jr, Kaplan SL. Diffusion of rifampin and vancomycin through a Staphylococcus epidermidis biofilm. Antimicrob. Agents Chemother. 1993;37:2522-6.
35. Jakubovics NS, Kolenbrander PE. The road to ruin: the formation of disease-associated oral biofilms. Oral Diseases. 2010;16:729-39.
36. Liu Y, Li J, Qiu X, Burda C. Bactericidal activity of nitrogen doped metal oxide nanocatalysts and the influence of bacterial extracellular polymeric substances (EPS). J. Photochem. Photobiol:A Chemistry. 2007;190:94-100.
37. Prosser BL, Taylor D, Dix BA, Cleeland R. Method of evaluating effects of antibiotics on bacterial biofilm. Antimicrob. Agents Chemother. 1987;31:1502-6.
38. Peulen TO, Wilkinson KJ. Diffusion of nanoparticles in a biofilm. Environ. Sci. Technol. 2011;45:3367-73.
39. Kim JE, Kim H, Na SS, Maeng EH, Kim MK, Song YJ. In vitro cytotoxicity of SiO2 or ZnO nanoparticles with different sizes and surface charges on U373MG human glioblastoma cells. Int. J. Nanomed. 2014;15:235-41.
40. Gomes, JE Filho, Silva FO, Watanabe S, Cintra LT, Tendoro KV, Dalto LG, et al. Tissue reaction to silver nanoparticles dispersion as an alternative irrigating solution. J. Endod. 2010;36:1698-702.
41. Pan CH, Liu WT, Bien MY, Lin IC, Hsiao TC, Ma CM, et al. Effects of size and surface of zinc oxide and aluminum-doped zinc oxide nanoparticles on cell viability inferred by proteomic analyses. Int. J. Nanomed. 2014;2:3631-43.
42. Barkhordari A, Barzegar S, Hekmatimoghaddam H, Jebali A, Rahimi Moghadam S, Khanjani N. The toxic effects of silver nanoparticles on blood mononuclear cells. Int. J. Occup. Environ. Med. 2014;5:164-8.
43. Gliga AR, Skoglund S, Wallinder IO, Fadeel B, Karlsson HL. Size-dependent cytotoxicity of silver nanoparticles in human lung cells: the role of cellular uptake, agglomeration and Ag release. Part Fibre Toxicol. 2014;17:11.













