Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Stomatos
versão impressa ISSN 1519-4442
Stomatos vol.16 no.31 Canoas Jun./Dez. 2010
ARTIGOS CIENTÍFICOS
Atividade antimicrobiana do PMCC, por contato direto e vapor, frente ao Enterococcus faecalis e ao Staphylococcus aureus
PMCC antimicrobial activity, by direct contact and vapor, against Enterococcus faecalis and Staphylococcus aureus
Cristiane RochaI; Luis Eduardo Duarte IralaII; Alexandre Azevedo SallesII; Renata Grazziotin-SoaresIII
ICirurgiã-dentista graduada pela Curso de Odontologia da ULBRA-Canoas
IIProfessor de Endodontia do Curso de Odontologia da ULBRA-Canoas
IIIAluna do curso de Doutorado em Odontologia da ULBRA-Canoas
RESUMO
O objetivo deste trabalho foi avaliar a atividade antimicrobiana do paramonoclorofenol canforado (PMCC), por contato direto e vapor contra o Enterococcus faecalis e Staphylococcus aureus. O método empregado foi o de difusão em ágar. Utilizaram-se dez dentes humanos extraidos (caninos superiores e inferiores, pré-molares superiores e inferiores), que foram transfixados a placas de Petry com resina acrílica auto-polimerizável, de forma que as coroas dentais ficassem acima da tampa destas placas. Ao redor dos ápices radiculares foi colado um cilindro de vidro de, aproximadamente, 5mm de diâmetro e 1,5 cm de altura. O teste por contato direto foi realizado com discos de papel filtro embebidos em 3µL de PMCC colocados diretamente sobre o meio de cultura inoculado com os microrganismos. Para o teste por vapor, o PMCC foi levado ao interior do canal com um cone de papel absorvente #40, onde permaneceu por 24 horas. Os resultados revelaram que o medicamento apresentou efeito antimicrobiano após contato direto com as culturas, formando halos de inibição bacteriana. Em relação aos vapores liberados pelo produto, pôde-se constatar que não houve nenhuma ação por vapor quando o fármaco esteve no canal radicular, pois houve crescimento bacteriano próximo a região do ápice radicular.
Palavras chave: tratamento do canal radicular, Enterococcus faecalis, Staphylococcus aureus, in vitro.
ABSTRACT
The aim of this study was to evaluate antibacterial activity of the canphorated paramonochorophenol (PMCC) by direct contact and vapor against Enterococcus faecalis and Staphylococcus aureus. The test of agar difusion was the method used. It were used human extracted teeth (maxillary and mandibulary canines and maxillary and mandibulary pre-molars) that were fixed on Petri slabs by acrylic resin in order to keep the tooth crown above of the slab cover. A glass cylinder (5 mm of diameter and 1,5 cm of height) was fixed around the root apex was fixed. The direct contact test was realized by papers disks were soaked with PMCC (3 µL) that put directly in contact with the agar. For the steam test, we put a paper point into canal root soaked with PMCC (3µL) that remained per 24 hours. The results showed that the PMCC was effective against micoorganisms when in direct contact with them, with zones of bacterial inhibition. Regarding the release of vapor by PMCC into de canal root, there was no any reaction, because there was bacterial growth.
Key word: Root canal therapy, Enterococcus faecalis, Staphylococcus aureus,, in vitro.
INTRODUÇÃO
O sucesso no tratamento endodontico depende do processo de limpeza do sistema de canais radiculares.Bactérias e seus sub-produtos são considerados as maiores causas das patologias pulpares e perirradiculares (Kakehashi et al., 1965). Até meados da década de 70, grande parte dos estudos microbiológicos destas infecções indicava o predomínio de bactérias aeróbias e facultativas. Contudo, Sundqvist (1976) observou que 94,3% das bactérias isoladas destes canais infectados eram anaeróbias estritas.
Schilder (1974) cita que o melhor e mais seguro método utilizado para descontaminar o sistema de canais radiculares é a criteriosa limpeza do conteúdo séptico necrótico. Muitas vezes, uma infecção persistente do canal radicular é resultado do preparo biomecânico e da medicação intracanal inadequados. Sabe-se que a ação mecânica e física da instrumentação e da irrigação são suficientes para eliminar uma quantidade substancial de germes e tecido degenerado do interior dos canais (Bystrom, Sundqvist, 1981). Entretanto, a eliminação total de bactérias não é observada na maioria dos casos, uma vez que existem locais inacessíveis tanto à instrumentação quanto ao irrigante.
Microrganismos Gram-positivos anaeróbios estritos ou facultativos, como o Enterococcus faecalis, tem maior influência sobre o prognóstico da terapia endodôntica, apesar de bacilos Gram-negativos anaeróbios estritos exercerem um papel relevante na ocorrência de sintomatologia clínica (Haapasalo,1993). A maioria das infecções endodônticas é de origem mista e polimicrobiana, com predomínio da bactérias anaeróbias estritas, sendo que, destas, as mais isoladas são os bacilos gram negativos (Siqueira et al.,1996).
Tanomaru Filho et al. (2002) atribuem às bactérias um papel decisivo no desenvolvimento das lesões periapicais crônicas. Embora a expressiva redução de microrganismos tenha sido observada após a conclusão da limpeza e modelagem, estudos relataram que o emprego da medicação intracanal favorece o processo de reparo tecidual após o tratamento de dentes despolpados (Holland et al., 1979; Bystrom, Sundqvist, 1981; Bystrom et al., 1987; Assed, 1993; Sydney, Estrela, 1996, Lopes, Siqueira, 1999).
Há diferentes situações na clínica endodôntica em que está indicada a utilização de uma medicação intracanal, tais como: na manutenção do saneamento conquistado durante o preparo do canal radicular em dentes com polpa vital e o controle microbiano em dentes com necrose pulpar (Soares, Goldberg, 2001).
Dentre as várias substâncias com esta finalidade, os compostos fenólicos (eugenol, fenol canforado e paramonoclorofenol combinado), os aldeídicos (tricresol formalina e glutaraldeído), além do hidróxido de cálcio e antibióticos são os mais indicados.
A combinação do PMC com outras substâncias ou a sua diluição têm sido propostas com o objetivo de potencializar a atividade antimicrobiana e reduzir a citotoxicidade do medicamento. A literatura revela que o PMC pode ser associado à cânfora, ao Furacin ou diluído em água.
A partir da combinação do PMC com a cânfora, em partes variáveis, forma-se uma mistura líquida denominada paramonoclorofenol canforado (PMCC). A cânfora reduz o poder cáustico do PMC puro e a mistura é tanto menos irritante quanto mais cânfora contiver. Esta associação, além de funcionar como um veículo, propicia um aumento do poder germicida, e reduz também seu potencial de irritação (Leonardo, 1991). O PMCC apresenta baixa tensão superficial e atua por capilaridade, agindo à distância no sistema de canais (Milano et al., 1983). Porém, alguns estudos demostraram que o PMCC pode perder a sua eficácia antibacteriana após 24-48 horas devido a sua volatilidade (Messer, Chen, 1984; Koontongkaew et al., 1988).
Segundo Lopes, Siqueira (1999) este produto desempenha sua atividade antimicrobiana pelo contato direto do líquido com os microrganismos, ou pela ação dos vapores liberados. A proporção mais empregada é a recomendada por Sommer et al. (1966), que utiliza três partes de PMC para sete de cânfora. Segundo autores, esta associação é bactericida e praticamente perde suas propriedades irritantes, sob condições de uso clínico. Comercialmente, o PMC está associado à cânfora na proporção 3,5:6,5 (SS White Brasil).
A partir dessas consideracoes, este estudo tem como objetivo investigar a atividade antimicrobiana do Paramonoclorofenol Canforado (PMCC), por contato direto e por vapor contra Enterococcus faecalis e Staphylococcus aureus.
METODOLOGIA
Este trabalho foi submetido e aprovado pelo Comite de Etica local antes da sua realizacao.
Utilizaram-se 10 dentes humanos extraidos (caninos superiores e inferiores e pré-molares superiores e inferiores). A abertura coronaria foi realizada em todas as amostras foi feita por meio de ponta diamantada esférica nº1014 (Fava) e brocas nº2 e nº4 esféricas carbide de haste média (Dentsply – Maillefer). O preparo cervical foi realizado com brocas largo I e II (Moyco Union Broach).
Preparo das amostras:
O dente foi envolto em gaze e fixado a uma morsa para realizacao do preparo quimico-mecanico. A medida do CRT (comprimento real de trabalho) foi estabalecido quando a lima tipo K#10 estava justaposta ao forame apical, recuando-se 1 mm. A instrumentacao do canal foi feita com limas manuais de aco-inoxidavel pela tecnica coroa-apice. O batente apical foi realizado com a lima #40. A irrigacao foi feita com hipoclorito de sodio a cada troca de instrumento. Realizou-se toalete final com EDTA 17%. Finalmente, realizou-se desbridamento foraminal com lima #25.
Cada amostra foi fixada com resina acrílica auto-polimerizável no centro de da tampa de placa de Petry, que havia sido previamente perfurada, permanecendo a coroa dental para cima da tampa da placa e a raiz para baixo. Na raiz foi fixado um cilindro de vidro (altura de 1,5 cm e diâmetro de 5 mm). O cilindro permitia que a raiz dentaria ficasse aproximadamente a 2 mm do meio de cultura, na base da placa.
Preparo e distribuicão dos meios:
Para o caldo nutriente, pesou-se 37g de Caldo BHI (Brain Heart Infusion Broth – Acumedia) em balança semi-analítica (Digimed 5000 C) e dissolveu-se em 1000ml de água destilada. Distribuiu-se este volume em tubos de ensaio tampa rosca – 9ml por tubo – e esterilizou-se em autoclave (FABBE – Modelo 103) a 121ºC durante 15 minutos. Para o ágar, pesou-se 37g de Caldo BHI, acrescido de 15g de Ágar Bacteriológico (Micro Med-Ref.: 2126) - o equivalente a 1,5% do volume total - e dissolveu-se em 1000ml de água destilada e acondicionou-se em frasco âmbar 500mL boca larga tampa rosca, os quais foram autoclavados a 121ºC durante 15 minutos. Após, distribuiu-se o meio em placas de Petry de vidro (90mm). Utilizando-se uma pipeta graduada, foram vertidos 20ml do meio em cada placa, promovendo-se uma espessura de 4 mm de ágar.
Cultivo e preparo das cepas:
Foram utilizadas culturas puras de Enterococcus faecalis – ATCC (c7030L) e Staphylococcus aureus – ATCC (c 6512) obtidas do Instituto Nacional Oswaldo Cruz- Fiocruz. As bactérias foram suspensas em 9ml de BHI líquido estéril e levadas à estufa bacteriológica (Biomatic) a 37ºC por 24 horas. Após, os tubos com crescimento bacteriano foram ajustados conforme o tubo nº1 da escala Mc Farland, que equivale a concentração de 3 X 108 células por mL. A seguir, foram realizadas quatro diluições, transferindo-se 1mL da suspensão bacteriana de um tubo para o outro, através de uma micropipeta (Acid, Ind. Brasileira), obtendo-se assim uma diluição de 1:30000 a partir do tubo nº1 da escala Mc Farland. A cada diluição os tubos eram flambados ao fogo e agitados.
Concentração inibitoria Minima (CIM):
Os microrganismos E.faecalis e S.aureus foram cultivados em meio de cultura BHI e incubados à temperatura de 37ºC por 24 horas. Após, com o auxilio de uma alça de platina, coletou-se material dessas placas e estas células microbianas foram suspensas em solução fisiológica (Ind. Farmacêutica Texon) esterilizada. Para os dois microrganismos, a suspensão foi ajustada ao tubo nº1 da escala Mc Farland, na concentração aproximada de 3 X 108 células por mL.
Para se determinar a CIM (Concentração Inibitória Mínima) foram realizadas diluições do agente anitimicrobiano com o uso de uma micropipeta de volume variável (HC High tech lab/ 0,1-2µL) nos tubos contendo caldo BHI contaminado com o microrganismo. As diluições variaram de 0,3 a 3µL de produto. Na sequência, os tubos de ensaio foram incubados a 37ºC por 48 horas. Após o período de incubação, o material foi analisado macroscopicamente, quanto à presença ou ausência de turvação, indicativa ou não da multiplicação de microrganismos. Empregou-se também, dois grupos controles, um negativo e um positivo. No controle negativo avaliou-se a qualidade e esterilidade do meio, enquanto no positivo avaliou-se a viabilidade das cepas utilizadas no experimento.
Inoculação das placas:
Utilizando-se uma micropipeta com ponteiras estéreis e descartáveis, procedeu-se à inoculação das placas com os respectivos microrganismos. Foi dispensado um inóculo de 100µL (0,1ml) de suspensão microbiana diluída (1:30000), que foi semeada imediatamente sobre a superfície do meio, com o auxílio de uma alça de Drigalski. Esta técnica foi utilizada para cada microrganismo e repetida três vezes com cada um deles, utilizando-se uma nova placa estéril para cada microrganismo.
Teste por contato direto:
Para o teste por contato direto confeccionou-se discos de papel filtro com o uso de furador de folha ofício. Logo após, estes discos foram esterilizados em autoclave, e em seguida, impregnados com 3µL do agente antimicrobiano (PMCC, SS Wkite Brasil, Lote 00m, Validade 09/OUT 2008) dentro de um copo de Becker estιril, através da pipeta de volume variável, seguros por uma pinça. A seguir, foram colocados sobre a superfície do ágar inoculado, pressionando-se levemente.
Teste por vapor:
Para a aplicação do medicamento nos canais radiculares, utilizaram-se cones de papel absorvente #40 (Dentsply) estéreis também embebidos em 3µL do produto (figura 4). Os cones foram levados ao interior do canal radicular através de uma pinça estéri, deixando-se este cone no interior de cada canal, com a medida 1 a 2 mm aquém do CRT de cada um deles. Posteriormente, a câmara pulpar foi selada com bolinha de algodão autoclavada e material restaurador temporário (Cavit-3M), cuidando para que tivesse 4 mm de material desde o cavo superficial da cavidade preparada.
Processo de pré-incubação e incubação:
Estas placas ficaram pré-incubadas à temperatura ambiente por 1 a 2 horas, com a finalidade de permitir a difusão das substâncias antes do desenvolvimento microbiano. Após pré-incubação, as placas foram levadas à estufa bacteriológica a uma temperatura de 37ºC por 24 horas.
Avaliação das placas:
A avaliação das placas foi realizada após o período de incubação e os resultados analisados para posterior apresentação em quadros.
RESULTADOS
O Quadro 1 apresenta as medidas dos halos de inibição do crescimento bacteriano por contato direto para o Enterococcus faecalis, evidenciando a medida obtida em cada uma das placas, bem como a ausência de turvação. O PMCC formou halos de inibição por contato direto em todas as placas e não houve formação de halo nos ápices radiculares quando o fármaco atuou por vapor.
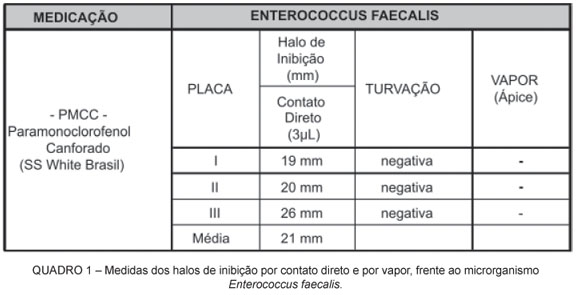
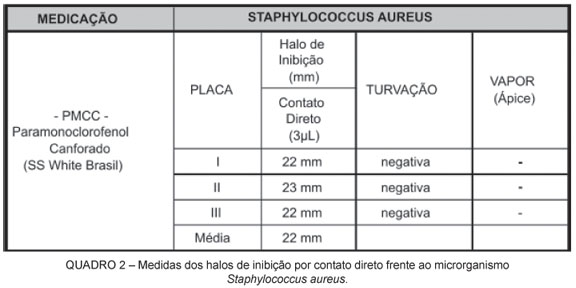
O Quadro 2 apresenta as medidas dos halos de inibição do crescimento bacteriano por contato direto para a bactéria Staphylococcus aureus.
DISCUSSÃO
Existem três técnicas que podem ser utilizadas para avaliar in vitro a capacidade antimicrobiana de fármacos utilizados em Odontologia: o teste de difusão em ágar, o de diluição em caldo e o de exposição direta.
Este trabalho utilizou o metodo de difusão em ágar, por constituir-se de um método simples, prático e eficiente, e que permite a observação de zonas de inibição e crescimento microbiano adjacentes aos discos que contêm o agente a ser testado. Entretanto, cabe ressaltar que o diâmetro deste halo não expressa obrigatoriamente uma inibição, mas também a difusão deste agente, necessitando portanto, ser executada uma contraprova para que se possa avaliar qual o tipo de halo tem-se presente (Estrela et al., 2005). Esta contraprova é realizada através da coleta de material do halo com o auxílio de uma alça de platina. Este material é levado ao caldo BHI, que vai para a estufa por 24 horas, para posterior análise macroscópica da turvação. Se não há turvação, significa que não houve multiplicação bacteriana e que o produro foi efetivo. Quando o halo é de difusão, tem-se a presença de microrganismos, uma vez que somente a difusão do produto não é suficiente para inibir tal crescimento. É importante ressaltar que quando há a formação de halo de inibição, obrigatoriamente houve a difusão do produto. Entretanto, a recíproca não é verdadeira, pois pode ocorrer a difusão do fármaco, sem que ele promova a inibição do crescimento microbiano.
Nos resultados encontrados, o halo ao redor dos discos de papel filtro foi de inibição, pois após a realização da contraprova, observou-se a ausência de turvação do caldo BHI, caracterizando a não multiplicação de microrganismos.
Em relacao à quantidade de microrganismos inoculados à placa, a metodologia adotada sugere que se tenha como referência o tubo nº1 da escala Mc Farland que corresponde a 3 x 108 cels por mL. No entanto esta quantidade é muitas vezes maior do que a que se tem no canal radicular quando da presença de infecções endodônticas. Assim sendo, achou-se necessário executar diluições seriadas até obter-se o valor de 1:30000 a partir do tubo inicial nº1, conforme trabalho de Stedile, Polesso (2005). Com esta diluição objetivou-se uma quantidade de microrganismos mais próxima da realidade, viabilizando a pesquisa e assim gerando resultados mais condizentes com a realidade clínica. A quantidade de microrganismos a serem inoculados à placa deveria ser de 30000 céls por ml, assim, se estabeleceu uma relação direta entre o tamanho das bactérias e o tamanho de uma lesão periapical normal. As bacterias utilizadas bactérias medem cerca de 0,5 a 1 micrômetro. Se uma lesão periapical mede, aproximadamente, 3mm, isto implica na presença de, provavelmente, 30000 bactérias. Desta forma, foi estabelecida a utilização da diluição de 1:30000 para o experimento.
Para mimetizar o espaço periapical, utilizou-se um cilindro de vidro que envolvia a raiz dental e que penetrava na placa de Petry, cujo objetivo era de limitar a área de atuação do fármaco PMCC. Estudos anteriores comprovaram que o compartimento total da placa de Petry e muito grande para que a evaporação do medicamento seja eficaz contra os germes ali presentes. Ainda, as placas foram pré-incubadas à temperatura ambiente por 1 a 2 horas, pois como cita Milano et al. (1983), este fármaco possui uma baixa tensão superficial, e deve, então permitir sua difusão no ágar antes do desenvolvimento microbiano.
Com o intuito de determinar a quantidade suficiente de PMCC para inibir o crescimento bacteriano, este estudo contemplou a determinação da CIM (Concentração Inibitória Mínima), que se constitui de um teste de difusão em caldo, em que se consegue descobrir a partir de qual a quantidade de produto já se tem a inibição da multiplicação microbiana. Deste modo, observou-se que a partir de 0,3 µL se faz presente o poder bacteriostático do fármaco. Porém, esta quantidade é muito pequena, sendo clinicamente inviável tê-la como protocolo de utilização do PMCC. Assim, de forma a buscar uma quantidade mais próxima da utilizada na clínica, o teste foi realizado com 3 µL do PMCC, tanto no cone de papel absorvente, quanto nos discos de filtros colocados sobre a superficie do meio de cultura. Para que se chegasse a esta quantidade de produto, o cone de papel absorvente foi inicialmente pesado sem o produto, após embebido no PMCC cujo excesso foi removido e então, novamente levado à balança analítica, o volume de produto ali fixado foi determinado pela diferença de peso detectada.
Deste modo, o grande questionamento do trabalho passa a ser então quanto a técnica utilizada para a execução do teste da atividade antimicrobiana do PMCC por vapor. Já tendo sido determinada a quantidade suficiente do produto para inibir a multiplicação microbiana a ser colocada no interior do canal radicular, existe a possibilidade de que a falta de um resultado positivo esteja então, relacionada à sua liberação intracanal.
Dos resultados obtidos, segundo os quadros 1 e 2, verificou-se que houve atuação do PMCC por contato direto aos dois microrganismos testados, corroborando com trabalhos de Siqueira et al. (1996) e Lopes, Siqueira (1999). Tal fato foi confirmado pela contraprova em caldo de BHI, onde não houve turvação. De outra forma a sua atuação por vapor, como advogam Siqueira, Lopes (1999), e Lopes, Siqueira (1999), não foi constatada neste estudo. Percebeu-se a ausência de halo sobre o ágar, chegando ao extremo de haver crescimento microbiano em torno do forame apical, vindo ao encontro dos achados de Ellerbruch, Murphy (1977).
Estudos in vitro sao importantes pois tem a capacidade de gerar novas hipoteses de pesquisa. Perspectivas de novos estudos com metodologia semelhante sao esperados, como por exemplo, com a utilizacao de diferentes microrganismos.
CONCLUSÕES
Baseado na metodologia aplicada e nos resultados obtidos por este estudo concluiu-se que:
- O PMCC apresentou atividade antimicrobiana contra o Enterococcus faecalis e Staphylococcus aureus,por contato direto
- O PMCC não apresentou efetividade contra o Enterococcus faecalis e Staphylococcus aureus, por vapor, liberado através do forame apical.
REFERÊNCIAS
Assed, S. Prevalência de microrganismos em canais radiculares de dentes humanos com reação periapical crônica. Efeito do preparo biomecânico e do curativo de demora. Imunofluorescência indireta e cultura. Ribeirão Preto, 1993. 110 p. Tese (Livre-Docência) - Faculdade de Odontologia de Ribeirão Preto-São Paulo.
Bystrom A, Happonen RP, Sjogren U, Sundqvist G. Healing of periapical lesions of pulpless teeth after endodontic treatment with controlled asepsis. Endod Dent Traumatol. 1987 Apr;3(2):58-63. [ Links ]
Byström A, Sundqvist G. Bacteriologic evaluation of the efficacy of mechanical root canal instrumentation in endodontic therapy. Scand J Dent Res. 1981 Aug;89(4):321-8. [ Links ]
Ellerbruch ES, Murphy RA. Antimicrobial activity of root canal medicament vapors. J Endod. 1977 May;3(5):189-93. [ Links ]
Estrela C, Pimenta FC.;Estrela CRA. Testes microbiológicos aplicados à pesquisa odontológica. In:____.Estrela C. Metodologia científica-ensino e pesquisa em odontologia. São Paulo: Artes Médicas, 2005. p.196-221. [ Links ]
Haapasalo M. Black-pigmented gram-negative anaerobes in endodontic infections. FEMS Immunol Med Microbiol. 1993 Mar;6(2-3):213-7. [ Links ]
Holland R, Souza V, Mello W, Nery MJ, Bernabe PFE, Otoboni-Filho JA.Healing process of dog's dental pulp after pulptomy and protection with calcium hydroxide. Rev. Odont. Unesp 1979; 8(9):63-7. [ Links ]
Kakehashi S, Stanley HR, Fitzgerald RJ. The effect of surgical exposures of dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral Med Oral Pathol. 1965 Sep;20:340-9. [ Links ]
Koontongkaew S, Silapichit R, Thaweboon B. Clinical and laboratory assessments of camphorated monochlorophenol in endodontic therapy. Oral Surg Oral Med Oral Pathol. 1988 Jun;65(6):757-62. [ Links ]
Leonardo MRL. Endodontia. Tratamento dos canais radiculares. 2ºed. São Paulo: Panamericana,1991. [ Links ]
Lopes HP, Siqueira jr. FJ. Medicação Intracanal. In:_____.Endodontia: Biologia e Técnica. 2ºed. Rio de Janeiro:Guanabara Koogan S.A, 1999. p.397-426. [ Links ]
Messer HH, Chen RS. The duration of effectiveness of root canal medicaments. J Endod. 1984 Jun;10(6):240-5. [ Links ]
Milano NF, Kolling IG, Facchin EF. Tensão superficial de alguns auxiliares químicos usados em Endodontia. RBO 1983; 31(1):37-8. [ Links ]
Schilder H. Cleaning and shaping the root canal. Dent Clin North Am. 1974 Apr;18(2):269-96. [ Links ]
Siqueira Jr. JF, Lopes HP. Estudo comparativo da atividade antimicrobiana de medicamentos intracanais através do contato direto e à distância. UFES Rev Odontol. 1999; 1(1):60-4 [ Links ]
Siqueira Jr. JF, Lopes HP, Uzeda M. Atividade antibacteriana de medicamentos endodônticos sobre bactérias anaeróbias estritas. Rev APCD. 1996; 50(4):326-331. [ Links ]
Soares I, Goldberg F. Procedimentos Químicos Auxiliares do Preparo Mecânico. In:____.Endodontia Técnica e Fundamentos.Porto Alegre:Artes Médicas Sul. 2001. 155-169 p. [ Links ]
Somer RF. et al. Clinical Endodontics.3ºed.Phyladelphia Saunders,1966. [ Links ]
Stedile E, Polesso K. Avaliação in vitro da atividade do Tricresol Formalina por contato direto e pro volatilização frente ao Enterococcus faecalis e ao Bacillus subitilis. Canoas, 2005.Monografia (Especialização) – Faculdade de Odontologia, Universidade Luterana do Brasil. [ Links ]
Sundqvist G. Bacteriological studies of necrotic dental pulps. Umea, 1976. 94p. Dissertation (Master) - University of Umeo, Sweden. [ Links ]
Sydney,G.B.;Estrela,C. The influence of root canal preparation on anaerobic bacteria in teeth with asymptomatic apical periodontitis. Braz. Endod. J 1996; 1(1):12-5. [ Links ]
Tanomaru Filho M, Leonardo MR, da Silva LA. Effect of irrigating solution and calcium hydroxide root canal dressing on the repair of apical and periapical tissues of teeth with periapical lesion. J Endod. 2002 Apr;28(4):295-9. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Alexandre Azevedo Salles
Av. Farroupilha, 8001. Prédio 22 – 4º andar
Bairro São José. Canoas/RS. CEP: 92425-900
Email: endosalles@gmail.com













