Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Stomatos
versão impressa ISSN 1519-4442
Stomatos vol.23 no.44 Canoas Jan./Jun. 2017
Contaminação de cones de papel absorvente e cones de guta percha utilizados em endodontia: avaliação "in vitro"
Contamination of absorbent of paper points and gutta percha points used in endodontics: Assessment "in vitro"
Amanda Pimienta da Silva I; Aline Lima dos Anjos II; Maria Perpétua Mota Freitas III
I Graduanda, Curso de Odontologia, Universidade Luterana do Brasil, Canoas/RS
II Mestranda em Microbiologia, Universidade Luterana do Brasil, Canoas/RS
III Professora Adjunta, Departamento de Ortodontia, Universidade Luterana do Brasil, Canoas-RS
RESUMO
O tratamento endodôntico tem como objetivo promover a desinfecção do canal radicular. Para isso, instrumentos e materiais devem estar livres de microrganismos, visto que poderão contribuir para a instalação e/ou persistência de lesões perirradiculares após o fechamento do canal. Apesar dos cones de papel e de guta-percha serem produzidos em condições assépticas, eles podem ser contaminados por fatores como aerossóis e/ou aspectos físicos durante sua armazenagem, bem como pelo manuseio, mesmo quando removidos cuidadosamente de suas embalagens. Neste contexto, o objetivo deste estudo foi avaliar a presença de contaminação microbiana de três marcas comerciais tanto de cones de papel absorvente consideradas estéreis, quanto de cones de guta-percha, em embalagens não estéreis, conforme disponibilizadas pelo fabricante, bem como após a colocação para uso clínico. Metodologia: Foram avaliados 120 cones, sendo 60 de papel absorvente e 60 de guta percha, ambos das marcas Dentsply Maillefer® sistema Protaper universal (Ballaigues, Suisse), VDW GmbH® sistema Mtwo (Bayerwaldstr, Munich, Alemanha) e Meta Biomed® (Cheongju-si, Chungbuk, Korea), divididos em doze grupos (n=10, cada). Para avaliação microbiológica, esses materiais foram submetidos a testes para detecção do crescimento bacteriano, determinado através do turvamento do meio de cultura. Resultados: Os dados mostraram que nenhuma das marcas, conforme disponibilizadas pelo fabricante, apresentou turvamento nas embalagens estéreis ou não estéreis, sugerindo ausência de crescimento bacteriano. Já para as embalagens após colocação para uso clínico, os cones de guta percha da marca Meta Biomed® mostraram-se contaminados. Pode-se concluir que as embalagens conforme disponibilizadas pelos fabricantes, tanto para cones de papel quanto gutapercha, mostraram-se isentas de contaminação e, portanto, confiáveis, diferente das embalagens abertas e colocadas para uso clínico, justificando a utilização de uma rotina de descontaminação desses cones antes da sua utilização clínica.
Palavras-chave: Endodontia; esterilização; cones; contaminação; biossegurança. Amanda.
ABSTRACT
The endodontic treatment has as goals to seek the disinfection of the root canal. For this, endodontic instruments and materials must be free from microorganisms, since that they may contribute to the installation and or persistence of apical periodontitis after closing the canal. Although paper points and gutta percha are produced under aseptic conditions, they may be contaminated by such factors as aerosol and or physical aspects during storage as well as for handling, even when carefully removed from their packaging. In this context, the aim of this study was to evaluate the presence of microbial contamination of three commercial brands being the absorbent paper cones considered sterile and gutta-percha cones in non-sterile packaging, as provided by the manufacturer, and after placement to clinical use. Methodology: 120 cones were evaluated, 60 of absorbent paper and 60 gutta percha, both of the brands Dentsply Maillefer® sistema Protaper universal (Ballaigues, Suisse), VDW GmbH® sistema Mtwo (Bayerwaldstr, Munich, Alemanha) and Meta Biomed® (Cheongju-si, Chungbuk, Korea), divided into twelve groups (n = 10, each). For microbiological evaluation, these materials were subjected to testing for bacterial growth, as determined by the turbidity of the culture medium. Results: The results showed that none of the marks showed turbidity in sterilized and sealed packages, suggesting the absence of bacterial growth. However, after placement for clinical use, the gutta percha brand Meta Biomed® proved to be contaminated. Conclusion: It can be concluded that packaging as provided by the manufacturers for paper and gutta-percha cones showed no microbial contamination, being reliable, unlike to the opened packagings, justifying the use of a decontamination routine these cones prior to clinical use.
Keywords: Endodontics; sterilization; cones; contamination; biosafety.
INTRODUÇÃO
O sucesso no tratamento das patologias de origem endodôntica se dá pelo controle da infecção microbiana no sistema de canais radiculares. A deficiência na eliminação ou diminuição da carga microbiana, quer no preparo químico e mecânico, na medicação intracanal ou após a obturação, assim como, a falta de um rígido protocolo de assepsia ou selamento coronário inadequado, estão entre os fatores que convergem para o fracasso do tratamento1.
As principais metas do tratamento endodôntico são a remoção de todo tecido necrosado e vital, bem como dos microorganismos do sistema de canais radiculares e obturar o canal visando evitar o crescimento microbiano2. Neste contexto, os materiais de secagem e de enchimento também devem estar livres de microorganismos, a fim de evitar a persistência e recontaminação do canal.
O acesso de microrganismos ao interior do sistema de canais radiculares inicia-se, comumente, através de processo da cárie, trauma ou procedimentos iatrogênicos3. Estudos relatam que, quando o tratamento endodôntico é realizado sob condições de assepsia, e de acordo com princípios clínicos, a taxa de sucesso é geralmente elevada4. Eliminar ou reduzir a carga microbiana, assim como prevenir a introdução de novos microrganismos nos canais radiculares, ou mesmo impedir a reinfecção por microrganismos da saliva, são os objetivos a serem alcançados pelo tratamento endodôntico4 .
Após o protocolo de desinfecção (preparo químico mecânico seguido ou não de medicação intracanal), a condição de desinfecção será mantida pela obturação e, nessa etapa, a umidade no interior do sistema de canais radiculares pode atuar como fator limitante ao perfeito selamento marginal da obturação5 . Para tentar solucionar este problema, vários métodos de secagem dos canais radiculares têm sido relatados: álcool, cânulas de aspiração associadas a papel absorvente, e cones de papel absorvente.
Dentre estes, o uso de cones de papel absorvente é o mais comum para esta finalidade, sendo também aplicado para coleta de amostras, para cultivo microbiano e introdução de medicamentos intracanais. O papel absorvente na forma de cone é o último material a ser inserido nos canais antes da obturação dos canais radiculares5.
Com relação à obturação, seu objetivo é conseguir um perfeito selamento do canal radicular, de modo a impedir o acesso das bactérias remanescentes aos tecidos perirradiculares, removendo espaços que contribuem para o contínuo crescimento microbiano. O preenchimento radicular visa, também, sepultar as bactérias que resistiram aos procedimentos da terapêutica endodôntica e ainda permaneceram nas paredes do canal ou nos túbulos dentinários, uma vez que podem sustentar a inflamação perirradicular impedindo o início do processo de reparação3.
Os cones de guta percha possuem alguma atividade antimicrobiana devido ao seu componente óxido de zinco6,7. Apesar desta atividade antimicrobiana, alguns estudos mostraram que cones de guta perchas retirados de suas embalagens seladas rendem o crescimento bacteriano, quando cultivadas em placas de Agar8.
Frente à vasta aplicabilidade dos cones de papel absorvente e de guta percha em Endodontia e à importância de mantê-los livre de contaminação para o sucesso da terapia pulpar, o objetivo deste estudo foi avaliar a presença de contaminação desses materiais nas embalagens disponíveis pelos fabricantes, bem como após abertas e colocadas para uso clínico, comparando diferentes marcas comerciais.
MATERIAL E MÉTODO
Este trabalho caracterizou-se como pesquisa experimental, observacional, sendo os testes realizados no Laboratório de Microbiologia e Biologia Molecular da ULBRA, Campus Canoas – RS.
Amostra
A amostra foi composta por 120 cones, sendo 60 de papel absorvente e 60 de guta percha, ambos das marcas Dentsply Maillefer® sistema Protaper universal (Ballaigues Suisse), VDW GmbH® sistema Mtwo (Bayerwaldstr, Munich, Alemanha) e Meta Biomed® (Cheongju-si, Chungbuk, Korea), divididos em doze grupos (n=10, cada), utilizados diretamente das embalagens estéreis ou não, disponibilizadas pelos fabricantes, bem como de embalagens após abertas e colocadas para uso clínico (Tabela 1).
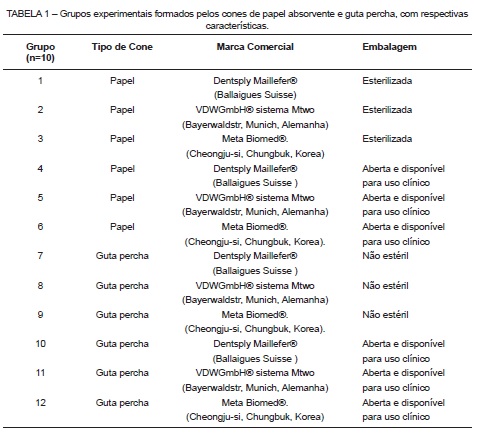
Para comprovação da esterilidade do meio Brain Heart Infusion® (BHI) (Himedia, Mumbai, Índia) a ser utilizado e efeitos de comparação, foram criados os Grupos Controle Negativo, contendo apenas o meio, visando constatar a ausência de crescimento bacteriano; bem como os Grupos Controle Positivo, onde foram colocados cones contaminados com Staphylococcus aureus, visando constatar crescimento bacteriano máximo.
Testes microbiológicos
Para a realização da análise microbiológica, foram preparados 240ml do meio BHI distribuídos em 120 tubos de ensaio (4 ml/ tubo), sendo 10 tubos para cada grupo estudado. Para cada litro de água destilada se utilizou 37g do pó BHI.
Os 120 tubos de ensaio, contendo o meio BHI, foram esterilizados em autoclave à temperatura de 121° C e 1 Atm, durante 15 minutos. A partir de então, os cones foram distribuídos nos tubos de ensaio e, então, armazenados em estufa à 37° C por 48 horas. Após este período, para análise do crescimento bacteriano, foi avaliado o turvamento do meio presente nos tubos. Dessa forma, nos tubos onde o meio BHI mostrou aspecto turvo, foi confirmada a presença do crescimento de bactérias.
RESULTADOS
Os resultados dos testes microbiológicos demonstraram que todas as amostras componentes dos Grupos Controle Negativo não exibiram turvamento do meio BHI, indicando ausência de crescimento bacteriano, assim como, de forma contrária, os componentes dos Grupo Controle Positivo demonstraram turvamento, sugerindo positividade de crescimento. Estes dados comprovaram a efetividade do método. Sobre as amostras avaliadas, pôde-se observar que todos os cones removidos das embalagens, conforme disponibilizadas pelos fabricantes, de todas as marcas, não predispuseram crescimento bacteriano, mostrando-se, portanto, livres de contaminação.
O mesmo aconteceu para a maioria das embalagens abertas e disponíveis para uso clínico, exceto para os cones de guta percha da marca Meta Biomed® (Cheongju-si, Chungbuk, Korea), cuja apresentou turvamento do meio BHI EM 100% das amostras, indicando crescimento bacteriano.
DISCUSSÃO
Partindo do pressuposto de que o tratamento do canal radicular tem como uma das suas principais metas evitar a contaminação ou buscar a desinfecção do ambiente endodôntico, procedimentos técnicos devem ser utilizados para controlar e manter a cadeia asséptica durante todo o tratamento, principalmente na fase de secagem e obturação do canal radicular. Com base nisso, diversos estudos na literatura têm testado a esterilidade das pontas de papel e guta percha, entretanto existe certa controvérsia de resultados ou escassez de estudos sobre embalagens ou marcas recentemente lançadas no mercado.
Neste estudo, das 120 amostras avaliadas, pode-se observar que todos os cones removidos das embalagens, conforme disponibilizadas pelos fabricantes, de todas as marcas, não predispuseram crescimento bacteriano, mostrando-se, portanto, livres de contaminação e confiáveis para uso clínico.
Esses achados corroboram com aqueles de Orstavick, Möller (1985)9 que comprovaram a esterilidade das pontas de papel absorvente das marcas Absorbent Points Sterile® (Johnson & Johnson, USA), Papperspetsar® (Johnson & Johnson, Suécia), Absorbent Paper Points Sterilized® (A\S Norsk Dental Depot, Noruega) e Absorbent Paper Points® (Produits Dentaire S.A., Suíça), bem como estão de acordo com os resultados de Doolittle et al. (1975)10, que não encontraram contaminação nos cones de guta percha, ambos em estudos sobre embalagens conforme disponibilizadas pelos fabricantes.
Sobre as embalagens abertas e colocadas para uso clínico, neste estudo, a maioria mostrou-se livre de contaminação, exceto para os cones de guta percha da marca Meta Biomed® (Cheongju-si, Chungbuk, Korea), cuja apresentou turvamento do meio BHI, indicando crescimento bacteriano. Esses resultados estão de acordo com os de Leonardo et al. (1997)11, que apesar de também constatar ausência de atividade microbiana em cones de guta perchas das marcas Kerr® e Sybron®, recomendaram a desinfecção destes antes do uso clínico, visto que, de acordo com os autores, em seus testes, houve crescimento microbiano nos cones das marcas Dia Dent ® e Tanari®.
Compatilhando do mesmo pensamento, os autores Frank, Pelleu (1983)12 afirmaram que, apesar dos cones de guta-percha serem produzidos em condições assépticas, eles podem ser contaminados por aerossóis e aspectos físicos durante sua armazenagem. Acrescentaram que, também, podem ser contaminados durante o manuseio, mesmo quando removidos cuidadosamente de suas embalagens.
Baseados nisso, muitos autores na literatura têm argumentado que a prevenção da contaminação torna-se um problema quando usamos os cones de guta percha para obturar o espaço do canal radicular, sem que seja feita desinfecção prévia. No entanto, uma vez que a guta percha não pode ser exposta a esterilização por calor, outros métodos vem sendo estudados, desencadeando uma série de estudos com diferentes agentes químicos.
Moorer, Genet (1982)6 questionaram a necessidade de descontaminação dos cones de guta-percha antes de seu uso clínico. De acordo com os autores, foi observada uma redução no número de bactérias após colocação dos cones de guta percha em suspensões bacterianas. Concluíram que esses cones possuem propriedades antibacterianas e que diversas espécies de microrganismos poderiam ser inibidas na presença destes.
Como proposta para o controle de crescimento bacteriano, tem-se recomendado a desinfecção química12,13. Para tanto, várias soluções têm sido propostas como o Hipoclorito de Sódio 2,5% e o glutaraldeído 6%, sendo os mais utilizados, ou ainda a clorexidina 2%, álcool etílico 3%, álcool isopropílico ou peróxido de hidrogênio 3%14. O tempo para que essas substâncias destruam os microorganismos varia de poucos segundos a períodos de tempo substanciais15.
Outra opção seria por irradiação gama ou por irradiação com feixes de elétrons12,13, mas, isso poderia ocasionar alterações nas propriedades físicas e químicas desses materiais.
Diante do exposto, faz-se importante salientar que apesar de apenas uma das marcas apresentarem contaminação, faz-se justificável a aplicação de uma rotina de descontaminação dos cones de guta percha obtidos de embalagens já abertas, antes da sua utilização, ou melhor, idealmente seria requerer a criação de embalagens individuais junto aos fabricantes, evitando assim o risco de contaminação pelo manuseio ou outros fatores, garantindo a segurança do paciente.
CONCLUSÕES
Com base nos resultados obtidos, pôde-se concluir que as embalagens conforme disponibilizadas pelos fabricantes, tanto para cones de papel, quanto guta-percha, não apresentaram contaminação microbiana, mostrando-se confiáveis. Entretanto, após abertas e colocadas para uso clínico, as amostras da marca Meta Biomed® (Cheongju-si, Chungbuk, Korea) mostraram-se contaminadas, justificando a utilização de uma rotina de descontaminação desses cones antes da sua utilização clínica.
REFERÊNCIAS
1. Siqueira Junior JF, Rôças IN, Bacterial Pathogenesis and Mediators in Apical Periodontitis. Braz. Dent. J. 2007; 18(4): 267-80. [ Links ]
2. Spangberg LSW. Tratamento Endodôntico de dentes sem periodontite Apical. In: Orstavik D, Pitt Ford TR, editores. Endodontia Essencial. Wiltshire: Blackwell Science; 2001, 211-36p.
3. Siqueira Junior, Rôças IN. Update on endodontic microbiology: candidate pathogens and patterns of colonisation. Endo, 2008;2(1):7-20.
4. Xavier SR, Revista Uningá. Review, 2014; 18(2): 28-32.
5. Nacif, MCAM. Evaluation of Contamination of Absorbent Paper Points, Rev. Bras. Odontol, Rio de Janeiro, 2010; 67(1): 81-5.
6. Moorer WR, Gennet JM antibacterial activity of guta percha cones attributed to the zinc oxide component. Oral Surg, Oral Med, Oral Pathol, 1982; 53: 508-514.
7. Kayaoglu G, Gurel M, Omurlu H, Bek ZG, Sadik B. Examination of gutta-percha cones for microbial contamination during chemical use. Journal of Applied Oral Science 2009;17(3): 244-7.
8. Leonardo MR, Da Silva LAB, André RFG. Evaluation of the sterility of absorbent points. Braz.Endod. J. 1997; 2:2-31.
9. Orstavick D, Möller B. Bacteriological studies on endodontic paper points, Acta. Odontol. Scand 1985; 43:5-91.
10. Doolittle TP, Rubel RL, Fried I. The eff efectiveness of common office disinfection on procedures for gutta-perha and silver points. N Y State Dent J 1975; 41(7):409-14.
11. Leonardo MR, Bonifacio KC, André RFG, Silva LAB, Ito IY. Evaluation of the sterility and anti microbial activity of gutta percha cones. Braz Endod J. 1997; 2(1):51-4.
12. Frank RJ, Pelleu GB. Glutaraldehyde decontaminati on of gutt a percha cones. J Endod 1983; 9(9):368-70.
13. Senia ES, Marraro RV, Mitchell JL, Lewis AG, Thomas L. Rapid sterilization of gutta-percha cones with 5,25% sodium hypoclorite. J Endod. 1975; 1(4):136-40.
14. Namazikhah SM, Sullivan DM, Trnavsky GL. Guta Percha: A look at the Need for Sterilization. Journaul of the Califórnia Dental Assciation 2000;28(6):425-429.
15. Gomes BP, Vianna ME, Matsumoto CU. Disinfection of gutta-percha cones with chlorhexidine and sodium hypochlorite. Oral Surg, Oral Med, Oral Pathol, Oral Radiol Endod 2005;100(4): 512-17.
 Correspondence:
Correspondence:
Amanda Pimienta da Silva
Rua Lobo da Costa nº 100, apto. 101
CEP: 91.360-370
Porto Alegre/RS
E-mail: amanda.pimienta@yahoo.com













