Services on Demand
Article
Related links
Share
Odontologia Clínico-Científica (Online)
On-line version ISSN 1677-3888
Odontol. Clín.-Cient. (Online) vol.9 n.1 Recife Jan./Mar. 2010
ARTIGO ORIGINAL ORIGINAL ARTICE
Avaliação da contaminação bacteriana em resinas compostas utilizadas nas clínicas de graduação da FO-UFJF
Evaluation of bacterial contamination in composite resins used at graduation clinics of FO-UFJF
Milene de OliveiraI; Roberta Mattos BarretoII; Ivone de Oliveira SalgadoIII; Henrique Duque de Miranda Chaves FilhoIV; Cláudio Galuppo DinizV
IDoutoranda em Clínica Odontológica pela FOP/Unicamp e Mestre em Clínica Odontológica pela FO/UFJF
IIMestre em Clínica Odontológica pela FO/UFJF
IIIDoutora em Materiais Dentários pela FOB/USP e Professora Titular do Departamento de Odontologia Restauradora da FO/UFJF
IVDoutor em Odontologia Restauradora pela Unesp/SJC e Professor Titular do Departamento de Odontologia Restauradorada FO/UFJF
VDoutor em Microbiologia pela UFMG e Professor Adjunto do Departamento de Microbiologia do Instituto de Ciências Biológicas da UFJF
RESUMO
OBJETIVO: avaliar a contaminação bacteriana em resinas compostas utilizadas nas clínicas de graduação da Faculdade de Odontologia da Universidade Federal de Juiz de Fora.
MÉTODOS: realizou-se a detecção de crescimento bacteriano em cultura de amostras de 50 tubos de resina composta, sendo 25 Charisma® (Heraeus-kulzer) e 25 Durafill® (Heraeus-kulzer). Dois tubos novos de cada marca comercial serviram como grupo controle, e os demais utilizados no estudo encontravam-se em uso nas clínicas de graduação, formando o grupo teste. A coleta das amostras foi realizada com técnica asséptica em capela de fluxo laminar, com uso de palitos previamente esterilizados. Após a coleta do material e inóculo em meio de cultura, os sistemas de avaliação foram mantidos em estufa bacteriológica a 37ºC.
RESULTADOS: após 24 horas de incubação, observou-se a turvação do meio de cultura em apenas 2 tubos de ensaio do grupo teste. Os resultados foram submetidos ao teste Qui Quadrado de Pearson, não mostrando resultados estatisticamente significativos (p>0,005).
CONCLUSÃO: as resinas compostas utilizadas na FO/UFJF não estavam contaminadas e acredita-se que as técnicas de manutenção da cadeia asséptica empregadas nas clínicas de graduação da instituᆳição foram eficazes, mas podem não ser as únicas responsáveis pela não contaminação.
Descritores: clínicas odontológicas; resinas compostas; contaminação.
ABSTRACT
OBECTIVE: evaluate the bacterial contamination in composite resins used daily at graduation clinical of FO/UFJF.
METHODS: for detection of bacterial growth on culture of samples from 50 tubes of composite resin, and 25 Charisma® (Heraeus-Kulzer) and 25 Durafill® (Heraeus-Kulzer). Two new tubes of each brand served as the control group and the other tubes of composite resin used in the study were in use in clinical studies, forming the test group. The collection of samples was performed with aseptic technique in the chapel of laminar flow, using previously sterilized toothpicks. After collecting the material and inoculum in the culture medium, the evaluation systems were maintained in bacteriological incubator at 37 ºC.
RESULTS: after 24 hours of incubation, observed the turbidity of the culture medium in only 2 test tubes of test group. The results were submitted to Pearson's Chi Square, not showing statistically significant results (p> 0.005).
CONCLUSION: the composite resins used in the FO/UFJF were not contaminated and it is believed that the technical maintenance of the aseptic chain employed in clinical studies of the institution were effective, but may not be the only ones responsible for not contamination.
Keywords: dental clinics; composite resins; contamination
INTRODUÇÃO
O Cirurgião-Dentista realiza com frequência intervençõesque, mesmo quando não são invasivas, potencialmentedevem ser consideradas como tal15. Em consultórios odontológicos, aerossóis e gotículas produzidas durante o atendimento contribuem para aumentar o risco de contaminação cruzada entre a equipe e o paciente ou entre pacientes22.
O controle da população microbiana é uma tarefa complexa que envolve aspectos clínicos, microbiológicos, culturais, sócio-econômicos, éticos, legais e políticos, para efetivamente minimizar os riscos de transmissão de microorganismos patogênicos7.
O primeiro propósito dos procedimentos de controlede infecção é a prevenção da transmissão de doenças infecto-contagiosas entre a equipe de saúde e os pacientes5.
O controle da população microbiana é uma tarefa complexa, que envolve aspectos clínicos, microbiológicos, culturais, sócio-econômicos, éticos, legais e políticos, para, efetivamente, minimizar os riscos de transmissão de microorganismos patogênicos7.
O primeiro propósito dos procedimentos de controle de infecção é a prevenção da transmissão de doenças infectocontagiosas entre a equipe de saúde e os pacientes5. Os princípios de biossegurança visam evitar ou diminuir a possibilidade de infecções cruzadas, contaminações com produtos tóxicos de qualquer natureza e a ocorrência de doenças profissionais através de precauções universais8.
As resinas compostas são materiais restauradores odontológicos, utilizados rotineiramente na clínica odontológica. A técnica recomendada para a confecção de restaurações de resina composta é a técnica incremental, na qual o material deve ser inserido na cavidade em pequenas porções4. Para isso, a espátula de inserção é levada diversas vezes, no tubo de resina composta e na cavidade a ser restaurada, podendo haver contaminação do interior do tubo.
Montenegro et al.14 comprovaram a presença de contaminação bacteriana na parte externa dos tubos de resina composta, representando um risco à saúde dos pacientes e dos profissionais e propuseram medidas para a manutenção da cadeia asséptica.
No entanto, devido à técnica incremental e ao manuseio dos tubos de resina composta por diversos alunos em instituições de ensino, pode haver contaminação do interior dos tubos e do material restaurador, aumentando o risco de infecção cruzada.
O objetivo deste estudo foi o de avaliar a contaminação bacteriana em resinas compostas utilizadas na clínica de graduação da Faculdade de Odontologia da Universidade Federal de Juiz de Fora (FO/UFJF).
MATERIAIS E MÉTODOS
Este experimento foi realizado no Laboratório de Bacteriologia do Instituto de Ciências Biológicas da Universidade Federal de Juiz de Fora. Foram preparados 50 tubos de ensaio, contendo 3 ml de meio de cultura (caldo nutriente, 8g/L - Biobrás® e 5g/L de cloreto de sódio - Reagen® e esterilizado sem autoclave a 121ºC por 15 minutos (Figura 1).

A coleta das amostras para análise foi realizada com palitos estéreis sob condições assépticas em capela de fluxo laminar, sob a proteção de um bico de Bunsen (Figura 2). Ogrupo teste foi constituído por 46 tubos de resina compostaem uso nas clínicas de graduação da FO/UFJF, após o atendimento clínico aos pacientes, sendo 23 tubos de Durafill® (Heraeus-kulzer) e 23 de Charisma® (Heraeus-kulzer). Quatro tubos de resina composta sem uso, originárias do almoxarifado desta instituição, formaram o grupo controle (02 de Durafill® e 02 de Charisma®).

Cada amostra de resina composta foi colocada em um dos tubos de ensaio, contendo meio de cultura estéril, e estes foram numerados de acordo com a sequência das resinas compostas utilizadas (Figura 3). Os tubos de ensaio foram vedados após a coleta do material e incubados em estufa bacteriológica a 37ºC por 24h, para avaliação do crescimento bacteriano.

Pela análise visual, comparou-se a turbidez dos meios de cultura contendo as amostras do grupo teste e do grupo controle. A turvação do meio indicava cultura positiva de bactérias.
RESULTADOS
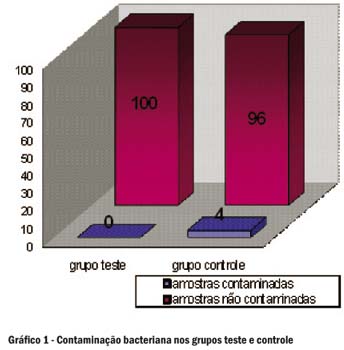
Através da análise visual, após 24 horas de incubação em estufa bacteriológica a 37ºC, observou-se que não houve turbação nos tubos do grupo controle, e, no grupo teste, houve turbação em dois tubos de ensaio (Figura 4). Os resultados são descritos do Gráfico 1 e foram submetidos ao teste estatístico Qui Quadrado de Pearson, com índice de significância de 5%, não mostrando resultados estatisticamente significativos para a contaminação bacteriana das resinas compostas (p=0,667)

DISCUSSÃO
A maior concentração de microrganismos no consultório dentário encontra-se na boca do paciente17. As mãos dos profissionais de Odontologia, uma vez contaminadas de saliva, fluido sulcular e/ou sangue, são os maiores veículos para contaminação de superfícies. Além dos vírus de hepatite B, C e D e o HIV, outras doenças infecciosas, como herpes e tuberculose, são reconhecidas como risco para profissionais e pacientes3,13.
O Cirurgião-Dentista que não adota uma técnica asséptica está cercado de inúmeros focos de infecção criados por ele mesmo através do contato com os itens utilizados durante o procedimento22. Há recomendações do Centers for Disease Control and Prevention (CDC) quanto à correta esterilização ou desinfecção dos instrumentais odontológicos, à limpeza e desinfecção do equipo e demais superfícies do consultório bem como ao uso de barreiras descartáveis em equipamentos, itens e superfícies que apresentam dificuldadesà esterilização ou desinfecção6. Embora não seja enfatizado pela literatura revisada, é necessário a tentar para os materiais de consumo odontológico, que podem ser contaminados durante os procedimentos clínicos a fim de que não se tornem focos de contaminação. O isolamento absoluto do campo operatório, a esterilização dos instrumentais clínicos, o uso de equipamentos de proteção individual, tanto do profissional quanto de sua equipe e a desinfecção da mesa clínica contribuem para a manutenção da biossegurança, mantém a cadeia asséptica, evitando possíveis contaminações nos procedimentos odontológicos.
Apesar de os resultados deste estudo apresentarem taxas não significativas de contaminação bacteriana (4%) no interior dos tubos de resina composta, um estudo anterior de Montenegro et al.14 relatou elevada taxa de contaminação da parte externa dos tubos de resina composta, apresentando riscos à saúde dos pacientes e dos profissionais, tendo os autores enfatizado a necessidade da desinfecção ou proteção com barreira dos tubos, para se evitar uma possível contaminação do material restaurador. Deve-se, também, realizar o isolamento absoluto do campo operatório6 e a desinfecção das espátulas após a inserção de cada incremento de resina composta12 .
Segundo Shivakumar et al.21 uma unidade de atendimento odontológico móvel apresenta uma contaminação atmosférica por microorganismos quatro vezes maior durante o atendimento odontológico do que antes dele, e, após o atendimento, a contaminação é reduzida em relação ao momento do tratamento. Há relatos de contaminação de equipamentos e utensílios odontológicos, como a cadeira odontológica2,20, a seringa tríplice18, aparatos utilizados em Radiologia5, Implantodontia8 e Sedação Inalatória com óxidonitroso e oxigênio17 .
Aguiar et al.1 afirmaram que as águas utilizadas nos equipamentos odontológicos e na seringa tríplice durante o atendimento clínico não atendem aos padrões de potabilidade estabelecidos pela legislação vigente em nosso país, podendo ser considerada fonte potencial de infecção cruzada e pós-operatória, uma vez que apresentam elevado índice de microorganismos patogênicos. De acordo com a American Dental Association (ADA), o índice de contaminação máxima permitida é de 200 UFC/ml (unidades formadoras de colôniapor mililitro)1.
Schweikl et al.19 abordaram a citotoxicidade das resinas compostas, e notaram efeitos mutagênicos sobre fibroblastos após um período de exposição de 24 horas. No entanto, resinas compostas condensáveis não demonstraram propriedades antimicrobianas após polimerização11. A citotoxicidade das resinas compostas já foi comprovada, havendo necessidade de identificar, por intermédio de outros estudos, se este fator é um dos responsáveis pela não contaminação bacteriana. Nalçaci, Oztan e Yilmaz16 relataram a citotoxicidade das resinas compostas após 48 horas de incubação, desaparecendo após sete dias. São necessários mais estudos que tentem correlacionar a citotoxicidade das resinas compostas com a cultura negativa de bactérias nestes materiais.
Para interferir no número de microorganismos, devemos estabelecer os meios de infecção e estabelecer a sequência de implantação do controle de infecção realizando lavagem das mãos10,17,21, dos ambientes, dos instrumentais, esterilização dos instrumentais através de meios químicos, físicos ou físico-químicos, a desinfecção do campo operatório e a antisepsia da pele e mucosas. Devem-se utilizar equipamentos de proteção individual (avental, gorro, máscara, óculos de proteção e luvas) e realizar a proteção de superfícies9,17,21,22
A situação de despreparo profissional e o desconhecimento do número real de pacientes portadores de doenças infectocontagiosas que são atendidos diariamente deixam odontológicos. Os Cirurgiões-Dentistas bem como seus auxiliares, não adotam as medidas de biossegurança com frequência e precisão necessárias, favorecendo, assim, a ocorrência de infecções cruzadas7.
Embora exista um padrão para o controle de infecção nas instituições de ensino, os materiais de uso odontológico são manuseados por diversos alunos num curto período de tempo, devendo ser redobrados os cuidados com medidas de prevenção a fim de evitar a contaminação bacteriana e a infecção cruzada. As técnicas restauradoras devem ser realizadas com o uso de isolamento absoluto, realizar a esterilização dos instrumentais odontológicos, paramentação pessoal, uso de óculos de proteção para o paciente21 e desinfecção e proteção de superfície dos materiais coletivos9.
Prevenir a ocorrência de infecção cruzada no consultório odontológico é condição obrigatória durante o atendimentode pacientes. Com o advento da AIDS e estudos comprovando a resistência e risco ocupacional do vírus da hepatite B (HBV), tornou-se responsabilidade do Cirurgião-Dentista a aplicação e fiscalização de medidas para prevençãode infecção cruzada entre pacientes e entre pacientes epessoal odontológico2.
CONCLUSÕES
• Foi encontrada uma taxa não significativa de contaminaçãobacteriana nas resinas compostas utilizadas naclínica de graduação da Faculdade de Odontologia de UniversidadeFederal de Juiz de Fora.
• Acredita-se que as técnicas de manutenção da cadeiaasséptica empregadas nas clínicas de graduação daFO/UFJF foram eficazes no que diz respeito ao conteúdo dostubos de resina composta, mas podem não ser as únicasresponsáveis pela não contaminação.
REFERÊNCIAS
1. Aguiar CM, Pinheiro JT. Avaliação bacteriológica da qualidade da água utilizada nos equipos odontológicos. Rev Assoc Paul Cir Dent. 1999;53(3):228-35. [ Links ]
2. Almeida KB, Jorge AOC. Avaliação da desinfecção de superfícieem cadeira odontológica. Rev Biociênc. 2002;8(1):19-27. [ Links ]
3. American dental association. Infection control for thedental Office and dental laboratory. J Am Dent Assoc.1992;123:1-8. [ Links ]
4. Anusavice KJ. Phillips, Materiais Dentários. 11a ed. Rio deJaneiro: Editora Elsevier; 2005. [ Links ]
5. Carvalho PL, Papaiz EG. Controle de infecção emRadiologia Odontológica. Rev Assoc Paul Cir Dent.1999;53(3):202-4. [ Links ]
6. CDC. Recommended infection-control practices for dentistry. MMWR Recomm Rep. 1993, May 28;42(RR-8):1-12. [ Links ]
7. Costa Carmo MR, Dias Costa AMD. Procedimentos de biossegurança em odontologia. JBC. 2001;5(26):116-19. [ Links ]
8. Faizibaioff R, Kignel S. Princípios de biossegurança em Implantodontia. Rev Assoc Pauli Cir Dent. 2000;54(4):329-34. [ Links ]
9. Kohn WG, et al. Guidelines for infection control in dental healthcare settings-2003. J Am Dent Assoc. 2004;135:33-47. [ Links ]
10. Magro-Filho O, et al. Lavagem das mãos com soluções de PVP-I, clorexidina e sabão líquido: estudo microbiológico. Rev Assoc Paul Cir Dent. 2000;54(1):25-28. [ Links ]
11. Matalon S, Slutzky H, Weiss EI. Surface antibacterial properties of packable resin composites: part I. Quintes sence Int. 2004;35(3):189-93 [ Links ]
12. Mazzriol et al. Isolamento do campo operatório na atualidade. Rev Paul Odont. 1990;12(3):10-8. [ Links ]
13. Molinari JA. Infection control - its evolution to the current standard precautions. J Am Dent Assoc. 2003;134:569-74. [ Links ]
14. Montenegro G, et al. Contaminação da parte externados tubos de resina composta. Rev Assoc Paul Cir Dent.2004;58(4):279-82. [ Links ]
15. Ministério da Saúde. Controle de infecções e a prática odontológica em tempos de AIDS: manual de condutas. Brasília:Ministério da Saúde; 2000. [ Links ]
16. Nalçaci A, Öztan MD, Yilmaz S. Citotoxicity of compositeresins polymerized with different curing methods. Int Endod J. 2004;37:151-6. [ Links ]
17. Ranali J, Ramacciato JC, Motta RHL. Biossegurança na sedação inalatória com óxido nitroso e oxigênio. Rev Assoc Paul Cir Dent. 2004;58(5):374-8. [ Links ]
18. Russo EMA, et al. Avaliação da intensidade de contaminaçãode pontas de seringa tríplice. Pesq Odontol Bras. 2000;14(3):223-7. [ Links ]
19. Schweikl H. et al. Cytotoxic and mutagenic effects ofdental composite materials. Biomaterials. 2005;26:1713– 1719 [ Links ]
20. Shivakumar KM et al. Assessment of atmosferic microbial contamination in a mobile dental unit. Indian J Dent Res.2007;18:177-80. [ Links ]
21. Shulman ER, Brehm WT. Dental clinical attire and infectioncontrol procedures. J Am Dent Assoc. 2001;132:508-16. [ Links ]
22. Teixeira M, Santos MV. Responsabilidade no controle de infecção. Rev Assoc Paul Cir Dent. 1999; 53(3):177-89. [ Links ]
 Correspondência para:
Correspondência para:
Milene de Oliveira
Rua Rei Alberto, 292 Centro Juiz de Fora-MG - Brasil
CEP: 36016-300
Tel.: (32) 32314056 Cel.: (19)88056197 Fax: (32)21023881
Email: milene@fop.unicamp.br
Recebido para publicação em 03/08/09
Aceito para publicação em 30/10/09