Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Odontologia Clínico-Científica (Online)
versão On-line ISSN 1677-3888
Odontol. Clín.-Cient. (Online) vol.9 no.2 Recife Abr./Jun. 2010
ARTIGO ORIGINAL ORIGINAL ARTICE
Atividades antibacteriana e antiaderente in vitro de tinturas de Schinus terebinthinfolius (Aroeira) e Solidago microglossa (Arnica) frente a bactérias formadoras do biofilme dentário
In vitro antibacterial and antiadherent activities of tinctures from Schinus terebinthifolius (Aroeira) and Solidago microglossa (Arnica) on dental biofilm forming bacteria
Irlan de Almeida FreiresI; Lívia Araújo AlvesI; Vanessa de Carvalho JovitoII; Leopoldina de Fátima Dantas de AlmeidaII; Ricardo Dias de CastroIII; Wilton Wilney Nascimento PadilhaIV
IGraduando(a) em Odontologia pela Universidade Federal da Paraíba
IICirurgiã-dentista pela Universidade Federal da Paraíba
IIIProfessor Assistente do Departamento de Clínica e Odontologia Social da UFPB e Professor Adjunto do Centro Universitário de João Pessoa (UNIPE). Doutorando em Farmacologia pela Universidade Federal da Paraíba e Mestre em Odontologia pela Universidade Federal do Rio Grande do Norte
IVProfessor Doutor Titular da Universidade Federal da Paraíba
RESUMO
O uso de produtos naturais na Odontologia constitui alternativa viável e eficaz na prevenção e combate de diversas patologias da cavidade oral. Inúmeros produtos com ação terapêutica têm sido relatados na literatura; dentre eles, destacam-se a Aroeira e a Arnica. Foi propósito deste estudo avaliar in vitro as atividades antibacteriana e antiaderente das tinturas de Schinus terebinthinfolius (Aroeira) e Solidago microglossa (Arnica) frente Streptococcus mutans e Lactobacillus casei. A atividade antibacteriana foi determinada pela Concentração Inibitória Mínima (CIM) do crescimento bacteriano através da microdiluição. A atividade antiaderente foi estabelecida pela Concentração Inibitória Mínima de Aderência (CIMA) da bactéria a tubos de vidro, na presença de sacarose a 5%. As linhagens bacterianas de S. mutans e L. casei mostraram-se susceptíveis à ação das tinturas avaliadas. Em relação à CIM, observaram-se valores mais expressivos dos produtos sobre o L. casei, apresentando a Aroeira a menor CIM (1,562 mg / mL). Em relação à CIMA, pôde-se perceber que a Aroeira apresentou resultados mais satisfatórios frente a S. mutans, pois foi capaz de inibir a aderência bacteriana ao vidro, estando em uma menor concentração (0,892 mg/mL). Assim, pôde-se concluir que as tinturas avaliadas apresentaram, in vitro, atividades antibacteriana e antiaderente frente aos microrganismos testados.
Descritores: Microbiologia. Plantas Medicinais. Produtos com Ação Antimicrobiana. Aderência Bacteriana.
ABSTRACT
The use of natural products in dentistry is a viable and effective alternative in preventing and fighting several diseases of the oral cavity. Numerous products with therapeutic effects have been reported in the literature, among them Aroeira and Arnica. This study aimed to evaluate the in vitro antibacterial and antiadherent action of tinctures from Schinus terebinthinfolius (Aroeira) and Solidago microglossa (Arnica) against Streptococcus mutans and Lactobacillus casei. The antibacterial action was determined by the Minimal Inhibitory Concentration (MIC) of bacterial growth, through microdilution method. The antiadherent activity was established by the Minimum Inhibitory Concentration of Adherence (MICA) of the bacterium to glass tubes, in presence of sucrose at 5%. The bacterial strains were shown to be susceptible to the action of the tinctures evaluated. In relation to MIC, there were more expressive values of the products against L. casei, exposing Aroeira the lowest MIC (1.562 mg / mL). In relation to MICA, it was found that Aroeira showed more satisfactory results on S. mutans, because it was able to inhibit bacterial adhesion to glass, even being in a lower concentration (0.892 mg / mL). Therefore, the tinctures evaluated showed in vitro antibacterial and antiadherent actions against tested microrganisms.
Keywords: Microbiology. Medicinal Plants. Products with Antimicrobial Action. Bacterial Adhesion.
INTRODUÇÃO
A formação do biofilme dentário ocorre a partir de processos complexos, que proporcionam a instalação de uma comunidade microbiana diversificada, cooperativa, dinâmica, de elevado potencial patogênico e, muitas vezes, resistente a agentes antimicrobianos. Tais processos envolvem mecanismos de aderência dos microrganismos à película adquirida bem como de co-adesão microbiana entre espécies semelhantes (homotípica) ou diferentes (heterotípica), mediadas por glicoproteínas salivares e receptores de superfície celular. Esses processos são responsáveis pela sucessão bacteriana, gerando ambientes favoráveis à colonização por bactérias cariogênicas, como o Streptococcus mutans e o Lactobacillus casei 8,9,24,25.
O S. mutans é considerado o principal agente etiológico da cárie dentária em humanos e fatores de virulência, tais como a composição de sua superfície celular (sorotipo) e a produção de bacteriocinas (mutacinas), têm sido investigados em relação à sua cariogenicidade19. A capacidade de adesão desse microrganismo está relacionada a sua patogenicidade, sendo, portanto, objeto de estudos que visam prevenir a formação de lesões de cárie, seja por meio de métodos mecânicos, com a utilização da escova dental, ou químicos, com a utilização de agentes antimicrobianos15,21.
Atualmente, dentre os agentes químicos, destaca-se o gluconato de clorexidina, que tem sido indicado pela sua eficácia comprovada na remoção química do biofilme cariogênico ou periodontopatogênico10.
A clorexidina se caracteriza por ser um detergente catiônico, da classe das bisbiguanidas, disponível nas formas de acetato, hidrocloreto e digluconato, sendo este último, o sal mais comumente empregado em fórmulas e produtos. Devido à sua natureza catiônica, ela adsorve-se a compostos aniônicos como glicoproteínas salivares, radicais fosfatados e carboxílicos presentes no biofilme dental como bactérias e polissacarídeos extracelulares, película dental e macromoléculas presentes na mucosa oral. O seu mecanismo de ação antibacteriano é explicado devido à molécula catiônica da clorexidina ser rapidamente atraída pela carga negativa da superfície bacteriana, sendo adsorvida à membrana celular por interações eletrostáticas, provavelmente por ligações hidrofóbicas ou por pontes de hidrogênio, sendo essa adsorção concentração-dependente26.
Porém, diante das limitações desse agente, como: machamento, alteração de paladar, desequilíbrio da microbiota, outros agentes, incluindo os de origem natural, têm sido investigados10.
As plantas medicinais entram nesse processo como um componente da biodiversidade de importância econômica e para a saúde17. Além da ação terapêutica comprovada de muitas espécies, estas representam parte integrante da cultura de um povo, sendo um saber utilizado e difundido pelas populações ao longo do tempo1.
O Brasil possui grande potencial para o desenvolvimento de produtos naturais aplicados, inclusive, à Odontologia, já que apresenta a maior diversidade vegetal do mundo, com o uso de plantas medicinais vinculado ao conhecimento tradicional e tecnologia para validar cientificamente este conhecimento2.
Dentre inúmeras espécies de plantas com propriedades medicinais1, especialmente atividade antimicrobiana, a literatura cita Schinus terebinthifolius – popularmente conhecida como Aroeira4,12,18,22,23 e Solidago microglossa, conhecida como Arnica5,6,16,20.
Destarte, o propósito deste estudo é o de avaliar in vitro as atividades antibacteriana e antiaderente das tinturas de Schinus terebinthinfolius (Aroeira) e Solidago microglossa (Arnica) frente a bactérias da cavidade bucal, que fazem parte do biofilme dentário, como S. mutans e L. casei.
MATERIAIS E MÉTODO
- Produtos avaliados
As tinturas da casca de S. terebinthifolius (10%) e parte aérea da S. microglossa (25%) foram adquiridas em farmácia de manipulação, sendo produtos comercializados na cidade de João Pessoa, Paraíba, Brasil. As tinturas atendem a todas as especificações exigidas concernentes ao seu controle de qualidade conforme análises realizadas pelo fornecedor.
O Quadro 1 contém informações sobre espécie, nome popular, constituintes químicos e ação terapêutica de cada produto avaliado.
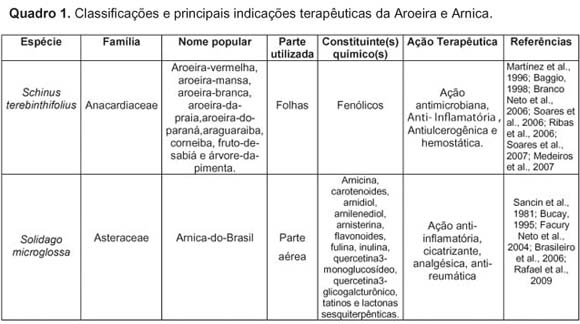
- Microrganismos utilizados
Foram utilizadas cepas de S. mutans (ATCC-25175) e L. casei (ATCC 7469). Suspensões das cepas testes foram preparadas em BHI caldo (Brain Heart Infusion Broth, DIFCO®, São Paulo) e padronizadas de acordo com o tubo 0,5 da escala McFarland, correspondendo à concentração de aproximadamente 108 Unidades Formadoras de Colônia - (UFC/mL).
- Determinação da Atividade Antibacteriana in vitro
A atividade antibacteriana foi determinada pela Concentração Inibitória Mínima do crescimento bacteriano, segundo a metodologia da microdiluição em caldo (microtitulação), proposta pelo National Committee for Clinical Laboratory Standard14 (2003).
Foram utilizadas microplacas com fundo em "U" esterilizadas, contendo 96 orifícios. Cada orifício recebeu 10µL da suspensão do inóculo, 100µL do meio de cultura líquido BHI (duplamente concentrado) e 100µL das tinturas em concentrações que variaram de 50,0 a 0,39 mg/mL para Aroeira e de 125,0 a 0,975 mg/mL para Arnica, posto que foram adquiridas já em diferentes concentrações iniciais.
O controle positivo foi a Clorexidina, em concentrações entre 1,2 e 0,009mg/mL. Também foram utilizados controle de crescimento, no intuito de verificação quanto à viabilidade do inóculo e controle de esterilidade do meio.
As placas foram, então, conduzidas para incubador bacteriológico, em microaerofilia, a 37 ºC por um período de 24 horas.
A leitura para determinação da CIM das tinturas sobre as cepas avaliadas foi feita através do método visual. Foi levada em consideração a formação ou não de aglomerados de células ("botão") no fundo da cavidade da placa. Desta forma, considerou-se como CIM a menor concentração dos produtos em teste capaz de produzir inibição visível sobre o crescimento das cepas utilizadas nos ensaios microbiológicos.
Para confirmação da presença de microrganismos viáveis nas concentrações não inibitórias, foi adicionado em cada orifício da placa o corante TCC (2,3,5 trifenil cloreto de tetrazólio), no volume de 10µL, que reflete a atividade das enzimas desidrogenases, envolvidas no processo de respiração. Pela hidrogenação do 2,3,5 trifenil cloreto de tetrazólio é produzida nas células vivas uma substância vermelha, estável e não difusível, o trifenil formazan. Isto tornou possível distinguir as amostras vivas, coloridas de vermelho, daquelas mortas que mantêm a sua cor7.
- Determinação da Atividade Antiaderente in vitro
A concentração Inibitória Mínima de Aderência (CIMA) da bactéria ao vidro foi determinada na presença de sacarose a 5%, usando-se concentrações crescentes e dobradas das soluções diluídas das tinturas, variando de 100,0 a 1,562 mg/mL para Aroeira e 250,0 a 3,906 mg/mL para Arnica. A partir do crescimento "overnight", as linhagens foram subcultivadas a 37ºC em caldo Müeller-Hinton (DIFCO), em microaerofilia, por um período de 24 horas, obtendo-se um inóculo de 106 UFC/ml.
Como controle positivo, foi usada a Clorexidina a 0,12%. Em cada tubo de vidro, foram inseridos 2,5 mL de BHI caldo sacarosado, 0,5mL de inóculo (106UFC/mL) e 0,5mL de cada concentração das tinturas ou o controle.
A adição das tinturas ao meio líquido e ao inóculo gerou uma maior diluição da concentração dos produtos. Diante disso, utilizou-se a fórmula química (c1.v1=c2.v2) para correção das concentrações das tinturas e do controle.
A incubação foi feita a 37ºC por 24 horas em microaerofilia, com os tubos inclinados a 30º. A leitura dos resultados foi feita pelo método visual por dois pesquisadores, isoladamente, da forma como os tubos saíram da estufa e após a adição de três gotas de evidenciador de placa na parede dos tubos (Replak®, Dentsply), para fins de confirmação da aderência ou não aderência bacteriana ao vidro.
A CIMA foi definida como a menor concentração das tinturas em meio com sacarose que impediu a aderência bacteriana ao tubo de vidro. Todo o estudo foi realizado em duplicata.
RESULTADOS
Verificou-se que as linhagens bacterianas de S. mutans e L. casei mostraram-se susceptíveis à ação das tinturas de Aroeira e Arnica.
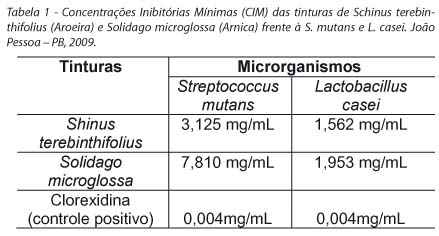
A tabela 1 apresenta os valores da Concentração Inibitória Mínima das tinturas e controle frente aos microrganismos em teste. Observaram-se valores mais expressivos dos produtos sobre o L. casei, apresentando a Aroeira a menor CIM (1,562 mg / mL).
Os valores das Concentrações Inibitórias de Aderência da Aroeira e Arnica estão expostos nas tabelas 2 e 3, respectivamente, com destaque para a CIMA. Pôde-se perceber que a Aroeira apresentou resultados mais satisfatórios do que a Arnica, pois foi capaz de inibir a aderência bacteriana ao vidro, estando em uma menor concentração (0,892 mg/mL).
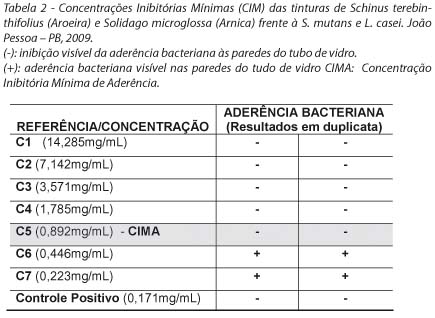
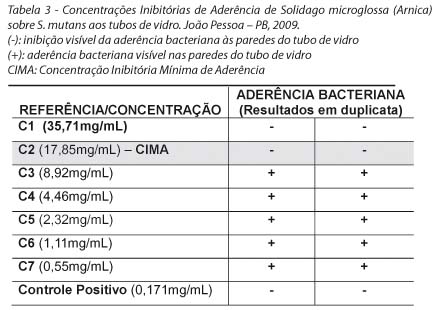
DISCUSSÃO
A pesquisa em prol do uso de plantas medicinais na Odontologia, principalmente as com atividade antimicrobiana, é relevante não apenas pelo benefício à saúde e pelo custo relativamente baixo mas também pela grande disponibilidade com que são encontradas pela população.
No entanto, muitos fatores geram dificuldades no que concerne à comparação dos resultados de diversos estudos com produtos naturais, como os desta pesquisa, em relação à atividade antimicrobiana e antiaderente. Pode-se citar as diferentes apresentações dos produtos a serem avaliados (tintura, extrato etanólico, óleo essencial, dentre outros) bem como variados critérios metodológicos empregados para a realização dos estudos.
Alves et al.3 (2009) avaliaram a ação antimicrobiana in vitro do extrato hidroalcoólico da aroeira sobre Streptococcus mutans, Streptococcus mitis, Streptococcus sobrinus, Streptococcus sanguis e Lactobacillus casei, verificando atividades bacteriostática e bactericida do produto sobre os microrganismos testados. Além disso, também exerceu ação antifúngica sobre Candida albicans, Candida tropicalis e Candida krusei.
Soares et al.23 (2006) e Soares et al.22 (2007) observaram que a tintura da casca da aroeira (20%) apresentou atividade antibacteriana sobre o S. mutans, em uma diluição de 1:8, pela técnica da CIM em meio sólido.
No nosso estudo, verificamos atividade antibacteriana da aroeira contra o S. mutans na diluição de 1:4 (3,125 mg/mL), estando a tintura em uma concentração inicial de 10%. Frente à L. casei, bactéria também correlacionada com a etiologia da cárie dentária, foram obtidos resultados mais satisfatórios, posto que a Aroeira foi capaz de inibir o crescimento bacteriano numa concentração de 1,562 mg/mL (1:32).
Alves et al.3 (2009) verificaram, ainda, ação antiaderente in vitro da aroeira semelhante à clorexidina 0,12%, demonstrando a capacidade desta planta em inibir a síntese do glucano pela glicosiltransferase.
Nossos resultados mostram que a Aroeira, numa concentração de 0,892 mg/mL, foi capaz de impedir a aderência de S. mutans às paredes do tubo de vidro. Esse dado é de grande importância, pois se sabe que essa espécie é encontrada na maioria dos indivíduos e é uma das principais responsáveis pela formação do biofilme dentário8,9,19.
Uma CIMA menor que a CIM, como encontrado para Aroeira frente a S. mutans, sugere a capacidade desse produto em atenuar a aderência bacteriana, sem, no entanto, desequilibrar a microbiota da cavidade oral, já que não inibe o crescimento do microrganismo.
Estudo feito por Morel et al.13 (2006) propôs-se a avaliar a atividade antimicrobiana do extrato metanólico das raízes da Arnica e do óleo essencial de suas partes aéreas. Foi verificado que o óleo essencial exibiu atividade concentração-dependente contra as bactérias e leveduras testadas.
Encontramos ação antibacteriana da tintura das partes aéreas da Arnica, contra o S. mutans e L. casei, nas concentrações de 7,810 mg/mL e 1,953 mg/mL, respectivamente. Os estudos de Brasileiro et al.5 (2006) indicaram CIM do extrato etanólico da Arnica contra Staphylococcus aureus de 0,5 mg/mL.
Quanto à atividade antiaderente da Arnica frente a bactérias da cavidade oral, estudos ainda são escassos na literatura. No entanto, tem-se verificado, preponderantemente, sua ação como anti-inflamatória6, antiplaquetário16 e também baixa citotoxicidade, por meio de ensaios realizados em ratos, em que se verificou-se biocompatiilidade in vitro com fibroblastos da mucosa humana11,. Verificamos que a tintura da Arnica apresenta atividade inibitória da aderência do S. mutans apenas em concentrações iguais ou superiores a 17,85 mg/mL.
Estudos in vitro, principalmente avaliando atividade antiaderente, apresentam-se como preliminares numa sequência desde ensaios microbiológicos até a fase clínica. Algumas limitações podem ser enumeradas, nesse caso: ausência de saliva/umidade e reprodução fiel das condições bucais, tais como estruturas anatômicas, potencial hidrogenio-iônico da cavidade oral, microbiota residente ou adventícia e também a utilização do vidro e não do esmalte dentário como substrato para a adesão bacteriana. Sugere-se a realização de estudos envolvendo microscopia eletrônica de varredura, a fim de verificar a presença de células bacterianas viáveis na superfície do material e utilização da hidroxiapatita como substrato para aderência dos microrganismos.
CONCLUSÃO
Nas condições do nosso estudo, as tinturas avaliadas apresentaram, in vitro, atividades antibacteriana e antiaderente frente aos microrganismos testados.
Esses resultados mostram a importância das indicações terapêuticas dos produtos avaliados na clínica odontológica, como método alternativo e de baixo custo na prevenção da cárie dentária. Previamente, sugere-se a realização de outros ensaios microbiológicos e clínicos para verificar a viabilidade de seu uso na Odontologia.
REFERÊNCIAS
01. Agra MF, Freitas PF, Barbosa-Filho JM. Synopsis of the plants known as medicinal and poisonous in Northeast of Brazil. Rev Bras Farmacogn, 17: 114-140, 2007. [ Links ]
02.Albuquerque UP, Hanazaki N. As pesquisas etnodirigidas na descoberta de novos fármacos de interesse médico e farmacêutico: fragilidades e perspectivas. Rev Bras Farmacogn, 16: 678-689, 2006. [ Links ]
03. Alves PM, Queiroz LMG, Pereira JV, Pereira MSV. Atividade antimicrobiana, antiaderente e antifúngica in vitro de plantas medicinais brasileiras sobre microrganismos do biofilme dental e cepas do gênero Candida. Rev. Soc. Bras. Med. Trop., 42(2): 1-3, 2009. [ Links ]
04. Branco Neto MLC et al. Avaliação do extrato hidroalcoólico de Aroeira (Schinus terebinthifolius Raddi) no processo de cicatrização de feridas em pele de ratos. Acta cir. bras., 21(Sup.2): 17-22, 2006. [ Links ]
05. Brasileiro BG, Pizziolo VR, Raslan DS, Jamal CM, Silveira D. Antimicrobial and cytotoxic activities screening of some Brazilian medicinal plants used in Governador Valadares district. Braz. j. pharm. sci., 42(2): 195-202, 2006. [ Links ]
06. Facury Neto MA, Fagundes DJ, Beletti ME, Novo NF, Juliano Y, Penha-Silva N. Systemic use of Solidago microglossa DC in the cicatrization of open cutaneous wounds in rats. Braz. J. morphol. Sci., 21(4): 207-210, 2004. [ Links ]
07. Gabre DF. Manual do teste de tetrazólio. Brasília; AGIPLAN; 1976. 85p. [ Links ]
08. Gibbons RJ. Bacterial Adhesion to Oral Tissues: A Model for Infectious Diseases. J Dent Res 68 (5): 750-760, 1989. [ Links ]
09. Jeon J-G, Klein MI, Xiao J, Gregoire S, Rosalen PL, Koo H. Influences of naturally occurring agents in combination with fluoride on gene expression and structural organization of Streptococcus mutans in biofilms. BMC Microbiology, 9: 228-238, 2009. [ Links ]
10. Lawrence JR et al. Community-Level Assessment of the Effects of the Broad-Spectrum Antimicrobial Chlorhexidine on the Outcome of River Microbial Biofilm Development. Applied and Environmental Microbiology, 74(11): 3541–3550, 2008. [ Links ]
11. Martins MD et al. Citotoxicidade in vitro de extratos de arnica brasileira (Solidago microglossa) e arnica paulista (Porophyllum ruderale). ConScientiae Saúde, 8(1): 99-104, 2009. [ Links ]
12. Medeiros KCP, Monteiro JC, Diniz MFFM, Medeiros IA, Silva BA, Piuvezam MR. Effect of the activity of the Brazilian polyherbal formulation: Eucalyptus globulus Labill, Peltodon radicans Pohl and Schinus terebinthifolius Radd in inflammatory models. Braz J of Pharmacogn, 17(1): 23-28, 2007. [ Links ]
13. Morel AF, Dias GO, Porto C, Simionatto O, Stuker CZ, Dalcol II. Antimicrobial activity of extractives of Solidago microglossa. Fitoterapia, 77: 453-5, 2006. [ Links ]
14. National Committee for Clinical Laboratory Standard. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically, Approved Standard - M7-A6, ed 6, vol. 23, 2003. [ Links ]
15. Pereira JV. Estudo com o extrato da Punica granatum Linn. (Romã): efeito antimicrobiano in vitro e avaliação clínica de um dentifrício sobre microrganismos do biofilme dental. Rev. odonto ciênc., 20(49): 262-9, 2005. [ Links ]
16. Rafael L, Teresinha N., Moritz JC, Maria IG, Eduardo MD, Tânia SF. Evaluation of antimicrobial and antiplatelet aggregation effects of Solidago chilensis Meyen. IJGP, 3(1): 35-39, 2009. [ Links ]
17. Rahman MA, Mossa JS, Al-Said MS, Al-Yahya MA. Medicinal plant diversity in the flora of Saudi Arabia 1: a report on seven plant families. Fitoterapia, 75: 149–161, 2004. [ Links ]
18. Ribas MO, Sousa MH, Sartoretto J, Lanzoni TA, Noronha L, Acra LA. Efeito da Schinus terebinthifolius Raddi sobre o processo de reparo tecidual das lesões ulceradas induzidas na mucosa bucal do rato. Rev. odonto ciênc., 21(53): 245-252, 2006. [ Links ]
19. Rodrigues MR, Maciel SM, Ferreira FBA, Piovezan A, Pieralisi FJS, Poli-Frederico RC. Análise do sorotipo e dos genes para mutacinas em Streptococcus mutans isolados de pré-escolares com diferentes experiências de cárie. Cienc Odontol Bras, 11(4): 40-46, 2008. [ Links ]
20. Sancin P, Lombard A, Rossetti V, Buffa M, Borgarello E. Evaluation of tinctures of Arnica montana L. roots. Acta Pharm. Iugosl. 31: 177-183, 1981. [ Links ]
21. Sawhney R, Berry V. Bacterial biofilm formation, pathogenicity, diagnostics and control: An overview. Indian j. med. sci., 63(7): 313-321, 2009. [ Links ]
22. Soares DGS, Oliveira CB, Leal C, Drumond MRS, Padilha WWN. Atividade Antibacteriana in vitro da Tintura de Aroeira (Schinus terebinthifolius) na Descontaminação de Escovas Dentais Contaminadas pelo S. mutans. Pesq Bras Odontoped Clin Integr, 7(3): 253-257, 2007. [ Links ]
23. Soares DGS, Oliveira CB, Leal C, Drumond MRS, Padilha WWN. Susceptibilidade in vitro de bactérias bucais a tinturas fitoterápicas. Rev. odonto ciênc., 21(53): 232-237, 2006. [ Links ]
24. Souza FB, Gil JN. Doença cárie: nem infecciosa nem transmissível. RGO, 49: 139-44, 2001. [ Links ]
25. Wolff MS, Larson C. The cariogenic dental biofilm: good, bad or just something to control? Braz. oral res., 23(supl.1): 31-38, 2009. [ Links ]
26. Zanatta FB, Rösing CK. Clorexidina: mecanismo de ação e evidências atuais de sua eficácia no contexto do biofilme supragengival. Scientific-A, 1(2): 35-43, 2007. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Irlan de Almeida Freires
Rua Severino Nicolau de Melo, 1060, Bloco D, Apto. 101,
Jardim Oceania, João Pessoa – Paraíba CEP: 58.037-700
(83) 3235-4181 ; (83) 8868-9520
Contato: irlan.almeida@gmail.com
Recebido para publicação: 09/12/09
Aceito para publicação: 10/03/10













