Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Odontologia Clínico-Científica (Online)
versão On-line ISSN 1677-3888
Odontol. Clín.-Cient. (Online) vol.9 no.3 Recife Set. 2010
ARTIGO ORIGINAL ORIGINAL ARTICE
Fluxo salivar e concentração do Fator de Crescimento Epidérmico (EGF) na saliva de pacientes diabéticos tipo 2
Salivary flow and Epidermal Growth Factor (EGF) levelsin saliva of type 2 diabetic patients
Monique Danyelle Emiliano Batista PaivaI; Amanda Maria Medeiros de AraujoII; Márcia Regina PiuvezamIII; Hermann Ferreira CostaIV; Lino João da CostaV
IDoutora em Estomatologia (UFPB/UFBA)
IIMestranda em Radiologia Odontológica na Faculdade de Odontologia de Piracicaba (UNICAMP/SP)
IIIDoutora em Imunologia (UFRJ) e Pós-Doutorado (Department of Immunology, University of Strathclyde, Escócia)
IVDoutorando em Produtos Naturais e Sintéticos Bioativos (UFPB)
VDoutor em Odontologia - Diagnóstico Bucal (USP). Professor de Estomatologia (UFPB)
RESUMO
O objetivo deste trabalho foi o de avaliar o fluxo salivar e a concentração do EGF na saliva de pacientes diabéticos, comparados a um grupo controle de pacientes clinicamente sadios. A amostra foi composta de 15 indivíduos divididos em dois grupos, G0 – controle (n=9) e G1 – diabéticos (n=6). A saliva foi coletada por estimulação mecânica com o auxílio de um hiperboloide. A concentração do EGF foi verificada por meio de imunoensaio do tipo sanduíche, com a utilização de Kit ELISA (R&D Systems®) e auxílio de um leitor de microplaca. Pôde-se observar uma média do fluxo salivar de 1,27 ml/min. no G0 e 1,26 ml/min. no G1, não havendo diferença estatisticamente significativa entre os dois grupos, quando empregado o teste t-Student (p=0,972). Quanto ao EGF, foram observadas as médias de 1624,08 pg/ml e 2367,66 pg/ml para o G0 e G1, respectivamente, também não sendo esta diferença significante (p=0,559). Os dados deste trabalho demonstraram que não houve diferenças significativas do fluxo salivar e da concentração de EGF na saliva dos pacientes diabéticos em relação ao grupo controle.
Descritores: Saliva; Fator de Crescimento Epidérmico; Diabetes Mellitus.
ABSTRACT
The aim of this study was to evaluate the salivary flow and the concentration of EGF in saliva of diabetic patients not insulin-dependents compared with a non diabetic patients (control group). Stimulated saliva was collected in two groups of patients: G0 – control (n=9) and G1 – diabetics (n=6), using a hiperbolóide. Saliva was expelled in the first minute and it was despised. In the following five minutes it was collected with a funnel connected to a graduated tube. EGF concentration measurement was performed using a sandwich-type immunoassay, using an ELISA Kit (R&D Systems®) and a microplate reader. It was observed an average of salivary flow of 1.27ml/min. in G0 and 1.26ml/min. in G1 and it was not found significant differences between the two groups (p=0.972). It was also observed an average of 1624.08 pg/ml of EGF in the G0 and 2367.66 pg/ml in the G1 and as the salivary flow the difference was not statistically significant (p=0.559). The data present in this work demonstrate no differences between salivary flow and EGF concentration of diabetic patients as compared as non-diabetic patients.
Keywords: Saliva; Epidermal Growth Factor; Diabetes Mellitus.
INTRODUÇÃO
Segundo a Organização Mundial da Saúde, a prevalência de diabetes é de mais de 180 milhões de pessoas no mundo, com incidência crescente em curso, podendo duplicar até 20301. O comprometimento da cicatrização de feridas em diabéticos se deve a alterações no sistema imunológico e defeitos inflamatórios inerentes ao Diabetes Mellitus2,3.
Ao longo das últimas décadas, os fatores de crescimento têm sido testados pela sua capacidade de acelerar o processo de cicatrização, na tentativa de sobrepor as alterações apresentadas pelos indivíduos diabéticos2.
Hormônios peptídicos salivares, como o Fator de Crescimento Epidérmico (EGF do inglês Epidermal Growth Factor), estão envolvidos na regulação de processos inflamatórios e na promoção da proliferação celular, contribuindo para uma rápida cicatrização de feridas no epitélio4. O EGF é conhecido por estimular a replicação de fibroblastos, aumentar a produção de colágeno, resultando em uma maior formação de epitélio 2.
É uma proteína composta por 53 aminoácidos, potencialmente mitogênica. Está presente nos fluidos biológicos, incluindo a saliva, e possui importante papel na manutenção de uma barreira epitelial protetora e na cicatrização da mucosa quando esta é agredida5,6, estimulando a proliferação das células da mucosa oral4.
O EGF da saliva origina-se das glândulas parótida e submandibular7, e sua concentração parece estar reduzida em pacientes tabagistas8. A glândula parótida é a principal fonte do EGF na saliva humana9. A proporção relativa de EGF nas glândulas parótida, submandibular e no restante das glândulas é de 6:4:110.
O objetivo deste trabalho foi o de aprofundar os estudos, avaliando o fluxo salivar e a concentração do EGF na saliva de pacientes diabéticos, que, devido a essa condição, já apresentam dificuldades na cicatrização, quando comparados a pacientes sadios.
METODOLOGIA
PACIENTES
Fizeram parte da amostra 15 indivíduos, divididos em dois grupos: G0 –controle, composto de 9 indivíduos sadios e G1 – diabéticos tipo 2, com 6 indivíduos não dependentes de insulina.
COLETA DA SALIVA
A saliva total estimulada foi obtida por meio de estimulação mecânica, baseada na técnica de Krasse11, modificada quanto ao material utilizado, de forma que o paciente foi orientado a mastigar o hiperboloide durante um minuto, deglutindo a saliva. Após o primeiro minuto, foi acionado um cronômetro, e este continuou mastigando, porém sem deglutir a saliva, a qual era expelida em funil de vidro de onde seguia para um tubo graduado, em intervalos frequentes de 1 minuto, durante cinco minutos.
DETERMINAÇÃO DA CONCENTRAÇÃO DE EGF
Uma vez coletada, a saliva foi centrifugada durante 10 minutos a uma velocidade de 4000 rpm para sedimentação de bactérias, células epiteliais, restos nucleares e outros detritos. O sedimentado foi desprezado, e o sobrenadante foi, então, congelado em um freezer a -80ºC, até o momento do imunoensaio. A análise da saliva para medição da concentração do EGF foi realizada por meio de um imunoensaio do tipo sanduíche, com a utilização de um Kit ELISA (R & D Systems®). A concentração de EGF foi expressa pela leitura de densidade óptica das amostras em comparação com uma curva padrão, com o auxílio de um leitor de microplaca com absorção de 450nm, seguida de 570 nm de comprimento de onda. As amostras foram submetidas ao ensaio em duplicata.
RESULTADOS
CARACTERIZAÇÃO DA AMOSTRA
Todos os indivíduos pertenciam a uma faixa etária de 40 a 70 anos, sendo 12 do gênero feminino e 3 do masculino. Quanto à etnia, 12 eram não-caucasianos, e 3, caucasianos. Nenhum possuía os hábitos de etilismo ou tabagismo.
FLUXO SALIVAR E CONCENTRAÇÃO DO EGF
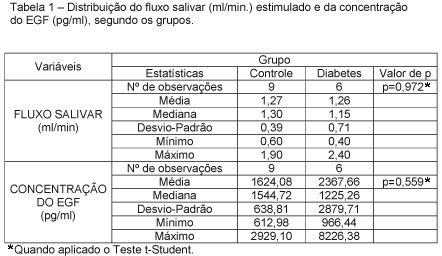
Foram observadas as seguintes médias de fluxo salivar para os grupos G0 e G1, respectivamente: 1,27 ml/min e 1,26 ml/min, não sendo observada diferença estatisticamente entre os dois grupos (p=0,972). A média da concentração de EGF foi de 1624,08 pg/ml no grupo G0 e 2367,66pg/ml no grupo G1, também não sendo essa diferença estatisticamente significante (p=0,559), (Tabela 1).
DISCUSSÃO
O Diabetes Mellitus tipo 2, também chamado diabetes mellitus não dependente de insulina, é a quinta condição crônica mais comum e a sexta maior causa de mortalidade entre os idosos12.
Alterações nos níveis de insulina bem como de glicose no sangue são fatores que afetam diretamente a capacidade das glândulas salivares para sintetizar proteínas específicas13. Desde a descoberta do EGF nas glândulas salivares, avanços foram feitos no conhecimento do estudo da biologia celular e saúde das ciências orais14.
Os fatores de crescimento presentes na saliva desenvolvem um importante papel no reparo dos tecidos moles da cavidade oral7 e na regulação do crescimento celular bem como proliferação e diferenciação8. Trabalhos realizados recentemente provaram a ação de reparação tecidual do EGF4, 6, 7, 12, 14 em diabéticos2,13,15,16,17.
Estudos referem a importância do EGF na proteção da mucosa oral, sendo também possível localizar, na literatura, citações, principalmente em relação ao seu efeito protetor em nível gastrointestinal18 e na mucosa do trato alimentar superior, no tratamento de colites e úlceras gastrointestinais18,19,20.
Tem havido uma compreensão mais profunda da farmacologia de fatores de crescimento que visa ao reforço do processo de cicatrização15, 21,22. Particularmente em pacientes diabéticos, a cicatrização de feridas após cirurgias é frequentemente comprometida. Também é comum a experiência de ulceração crônica das extremidades13,15. Por isso, a redução dos níveis do EGF na saliva pode ajudar a explicar a presença de complicações orais e sistêmicas na cicatrização de feridas associadas com o diabetes2,13,16.
Nossos resultados mostraram que não houve diferença significativa entre fluxo salivar e concentração do EGF entre pacientes saudáveis e diabéticos não insulino-dependentes, o que difere dos achados de Oxford13, que encontrou diferença estatística nessas variáveis, sendo menores as concentrações em pacientes diabéticos.
Sugerimos a necessidade de novos estudos com maior número amostral que possam contribuir para novas descobertas na área do diabetes e dos fatores de crescimento, de maneira a proporcionar melhoria da qualidade de vida dos pacientes portadores dessa patologia crônica, melhorando os processos de reparo e regeneração tecidual nestes.
CONCLUSÃO
Conclui-se não haver diferenças quanto ao fluxo salivar e à concentração do EGF na saliva dos pacientes diabéticos tipo 2 estudados em relação ao grupo controle de indivíduos sem distúrbios sistêmicos.
REFERÊNCIAS
1. World Health Organization. Diabetes: World Health Organization Fact Sheet. 2008; 312. [ Links ]
2. Dogan S, Demirer S, Kepenekci I, Erkek B, Kiziltay A, Hasirci N, et al. Epidermal growth factor-containing wound closure enhances wound healing in non-diabetic and diabetic rats. Int Wound J 2009; 6:107–15 [ Links ]
3. Blakytny R, Jude E. The molecular biology of chronic wounds and delayed healing in diabetes. Diabet Med 2005; 23: 594– 608. [ Links ]
4. Groschl M. The physiological role of hormones in saliva. Bio- Essays 2009, 31: 843-52. [ Links ]
5. Epstein JB, et al. The correlation between growth factor levels in saliva and the severity of oral mucositis during oropharyngeal radiation therapy. Cancer. 2000; 89(11): 2258-65. [ Links ]
6. Ohshima M, et al. Physiologic levels of Epidermal growth factor in saliva stimulate cell migration of an oral epithelial cell line, HO-1-N-1. Eur J Oral Sci 2002; 110: 130-6. [ Links ]
7. Dumbrigue HB, et al. Salivary epidermal growth factor levels decrease in patients receiving radiation therapy to the head and neck. Oral Surg Oral Med Oral Pathol Oral Radiol End 2000; 89(6): 710-6. [ Links ]
8. Konturek JW, et al. Distribution and release of epidermal growth factor in man. Gut 1989; 30(9): 1194-200. [ Links ]
9. Thesleff I, Viinikka L, Saxen L, Lehtonen E, Perheentupa J. The parotid gland is the main source of human salivary epidermal growth factor. Life Science 1988; 43(1): 13-8. [ Links ]
10. Ino M, Ushiro K, Yamashita T, Kumazawa T. Kinetics of epidermal growth factor in saliva. Acta Otolaryngol Suppl 1993; 500:126-30. [ Links ]
11. Krasse B. Risco de cáries - Guia prático para controle e assessoramento. 2 ed. São Paulo: Quintessence, 1988, 113p. [ Links ]
12. Lima DC, Nakata GC, Balducci I, Almeida JD. Oral manifestations of diabetes mellitus in complete denture wearers. The J Prosthetic Dentistry 2008; 99(1): 60-5. [ Links ]
13. Oxford GE, Tayari L, Barfoot MD, Peck AB, Tanaka Y, Humphreys- Beher MG. Salivary EGF levels reduced in diabetic patients. J Diabetes and its complications. 2000; 14: 140-5. [ Links ]
14. Mori M, Sumimoto S, Shrestha P, Tanaka S, Takai Y, Shikimori M. Multifunctional roles of growth factors or biologically active peptides in salivary glands and saliva. Oral Med Pathol 2008; 12: 115-23. [ Links ]
15. Acosta JB, Savigne W, Valdez C, Franco N, Alba JS, del Rio A, et al. Epidermal growth factor intralesional infiltrations can prevent amputation in patients with advanced diabetic foot wounds. Int Wound J 2006; 3:232–9. [ Links ]
16. Lee HY; Yea K, Kim J, Lee BD, Chae YC, Kim HS, et al. Epidermal growth factor increases insulin secretion and lowers blood glucose in diabetic mice. J Cell Mol Med 2008; 12(5A): 1593-604. [ Links ]
17. Akhtar S, Almubrad T, Bron AJ, Yousif MHM, Benter IF, Akhtar S. Role of epidermal growth factor (EGFR) in corneal remodeling in diabetes. Acta Ophthalmologica 2009; 1-9. [ Links ]
18. Guglietta A, Sullivan PB. Clinical applications of epidermal growth factor. Eur J Gastroenterol Hepatol 1995; 7(10); 945-50. [ Links ]
19. Maccini DM; Veit BC. Salivary epidermal growth factor in patients with and without acid peptic disease. Am J Gastroenterol 1990; 85(9): 1102-4. [ Links ]
20. Sarosiek J, et al. Salivary and gastric epidermal growth factor in patients with Zollinger-Ellison Syndrome: its protective potencial. AJG 2000; 9(5): 1158-65. [ Links ]
21. Dagogo-Jack, S., Epidermal growth factor EGF in human saliva: eff ect of age, sex, race, pregnancy, and sialogogue. Scand J Gastroenterol Suppl 1986; 124: 47–54. [ Links ]
22. Playford RJ, Wright NA. Why is epidermal growth factor present in the gut lumen? Gut 1996; 38:303-5. [ Links ]
 Endereço para correspondência
Endereço para correspondência
Monique Danyelle Emiliano Batista Paiva
Rua Tertuliano de Castro, 101/303 - Bessa - João Pessoa/PB - CEP: 58035-170
Email: monique_batista@yahoo.com.br
Recebido para publicação: 22/12/09
Aceito para publicação: 12/04/10













