Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Odontologia Clínico-Científica (Online)
versão On-line ISSN 1677-3888
Odontol. Clín.-Cient. (Online) vol.11 no.2 Recife Abr./Jun. 2012
ARTIGO ORIGINAL / ORIGINAL ARTICLE
Análise histomorfológica da cicatrização óssea em implantes com aplicação de hormônio do crescimento
Histomorphologic analysis of bone repair in implants with growth hormone application
Wander Célio KobayashiI; Daniel Couto UchôaII; Ricardo Padilha FortesIII
ICoordenador do Curso de Especialização em Implantodontia – Uningá/SP
IIDoutor em Biotecnologia pela RENORBIO – Universidade Estadual do Ceará
IIIMestre em Implantodontia pela Universidade de Santo Amaro/SP
RESUMO
O objetivo deste estudo foi avaliar, por meio de análise histomorfológica, se o uso tópico do hormônio do crescimento recombinante humano (rhGH) melhora a cicatrização óssea. Foram realizadas oito cirurgias em oito coelhos, e instalados 32 implantes. Cada coelho recebeu, em suas tíbias, quatro implantes Biomet 3i®, com dimensões de: 3,25mm de diâmetro por 8,5mm de comprimento. Os implantes foram instalados, aplicando-se força de torque inicial de 20Ncm. Os alvéolos cirúrgicos foram divididos em quatro grupos: A (controle - 28 dias): 8 implantes sem aplicação tópica de rhGH e reabertura para avaliação histomorfológica aos 28 dias; A1 (teste – 28 dias): 8 implantes com aplicação tópica de rhGH e reabertura para avaliação histomorfológica aos 28 dias; B (controle – 56 dias): 8 implantes sem aplicação tópica de rhGH e reabertura para avaliação histomorfológica aos 56 dias; B1 (teste – 56 dias): 8 implantes com aplicação tópica de rhGH e reabertura para avaliação histomorfológica aos 56 dias. Após 28 e 56 dias, os coelhos foram sacrificados, e suas tíbias foram seccionadas. As lâminas foram confeccionadas e avaliadas histomorfologicamente. Os resultados histológicos mostraram que o uso tópico do rhGH melhorou a cicatrização óssea ao redor dos implantes nos grupos A1 e B1.
DESCRITORES: Hormônio do Crescimento Humano; Osseointegração; Implantes Dentários.
ABSTRACT
The objective of this study was to evaluate, through histomorphological analysis, if the topical use of the recombinant Growth Hormone (rhGH) improves the bone repair around osseointegrated implants in rabbits tibias. Eight rabbits received four implant each, in their tibias. Thirty-two Biomet 3i® implants were placed, measuring 3.25mm in diameter x 8.5mm in length. The implants were placed with the aid of a torque gauge, by applying a torque force of 20 Ncm. They were divided in four groups: A (control – 28 days): eight implants without topical application of rhGH and reopening for histomorphological assessment at 28 days; A1 (test – 28 days): eight implants with topical application of rhGH and reopening for histomorphological assessment at 28 days; B (control – 56 days): eight implants without topical application of rhGH and reopened for histomorphological assessment at 56 days; B1 (test – 56 days): eight implants with topical application of rhGH and reopened for histomorphological assessment at 56 days. After 28 and 56 days, the rabbits were sacrificed and their tibias were immediately sectioned. The sheets were prepared and histomorphologically evaluated. The histological results showed that the topical use of the rhGH improved the bone repair around the implants of groups A1 and B1.
Keywords: Human Growth Hormone; Osseointegration; Dental Implants.
INTRODUÇÃO
Inúmeros trabalhos vêm sendo realizados com a finalidade de se utilizar um material que possa substituir a raiz de um dente perdido. Dentre tantos materiais, apenas o titânio mostrou ter características químicas e mecânicas que permitam sua utilização com essa finalidade. Em diversos trabalhos retrospectivos, evidenciaram-se altos índices de sucesso na osseointegração dos implantes dentários de titânio. Esses índices levaram à consagração do uso dos implantes dentários de titânio em Odontologia.1
Embora tenha se atingido um alto grau de previsibilidade no tratamento com implantes, persiste ainda um pequeno índice de insucesso, fazendo com que os pesquisadores se preocupem com mudanças no desenho dos implantes, no tratamento de superfícies e na busca de adaptações cada vez mais precisas e estáveis das conexões protéticas sobre esses implantes. Além de mudanças na estrutura dos implantes e de suas conexões, os pesquisadores objetivam estudar as alterações endógenas e exógenas que possam interferir, de maneira significativa, no processo de osseointegração dos implantes.2,3
Apesar do sucesso dos implantes osseointegráveis1, mesmo em tratamentos com implantes com carga precoce4, a literatura mostra que há um índice de perda de implante empacientes diabéticos5 e fumantes6; nesses casos, os pacientes submetidos ao tratamento com implantes precisam estar controlados durante o tempo de cicatrização óssea ao redor dos implantes. Por essa razão, quanto menor o tempo de cicatrização óssea ao redor dos implantes, menor será o tempo de controle desses pacientes, melhorando, assim, a previsibilidade de sucesso dos tratamentos com implantes nesses tipos de paciente.
Outros fatores que podem afetar a osseointegração são: osteoporose7, tempo de cirurgia8 e radioterapia9.
A evolução no desenho dos implantes, na forma de união das conexões e as diversas formas de tratamento de superfície promovem um aumento da adesão do coágulo sanguíneo, e essas inovações são responsáveis pelo aumento da previsibilidade do tratamento.10
Alguns trabalhos procuram esclarecer as causas dos fracassos dos implantes osseointegrados, sugerindo, muitas vezes, que os fatores endógenos possam estar relacionados com a idade, a saúde geral e os hábitos do paciente e com fatores exógenos relativos ao operador, a biomateriais e à qualidade óssea.8,11
Algumas pesquisas foram realizadas no sentido de se avaliar a utilização de medicamentos e hormônios que pudessem atuar na melhoria da ossointegração.12,13,14
As pesquisas com hormônio do crescimento (GH) revelam que a administração local pode estimular o crescimento da largura da cartilagem da epífise e o crescimento longitudinal do osso, mostrando que a administração de GH teve a capacidade de estimular localmente o crescimento ósseo.15
O GH, como diz o próprio nome, é responsável pelo crescimento da criança durante a fase de crescimento. Trata-se de uma proteína globular, com 191 aminoácidos em sua estrutura, produzida na parte anterior da glândula hipófise.
A administração local do hormônio do crescimento recombinante humano (rhGH) pode estimular as primeiras fases do processo de remodelação óssea, em que a resposta cortical e o contato osso-implante foram significantemente maiores no grupo em que foi utilizado rhGH12.
Durante a colocação do implante, a administração local de rhGH induziu reação periostal, transcostical e mineralização óssea ao redor da superfície do titânio.13
Os resultados encontrados na literatura, em que o GH e rhGH diminuem o tempo de cicatrização óssea bem como a possibilidade da aplicação clínica dessa droga em implantodontia, foram a motivação da realização desta pesquisa.
PROPOSIÇÃO
O presente trabalho objetivou avaliar, por meio da análise histomorfológica, se o uso tópico de hormônio do crescimento recombinante humano (rhGH) melhora a cicatrização óssea ao redor dos implantes dentários instalados em tíbias de coelhos.
MATERIAL E MÉTODO
•Seleção dos Animais
Foram utilizados oito coelhos New Zealand fêmeas, com peso variando entre 3,0 e 3,4 kg e idades entre 11 e 15 meses, provenientes do biotério do Laboratório Universitário de Análises Toxicológicas (Unitox) da Universidade de Santo Amaro/UNISA.
A pesquisa foi realizada de acordo com os "Princípios Éticos de Experimentação Animal", elaborados pelo Colégio Brasileiro de Experimentação Animal (COBEA). Os animais foram inicialmente mantidos em observação por um período de 15 dias após sua chegada, para que fossem descartadas quaisquer anomalias em seu estado geral de saúde. Foram acondicionados em local apropriado, com ventilação e temperaturas controladas (22 ± 2° C). Durante todo o experimento, foram alimentados com ração Nutriara® (Nutriara Alimentos Ltda., Paulínia/SP, Brasil) e água administrada ad libtum. A higienização das gaiolas foi realizada de acordo com as normas do biotério do Unitox, ou seja, lavadas diariamente, com água e sabão e desinfetadas com desinfetante hospitalar, sendo diariamente realizada a troca da maravalha estéril. Durante o período experimental, os animais foram mantidos em gaiolas de ferro, sob as mesmas condições ambientais.
Os animais receberam a mesma quantidade e qualidade de ração e ficaram sob a supervisão dos veterinários da Faculdade de Medicina Veterinária da UNISA. O protocolo de pesquisa foi aprovado pelo Comitê de Ética em Pesquisa da UNISA (REGISTRO CEP UNISA Nº 042/07)
•Preparo dos Animais
Foram acondicionados em gaiolas individuais e identificados por números Os animais marcados em suas orelhas. No prontuário, havia a data da cirurgia e o nome do cirurgião. Eles foram pesados no pré-operatório, para que fosse estabelecida a dose ideal do anestésico e da medicação pós-operatória.
Na medicação pré-anestésica (MPA), foram utilizados 0,6ml de Cloridrato de Ketamina (Vetanorcol® – 50mg/ml, König, Avellaneda, Argentina), 0,3ml de Midazolan (Fenelon® – 5mg/ml, Hipolabor, Belo Horizonte/MG, Brasil) e 0,5ml de Mepiridina (Dolosal® - 50mg/ml, Cristália Produtos Químicos e Farmacêuticos, Itapira/SP, Brasil) por via intramuscular. E, para a indução, 1,0ml de Cloridrato de Ketamina intramuscular (IM), injetada após 10 minutos da MPA; como manutenção, foi aplicado 0,4 ml de Cloridrato de Ketamina a cada 15 minutos, até o término da cirurgia.
A partir da indução, o animal passava a receber oxigênio, via máscara inalatória, adaptada ao focinho, durante todo o procedimento cirúrgico. Após a verificação da indução anestésica pela ausência do reflexo de dor, estimulada pela pressão bidigital na orelha do animal, foi realizada a tricotomia na região da tíbia a ser operada. Ele recebia anestesia infiltrativa na região medial da tíbia, onde era aplicado, por meio do uso de seringa carpule, um tubete de anestésico, contendo Cloridrato de Prilocaína mais Felipressina a 0,03 Ul/ml (Citanest®, Dentsply Pharmaceutical, Catanduva/SP, Brasil). A anestesia infiltrativa foi realizada, porque, em cirurgias anteriores, foram relatadas contrações musculares, o que poderia sugerir sensibilidade dolorosa.
•Técnica cirúrgica
Com o uso de uma lâmina de bisturi nº 15c (Embramed Indústria e Comércio de Produtos Hospitalares Ltda., Jurubatuba/SP, Brasil), foi realizada uma incisão na pele, na face anterior da tíbia, com extensão de aproximadamente 5cm. Posteriormente, foram incisadas as fácias musculares, com exposição da musculatura. Com o uso de uma tesoura Metszembaun (Duflex, Rio de Janeiro/RJ, Brasil), foi realizada a divulsão da musculatura até a exposição do periósteo que se apresentava extremamente delgado. Este, por sua vez, foi incisado com uma leve pressão da lâmina de bisturi contra o osso. Em seguida, o periósteo foi deslocado com o uso de uma cureta de Molt (Duflex, Rio de Janeiro/RJ, Brasil) e com o auxílio de uma pinça mosquito (Duflex, Rio de Janeiro/RJ, Brasil), permitindo a exposição completa da superfície óssea com o menor trauma possível.
O contra-ângulo cirúrgico 16:1 (Kavo do Brasil Ind., Joinville/SC, Brasil), conectado ao micromotor cirúrgico Biomet 3i® (Implant Innovations do Brasil Ltda., São Paulo/SP, Brasil), tinha a rotação previamente ajustada para 1700 RPM e a bomba peristáltica ajustada para o máximo de vazão. Um kit cirúrgico Biomet 3i® (Implant Innovations do Brasil Ltda., São Paulo/SP, Brasil) estéril foi depositado sobre o campo cirúrgico, quando, então, deu-se início às perfurações para o preparo dos alvéolos cirúrgicos. Inicialmente utilizou-se a fresa esférica para marcar os pontos de perfuração (Figura 1), feitos no lado medial da tíbia o mais próximo possível da articulação do joelho e posteriormente o mais distante possível, na direção da articulação da pata, sem provocar danos a estas. Na sequência, foi utilizada a fresa supercortante, alterando o protocolo sugerido pelo fabricante; em seguida, foi utilizada a fresa piloto 2/3. Para diminuir o estresse no osso, no momento da inserção dos implantes, utilizou-se a fresa de 3,0mm. Finalizando, foi utilizada a fresa macho de rosca (TAP) com diâmetro do implante (3,25mm), o que permitia a confecção da rosca no osso, facilitando a inserção dos implantes (Figura 2) e possibilitando o controle uniforme da força de torque de instalação padronizado em 20Ncm, mediante a utilização do torquímetro (Intra-Lock® Int, Boca Raton/FL, USA).
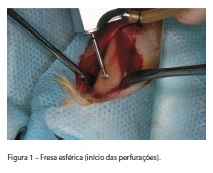
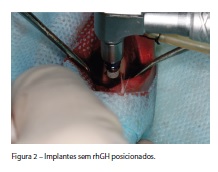
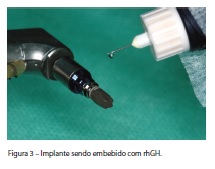
Cada animal recebeu quatro implantes de titânio Biomet 3i® (Implant Innovations do Brasil Ltda., São Paulo/SP, Brasil) com tratamento de superfície Osseotite®, medindo 3,25mm de diâmetro por 8,5mm de comprimento, dois em cada tíbia. No grupo-controle, os implantes não foram embebidos no rhGH, entretanto, no grupo-teste, os implantes foram embebidos com oito gotas de rhGH (Norditropin® SimplexxTM 5mg/1,5ml, Novo Nordisk Farmacêutica do Brasil Ltda., Araucária/PR, Brasil), que é equivalente a 0,4mg, proporcionando, assim, o molhamento total de cada implante (Figura 3). Para que os implantes recebessem a mesma quantidade de hormônio, utilizou-se o dispersador de hormônio do fabricante (Novo Nordisk Farmacêutica do Brasil Ltda., Araucária/PR, Brasil).
Após instalação dos implantes, foi realizada sutura interna com fio de nylon ETHICON® 4.0 (Johnson & Johnson Com. e Distribuição Ltda. São José dos Campos/SP, Brasil). Terminada a sutura da pele, foi feito um curativo oclusivo, com o uso de atadura de gaze fixada por esparadrapo.
•Delineamento do estudo
Os alvéolos cirúrgicos foram divididos em quatro grupos experimentais, conforme o tempo de sacrifício e de acordo com a aplicação de rhGH na superfície do implante.
Grupo A: (controle – 28 dias): oito implantes instalados sem a aplicação via tópica de rhGH que sofreram reabertura aos 28 dias para avaliação histomorfológica.
Grupo A1: (teste – 28 dias): oito implantes instalados com aplicação tópica de rhGH e que sofreram reabertura aos 28 dias para avaliação histomorfológica.
Grupo B: (controle – 56 dias): oito implantes instalados sem a aplicação tópica de rhGH e que sofreram reabertura aos 56 dias para avaliação histomorfológica.
Grupo B1: (teste – 56 dias): oito implantes instalados com a aplicação tópica de rhGH e que sofreram reabertura aos 56 dias para avaliação histomorfológica.
•Análise histológica
Decorridos 28 e 56 dias, todos os coelhos de cada grupo foram sacrificados em cada um dos períodos, utilizando-se a técnica preconizada pelo COBEA por meio de superdose do medicamento tiopental sódico (Thiopentax®, Cristália Produtos Químicos e Farmacêuticos, Itapira/SP, Brasil) na dose de 200mg/kg de peso do animal. As tíbias foram cuidadosamente dissecadas, e, em seguida, seccionadas, utilizando-se o motor de implante com um disco diamantado (Komet Brazil, Santo André/SP, Brasil) conectado a uma peça reta INTRAmatic 10 ABN 1:1 (Kavo do Brasil Ind., Joinville/SC, Brasil). Para que não houvesse alteração das amostras, foi utilizada irrigação com soro fisiológico 0,9% (Segmenta Farmacêutica Ltda., Ribeirão Preto/SP, Brasil). As secções foram feitas com uma margem de 5mm de distância dos implantes, sendo que essas continham os dois implantes. Após serem removidas, as peças foram imediatamente armazenadas em formol 10% (pH 7,0), durante 72 horas.
Todos os frascos foram identificados com etiquetas escritas com grafite. As amostras foram enviadas ao Departamento de Histologia da UNISA, onde foram descalcificadas com ácido fórmico 5%, por um período de 21 dias. Após a descalcificação, os implantes foram removidos através de pressão rotacional no sentido anti-horário, com o auxílio do torquímetro adaptado ao montador do implante.
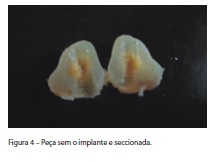
Removidos os implantes, as peças foram seccionadas no meio e ao longo eixo do espaço deixado pelo implante (Figura 4) e novamente colocadas em solução de ácido fórmico 5%, por mais 21 dias, finalizando a descalcificação. Após a descalcificação, as peças foram diafanizadas com xilol comercial, por três dias. Em seguida, as amostras foram processadas e incluídas em parafina, e foram realizados cortes com 5μm de espessura, utilizando micrótomo. As lâminas foram coradas com hematoxilina-eosina, tricrômico de Mallory e tricrômio de Masson, e os cortes histológicos foram analisados por meio de microscopia de luz.
RESULTADOS
•Grupo A (controle – 28 dias)
A cicatrização óssea se processou de maneira completa, somente no osso cortical relativo à diáfise da tíbia, porém, na região relativa à medula, não houve processo de cicatrização significativo. Essa região manteve a presença de um tecido mole de aspecto típico de medula óssea amarela, e esse tecido demonstrou a presença maciça de células adiposas e uma quantidade significativa de vasos sanguíneos (Figura 5).
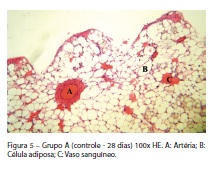
Observando-se em maior aumento esse tecido mole medular, especificamente na região relativa às espiras do implante, foi possível identificar algumas regiões de tecido conjuntivo frouxo, com a presença de fibroblastos e raras fibras colágenas. Também se verificou a presença de algumas regiões de infiltrado mononuclear focal, de caráter inflamatório. Ainda nessas amostras, em raras regiões desse tecido medular, especificamente na sua interface em relação ao implante, pequenos centros de ossificação apresentaram formação de osso tipicamente primário.
Verificou-se, também, nessas amostras, a presença do sistema circunferencial interno, estrutura típica da face interna de qualquer cilindro diafisário, em que as fibras colágenas de matriz óssea se organizam em arranjos paralelos à superfície interna do osso, determinando a "cortical interna" do canal medular. A presença desse sistema circunferencial interno delimita a circunferência do canal medular que se mostrou preservada e preenchida somente pelo tecido medular, já descrito anteriormente. Essa situação não foi observada nos grupos-teste, nos quais não foi possível observar esse canal medular, uma vez que essa região estava totalmente preenchida por tecido ósseo.
•Grupo A1 (teste – 28 dias)
Foi encontrado, em toda a superfície do implante, desde a cervical até o ápice, osso neoformado sem a presença de tecido conjuntivo, indicando fibrose. Foi observada nitidamente a interface entre o osso pré-existente (tipicamente secundário) e o osso neoformado. Este presente nas espiras dos implantes, apresenta osteócitos em grande quantidade, habitando em lacunas amplas, o que nos leva a acreditar que são osteócitos jovens. Ainda se mostram presentes alguns centros de ossificação intramembranosos no interior do osso neoformado, revestidos de osteoblastos secretores (Figura 6).
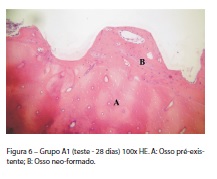
Observou-se que o osso neoformado já se encontrava em fase de substituição para osso secundário (maduro), uma vez que foi possível observar sistemas de Havers em formação, já apresentando canais de Havers e osteócitos distribuídos em sistemas de lamelas concêntricas ao redor desses canais. Ainda é evidente a observação de que esses osteócitos presentes no sistema de Havers habitam lacunas típicas de osso secundário, porque são lacunas de volume reduzido e formato elipsoide. O osso pré-existente é tipicamente secundário, fazendo parte da cortical diafisária da tíbia do animal.
•Grupo B (controle – 56 dias)
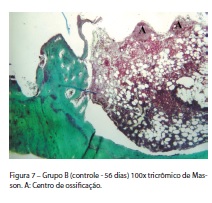
Foi observada a presença de cicatrização óssea completa somente na região da cortical da tíbia. Na região medular, não houve processo de ossificação significativo, tendo a mesma descrição do grupo A (controle de 28 dias). A diferença observada foi no sentido de que o osso na região medular, relativo às espiras do implante, pareceu ser um pouco mais maduro (Figura 7).
•Grupo B1 (teste – 56 dias)
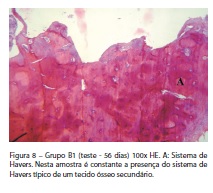
Aos 56 dias, mesmo com o processo de descalcificação das amostras, encontramos dificuldade no momento da remoção dos implantes. Isso foi revelado, também, nos cortes histológicos que revelaram uma destruição parcial da superfície óssea relativa à região do implante. O osso remanescente encontrado nas amostras revelou-se maduro, recobrindo toda a extensão do implante desde a região cervical até a região mais profunda do alvéolo cirúrgico. Não foi possível observar nenhum tipo de tecido fibroso ao redor do implante (Figura 8).
•Considerações Finais
No grupo A1 (teste – 28 dias), verificou-se diferença macroscópica em relação ao grupo A (controle – 28 dias). A porção medular da tíbia dos coelhos do grupo A1 apresentou-se macroscopicamente compacta. Na análise microscópica, observamos a presença de grande quantidade de osteócitos jovens, alguns centros de ossificação e locais com osso secundário. A melhoria da cicatrização óssea ao redor dos implantes, obtida em nossos experimentos, se deu por meio de uma maior e mais rápida formação óssea ao redor dos implantes. Nos grupos A1 e B1, em que o rhGH foi administrado localmente, houve uma evidente atividade estimulatória de regeneração óssea, mostrando que o rhGH exerce efeito específico e direto no tecido ósseo.
DISCUSSÃO
Com o objetivo de melhorar a previsibilidade de sucesso e diminuir o tempo de cicatrização dos implantes osseointegrados, muitas pesquisas foram realizadas com o propósito de aumentar a superfície de contato osso-implante por meio dos tratamentos de superfície. Vários autores demonstraram que a extensão da interface osso-implante é positivamente relacionada com o aumento da rugosidade da superfície do implante16,17, porque ocorre um aumento significante nos níveis de adesão celular. Estudos com implantes cujo tratamento é à base de superfície SLA®, TPS e Osseotite® resultaram em melhoria da osseointegração e da qualidade óssea ao redor desses implantes.18,19
A literatura relata também que fatores sistêmicos podem alterar a osseointegração devido à interferência na cicatrização óssea. E, ainda, que o hormônio de crescimento melhora a deposição de osso e a força mecânica de defeitos em cicatrização óssea.7
Uma vez que o rhGH administrado sistemicamente pode levar a efeitos colaterais relacionados à quantidade excessiva e ao uso prolongado20, levando-se em consideração que o GH tem ação local, estudos foram feitos para avaliar a melhoria da osseointegração com a aplicação tópica de rhGH e GH na instalação de implantes.12,13,21,22 Seguindo essa linha de raciocínio, foi desenvolvida esta pesquisa.
A melhoria da cicatrização óssea ao redor dos implantes obtida neste trabalho se deu por meio de uma maior e mais rápida formação óssea ao redor dos implantes, o que está de acordo com os achados de alguns autores que demonstraram que a administração do rhGH aumenta a deposição óssea e resistência mecânica de defeitos em cicatrização em calvária de ratos.23
Alguns trabalhos comprovam que, quando o GH é administrado localmente, existe uma clara atividade estimulatória de regeneração óssea, mostrando que o GH exerce efeito específico e direto no tecido ósseo21,22, o que vai de encontro aos resultados deste trabalho.
CONCLUSÃO
Com base na metodologia empregada e nos resultados obtidos, pode-se concluir que o uso tópico de rhGH melhorou a cicatrização óssea ao redor dos implantes tanto no grupo A1 (teste – 28 dias) quanto no grupo B1 (teste – 56 dias).
REFERÊNCIAS
1. Cronin RJ Jr, Oesterle LJ. Implant use in growing patients. Treatment planning concerns. Dent Clin North Am 1998; 42(1);1-34 [ Links ]
2. Lindquist LW, Carlsson GE, Jemt T. A prospective 15-year follow-up study of mandibular fixed prostheses supported by osseointegrated implants. Clinical results and marginal bone loss. Clin Oral Implants Res 1996;7(4):329-36. [ Links ]
3. Mericske-Stern R, Aerni D, Buser D, Geering, AH. Long-term evaluation of non-submerged hollow cylinder implants. Clin Oral Impl Res 2001; 12: 252-9. [ Links ]
4. Qu Z, Rausch-Fan X, Wieland M, Matejka M, Schedle A. The initial attachment and subsequent behavior regulation of osteoblasts by dental implant surface modification. J Biomed Mater Res 2007 Sep 1;82(3):658-68. [ Links ]
5. Esposito M, Hirsch JM, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated oral implants (II). Etiopathogenesis. Eur J Oral Sci 1998;106(3):721-64. [ Links ]
6. van Steenberghe D, Quirynen M, Molly L, Jacobs R. Impact of systemic diseases and medication on osseointegration. Periodontol 2000, 2003;33:163-71. [ Links ]
7. Tresguerres IF, Alobera MA, Baca R, Tresguerres JA. Histologic, morphometric, and densitometric study of peri-implant bone in rabbits with local administration of growth hormone. Int J Oral Maxillofac Implants 2005;20(2):193-202. [ Links ]
8. Tresguerres IF, Clemente C, Donado M, Gómez-Pellico L, Blanco L, Alobera MA et al. Local administration of growth hormone enhances periimplant bone reaction in an osteoporotic rabbit model. Clin Oral Implants Res 2002;13(6):631-6. [ Links ]
9. Clemente de Arriba C, Rodriguez-Torres R, Fernandez-Tresguerres I, Tresguerres JAF, Gomez-Pellico L. The role of growth hormone in bone response for implant treatment. Experimental study using presenile animals. Eur J Anat. 2001;5(2):105-11. [ Links ]
10. Isaksson OGP, Lindahl A, Nilsson A, Isgaard J. Mechanism of stimulatory effect of growth hormone on longitudinal bone growth. Endodrine Reviews 1987;8(4):426-38. [ Links ]
11. Engstrand P, Gröndahl K, Ohrnell LO, Nilsson P, Nannmark U, Brånemark PI. Prospective follow-up study of 95 patients with edentulous mandibles treated according to the Brånemark Novum concept. Clinical Implant Dent Relat Res. 2003; 5(1):3-10. [ Links ]
12. McCrachen MS, Aponte-Wesson R, Chavali R, Lemons JE. Bone associated with implants in diabetic and insulin-treated rats. Clin Oral Impl Res. 2006;17(5):495-500. [ Links ]
13. Hinode D, Tanabe S, Yokoyama M, Fujisawa K, Yamauchi E, Miyamoto Y. Influence of smoking on osseointegrated implant failure: a meta-analysis. Clin Oral Implants Res. 2006;17(4):473-8. [ Links ]
14. Mombelli A, Cionca N. Systemic diseases affedting osseointegration therapy. Clin Oral Implants Res 2006;17(2):97-103. [ Links ]
15. Yerit KC, Posch M, Seemann M, Hainich S, Dörtbudak O, Turhani D et al. Implant survival in mandibles of irradiated oral cancer patients. Clin Oral Implants Res. 2006;17(3):337-44. [ Links ]
16. Buser D, Schenk RK, Steinemann S, Fiorellini JP, Fox CH, Stich H. Influence of surface characteristics on bone integration of titanium implants. A histomorphometric study in miniature pigs. J Biomed Mater Res 1991;25(7):889-902. [ Links ]
17. Brunette, DM. The effect of implant surface topography on the behavior of cells. Int J Oral Maxillofac Implants. 1988;3(4):231-46. [ Links ]
18. Veis AA, Papadimitriou S, Trisi P, Tsirlis AT, Parissis NA, Kenealy JN. Osseointegration of Osseotite and machined-surfaced titanium implants in membrane-covered critical-sized defects: a histologic and histometric study in dogs. Clin Oral Implants Res. 2007;18(2):153-60. [ Links ]
19. Cochran DL, Schenk RK, Lussi A, Higginbottom FL, Buser D. Bone response to unloaded and loaded titanium implants with a sandblasted and acid-etched surface: a histometric study in the canine mandible. J Biomed Mater Res. 1998;40(1):1-11. [ Links ]
20. Guyton AC, Hall JE. Os hormônios hipofisários e seu controle pelo hipotálamo. In: Tratado de Fisiologia Médica. Rio de Janeiro: Guanabara Koogan; 2002. p 791-801. [ Links ]
21. Gómez-Moreno G, Cutando A, Arana C, Worf CV, Guardia J, Muñoz F et al. The effects of growth hormone on the initial bone formation around implants. Int J Oral Maxillofac Implants. 2009;24(6):1068-73. [ Links ]
22. Hossam Eldein AM, Elghamrawy SH, Osman SM, Elhak AR. Histological evaluation of the effect of using growth hormone around immediate dental implants in fresh extraction sockets: an experimental study. Implant Dent. 2011 Feb;20(1):47-55. [ Links ]
23. Cacciafesta V, Dalstra M, Bosch C, Melsen B, Andreassen TT. Growth hormone treatment promotes guided bone regeneration in rat calvarial defects. Eur J Orthod. 2001 Dec;23(6):733-40. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Ricardo Padilha Fortes
Rua Doutor José Lourenço, 590 – sala 06
Meireles – Fortaleza/CE
CEP: 60115-280
e-mail: drfortes@hotmail.com
Recebido para publicação: 11/11/11
Enviado para reformulação: 23/04/12
Aceito para publicação: 30/05/12













