Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista de Cirurgia e Traumatologia Buco-maxilo-facial
versão On-line ISSN 1808-5210
Rev. cir. traumatol. buco-maxilo-fac. vol.10 no.1 Camaragibe Jan./Mar. 2010
ARTIGO ORIGINAL
Atividade antimicrobiana do extrato de Momordica charantia L.
Antimicrobial activity of the Mormodica charantia L. extract
Elizabeth Arruda Carneiro PonziI; Thompson Lopes de OliveiraII; Iracema Andrade Ferrer de MoraisIII; José Justino da Silva JúniorIV; Marleny Martinez GerbiV; Ivone Antônia de SouzaVI; Maria Nelly Caetano PsiottanoVII; Haroudo Satiro XavierVIII
IProf.ª Assistente do Departamento de Prótese e Cirurgia Buco-Maxilo-Facial da UFPE
IIProf. Adjunto da Universidade Federal da Paraíba
IIIProf. Adjunto da Universidade Federal de Pernambuco - UFPE
IVCirurgião-dentista, mestre em Ciências Farmacêuticas da UFPE
VProf.ª Adjunta da Universidade de Pernambuco – UPE
VIProf.ª Adjunta do Departamento de Antibióticos da UFPE
VIIProf.ª Titular do Departamento de Ciências Farmacêuticas da UFPE
VIIIProf. Titular do Departamento de Ciências Farmacêuticas da UFPE
RESUMO
INTRODUÇÃO: A Momordica charantia L., conhecida popularmente como Melão de São Caetano, pertencente à família das Cucurbitaceae, é uma planta tropical, de crescimento rápido, comum em terrenos abandonados e que apresenta efeito medicinal, comprovado para o tratamento de várias afecções de origem microbiana.
METODOLOGIA: Para a realização dos ensaios microbiológicos, foram selecionados espécimes de origem clínica bem como, cepas padrões de origem ATCC. Em placas esterilizadas, foi depositado 1 mL da suspensão de cada microrganismo teste, e, em seguida, foram realizadas cavidades por meio de cânulas estéreis, em que foram depositadas alíquotas do extrato de Momordica charantia L em concentrações diferenciadas. Os controles antimicrobianos utilizados foram: Tetraciclina e Cloranfenicol para bactérias e Cetoconazol para fungos.
RESULTADOS: O extrato hidroetanólico da planta foi eficaz para Staphylococos aureus e epidermidis e para os fungos Candida albicans e tropicalis.
CONCLUSÃO: O extrato hidroetanólico de M. charantia L. foi eficaz, inibindo as linhagens estudadas, sugerindo a utilização dessa substância como meio alternativo de baixo custo para o tratamento das afecções da boca, justificando seu desenvolvimento tecnológico farmacêutico.
Descritores: Mormodica charantia L. Extratos Vegetais. Plantas Medicinais.
ABSTRACT
INTRODUCTION: The Momordica charantia L., a member of the Cucurbitaceae plant family, is a fast-growing tropical plant, commonly found on abandoned land, which has proven medicinal effects for the treatment of various diseases of microbial origin.
METHODOLOGY: For a microbiological study specimens of clinical and ATCC origin were selected. One ml of each microbe suspension was deposited on sterilized plates. Next, cavities were made using sterilized canullae, into which the extract of the plant was injected in different concentrations. The antimicrobial activity was tested using tetracycline and cloanphenicol for bactéria and cethocanozol for fungi.
RESULTS: The aqueous ethanol extract was effective for Staphylococcus aureus and epidermidis and for the Cândida albicans and tropicalis fungi.
CONCLUSION: The aqueous ethanol extract of the plant species M. charantia L. was effective in the microbes studied, suggesting that the use of this substance is a low-cost option in the treatment of diseases of the mouth, justifying its technological pharmaceutical development.
Keywords: Mormodica charantia L. Plant Extracts. Plants, Medicinal.
INTRODUÇÃO
A partir de uma perspectiva histórica, a produção de medicamentos e o tratamento farmacológico de diversas doenças tiveram seu início com o uso de plantas medicinais. Em 1800, quando a medicina entrou na era científica, a medicina tradicional que utilizava as plantas era considerada base inquestionável para todos os livros-textos clássicos de farmacologia1,2.
Os Chineses, Egípcios, Indus e Gregos foram os primeiros a catalogar as ervas medicinais, classificando-as de acordo com sua forma, cor, sabor e aroma, incluindo, também, suas ligações com os astros e com os atributos mágicos. O conjunto de dados a respeito das plantas foi sendo transmitido por diversas gerações e melhorando, cada vez mais, através da incorporação de outras ervas, assim como as técnicas de utilização3,4.
Desde a Antiguidade, o homem tem utilizado as plantas para o tratamento de diversas doenças5. Com a evolução da ciência e dos métodos de análise, as plantas com atividades terapêuticas começaram a ser estudadas sob o ponto de vista químico; procurou-se isolar os seus princípios ativos para verificar os efeitos que exerceriam no organismo animal6.
Em decorrência do alto custo dos medicamentos e da baixa condição financeira de 80% da população mundial, as plantas voltaram a ser um importante aliado nos serviços de saúde. A Organização Mundial de Saúde (OMS), reconhecendo essa realidade lançou, em 1972, um incentivo à chamada Medicina Tradicional, em que a Fitoterapia se destaca como uma das práticas mais importantes. Em qualquer caso, o aproveitamento adequado das ervas medicinais depende de vários fatores: Plantio, Coleta, Secagem, Armazenamento e Forma de Preparo6,7.
O Staphylococcus aureus é um patógeno em potencial e pode ser encontrado na região da orofaringe e nas fossas nasais. São agentes responsáveis por infecções de ferimentos e representam a terceira causa mais comum de infecção hospitalar8.
A análise da resistência estafilocócica a agentes antimicrobianos tem revelado três mecanismos bioquímicos principais que se constituem de: inativação de antimicrobianos através de enzimas que modificam ou hidrolisam estes agentes; por alteração dos receptores-alvo, seja em decorrência da aquisição de um alvo com reduzida afinidade ao antimicrobiano devido à aquisição de enzimas que possam converter o alvo nativo, seja através de mutação de genes que codifiquem este alvo e, finalmente, por um acesso limitado dos antimicrobianos9.
MATERIAIS E MÉTODOS
O presente trabalho foi realizado no Laboratório de Micologia do Departamento de Ciências Farmacêuticas do Centro de Ciências da Saúde da Universidade Federal da Paraíba.
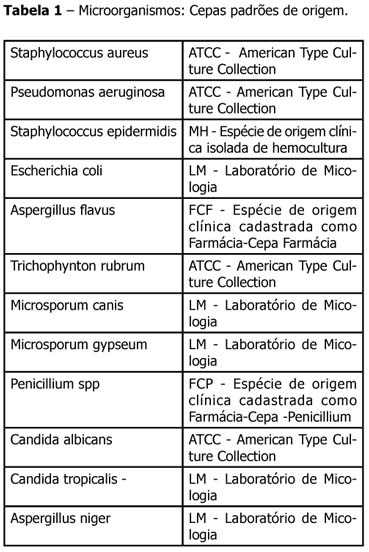
Para a realização dos ensaios microbiológicos, foram selecionados espécimes de origem clínica, registradas no Laboratório de Micologia do Departamento de Ciências Farmacêuticas da UFPB bem como cepas padrões de origem ATCC: Staphylococcus aureus (ATCC-25923), Pseudomonas aeruginosa (ATCC-9028), Staphylococcus epidermidis - MH, Escherichia coli - LM, Aspergillus flavus (FCF-126), Trichophynton rubrum (ATCC-2812), Microsporum canis (LM-003), Microsporum gypseum (LM-002), Penicillium spp (FCP-281), Candida albicans (ATCC-90028), Candida tropicalis LM-13 e Aspergillus niger (LM-05).
Método de difusão em meio sólido: utilizado na determinação do "screening" da atividade antimicrobiana dos extratos de Momordica charantia L contra bactérias e fungos de coleção: em placas esterilizadas, foi depositado 1 mL da suspensão de cada microrganismo teste, preparada em solução fisiológica a 0,85% padronizada pelo tubo de 0,5 na escala de McFarland e ajustada para 90% T (530 nm), correspondendo aproximadamente a 106 UFC/mL.
Em seguida, foi adicionado às placas com a suspensão dos microrganismos 21mL do meio sólido, fundido a 50º C, específico para cultivo de bactérias e de fungos. Posteriormente, após solidificação, foram realizadas cavidades de 6x8mm de diâmetro por meio de cânulas estéreis, nas quais foram depositadas alíquotas de 50 µ L do extrato de Momordica charantia L em concentrações diferenciadas. Os controles antimicrobianos utilizados foram: Tetraciclina e Cloranfenicol 30 µg para bactérias e Cetoconazol a 50 µ L para fungos.
Os ensaios foram incubados a 35º C +/- 2º C por 24-48 horas, para culturas bacterianas, e leveduriformes à temperatura ambiente por 7-14 dias para fungos filamentosos.
RESULTADOS
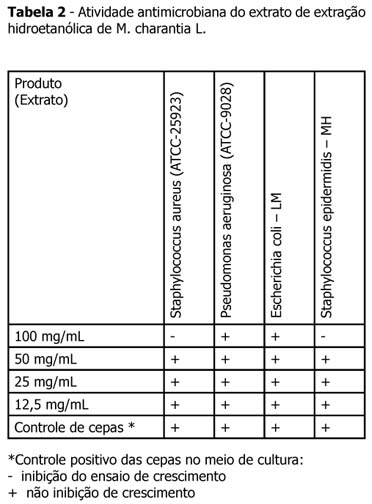
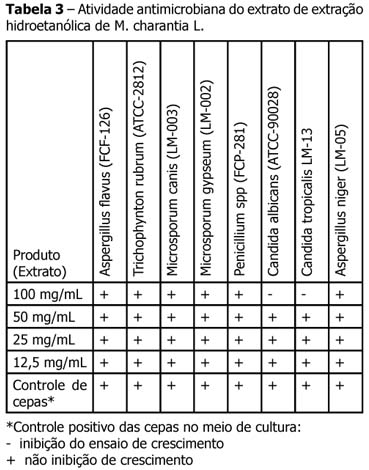
As cepas utilizadas para determinação da eficácia antimicrobiana do extrato de M charantia L., neste estudo, são apresentadas na Tabela 1 na qual figuram as cepas padrões ATCC e isolados clínicos. As atividades evidenciadas pelo extrato nas concentrações de 100 mg/mL, 50 mg/mL, 25 mg/mL e 12,5 mg/mL são apresentadas nas Tabelas 2 e 3. Os halos de inibição do extrato de M charantia L. à concentração de 100 mg/mL foram para Staphylococcus aureus ATCC de ordem de 12 mm e para Staphylococcus epidermidis MH foram de 13 mm, contra halos de diâmetro de 16 a 19 mm para os antibióticos padrões (Tetraciclina 30 µg , Cloranfenicol 30 µg), para Candida albicans ATCC de ordem de 12 mm, para Candida tropicalis LM foram de 10 mm contra halos de diâmetro de 16 a 15 mm para o antibiótico padrão Cetaconazol 50 µg.
DISCUSSÃO
A medicina tradicional tem-se mostrado ineficiente em alguns aspectos relacionados às infecções causadas por um número grande de microrganismos existentes. Os resultados positivos obtidos neste testes de ação antimicrobianas do extrato de M. charantia L numa concentração inibitória mínima de 100 mg/ml corroboraram os autores que já defendiam o potencial farmacológico ativo das plantas medicinais 3,4.
Em relação aos métodos de tratamento com antibioticoterapia, muitas vezes se mostram ineficazes ou realizados de maneira que propiciam o desenvolvimento, cada vez maior, de resistência bacteriana9.
As cepas utilizadas para determinação da eficácia antimicrobiana do extrato de M charantia L , neste estudo, são apresentadas na Tabela 1 na qual figuram as cepas padrões ATCC e isolados clínicos. As atividades evidenciadas pelo extrato nas concentrações de 100 mg / mL ,50 mg / mL , 25 mg / mL e 12,5 mg / mL são apresentados nas Tabelas 2 e 3. Os halos de inibição do extrato de M charantia L à concentração de 100mg / mL foram para Staphylococcus aureus ATCC de ordem de 12 mm e para Staphylococcus epidermidis MH foi de 13 mm , contra halos de diâmetro de 16 a 19 mm para os antibióticos padrões (Tetraciclina 30 µg , Cloranfenicol 30 µg ), para Candida albicans ATCC de ordem de 12 mm, para Candida tropicalis LM foram de 10 mm , contra halos de diâmetro de 16 a 15 mm para o antibiótico padrão Cetaconazol 50 µg semelhante às pesquisas já realizadas 10-13; divergindo de Zhang et al.14, que em seus resultados não obteve efeitos sobre fungos.
O baixo custo das plantas medicinais e baixos efeitos colaterais justificam sua aplicação 7,3 de acordo com Siani7 e Matos3.
As medidas preventivas e curativas de uso de produtos naturais, como extrato de M. charantia L., podem desempenhar importante função no sentido de resolver para as condições infecciosas crônicas, constituindo-se em uma alternativa para o desenvolvimento contínuo a fim de vencer as resistências aos microorganismos na prática clínica9. Outros autores relataram em experimento que a formação de enzimas, as alterações de receptores e o acesso limitado aos antimicrobianos são responsáveis por fatores de resistência à ação dos antimicrobianos, o que não aconteceu nas concentrações ativas do extrato de M. charantia L, nos testes antimicrobianos positivos desta pesquisa 15,16.
CONCLUSÃO
O extrato hidroetanólico de M. charantia L. foi eficaz, inibindo as linhagens estudadas de Staphylococcus aureus e epidermidis e Candida albicans e tropicalis, sugerindo a utilização dessa substância como meio alternativo de baixo custo no tratamento das afecções da boca, e, assim, justificando seu desenvolvimento tecnológico farmacêutico.
REFERÊNCIAS
1. Cruz GL. Dicionário das plantas úteis do Brasil. 3 ed. Rio de Janeiro: Civilização Brasileira; 1995. [ Links ]
2. Schulz V, Hänsel R, Tyler VE. Fitoterapia racional - um guia de fitoterapia para as Ciências da Saúde. São Paulo: Editora Manole; 2002. [ Links ]
3. Matos FJA. Plantas medicinais: guia de seleção e aproveitamento de plantas usadas em fitoterapia no Nordeste do Brasil. Fortaleza: IOCE; 1989. [ Links ]
4. Lorenzi H, Matos FJA. Plantas daninhas do Brasil: terrestres, aquáticas, parasitas e tóxicas. 3 ed. São Paulo: Nova Odesa,Instituto Plantarum; 2000. [ Links ]
5. Sena Filho JG, Melo JGS, Saraiva AM, Gonçalves AM, Psiottano MNC, Xavier HS. Antimicrobial activity and phytochemical profile from the roots of Lippia alba (Mill.). Brazilian Journal of Pharmacognosy. 2006;16: 506-9. [ Links ]
6. Matos FJA. O formulário fitoterápico do Prof. Dias da Rocha: informações sobre o emprego na medicina caseira, de plantas do Nordeste, especialmente do Ceará. 2 ed. Fortaleza: Fac-sim, 1997. [ Links ]
7. Siani AC. Desenvolvimento tecnológico de fitoterápicos: plataforma metodológica. Rio de Janeiro: Scriptori; 2003. [ Links ]
8. Silva D. Atividade Antimicrobiana do Conocarpano e seus derivados e análogos frente a cepas resistentes de Staphylococcus aureus [dissertação]. Santa Catarina: Universidade Vale do Itajaí; 2007. [ Links ]
9. Freitas DB. Atividade antimicrobiana de fluorquinolonas e ação sobre plasmídios em amostras de Staphylococcus aureus humanas e bovina. [dissertação]. João Pessoa: Universidade Federal da Paraíba; 2003. [ Links ]
10. Omoregle RE, Ikuebe OM, Ihimire IG. Antimicrobial activity of some medicinal plants extracts on Escherischia coli, Salmonella paratyphi and Shigella dysenteriae. Journal of Medicine and Medical Science. 1996;25: 373-5. [ Links ]
11. Brasileiro BG, Pizziolo VR, Rasian DS, Jamal CM, Silveira D. Triagem das atividades antimicrobianas e cititoxicas de algumas plantas medicinais brasileiras, usadas na cidade de Governador Valadares. Rev Bras Cienc Farm. 2006;42: 195-202. [ Links ]
12. Pham TV, Hoang TT, Hoffman A. Antimicrobial activity from acorn and bitter melon. ACS National Meeting. New Orleans; LA. United States, April 6-10, 2008. [ Links ]
13. Braca A, Siciliano T, D'Arrigo M, Germano MP. Chemical composition and antimicrobial activity of Momordica charantia seed essential oil. Fitoterapia.2008;79:123-5. [ Links ]
14. Zhang P, Liu J, Wang C, Ye Y, Xie J. Study on the antimicrobial activities of the extracts from momordica charantia L. Tianjin. 2008;20:721-4. [ Links ]
15. Campos-Takaki GMC. Atividade "in vitro" das fluorquinolonas perfloxacina, ofloxacina, ciprofloxacina e norfloxacina sobre Staphylococcus aureus, Staphylococcussoprofhyticus. Recife: UFPE; 1992, 380p. [ Links ]
16. Tortora GJ, Funker BR, Case CL. Microbiologia. 6.ed. Porto Alegre: Artmed. 2003. [ Links ]
 Endereço para correspondência
Endereço para correspondência
R. Diógenes Fernandes Távora, 507 - Casa Caiada
Olinda/PE. CEP. 53130-230
E-mail: bethcirurgia@hotmail.com
Recebido em 30/04/2009
Aprovado em 22/07/2009













