Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista de Cirurgia e Traumatologia Buco-maxilo-facial
versão On-line ISSN 1808-5210
Rev. cir. traumatol. buco-maxilo-fac. vol.11 no.1 Camaragibe Jan./Mar. 2011
Avaliação in vitro da Citotoxicidade de Enxaguatórios Bucais com e sem Álcool
In vitro assessment of the cytotoxicity of mouthwashes with and without alcohol
Matheus Melo PithonI; Adrielle Mangabeira SantosII; Lívia Maria Andrade FreitasI; Ricardo Alves SouzaI; Rogério Lacerda SantosIII; Fernanda Otaviano MartinsIV; Maria Teresa Villela RomanosV
I Professor de Ortodontia Universidade Estadual do Sudoeste da Bahia – UESB;
II Acadêmica de Odontologia Universidade Estadual do Sudoeste da Bahia;
III Doutor em Ortodontia Universidade Federal do Rio de Janeiro – UFRJ;
IV Microbióloga graduada pela Universidade Federal do Rio de Janeiro – UFRJ;
V Professora de Virologia Universidade Federal do Rio de Janeiro – UFRJ.
RESUMO
O objetivo do presente trabalho foi verificar a hipótese de que enxaguatórios bucais sem álcool apresentam menor citotoxicidade quando comparado aos com álcool. Avaliou-se os enxaguatórios Plax: Convencional (com álcool) e Sem álcool em diferentes tempos: 1, 15, 30, 45, 60 e 120 segundos quanto seu efeito citotóxico em fibroblastos gengivais L929. Utilizou-se 3 grupos controle: positivo (C+) detergente celular Tween 80, negativo (C-) PBS, e controle de célula (CC) onde as células não foram expostas a nenhum material. O ensaio de citotoxicidade foi realizado utilizando cultura celular de fibroblasto de camundongo (L929). Após contato do enxaguatório com as células, as mesmas foram colocadas em contato com o corante vital vermelho neutro utilizado-se a técnica ("dye uptake"). Os valores da quantidade de células viáveis, foram submetidos à análise da variância (ANOVA) para determinar se havia diferenças estatísticas entre os grupos, e posteriormente ao teste de Tukey (p<0.05). Os resultados demonstraram maior citotoxicidade dos enxaguatórios com álcool. Os enxaguatórios sem álcool apresentaram maior quantidade de células viáveis no entanto ainda assim apresentaram diferenças estatísticas com os grupos controle de células e controle negativo (p<0.05). A citotoxicidade foi diretamente proporcional ao tempo de exposição às culturas de células. Dessa forma pode-se concluir que a hipótese foi confirmada em partes, haja vista que os enxaguatórios sem álcool apresentaram menor citotoxicidade que os com álcool, mas ainda apresentaram citotoxicidade quando comparado aos grupos controle de célula e negativo.
Descritores: Citotoxicidade; enxaguatórios bucais, cultura de células. Introdução
INTRODUÇÃO
Diversas doenças da cavidade oral estão associadas ao acúmulo do biofilme bucal, como cárie, doenças periodontais e infecções1. Dessa forma, minimizar esse paradigma de acúmulo do biofilme é um fator imprescindível para a manutenção da saúde bucal através de meios mecânicos2.
Para tal, a American Dental Association preconiza a higiene mecânica da cavidade bucal por meio da escovação, duas vezes por dia e da limpeza interdental, uma vez ao dia3.
Como forma complementar, com finalidade de auxiliar os métodos convencionais de higiene, os agentes químicos apresentam bastante efetividade sendo indicados na remoção química de biofilmes orais controlando o crescimento microbiano e, conseqüentemente, prevenindo possíveis infecções4-6.
Eles atuam no sentido profilático, evitando que ocorra um desequilíbrio da microbiota quando os métodos mecânicos são ineficientes, ou terapêutico visando atingir as bactérias relacionadas às doenças, com o intuito de reequilibrar a microbiota com o hospedeiro quando o indivíduos já apresenta uma microbiota desequilibrada7.
As disponibilidades desses enxaguatórios bucais contêm distintos ingredientes ativos como óleos essenciais, clorexidina e cloreto de cetilperidíneo tratando-se de uma mistura de componente ativo, água, álcool, surfactantes, umectantes e flavorizantes8.
Em sua maioria, na composição intrínseca contém álcool entre 5 e 25%, sendo igual ou superior as bebidas alcoólicas9, que é empregado para estabilizar e dissolver os ingredientes ativos, provendo uma sensação refrescante, prevenindo a contaminação por microorganismos e aumentando o prazo de validade10.
Algumas preocupações, porém, tem sido levantado acerca dos possíveis efeitos colaterais na cavidade bucal devido o uso prolongado de colutórios contendo álcool, uma vez que sua ação se dar na membrana celular alterando sua conformação da cadeia lipídica, não sendo aconselhável a utilização a todos os indivíduos como crianças, lactantes e gestantes11.
Para isso, foram desenvolvidos enxaguatórios sem álcool e que apresente eficácia semelhante em relação à formulação convencional.
Um dos principais desafios tem sido desenvolver e selecionar substâncias biocompatíveis12. Até pouco antes do século passado, pouca informação científica estavam disponíveis sobre biocompatibilidade de materiais e substâncias de uso odontológico sobre os diferentes tipos de células13.
Reações tóxicas, inflamatórias, alérgicas ou mutagênicas são possíveis respostas biológicas frente a essas substâncias.
A toxicidade é um dos parâmetros cruciais para a avaliação de resposta biológica e do potencial lesivo que causar a morte de células ou tecidos, sendo hoje o primeiro teste de escolha usado para quase todas as novas substâncias14.
Diante dessa premissa, o propósito deste trabalho é verificar a hipótese de que enxaguatórios bucais sem álcool apresentam menor citotoxicidade quando comparado aos com álcool.
Materiais e Métodos
Cultura de células
A linhagem celular utilizada foi L929 obtido do American Type Culture Collection (ATCC, Rockville, MD) (fibroblasto de camundongo) cultivada em meio mínimo essencial de Eagle (MEM) (Cultilab, Campinas, São Paulo, Brazil) suplementado com 2 mM de L-glutamina (Sigma, St. Louis, Missouri, USA), 50 g/ ml de gentamicina (Schering Plough, Kenilworth, New Jersey, USA) , 2,5 g/ml de fungizona (Bristol-Myers- Squibb, New York, USA), 0.25ml solução de bicarbonato de sódio (Merck, Darmstadt, Germany), 10 mM de HEPES (Sigma, St. Louis, Missouri, USA), e 10% de soro fetal bovino (SFB) (Cultilab, Campinas, São Paulo, Brazil) e mantida a 37 0C em ambiente contendo 5% de CO2.
Enxaguatório avaliado
Plax convencional com álcool em sua formulação e Plax sem álcool.
Controles
Para verificar a resposta celular frente aos extremos, outros três grupos foram avaliados. Grupo CC (controle de célula) onde as células não foram expostas a nenhum material, grupo C+ (controle positivo) Tween 80 detergente utilizado em solubilização de proteínas de membrana (Polioxietileno-20-Sorbitan), C- (controle negativo) solução de PBS (Phosphate-bufferid saline).
Ensaio de citotoxicidade
Os enxaguatórios foram colocados, em quintruplicata, em placas de 96 poços contendo monocamada confluente de L929. O tempo de contato do enxaguatório (100 μl) com as células foi 1, 15, 30, 45, 60 e 120 segundos. Após contato o enxaguatório foi removido seguido da colocação de meio de cultura sobre as células. Após isso a viabilidade celular foi determinada através da técnica "dye-uptake", descrita por Neyndorff et al 15 em 1990.
Ou seja, foram adicionados 100 l de vermelho neutro a 0,01% (Sigma, St. Louis, Missouri, USA), em meio de cultura, em cada poço das microplacas e estas foram incubadas a 37°C por 3 horas para penetração do corante nas células vivas. Passado esse período, após desprezar o corante, foram adicionados 100 l de solução de formaldeído (Reagen, Rio de Janeiro, Brasil) a 4% em PBS (NaCl 130 mM; KCl 2 mM; Na2HPO4 2H2O 6 mM; K2HPO4 1mM, pH7,2) por 5 minutos, para promover a fixação das células às placas. Em seguida, para a extração do corante, foram adicionados 100l de uma solução de ácido acético (Vetec, Rio de Janeiro, Brasil) a 1% com metanol (Reagen, Rio de Janeiro, Brasil) a 50%. Após 20 minutos a leitura foi realizada em espectrofotômetro (BioTek, Winooski, Vermont, USA) em um comprimento de onda de 492 nm.
Análise estatística
As análises estatísticas foram realizadas com auxílio do programa SPSS 13.0 (SPSS Inc.,Chicago, Illinois). Análise estatística descritiva incluindo média e desvio padrão foi calculada para os grupos avaliados. Os valores da quantidade de células viáveis foram submetidos à análise de variância (ANOVA) para determinar se havia diferenças estatísticas entre os grupos, e posteriormente ao teste de Tukey.
Resultados
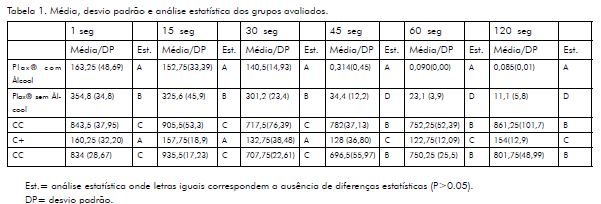
Os resultados obtidos quanto à citotoxicidade do enxaguatório avaliado nos diferentes tempos estão descritos na Tabela 1.
DISCUSSÃO
A deficiência da manutenção da saúde bucal pode propiciar, em decorrência do acúmulo de biofilme, a instalação de diversas doenças da cavidade oral16. Com o intuito de manter a integridade dos tecidos bucais é indispensável que se tenha uma adequada higienização oral.
A implementação de soluções antimicrobiana, como forma complementar, tem demonstrado ser de grande valia para estabelecer o equilíbrio na cavidade oral e na sua higienização17.
Os colutórios representam o veículo mais trivial para os agentes quimioprofiláticos. Eles são constituídos de substâncias, que devido aos seus ingredientes e secundariamente de suas concentrações, os difere na atuação na cavidade oral quanto à remoção do acúmulo de biofilme dentário. Entretanto, o uso freqüente e regular de substâncias antimicrobianas ativas deve ser avaliada de forma crítica devido os efeitos adversos que podem surgir como enfraquecimento dos dentes, alterações na microflora oral, e irritação da mucosa oral17.
A pluralidade dos colutórios com propriedades antiplaca possui determinados graus farmacêuticos de álcool desnaturado com o propósito de solubilidade, preservação e atividade germicida.
Vários estudos vêm sendo geridos no que diz respeito aos efeitos adversos desses enxaguatórios, incluindo o aumento do risco de desenvolver xerostomia, câncer oral e a queima ou irritação18.
Com o intuito de conseguir características de enxaguatórios mais favoráveis, os fabricantes de materiais odontológicos lançam constantemente no mercado produtos que tem como objetivo se enquadrar em todas as peculiaridades pré-estabelecidas da cavidade oral.
Assim, o presente trabalho se dispôs a verificar a hipótese de que enxaguatórios bucais sem álcool apresentam menor citotoxicidade quando comparado aos com álcool.
Neste estudo, para avaliar a citotoxicidade dos enxaguatórios bucais, utilizou-se linhagem de célula L929 (fibroblastos de camundongos), bastante usada para avaliar a citotoxicidade de produtos de uso odontológico19-21.
O tempo de avaliação em contato com o enxaguatório (100 μl) com as células foi de 1, 15, 30, 45, 60 e 120 segundos. A escolha desses tempos deu-se por ser esses períodos os mais utilizados quando do bochecho por parte dos pacientes. Os enxaguatórios, após o contato com os confluentes de L929, foram removidos e posteriormente, sobre as células, colocou-se o meio de cultura e analisou-se a viabilidade celular.
Os resultados do presente trabalho demonstraram que os enxaguatórios, que em sua composição havia a presença do álcool, apresentaram maior citotoxicidade. Os enxaguatórios sem álcool apresentaram diferenças estatísticas com os grupos controle de células e controle negativo (p<0.05), porém, demonstraram maior quantidade de células viáveis. Os resultados apresentados por esse trabalho corroboram com Santos et al22 quando avaliaram a citotoxicidade do enxaguatório bucal Cepacol em diferentes períodos de tempo. É válido ressaltar que o tempo de exposição às culturas de células foram diretamente proporcional a citotoxidade apresentada.
O resultado desta pesquisa contribuiu para o conhecimento acerca do tratamento com emprego de colutório demonstrando seus possíveis efeitos colaterais na cavidade oral.
Dessa forma, ressalta-se a importância da utilização dos enxaguatórios bucais sob a correta prescrição do cirurgião-dentista, tendo em vista a possibilidade de ocorrência de aparecimento de lesões teciduais, provocadas principalmente pela presença de álcool, assim como hipótese do trabalho se confirmou .
Conclusão
Pode-se concluir que houve a confirmação da hipótese, tendo em vista que os enxaguatórios que apresentaram menor citotoxicidade foram os que não continham álcool em sua formulação, entretanto eles ainda apresentaram citotoxicidade comparado aos grupos controle de célula e negativo.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Marinho VC, Higgins JP, Logan S, Sheiham A. Fluoride mouthrinses for preventing dental caries in children and adolescents. Cochrane Database Syst Rev 2003:CD002284. [ Links ]
2. Marinho VC, Higgins JP, Logan S, Sheiham A. Topical fluoride (toothpastes, mouthrinses, gels or varnishes) for preventing dental caries in children and adolescents. Cochrane Database Syst Rev 2003:CD002782.
3. Livingston BE. Minutes of the Executive Committee of the Council. Science 1920;52:495-496.
4. Amini P, Araujo MW, Wu MM, Charles CA, Sharma NC. Comparative antiplaque and antigingivitis efficacy of three antiseptic mouthrinses: a two week randomized clinical trial. Braz Oral Res 2009;23:319-325.
5. Fedorowicz Z, Aljufairi H, Nasser M, Outhouse TL, Pedrazzi V. Mouthrinses for the treatment of halitosis. Cochrane Database Syst Rev 2008:CD006701.
6. Gurgan S, Yalcin Cakir F. The effect of three different mouthrinses on the surface hardness, gloss and colour change of bleached nano composite resins. Eur J Prosthodont Restor Dent 2008;16:104-108.
7. Marsh PD. Microbiological aspects of the chemical control of plaque and gingivitis. J Dent Res 1992;71:1431-1438.
8. Thylstrup A, Fejerskok O. Cariologia Clínica. São Paulo: Editora Santos; 1995.
9. Gagari E, Kabani S. Adverse effects of mouthwash use. A review. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1995;80:432-439.
10. Quirynen M, Soers C, Desnyder M, Dekeyser C, Pauwels M, van Steenberghe D. A 0.05% cetyl pyridinium chloride/0.05% chlorhexidine mouth rinse during maintenance phase after initial periodontal therapy. J Clin Periodontol 2005;32:390-400.
11. Mankodi S, Bauroth K, Witt JJ, Bsoul S, He T, Gibb R et al. A 6-month clinical trial to study the effects of a cetylpyridinium chloride mouthrinse on gingivitis and plaque. Am J Dent 2005;18 Spec No:9A-14A.
12. Jorge JH, Giampaolo ET, Pavarina AC. Cytotoxicity of the dental materials. A literature review. Rev Odontol UNESP 2004;33:65-68.
13. Morais LS, Serra GS, Muller CA, Palermo EFA, Andrade LR, Meyers MA et al. In vivo metal ion release from Ti-6AL-4V orthodontic mini-implants. Revista Matéria 2007;12:290-297.
14. Siqueira Goncalves T, Minghelli Schmitt V, Thomas M, Lopes de Souza MA, Macedo de Menezes L. Cytotoxicity of two autopolymerized acrylic resins used in orthodontics. Angle Orthod 2008;78:926-930.
15. Neyndorff HC, Bartel DL, Tufaro F, Levy JG. Development of a model to demonstrate photosensitizermediated viral inactivation in blood. Transfusion 1990;30:485-490.
16. Trentesaux T, Sandrin-Berthon B, Stuckens C, Hamel O, Herve C. [Dental carie as chronic disease, a new therapeutic approach.]. Presse Med 2010.
17. Hagedorn B, Willershausen B, Ernst CP, Wehse T, Schimmel M. A comparative study of 2 fluoride-based mouthrinses. Quintessence Int 2000;31:125-128.
18. Mascarenhas AK. Inconclusive evidence to suggest that alcoholcontaining mouthwash increases the risk of oropharyngeal cancer. J Evid Base Dent Pract 2004;4:249-250.
19. Alcaide M, Serrano MC, Pagani R, Sanchez-Salcedo S, Nieto A, Vallet-Regi M et al. L929 fibroblast and Saos-2 osteoblast response to hydroxyapatite-betaTCP/ agarose biomaterial. J Biomed Mater Res A 2008.
20. Jin CY, Zhu BS, Wang XF, Lu QH. Cytotoxicity of titanium dioxide nanoparticles in mouse fibroblast cells. Chem Res Toxicol 2008;21:1871-1877.
21. Donadio M, Jiang J, Safavi KE, Zhu Q. Cytotoxicity evaluation of Activ GP and Resilon cones in vitro. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008;106:e76-79.
22. Santos RL, Pithon MM, Martins FO, Romanos MT. Citotoxicidade de enxaguatório bucal em células fibroblásticas: avaliação de diferentes tempos Full Dentistry in Science 2009;1:80-83.
 Endereço para correspondência:
Endereço para correspondência:
Matheus Melo Pithon
Av. Otávio Santos, 395, sala 705, Centro Odontomédico
Dr. Altamirando da Costa Lima,
Bairro Recreio, CEP 45020-750 – Vitória da Conquista
– Bahia, Brasil
e-mail: matheuspithon@gmail.com













