Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista de Cirurgia e Traumatologia Buco-maxilo-facial
versão On-line ISSN 1808-5210
Rev. cir. traumatol. buco-maxilo-fac. vol.11 no.3 Camaragibe Jul./Set. 2011
Avaliação microbiológica da antissepsia pré-operatória das mãos
Microbiological evaluation of preoperative antisepsis of hands
Douglas Rangel GoulartI; Evaldo Arruda de AssisII; Marlene Teixeira De-SouzaIII
I Cirurgião-Dentista e estagiário da Clínica Odontológica do Hospital Universitário de Brasília.
II Professor Adjunto da Universidade de Brasília do Departamento de Odontologia.
III Professora Adjunta da Universidade de Brasília do Departamento de Biologia Celular.
RESUMO
Objetivo: Comparar a carga microbiana após a antissepsia das mãos, utilizando dois protocolos, um de acordo com a técnica da Organização Mundial de Saúde (OMS) e outro modificado. Metodologia: O estudo foi realizado com alunos voluntários do curso de odontologia da Universidade de Brasília, tendo sido composto de fases laboratorial e clínica. A coleta de amostras foi realizada com a técnica modified glove-juice, em três tempos: controle – após a lavagem das mãos com sabão neutro, após a antissepsia e na fase clínica pós-cirurgia. Todos os procedimentos foram realizados com intervalo de sete dias. Os dados foram analisados com o programa estatístico de computador Statistical Package for the Social Sciences (SPSS, versão 18.0 para Windows). Resultados: Foram incluídos, no estudo, cinco alunos, o que gerou 200 campos. As técnicas apresentaram resultados similares na fase laboratorial. Na fase clínica, a comparação do resultado entre as técnicas, utilizando os dados da enumeração das amostras controle e do pós-cirúrgico apresentou tamanho de efeito idêntico (z Wilcoxon = - 3,92; p<0,001; r = 0,88). Conclusões: As técnicas apresentaram resultados similares após a antissepsia e a cirurgia. A técnica modificada exige um menor tempo de antissepsia com menor rigidez, o que pode aumentar sua adesão.
Descritores: Higienização Pré-Cirúrgica de Mãos; Profissionais da saúde; Procedimento cirúrgico.
ABSTRACT
Purpose: Compare the microbial counts after two procedures of hands scrub, one with the technique of the World Health Organization (WHO), and another modified. Methodology: A study was performed with dentistry students of the University of Brasília, encompassing laboratorial and clinical steps. The samples were collected following the modified glove-juice method, and consisted of three periods: control – after hands washing with neutral soap, after hands scrub and in the clinic phase after the surgery. The students did the procedures with an interval of seven days. The data was analyzed with the computer statistic program Statistical Package for the Social Sciences, version 18.0. Results: Five students were included, which produced the inspection of 200 plaques. The techniques were similar in the laboratory step. The techniques were compared in the clinic step using the data from microbiological counts of control and after surgery; the hands scrub in both procedures had the same size effect (z Wilcoxon = - 3,92; p < 0,001; r = 0,88). Conclusion: Both techniques had similar results after the hands scrub and after surgery. The modified technique is faster and easier than the WHO's technique; these results could increase the practice of hands scrub by the surgery team.
Keywords: Handwashing; Health Personnel; Surgical Procedures.
INTRODUÇÃO
O efeito da antissepsia da pele na redução da infecção do sítio cirúrgico foi historicamente demostrado por Joseph Lister (1827-1912). Na época, luvas cirúrgicas ainda não estavam disponíveis, o que tornava a apropriada antissepsia da pele do paciente e das mãos do cirurgião ainda mais importantes1.
A atividade de higienização das mãos tem sido associada a uma redução significativa de infecções hospitalares. As evidências de estudos experimentais e não experimentais são bastante consistentes com a hipótese de que lavar as mãos é associação causal com a redução do risco de infecção2.
A pele humana é colonizada por bactérias, cuja densidade varia de acordo com os sítios. A contagem bacteriana total nas mãos de profissionais da saúde tem variado de 3,9 x 104 a 4,6 x 106 UFC/cm3 (Unidades Formadoras de Colônias por centímetro cúbico). As espécies encontradas nas mãos são classificados em dois grupos, microbiota residente e microbiota transitória3.
A microbiota residente habita as camadas mais profundas da pele, em sua maioria os sulcos e as regiões de concentração das glândulas sebáceas. Por serem locais de difícil acesso, esses microrganismos não são totalmente eliminados no processo de antissepsia das mãos e antebraços, podendo apenas ser diminuídos temporariamente. Apesar disso, geralmente apresentam baixa virulência e raramente são responsáveis por infecções cirúrgicas3. A composição da microbiota residente varia quantitativa e qualitativamente dependendo do gênero, idade, condição clínica e higiene do paciente, tempo de hospitalização e estação climática4. Normalmente encontram-se cerca de 60% de Corynecbacterium spp e Propionibacterium spp, sendo que, nas áreas mais secas da pele, predominam os estreptococos coagulase negativa (Streptococcus epidermidis, S. hominis e S. capitis) e os Micrococcus spp4.
A microbiota transitória ou temporária é transferida para a pele por contato com fontes externas, possui composição variável, sendo frequentemente constituída por Staphylococcus aureus, Escherichia coli, Streptococcus spp, Pseudomonas spp e Proteus spp4. Esses microrganismos podem aderir às mãos em ambiente hospitalar, com possibilidade de apresentarem resistência à antibioticoterapia usual. As bactérias da microbiota transitória, apesar de possuírem maior patogenicidade, parecem ser removidas por meio de higienização das mãos, por se encontrarem mais superficialmente e fracamente aderidas à pele4-6.
A conscientização dos profissionais da saúde sobre os mecanismos básicos de transmissão das doenças infecciosas e a necessidade da higienização das mãos tem baixa adesão com estudos mostrando variações entre 16% a 81%, o que favorece a transmissão cruzada das infecções6. Além disso, quanto mais frequente a necessidade de higiene das mãos durante um processo assistencial, menor a probabilidade de sua execução7.
No preparo pré-cirúrgico das mãos, os membros de equipes cirúrgicas utilizam regimes de antissepsia diferenciados, utilizando escovas e esponjas, além de agentes antissépticos1. O objetivo da antissepsia pré-cirúrgica é reduzir a carga microbiana residente e transitória das mãos, e assim, reduzir a introdução de microrganismos no sítio cirúrgico8.
A utilização de agentes antissépticos está indicada para toda equipe cirúrgica no pré-operatório. As preparações que podem ser utilizadas para antissepsia das mãos são soluções de iodopolvidona (PVPI a 10%) e digluconato de clorexidina a 4%9. Essas substâncias devem ter o poder de reduzir um amplo espectro de microrganismos da pele intacta, além de ter ação rápida e efeito persistente1. Apesar de existirem poucas evidências científicas, preconiza-se que as soluções de digluconato de clorexidina devam ser utilizadas em detrimento daquelas à base de PVPI10.
As luvas são utilizadas como barreira física durante a cirurgia para evitar a infecção cruzada, porém não são completamente impermeáveis. Apesar da alta qualidade das luvas fabricadas atualmente, devemos sempre contar com microperfurações causadas durante os procedimentos clínicos ou por defeitos de fábrica1,11. Estudos apontam que, após os procedimentos cirúrgicos, podem ser encontradas pequenas perfurações em 18% das luvas, com variação de 5% a 82%; além disso, 80% dos casos passam despercebidos pelo cirurgião. Depois de duas horas de cirurgia, cerca de 35% das luvas demonstram perfurações que permitem a passagem de água e fluidos corporais1. Essas evidências reafirmam a importância de utilizar a técnica correta de antissepsia das mãos, que inclui o emprego de um agente antimicrobiano eficaz.
Apesar de a antissepsia das mãos ser parte integrante dos procedimentos pré-cirúrgicos, o método ideal, incluindo o tempo necessário, o antisséptico mais eficaz e o uso ou não de escovas ainda são assuntos em debate.
Nesse contexto, o objetivo desta pesquisa foi comparar a carga microbiana presente no preparo pré-operatório das mãos, utilizando dois protocolos de antissepsia, um desses rigorosamente de acordo com a literatura e outro modificado, sem a rigidez da técnica preconizada. Essa flexibilidade da técnica traz consigo, entretanto, a noção de que se trata de um preparo para atuação em cirurgia e, portanto, com uma percepção profissional da importância do procedimento.
METODOLOGIA
Foi realizado um estudo transversal com alunos do curso de graduação em Odontologia da Universidade de Brasília (UnB), no período de abril a julho de 2011. Para fazerem parte do estudo, os sujeitos da pesquisa deveriam estar cursando a disciplina de Cirurgia Buco-Maxilar. Foram excluídos os alunos em uso de antibióticos ou antifúngicos locais ou sistêmicos até duas semanas antes do início da pesquisa, os que apresentavam lesões cutâneas na região das mãos e dos antebraços e os que relataram apresentar alergia ao antisséptico a ser utilizado. Considerados esses critérios de exclusão, foram selecionados cinco alunos voluntários para participarem do estudo.
Foram propostos dois métodos de antissepsia pré-operatória das mãos. O primeiro protocolo seguiu rigorosamente as recomendações da OMS12, e o segundo, com modificações propostas pelos autores. Ambas as técnicas foram demonstradas antes de a pesquisa ser iniciada e supervisionda pelos pesquisadores durante sua execução. Antes da antissepsia das mãos, os participantes foram orientados a remover adereços (anéis, relógios, pulseiras etc.), estar devidamente munidos dos Equipamentos de Proteção Individual (EPIs) necessários à sua atuação na cirurgia, principalmente, gorro, máscara e óculos de proteção e manter o corpo afastado da pia. No estudo, foi utilizada uma pia acionada por pedal.
Ambos os protocolos incluíram as seguintes etapas: molhar completamente as mãos e antebraços, recolher com o as mãos em concha 5 mL do agente antisséptico digluconato de clorexidina a 4% (RIOHEX a 4% degermante, Indústria Farmacêutica Rioquímica LTDA, São José do Rio Preto - Brasil). O agente foi colhido de seu recipiente com o auxílio de uma seringa estéril descartável e espalhado pelas mãos, antebraço e cotovelo, de forma a entrar em contato com todas as superfícies a serem degermadas. Após esses procedimentos iniciais, foi cronometrada a execução dos protocolos de antissepsia.
O protocolo da OMS preconiza a limpeza das regiões ungueais e subungueais com o auxílio de escova/esponja esterilizada descartável de cerdas macias, que foram fornecidas pelos pesquisadores (RQ Escova Seca - conjunto escova/esponja descartável e estéril, Indústria Farmacêutica Rioquímica LTDA, São José do Rio Preto - Brasil). Com o auxílio do lado da esponja, foi orientada a antissepsia de uma mão por vez, iniciando com a escovação de todos os lados de cada dedo, os espaços interdigitais, a face dorsal e a face palmar de cada mão, iniciada pela esquerda, de modo que o tempo total para cada mão foi de 2 minutos. Com as mãos sempre mantidas em nível acima dos antebraços, procedeu-se à antissepsia desses, no sentido dos pulsos para o cotovelo, primeiramente o lado esquerdo e depois o direito, de modo que a escova não retornou às mãos. Essa antissepsia para os antebraços teve a duração de 4 minutos, ou seja, 2 minutos para cada antebraço, sendo 1 minuto para cada lado do antebraço. Dessa forma, o tempo total do procedimento foi de 8 minutos. Após a antissepsia, as mãos foram enxaguadas em água corrente, no sentido das mãos para cotovelos, retirando todo o resíduo do produto. Para a secagem dos membros, utilizaram-se compressas estéreis, com movimentos compressivos, iniciando pelas mãos e seguindo pelo antebraço até o cotovelo, atentando para utilizar as diferentes dobras da compressa para regiões distintas.
Na técnica modificada, o participante, apenas com as mãos, deveria friccionar as regiões ungueais e subungueais, seguida das demais superfícies das mãos e antebraços, de forma aleatória, mão contra mão, mão contra antebraço contralateral, podendo retornar à fricção mão contra mão. As seguintes áreas deveriam ser incluídas na fricção: as quatro superfícies de cada um dos dedos e as áreas interdigitais; face palmar; face dorsal; pulso e antebraço. O tempo determinado para o procedimento foi de 5 minutos. Após a antissepsia, o enxague das mãos foi em água corrente de forma a retirar todo resíduo do produto, friccionando uma mão contra a outra, deixando a água escorrer no sentido dedos-antebraço. Foi adotado como método de secagem o uso de compressa de algodão estéril com movimentos compressivos, iniciando pelas mãos e seguindo pelo antebraço até o cotovelo, de forma aleatória, com atenção para modificar a posição apenas para utilizar as partes secas.
A coleta de amostras foi dividida em duas fases: laboratorial e clínica. A primeira foi realizada no Laboratório de Microbiologia/Bacillus spp, vinculado ao Departamento de Biologia Celular do Instituto de Biologia da UnB. Nesta, foram realizados dois ciclos de coleta de amostras com os mesmos participantes, de forma que cada aluno utilizou os dois protocolos propostos em um intervalo de sete dias. Os alunos foram divididos aleatoriamente em dois grupos, de forma que os protocolos foram realizados, no mesmo dia, por alunos diferentes.
Foram realizadas duas coletas para cada participante em cada ciclo, nos seguintes tempos: primeiro foi pedido para que os alunos realizassem a higienização das mãos habitual com sabão líquido neutro, com tempo médio de 1 minuto. Após enxague em água corrente e secagem com papel toalha, foi feita a coleta controle. A segunda coleta foi feita após o protocolo de antissepsia e secagem das mãos. Sete dias após, foi realizado outro ciclo de coleta, em que os participantes alternaram o protocolo de antissepsia.
Como instrumentos de coleta, foram utilizados sacos plásticos esterilizados (LABPLAS INC, Quebec Canada), contendo 75 mL de Caldo Tríptico de Soja – TSB (Acumedia, Baltimore, Estados Unidos da América - USA). A coleta de amostras foi realizada de acordo com a técnica modified glove-juice, na qual o sujeito da pesquisa insere as mãos separadamente até a região dos punhos dentro de sacos plásticos estéreis contendo o meio nutritivo. A seguir, as mãos foram simultaneamente massageadas contra as paredes do saco plástico, de maneira a estabelecer o contato com toda a superfície das mãos, com a duração de um minuto.
A fase clínica foi realizada na Clínica Odontológica do Hospital Universitário de Brasília (CO/HUB). Nesta, os alunos realizaram dois ciclos de coleta de amostras similar à fase laboratorial, tendo sido realizada uma coleta adicional no pós-cirúrgico, imediatamente após a retirada das luvas cirúrgicas. O material necessário para a coleta foi transportado para a clínica em um recipiente térmico. Os sacos plásticos, identificados previamente, foram abertos no momento da coleta e imediatamente lacrados após ela ter sido feita.
Imediatamente após as coletas, uma parte (0,2 ml) de cada amostra foi inoculada em placas de Petri contendo Ágar Tríptico de Soja – TSA (Acumedia, Baltimore, USA). As amostras foram inoculadas em duplicata e incubadas em estufas bacteriológicas a 37 ºC por 48 horas, em aerobiose. Após esse período, foi realizada a quantificação das UFCs.
Os dados quantitativos foram submetidos a análises descritivas e comparativas com o auxílio de programa estatístico de computador (SPSS, versão 18.0 para Windows).
O estudo seguiu as recomendações de pesquisa envolvendo seres humanos, adotadas pela Resolução 196/96, do Conselho Nacional de Saúde, tendo sido aprovado pelo Comitê de Ética em Pesquisa, da Faculdade de Ciências da Saúde, da Universidade de Brasília sob o nº 023/11. Os alunos interessados em participar assinaram um Termo de Consentimento Livre e Esclarecido.
RESULTADOS
O material, oriundo dos cinco alunos voluntários, gerou amostras de dez mãos, que foram coletadas em duas fases, a laboratorial com dois tempos e a clínica com três tempos. As amostras foram inoculadas em placas de Petri em duplicata, do que resultou a produção e a leitura de 200 placas.
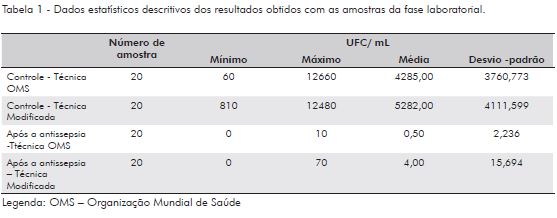
Na fase laboratorial, foram realizadas duas etapas de coleta, cada uma com dois tempos: controle e após a antissepsia. Dessa forma, a realização de dois ciclos, em que dez amostras (cinco pares de mãos) foram coletadas em dois tempos, em duplicata, gerou a leitura de 80 campos. As amostras controles apresentaram uma variação de 6,0 x 101 a 1,2 x 104 UFC/mL, para o procedimento da OMS e para o procedimento modificado 8,1 x 102 a 1,1 x 104 UFC/mL. Nas placas em que foram inoculadas as amostras após a antissepsia das mãos, prevaleceu contagem nula (37 placas de Petri), foram enumeradas colônias em três placas, uma após o procedimento de antissepsia de acordo com a OMS (10 UFC/mL) e duas após o procedimento modificado (10 e 70 UFC/mL). A Tabela 1 apresenta os dados estatísticos descritivos dos resultados obtidos com as amostras da fase laboratorial.
Na fase clínica, foram realizadas duas etapas de coleta, cada uma com três tempos: controle, após a antissepsia e imediatamente após a remoção das luvas depois da cirurgia, tendo o tempo cirúrgico variado de 50 a 80 minutos. A realização dos dois ciclos, em que dez amostras (cinco pares de mãos) foram coletadas em três tempos, em duplicata, gerou a leitura de 120 campos. A variação dos resultados das amostras controle para o procedimento da OMS foi de 1,7 x 10 a 9,6 x 103 UFC/mL, e para o procedimento modificado foi de 2,0 x102 a 1,0 x 104 UFC/mL. Nas placas em que foram inoculadas as amostras após a antissepsia das mãos, prevaleceu contagem nula (38 placas de Petri), sendo que em duas placas após o procedimento da OMS foram contadas 10 e 15 UFC/mL. Nas placas em que foram inoculadas as amostras do pós-cirúrgico, observou-se crescimento em 17 das 40 placas, e a contagem variou de 5 a 180 UFC/mL. A Tabela 2 apresenta os dados estatísticos descritivos dos resultados obtidos com as amostras da fase clínica.
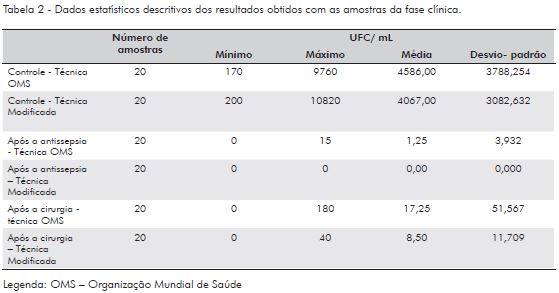
Na comparação das técnicas, foram utilizados os dados da enumeração das amostras controle e do pós-cirúrgico. As amostras colhidas no procedimento modificado e no da OMS apresentaram tamanho de efeito idêntico (z Wilcoxon = - 3,92; p < 0,001; r = 0,88). Foi utilizado o teste de Wilcoxon em função da distribuição não normal dos dados devido ao tamanho reduzido da amostra. Os resultados foram considerados estatisticamente significativos para valores de p < 0,05.
Na comparação entre as amostras controle, divididas de acordo com o procedimento realizado, OMS ou modificado, foi utilizado teste de Wilcoxon primeiramente para a fase laboratorial e depois na fase clínica. Na fase laboratorial, o resultado foi z Wilcoxon = -1,64; p = 0, 10; r = 0,37 e para fase clínica z Wilcoxon = -0,709; p = 0,48; r = 0,16.
Com a finalidade de caracterizar a microbiota das mãos enumerada por este estudo, foi realizada a descrição da morfologia das colônias das placas da fase clínica, que foram separadas de acordo com a amostra: controle e após a cirurgia. Foram selecionadas as colônias com morfologia mais frequentes, de forma representativa, para a realização de esfregaço em lâminas de vidro seguida da coloração diferencial de Gram. As células foram classificadas morfologicamente, de acordo com a sua forma e com o grau de agregação, além do registro da coloração de Gram.
Foram selecionadas 30 colônias representativas da amostra controle, destas, 28 eram cocos Gram positivos (isolados, aos pares, estafilococos, estreptococos e tétrade), e, em duas colônias, verificou-se a presença de bacilos Gram positivos.
Nas amostras do pós-cirúrgico, foram selecionadas 23 colônias; destas, 22 representavam cocos Gram positivos (isolados, aos pares, estafilococos, estreptococos e tétrade), e, em uma colônia, foram identificados bacilos Gram positivos.
DISCUSSÃO
Os estudos clínicos para a avaliação da eficácia de antimicrobianos ou técnicas de higienização de mãos fazem parte dos testes in vivo, que são mais simplificados e utilizam classicamente a técnica de impressão dos dedos em placas de Petri contendo meios nutritivos. Outros métodos propostos utilizam como instrumentos de coleta de amostras hastes flexíveis com extremidade em algodão (swabs), luvas ou sacos de plásticos esterilizados – método glove juice11.
Para a maioria das espécies de microrganismos, a dose infectante ou o número de UFCs capaz de induzir infecção em indivíduos em ambiente hospitalar ainda não está estabelecida5. Deve-se considerar que as infecções do sítio cirúrgico são complexas e geralmente multifatoriais, existindo diversos fatores de risco relacionados ao paciente, ao cirurgião e à equipe de saúde, de modo que a redução de apenas um fator de risco pode ter uma influência limitada no resultado final1.
No presente estudo, foi observada uma grande redução na carga microbiana após os procedimentos de antissepsia utilizados. As técnicas demonstraram ser similares no momento imediato após a antissepsia, e, após a cirurgia, não foram encontradas diferenças significativas entre o número de microrganismos presentes nas amostras controle, o que poderia pressupor um benefício, ou seja, menor carga microbiana inicial em determinada técnica. A técnica modificada exige um menor tempo de antissepsia. Esse tempo está conforme o recomendado pela Agência Nacional de Vigilância Sanitária (3 a 5 minutos)9. Além disso, o tempo de 5 minutos tem sido relatado como o mais empregado em protocolos de diferentes países11. Em estudos empregando tempos menores, não foram encontradas diferenças significativas na contagem de microrganismos para degermação das mãos por 2 e 3 minutos com digluconato de clorexidina a 4%. Os autores desses estudos recomendam que a antissepsia das mãos deva ser efetuada entre 2 a 6 minutos13.
A utilização da escova para as unhas não ofereceu descontaminação adicional às mãos. Estas representam custos adicionais aos serviços. Caso os profissionais queiram limpar suas unhas, podem ser utilizados limpadores não esterilizados antes da antissepsia das mãos, que são menos onerosos14. Além disso, a utilização de escovas e esponjas, antissépticos com surfactantes e/ou detergentes podem, após uso prolongado, contribuir para deterioração da pele e modificar de maneira indesejada a microbiota, com aumento do número de bactérias Gram negativas e Candida spp13.
Em adição, a utilização da escova pode gerar desconforto, que em algumas situações, pode levar o profissional a reduzir o tempo de antissepsia das mãos. Esse fato pode resultar num tempo insuficiente de contato entre o antisséptico e a área a ser degermada15.
No presente estudo, foram encontradas similaridades entre a morfologia das colônias das amostras controle e do pós-cirurgico. A coloração de Gram demonstrou o predomínio de cocos Gram positivos, principalmente estafilococos, além de bacilos Gram positivos, compatíveis com a microbiota residente tipicamente descrita para mãos, o que foi compatível com outros trabalhos3-5.
As técnicas preconizadas na literatura são descritas de forma rígida, devendo ser realizada por passos, desde a ponta dos dedos até o cotovelo, de forma ordenada e sistemática9-12. A partir dos resultados encontrados por esta pesquisa, questiona-se se essa rigidez no procedimento de antissepsia das mãos e dos antebraços tem uma razão de ser e deve ser realmente seguida.
A prática diária mostra que os profissionais descumprem os preceitos técnicos do procedimento da antissepsia, seja na questão do tempo determinado para tal bem como em relação às áreas que precisam ser degermadas8. Na prática, o que se verifica é um procedimento de antissepsia das mãos e antebraços sem a utilização de uma técnica rígida como a descrita na literatura, seguindo uma técnica aleatória, sem o engessamento preconizado pela técnica.
CONCLUSÕES
Os resultados obtidos nos permitem concluir que as técnicas estudadas demonstraram ser similares no momento imediato após a antissepsia e após a cirurgia, desde que foi observada uma grande redução na carga microbiana após ambos os procedimentos de antissepsia estudados. A utilização da escova para unhas associada com a esponja não ofereceu descontaminação adicional e, além disso, representa um custo adicional aos serviços. A técnica modificada exige um menor tempo de antissepsia com menos rigidez, o que pode influenciar, positivamente, na sua adesão na rotina de antissepsia dos cirurgiões, além de representar custos menores.
Em razão do número restrito de sujeitos utilizados, os resultados são limitados, e, por isso, são necessários estudos mais amplos em diversos centros cirúrgicos para avaliar a resposta da técnica na adesão dos profissionais e na redução da carga microbiana.
Os profissionais da saúde, primordialmente os cirurgiões e os profissionais auxiliares da área cirúrgica, médica ou odontológica, precisam se conscientizar da importância de higienizar as mãos, de forma a manter o controle de infecções cruzadas em ambientes de atendimento da saúde, por meio da ratificação da utilização da técnica da forma como preconizada ou admitindo modificações não tão rígidas que podem levar aos mesmos resultados.
REFERÊNCIAS
1. Widmer AF, Rotter M, Voss A, Nthumba P, Allegranzi B, Boyce J, Pittet D. Surgical hand preparation: state-of-the-art. J Hosp Infect. 2010 Feb;74(2):112-22. [ Links ]
2. Larson, E. Skin hygiene and infection prevention: more of the same or different approaches? Clin Infect Dis 1999;29:1287-94.
3. Custódio J, Alves JF, Silva FM, von Dolinger EJO, Santos JGS, Brito D. Avaliação microbiológica das mãos de profissionais da saúde de um hospital particular de Itumbiara, Goiás. Rev Ciênc Méd, 2009;18:7-11.
4. Kawagoe, JY. Higiene das mãos: comparação da eficácia antimicrobiana do álcool - formulação gel e líquida - nas mãos com matéria orgânica [Dissertação]. São Paulo: Universidade de São Paulo, Escola de Enfermagem; 2004. 132 p.
5. Oliveira DGM, Souza PR, Watanabe E, Andrade D. Avaliação da higiene das mãos na perspectiva microbiológica. Rev Panam Infectol, 2010; 12(3):28-32.
6. Agência Nacional de Vigilância Sanitária (Brasil). Serviços Odontológicos: Prevenção e Controle de Riscos. Brasília: Ministério da Saúde, 2006. [acesso em: 02 Jul 2011]; Disponível em: http://portal.anvisa.gov.br/manual_odonto.pd.
7. Pittet D. Improving compliance with hand hygiene in hospitals. Infect Control Hosp Epidemiol 2000; 21: 381–86.
8. Adams AB. Surgical Hand Antisepsis: Where We Have Been and Where We Are Today. Perioperative Nursing Clinics, 2010; 5(4): 443-448.
9. Agência Nacional de Vigilância Sanitária (Brasil). Higienização das mãos em serviços de saúde. Brasília: Anvisa, 2007. [acesso em: 02 jul 2011]; Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/higienizacao_maos.pdf .
10. Casey AL, Elliott TS. Progress in the prevention of surgical site infection. Curr. Opinion. Infect. Dis. 22, 370–375 (2009).
11. Rotter M, Sattar S, Dharan S, Allegranzi B, Mathai E, Pittet D. Methods to evaluate the microbicidal activities of hand-rub and hand-wash agents. J Hosp Infect 2009;73:191-9.
12. Guidelines on hand hygiene in health care (World Health Organization). First global patient safety challenge: "Clean care is safer care". Geneva: WHO, 2009: p.54-59. [Acesso em 02 Jul 2011] Disponível em: http://whqlibdoc.who.int/publications/2009.pdf
13. Hsieh HF, Chiu HH, LEE FP. Surgical hand scrubs in relation to microbial counts: systematic literature review. J advanc nursing. Taiwan, n. 1, v.55, p.68-78, 2006.
14. Tanner J, Khan D, Walsh S, Chernova J, Lamont S, Laurent T. (2009). Brushes and picks used on nails during the surgical scrub to reduce bacteria: a randomised trial. J Hosp Infect.2009 Mar; 71(3): 234 - 238.
15. da Silva DR, Lima PC, Nunes MRCM, Cravinhos JCP. Comparação de Dois Métodos de Antissepsia Pré-Operatória de Mãos em Cirurgia Bucal. Rev Cir Traumatol Buco-Maxilo-Fac, 2011 Abr; 11(2): 45-54.
 Endereço para correspondência:
Endereço para correspondência:
Douglas Rangel
Clínica Odontológica do Hospital Universitário de Brasília SGAN 605, Av. L2 Norte Brasília / DF - CEP: 70840-901
e-mail: douglasrgoulart@gmail.com













