Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista de Cirurgia e Traumatologia Buco-maxilo-facial
versão On-line ISSN 1808-5210
Rev. cir. traumatol. buco-maxilo-fac. vol.11 no.4 Camaragibe Out./Dez. 2011
Avaliação in vitro da citotoxicidade de enxaguatórios bucais Listerine®
In vitro cytotoxicity of Listerine® mouthwash
Matheus Melo PithonI; Rogério Lacerda SantosII; Débora Laís Ribeiro e RibeiroIII; Lívia Maria Andrade FreitasIV; Ricardo Alves SouzaIV; Fernanda Otaviano MartinsV; Maria Teresa Villela RomanosVI
I Professor de Ortodontia da Universidade Estadual do Sudoeste da Bahia - UESB; Mestre e doutor em Ortodontia Universidade Federal do Rio de Janeiro – UFRJ.
II Doutor em Ortodontia da Universidade Federal do Rio de Janeiro – UFRJ.
III Acadêmico de Odontologia da Universidade Estadual do Sudoeste da Bahia.
IV Professor de Ortodontia daUniversidade Estadual do Sudoeste da Bahia - UESB.
V Microbióloga graduada pela Universidade Federal do Rio de Janeiro – UFRJ.
VI Professora de Virologia da Universidade Federal do Rio de Janeiro – UFRJ.
RESUMO
Objetivo: Avaliar a citotoxicidade de enxaguatórios bucais Listerine em diferentes períodos de tempo. Material e Métodos: Avaliaram-se os enxaguatórios Listerine: Vanilla Mint, Clássico, Cool Citrus, Menta, Tarta Control e Whitening em diferentes tempos: 1, 15, 30, 45, 60 e 120 segundos quanto ao seu efeito citotóxico em fibroblastos gengivais L929. Utilizaram-se 3 grupos controle: positivo (C+) detergente celular Tween 80, negativo (C-) PBS e controle de célula (CC) em que as células não foram expostas a nenhum material. O ensaio de citotoxicidade foi realizado, utilizando-se cultura celular de fibroblasto de camundongo (L929). Após contato do enxaguatório com as células, estas foram colocadas em contato com o corante vital vermelho neutro, utilizando-se a técnica ("dye uptake"). Os valores da quantidade de células viáveis foram submetidos à análise da variância (ANOVA) para determinar se havia diferenças estatísticas entre os grupos e posteriormente ao teste de Tukey (p<0.05). Resultados: Os resultados demonstraram que todos os enxaguatórios apresentaram citotoxicidade em todos os tempos avaliados. Os mais citotóxicos foram o Tarta Control e Whitening, e o que apresentou menos citotoxicidade foi o Clássico. Essa citotoxicidade foi diretamente proporcional ao tempo de exposição às culturas de células. Conclusão: Pode-se concluir com a realização deste trabalho que todos os enxaguatórios avaliados apresentaram citotoxicidade.
Descritores: Citotoxicidade; Enxaguatórios bucais; Cultura de células.
ABSTRACT
Objective: Evaluate the cytotoxicity of Listerine mouthwash in different time periods. Materials and Methods: We evaluated the mouthwash Listerine: Mint Vanilla, Classic, Cool Citrus, Mint, Control and Tarta Whitening at different times: 1, 15, 30, 45, 60 and 120 seconds as their cytotoxic effect on gingival fibroblasts L929. We used three control groups: positive (C +) cell detergent Tween 80 was negative (C-), PBS, and cell control (CC) where the cells were not exposed to any material. The cytotoxicity assay was performed using cell culture of mouse fibroblast (L929). After contacting the mouthwash with the cells, they were placed in contact with the vital dye neutral red used the technique (dye uptake). The values of the amount of viable cells, were subjected to analysis of variance (ANOVA) to determine whether there were statistical differences between groups, and subsequently Tukey test (p <0.05). Results: The results showed that all mouthrinses showed cytotoxicity at all times evaluated. The most cytotoxic were Tarta Control and Whitening, and showed less cytotoxicity than was the Classic. This cytotoxicity was directly proportional to exposure time to cell cultures. Conclusion: It can be concluded with the completion of this work showed that all mouthrinses evaluated cytotoxicity.
Keywords: Cytotoxicity; Mouthwashes; Cell culture.
INTRODUÇÃO
A prática de enxaguar a boca é usada por humanos há mais de 2000 anos, sendo que esta foi atribuída pela primeira vez aos chineses. No entanto, há pouco mais de 30 anos, ocorreu a chegada de enxaguatórios bucais disponíveis comercialmente, especificamente formulado para controle da placa supragengival e gengivite1.
O controle mecânico do biofilme bacteriano é, muitas vezes, inadequado para a maioria dos indivíduos; em decorrência disso, os enxaguatórios bucais deveriam ajudar a reduzir a placa deixada pela falha de escovação1.
Lindhe2 afirmou que a placa bacteriana produz substâncias irritantes (ácidos endotoxinas e antígenos), que, com o passar do tempo, invariavelmente, destroem dentes e tecidos de suporte2-3.
Os agentes etiológicos principais da placa dentária são os Streptococcus sp. (cocos Gram-positivos) e Actinomices sp. (bacilos Gram-negativos). A característica da placa é de contínua agressão, que vai adquirindo novas espécies de microorganismos, como o S. miti, S. sagüis, S. sobrinus, S. mutans e Lactobacillus casei em cada etapa de seu desenvolvimento4.
A placa dentária inicia com a instalação de bactérias orais, podendo ser de natureza patogênica ou não, que aderem à película dental, derivada de produtos bacterianos e saliva, que se formam sobre os dentes. A placa é considerada fator chave de contribuição para a inflamação gengival que, se não tratada, pode progredir para a periodontite4.
Os enxaguatórios bucais são veículos ideais para se incorporarem substâcias químicas, que promovem hálito fresco e ajudam a atenuar o problema de odor bucal1.
No controle químico do biofilme, por meio do uso do enxaguatório, um agente antimicrobiano deveria inibir o estágio de adesão da colonização bacteriana, afetando o crescimento e a atividade metabólica dos microorganismos do biofilme, sem interferir em qualquer outro processo biológico. Além disso, a toxicidade deveria ser baixa, uma vez que tais soluções, ao serem utilizadas, poderiam ser eventualmente engolidas1.
Assim, o objetivo do presente trabalho consiste em avaliar a citotoxicidade de enxaguatórios bucais Listerine em diferentes períodos de tempo.
RELATO DE CASO
Cultura de células
A linhagem celular utilizada foi L929 obtida do American Type Culture Collection (ATCC, Rockville, MD) (fibroblasto de camundongo), cultivada em meio mínimo essencial de Eagle (MEM) (Cultilab, Campinas, São Paulo, Brazil), suplementado com 2 mM de L-glutamina (Sigma, St. Louis, Missouri, USA), 50 mg/ml de gentamicina (Schering Plough, Kenilworth, New Jersey, USA) , 2,5 mg/ml de fungizona (Bristol-Myers-Squibb, New York, USA), 0.25ml solução de bicarbonato de sódio (Merck, Darmstadt, Germany), 10 mM de HEPES (Sigma, St. Louis, Missouri, USA) e 10% de soro fetal bovino (SFB) (Cultilab, Campinas, São Paulo, Brazil) e mantida a 37°C em ambiente contendo 5% de CO2.
Enxaguatório avaliado
Os enxaguatórios Listerine avaliados foram: Vanilla Mint, Clássico, Cool Citrus, Menta, Tarta Control e Whitening. (Figura 1)

Controles
Para verificar a resposta celular frente aos extremos, outros três grupos foram avaliados. Grupo CC (controle de célula) no qual células não foram expostas a nenhum material, grupo C+ (controle positivo) Tween 80, detergente utilizado em solubilização de proteínas de membrana (Polioxietileno-20-Sorbitan) e C- (controle negativo), solução de PBS (Phosphate-bufferid saline).
Ensaio de citotoxicidade
Os enxaguatórios foram colocados, em quintruplicata, em placas de 96 poços, contendo monocamada confluente de L929. O tempo de contato do enxaguatório (100 μl) com as células foi 1, 15, 30, 45, 60 e 120 segundos. Após contato, o enxaguatório foi removido seguido da colocação de meio de cultura sobre as células. Em seguida, a viabilidade celular foi determinada por meio da técnica "dye-uptake", descrita por Neyndorff et al.5 em 1990.
Ou seja, foram adicionados 100 μl de vermelho neutro a 0,01% (Sigma, St. Louis, Missouri, USA), em meio de cultura, em cada poço das microplacas, e estas foram incubadas a 37°C por 3 horas, para a penetração do corante nas células vivas. Passado esse período, após desprezar o corante, foram adicionados 100 μl de solução de formaldeído (Reagen, Rio de Janeiro, Brasil) a 4% em PBS (NaCl 130 mM; KCl 2 mM; Na2HPO4 2H2O 6 mM; K2HPO4 1mM, pH7,2) por 5 minutos, para promover a fixação das células às placas. Em seguida, para a extração do corante, foram adicionados 100 μl de uma solução de ácido acético (Vetec, Rio de Janeiro, Brasil) a 1% com metanol (Reagen, Rio de Janeiro, Brasil) a 50%. Após 20 minutos, a leitura foi realizada em espectrofotômetro (BioTek, Winooski, Vermont, USA) em um comprimento de onda de 492 nm.
Análise estatística
As análises estatísticas foram realizadas com o auxílio do programa SPSS 13.0 (SPSS Inc.,Chicago, Illinois). A análise estatística descritiva, incluindo média e desvio-padrão, foi calculada para os grupos avaliados. Os valores da quantidade de células viáveis foram submetidos à análise de variância (ANOVA), para determinar se havia diferenças estatísticas entre os grupos, e posteriormente ao teste de Tukey.
RESULTADOS
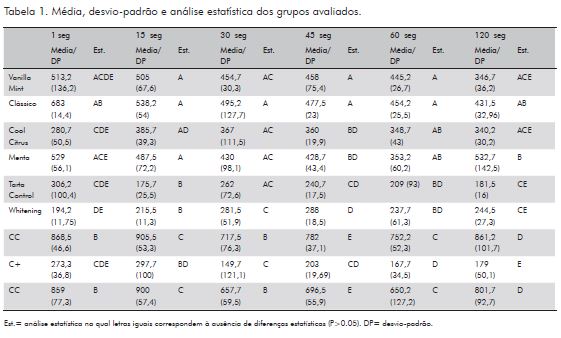
Os resultados obtidos quanto à citotoxicidade do enxaguatório avaliado nos diferentes tempos estão descritos na Tabela 1.
DISCUSSÃO
Diversas doenças da cavidade oral estão associadas ao acúmulo do biofilme bucal, como cárie, doenças periodontais e infecções6.
Dessa forma, diminuir o acúmulo do biofilme é um fator primordial à manutenção da saúde bucal por meio de meios mecânicos7-9.
Como forma complementar aos métodos convencionais de higiene, os agentes químicos apresentam bastante efetividade, sendo indicados na remoção química de biofilmes orais, controlando o crescimento microbiano e, consequentemente, prevenindo possíveis infecções8-10.
Além disso, algumas melhorias podem ser esperadas, com a utilização de um enxaguatório bucal, tais como: melhorar o hálito e o frescor da boca, prevenir problemas bucais, como a cárie e o controle do cálculo dental, reduzir a sensibilidade dentinária, promover alívio de patologias orais, como ulcerações e, sobretudo, prevenir a formação do biofilme dental1.
Em contrapartida, essas substâncias podem provocar certas respostas biológicas, a saber, reações tóxicas, inflamatórias, alérgicas ou mutagênicas.
A toxicidade é um dos parâmetros cruciais para a avaliação de resposta biológica e do potencial lesivo, que causa a morte de células ou tecidos, sendo hoje o primeiro teste de escolha usado para quase todas as novas substâncias11.
Assim, o presente artigo se dispôs a verificar a citotoxicidade dos enxaguatórios bucais Listerine em diferentes períodos de tempo.
Neste estudo, avaliaram-se os enxaguatórios Listerine: Vanilla Mint, Clássico, Cool Citrus, Menta, Tarta Control e Whitening em diferentes tempos: 1, 15, 30, 45, 60 e 120 segundos quanto ao seu efeito citotóxico. A escolha desses períodos deu-se por serem esses os períodos utilizados corriqueiramente, durante o enxágue da boca com essas substâncias.
O ensaio de citotoxicidade foi realizado utilizando cultura celular de fibroblasto de camundongo (L929). Essas células são as mais utilizadas quando da realização de testes de citotoxicidade de materiais odontológicos, pois são células fáceis de serem cultivadas e simulam bem os fibroblastos presentes na cavidade bucal.
Os enxaguatórios, após o contato com os confluentes de L929, foram removidos e posteriormente, sobre as células colocou-se o meio de cultura e analisou-se a viabilidade celular.
Os resultados do presente trabalho demonstraram que todos os enxaguatórios apresentaram citotoxicidade em todos os tempos avaliados. Os mais citotóxicos foram o Tarta Control e Whitening, e o que apresentou menos citotoxicidade foi o Clássico. É notório ressaltar que a citotoxicidade foi diretamente proporcional ao tempo de exposição às culturas de células.
Esse fato é ratificado na literatura. Estudos utilizando o enxaguatório Cepacol Tradicional demonstraram resultados que apresentaram um caráter citotóxico também proporcional ao tempo de exposição à cultura de células, porém, neste trabalho com 45, 60 e 120 segundos, não ocorreu um aumento expressivo dessa citotoxicidade, comparado aos tempos de 1, 15 e 3 segundos12, o que pode significar um caráter citotóxico ao início do bochecho12.
O resultado desta pesquisa contribuiu para o conhecimento acerca do tratamento com o uso de enxaguatório, demonstrando seus possíveis efeitos benéficos e colaterais na cavidade oral.
Destarte, ressalta-se a importância da utilização dos enxaguatórios bucais no controle do biofilme dental, tendo em vista a possibilidade de ocorrência de respostas biológicas em virtude da tocixidade desses colutórios.
CONCLUSÃO
Pode-se concluir com a realização desse trabalho que
• todos os enxaguatórios avaliados apresentaram citotoxicidade.
• a citotoxidade apresentada foi diretamente proporcional ao tempo de exposição às culturas de células.
REFERÊNCIAS
1. Leite MF. Desenvolvimento e caracterização de microemulsões contendo extrato e óleo essencial de Baccharis dracunculifolia para enxaguatório bucal. Ribeirão Preto: Tese de Doutorado, Universidade de São Paulo - USP; 2009. [ Links ]
2. Lindhe J. Tratado de Periodontia Clínica e Implantodontia Oral. Rio de Janeiro: Ed. Guanabara Koogan, 1999. 720p.
3. Santos PSS, Mello WR, Wakim RCS, Paschoal MAG. Uso de solução bucal com sistema enzimático em pacientes totalmente dependentes de cuidados em unidade de terapia intensiva. Revista brasileira de terapia intensiva 2008;20:154-59.
4. Zanin SMW, Miguel MD, Barreira SMW, Nakashima T, Cury CD, Costa CK. Enxaguatório Bucal: principais ativos e desenvolvimento de fórmula contendo extrato hidroalcoólico de salvia officinalis l. Visão Acadêmica 2007;8:19-24.
5. Neyndorff HC, Bartel DL, Tufaro F, Levy JG. Development of a model to demonstrate photosensitizer-mediated viral inactivation in blood. Transfusion 1990;30:485-90.
6. Marinho VCC, Higgins JPT, Logan S, Sheiham A. Fluoride mouthrinses for preventing dental caries in children and adolescents. Cochrane Database Syst Rev 2003;3(Art:2284).
7. Aquino DR, Cortelli JR, Querido SMR, Dotto PP, Jorge AOC, Cortelli SC. Estudo in vitro da efetividade do triclosan/associado sobre microrganismos bucais. JBE 2002;3:62-67.
8. Torres CRG, Kubo C, Anido A, Rodrigues JR. Agentes antimicrobianos e seu potencial de uso em Odontologia. Pós-Grad. Ver. Fac. Odontol. São José dos Campos 2000;3:43-52.
9. Neto RL, Macedo NL, Lima FR, Kerbauy WD, Jardini MAN, Ferreira UR. Bochechos e formação de placa. RGO 1991;39:417-19.
10. Lima ADS, Grégio AMT, Tanaka O, Machado MAN, França BHS. Tratamento das ulcerações traumáticas bucais causadas por aparelhos ortodônticos. Rev Dental Press Ortodont Ortoped Facial. 2005;10:30-6.
11. Siqueira GT, Minghelli SV, Thomas M, Lopes dS, M. A., Macedo NL. Cytotoxicity of two autopolymerized acrylic resins used in orthodontics. Angle Orthod 2008;78:926-30.
12. Santos RL, Pithon MM, Martins FO, Romanos TV. Citotoxidade de enxaguatório bucal em células fibroblásticas: avaliação de diferentes tempos. Full Dentistry in Science 2009;1:80-84.
 Endereço para correspondência:
Endereço para correspondência:
Matheus Melo Pithon
Av. Otávio Santos, 395 - Sala 705
Centro Odontomédico Dr. Altamirando da Costa Lima, Recreio
Vitória da Conquista – Bahia/Brasil
CEP: 45020-750
e-mail: matheuspithon@gmail.com













