Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista de Cirurgia e Traumatologia Buco-maxilo-facial
versão On-line ISSN 1808-5210
Rev. cir. traumatol. buco-maxilo-fac. vol.13 no.3 Camaragibe Jul./Set. 2013
Laser terapêutico e células inflamatórias – parte 1: mastócitos*
Therapeutic laser and inflammatory cells - part 1: mast cells
Otacílio Luiz Chagas JúniorI; Bruna MuhlinbergVetromillaII; Jimmy Charles Melo BarbalhoIII; Rogério Miranda PagnoncelliIV; Dra. Camila Leal SonegoV
I Professor Adjunto do Departamento de Cirurgia, Traumatologia e Prótese Buco-Maxilo-Faciais da Faculdade de Odontologia da UFPel, Pelotas, RS, Brasil.
II Graduanda Bolsista do Departamento de Cirurgia, Traumatologia e Prótese Buco-Maxilo-Faciais da Faculdade de Odontologia da UFPel, Pelotas, RS, Brasil.
III Professor do Departamento de Cirurgia e Traumatologia Buco-Maxilo-Faciais do Departamento de Odontologia da Universidade Estadual do Rio Grande do Norte-UERN, Caicó-RN/Brasil.
IV Professor do Departamento de Cirurgia, Faculdade de Odontologia da PUCRS, Porto Alegre-RS/Brasil.
V Cirurgiã-Dentista pela UNIFRA Especialista em CTBMF pela UFPel Mestranda em CTBMF pela ULBRA.
RESUMO
O presente estudo avaliou a quantidade de mastócitos após irradiação do laser não cirúrgico λ685 nm. Dezoito ratos machos, linhagem Wistar (250 a 300 gramas), nos quais foram realizadas feridas cirúrgicas padronizadas, foram distribuídos em seis grupos, três experimentais (com quatro ratos) e três controles (com dois ratos). Os grupos experimentais foram irradiados em quatro pontos perilesionais equidistantes (0,5 J/cm2, 35 mW, 35 Hz e 17 segundos). Os grupos-controles não foram irradiados. Os animais foram mortos 6, 12 e 24 horas após a irradiação, sendo obtidas peças que seguiram para processamento laboratorial de rotina. O estudo das lâminas foi realizado por meio da contagem absoluta dos mastócitos pelo método esteriológico. Os resultados obtidos demonstraram que, nas primeiras 6 e 12 horas, após a irradiação laser, existe uma diminuição no número total de mastócitos, estatisticamente significante, quando comparados aos grupos controles, porém, após 24 horas, não existem diferenças no número de mastócitos entre os grupos experimental e controle. Baseados nos resultados obtidos com o protocolo de aplicação da luz laser utilizado, para esse modelo animal, pôde-se concluir que a luz laser é capaz de diminuir o número total de mastócitos após uma única irradiação.
Descritores: Laser não-cirúrgico. Mastócitos. Azul de Toluidina. Método Esteriológico.
ABSTRACT
This study measured the variation in the total number of mast cells after low level laser therapy (λ= 685 nm) using a stereological method. Eighteen male Wistar rats (250 to 300 grams) with standardized surgical wounds were randomly distributed into 6 groups - 3 study groups with 4 rats each, and 3 control groups with 2 rats each. In the study groups, four equidistant spots around the standardized wound were irradiated (0.5 J/cm2, 35 mW, 35 Hz, 17 seconds). The control groups were not irradiated. The animals were killed at 6, 12 and 24 hours after laser therapy. Biological specimens were harvested and routinely processed; slides were prepared and stained with toluidine blue. The total number of mast cells was counted using the stereological method. A statistically significant decrease in the total number of mast cells was observed at 6 and 12 hours after irradiation. However, there was nodifference in the number of mast cells between study and control groups at 24 hours. Our results showed that one single irradiation with laser light reduced the total number of mast cells in the animal model used in this study.
Key words: Low level laser therapy (LLLT). Mast cells.Toluidine blue. Stereological method.
INTRODUÇÃO
A prática da Cirurgia e Traumatologia Bucomaxilofacial está associada a traumatismos e infecções, tendo como características clínicas, dor, hiperalgesia, eritema e edema.
A inflamação está presente em quase todas as lesões produzidas no organismo humano. Dentre a população celular envolvida com a inflamação, encontramos o mastócito, célula presente em grande variedade de tecidos conjuntivos, estrategicamente localizada próxima a vasos sanguíneos e a superfícies mucosas e cutâneas. No curso dos eventos constituintes da reação inflamatória, os mastócitos assumem uma posição intermediária, ligando eventos não celulares, transmitidos, principalmente, por diferentes agentes, com a fase de inflamação distinguida pela migração neutrofílica e monocítica.1
A importância dessas células na inflamação reside no conteúdo de seus numerosos grânulos citoplasmáticos, os quais armazenam mediadores químicos biologicamente ativos, como a histamina, importante amina vasoativa que participa do processo inflamatório agudo.2 A degranulação dos mastócitos, dessa maneira, segue imediatamente o tecido lesivo não-específico e a ativação do Sistema Complemento em outros eventos inflamatórios iniciais. A histamina liberada pelos mastócitos tem um papel decisivo na hiperemia regularmente associada aos estágios iniciais da inflamação. Esse mecanismo ativo resulta em edema inflamatório.
O uso dos lasers não cirúrgicos, terapêuticos, ou de baixa potência, ou ainda, não ablativos por profissionais da área odontológica e médica tem crescido constantemente.3,4
Há um grande número de trabalhos que relatam o uso do laser no processo de reparo, quando aplicado particularmente nas fases prematuras desse processo. A vasodilatação é um dos efeitos induzidos pelo laser de baixa potência nos tecidos. Isso sugere que o laser não somente age diretamente nos receptores celulares, como também estimula a liberação de metabólitos vasodilatadores teciduais ou mediadores vasculares humorais, como os liberados pelos mastócitos após lesão.5
Ao laser não cirúrgico vêm sendo atribuído efeitos analgésicos, anti-inflamatórios e estimulantes do processo de cicatrização, sendo o estudo das interações entre a luz laser e a matéria viva marcadamente complexo. A energia depositada nos tecidos sofre fenômenos de absorção, reflexão, difusão e transmissão.4
A luz emitida pelo aparelho laser é caracterizada pela monocromaticidade, paralelismo e coerência. A radiação emitida é a térmica, o que significa que o efeito biológico não é causado pelo aquecimento perceptível ou dano celular.6
À biomodulação tem sido atribuído o aumento do alcance dos efeitos biológicos desde o crescimento epitelial e fibroblástico, estimulação da síntese de colágeno, aumento da capacidade de fagocitose e de liberação de endorfina.3
As funções terapêuticas no campo da analgesia e de biomodulação do processo inflamatório são geralmente desenvolvidas no espectro vermelho e infravermelho da luz, de λ600 nm a λ900 nm, aproximadamente.7
É importante conhecer as características e peculiaridades que a luz laser oferece a fim de melhor usufruir da sua variada gama de procedimentos. Sendo assim, o objetivo deste trabalho foi avaliar a ação do laser, λ= 685nm, na população de mastócitos, em feridas cirúrgicas no dorso de ratos, por meio da contagem absoluta pelo método esteriológico.
METODOLOGIA
Esta pesquisa foi aprovada pela Comissão Científica e de Ética da Faculdade de Odontologia da Pontifícia Universidade Católica do Rio Grande do Sul, sob o protocolo n° 0027/03.
OBTENÇÃO DA AMOSTRA
A amostra foi constituída de 18 ratos machos com peso entre 250 e 300 gramas da espécie Rattusnorvegicus, ordem Rodentia, linhagem Wistar, distribuídos aleatoriamente em seis grupos, três experimentais e três controles. Cada grupo experimental foi composto por quatro ratos, e cada controle, por dois (tab. 1).
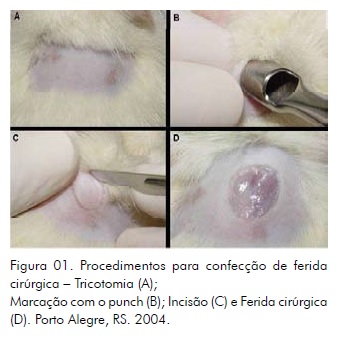
O procedimento cirúrgico foi realizado sob anestesia geral (Xilazina® e Quetamina® intraperitoneal). Os animais foram tricotomizados na porção superior de dorso quando já em plano anestésico, sendo lavados com solução fisiológica 0,9% e secos com gaze estéril. Em seguida, realizada antissepsia com solução de clorexidina a 2%. A cirurgia seguiu o protocolo de Panarello4: o punch foi posicionado perpendicularmente à superfície da pele da região tricotomizada, promovendo, assim, movimentos giratórios para facilitar a penetração da lâmina a uma profundidade de 1 mm. Em seguida, foi dissecado o tecido incluído na demarcação, com bisturi e pinça de Adson Brown, removendo delicadamente a quantidade de tecido necessária à produção de uma lesão com 1 mm de profundidade e 8 mm de diâmetro, que proporcionou uma área tecidual de aproximadamente 0,5 cm2, com volume de 0,05 cm3 (Fig. 1). O sangramento não foi interrompido ou removido, permitindo a hemostasia espontânea das feridas.
O aparelho laser utilizado foi o modelo Theralase ® (DMC, São Carlos, SP), de meio ativo InGaIP, emissor laser visível, com λ= 685 nm, área do feixe de 2 mm2, divergência de 1,5°. A aplicação foi feita imediatamente após a realização da lesão, transcutaneamente nas bordas da ferida em quatro pontos equidistantes demarcados.4 Todos os ratos dos grupos experimentais foram irradiados com o mesmo protocolo de irradiação que correspondeu a uma única aplicação de forma pontual, pulsátil, com frequência de 35 pulsos por segundo, potência de 35 mW e densidade de energia de 0,5 J/cm2 por ponto, tempo de 17 segundos, totalizando uma dose total de 2 J/cm2 e tempo total de 68 segundos por animal.
A morte dos animais seguiu a distribuição por grupos: 6, 12 e 24 horas após a irradiação laser. Para tal, foi empregada câmara de CO2, ocasionando morte por parada cardiorrespiratória, respeitando-se a Declaração dos Direitos dos Animais.8
PROCEDIMENTOS LABORATORIAIS
Após a morte de cada animal, foi retirada uma peça elíptica com margem de segurança envolvendo a lesão.
As peças foram fixadas em solução de formol a 10% tamponado2,9, por um período de 24 horas, em frascos individualizados e separados por grupos. Depois, foram seccionadas ao meio e incluídas em parafina. Depois de confeccionados os blocos, foram obtidos cortes histológicos com 5 micra de espessura, e montados em lâminas, que foram coradas pela técnica do azul de toluidina.2,9,10
ANÁLISE HISTOLÓGICA
Utilizou-se a microscopia óptica de luz para estudo das lâminas, objetivando a contagem absoluta de mastócitos presentes na lesão e em sua periferia, através do método esteriológico11, utilizando um sistema composto por microscópio óptico marca Olympus, modelo BX50; câmera de captura de imagem acoplada ao microscópio, marca Sony® CCD-Iris – Color VideoCamera, modelo DXC- 107A; microcomputador COMPAQ®, processador Intel® Pentium 4, CPU 1.8 GHz e 128 MB de memória RAM, HD com 40 GB, Sistema Operacional Microsoft® Windows XP Professional, versão 2002; e o software Image – Pro Plus®, versão 4.5.1.22 para Windows 98/NT/ME/2000/XP Prof., Media Cybernetics, Inc, Silver Spring, MD, USA.
TRATAMENTO ESTATÍSTICO
Foi utilizada a análise de variância por meio do teste paramétrico (One-way ANOVA), com pós-teste de Tukey-Kramer, através do software GrafPadInStat ®, versão 3.05, 32 bit para Windows 95/NT, criado em 27 de setembro de 2000 pela GrafPad Software, Inc., San Diego, CA, USA.
RESULTADOS
CONTAGEM ABSOLUTA
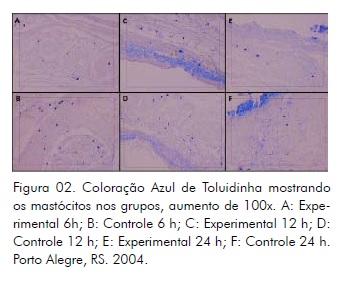
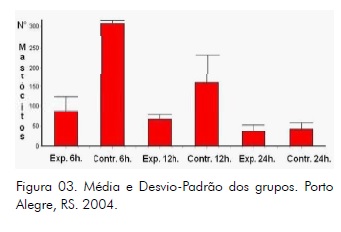
Observou-se à microscopia óptica de luz um maior número de mastócitos presentes no grupo controle 6h em relação ao grupo experimental 6h, bem como no grupo controle 12h em relação ao experimental 12h (Fig. 02).
Entretanto, entre os grupos controle e experimental 24h, não se percebe diferença quanto ao número de mastócitos presentes (Fig. 02).
ANÁLISE ESTATÍSTICA
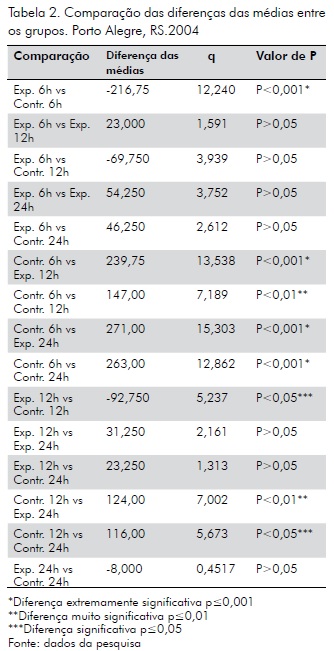
Análise de Variância (ANOVA One-way): O valor de P é < 0,001, considerado extremamente significante. A variação entre as médias das colunas é significantemente maior que o esperado pela ocasião.
Teste de Tukey-Kramer para comparações múltiplas: Se o valor de q é maior que 4,751 então o valor de P é menor que 0,05 (tab. 2; fig. 03).
DISCUSSÃO
Muitos são os trabalhos na literatura sobre a atuação da irradiação laser sobre o processo de reparo, mas raros são os que abordam as fases iniciais da inflamação como tema de estudo. Dessa forma, objetivou-se neste conhecer a atuação da luz laser em uma das principais células do processo inflamatório agudo, o mastócito, a fim de possibilitar estudos futuros sobre a atuação do laser não-cirúrgico na inflamação como um todo e, assim, fazer metanálises com os trabalhos já existentes sobre laser e reparo.
A dificuldade encontrada foi a gama de metodologias existentes na literatura, optando-se, portanto, por utilizar parte da metodologia de Panarello4, pois seu trabalho tem a mesma linha de pesquisa deste. A dosimetria e a potência empregadas encontram-se na faixa recomendada por Basford12 para se obterem feitos biomoduladores com o laser não cirúrgico. O regime de frequência de irradiação utilizado encontra-se próximo a uma das janelas de frequência citadas por El Sayed e Dyson.13
El Sayed e Dyson13, El Sayed e Dyson5e Silveira e Lopes10 utilizaram como controle o mesmo animal, porém, Belkin e Schwartz14 e Rochkindet al14 afirmam que o laser não cirúrgico possui efeitos sistêmicos pronunciados. Neste trabalho, optou-se por se utilizarem animais diferentes em grupos diferentes.
El Sayed e Dyson5, El Sayed e Dyson13, Silveira e Lopes10e Tsyganova15 utilizaram doses únicas de irradiação laser, como no presente estudo.
A morte dos animais foi realizada em 2, 24, 48 horas e 5, 7, 10, 20 e 30 dias após a irradiação laser por Tsyganova15; 2 horas após por El Sayed e Dyson13;0, 4, 8, 24, 72, 120 e 144 horas após por Silveira e Lopes10, e neste foi realizada em 6, 12 e 24 horas após. Julga-se importante a observância desse dado, uma vez que nos resultados apresentados neste trabalho, verificou-se que 24 horas após a irradiação laser não há diferenças estatísticas significantes entre o grupo irradiado e o controle quanto ao número total de mastócitos.
Os parâmetros fundamentais, citados por Schindl et al.6, do protocolo de irradiação laser essencial para comparação dos dados, como: comprimento de onda, frequência, potência de saída, diâmetro do spot, tempo de irradiação, intensidade, dose, e intervalos de tratamento; não são totalmente relatados nos trabalhos de El Sayed e Dyson5, El Sayed e Dyson13, Silveira e Lopes10, Tsyganova15 e encontram-se no presente trabalho.
Comparando esse estudo com os da literatura, observam-se diferenças quanto aos parâmetros de irradiação, como o comprimento de onda utilizado, densidade de energia, potência, tempo de aplicação. Tsyganova15, utilizou um λde 1060 nme densidades de energia de 10,2, 48 e 105 J/cm2; El Sayed e Dyson5utilizaram um λde 660 e 950 nm, intensidade de potência de 45 e 120 mW/cm² e uma dose de 10,8 J/cm2; Silveira e Lopes10 utilizaram um λ de 904 nm, em alta potência, durante cinco minutos; El Sayed e Dyson13 utilizaram um λde 820 nm, intensidade de potência de 800 mW/cm2, dose de 21,6 J/cm2 durante 27 segundos.
El Sayed e Dyson5 trabalharam com laser vermelho(visível), como neste trabalho,enquanto o resto dos autores, com laser infravermelho (invisível).
Os resultados deste trabalho corroboram os achados de Silveira e Lopes10 em que há uma redução no número de mastócitos após a irradiação laser, diferentemente de El Sayed e Dyson5 e Tsyganova15 que relatam um aumento na população de mastócitos.
Todos os trabalhos até então publicados na literatura, que são poucos, falando sobre o comportamento do mastócito após a irradiação do laser não cirúrgico, não explicam a provável modificação estrutural nesse tipo celular, mesmo por quê, até hoje, ainda não existem dados que comprovem a verdadeira ação do laser em nível celular e molecular. O que se tem são teorias.
Considerando que o mastócito contém múltiplas mitocôndrias1e, ainda, a teoria de Karu17, que afirma que a fotorrecepção ocorrendo em nível mitocondrial pode intensificar o metabolismo respiratório e as propriedades eletrofisiológicas da membrana, desta maneira, mudando a fisiologia celular, pode-se inferir que a luz do laser, agindo nos mastócitos altera seu processo de degranulação, como pode ser visto em El Sayed e Dyson13, Silveira e Lopes10 e El Sayed e Dyson5, em que afirmam que há um aumento na degranulação.
Seriam necessários maiores estudos em Biologia Celular e Molecular a fim de provar os diversos postulados da ação da irradiação laser em nível celular.
REFERÊNCIAS
1. Parwaresch, MR et al. Tissue mast cells in health and disease. Pathol ResPract. 1985 Mar; 179(4- 5):439-61. [ Links ]
2. Zhong, FC; Zhen, ZJ. Localization and quantification of histamine in injured skinas parameters for the timing of wounds. Forensic Sci Int. 1991 Oct; 51(2):163-71.
3. Mester, E; Mester, AF; Mester, A. The biomedical effects of laser application. Lasers Surg Med 1985;5(1):31-9.
4. Panarello, AF. Avaliação da potência e intensidade do laser não ablativo no processo de inflamação e reparo de tecidos moles. Porto Alegre, 2003. Dissertação(Mestrado). Faculdade de Odontologia, Pontifícia Universidade Católica do Rio Grande Do Sul.
5. El Sayed, SO; Dyson, M. Comparison of the effect of multiwavelength lightproduced by a cluster of semiconductor diodes and of each individual diode on mastcell number and degranulation in intact and injured skin. Lasers Surg Med. 1990; 10(6):559-68.
6. Schindl, A. Et Al. Low-Intensity laser therapy: A review. J Investig Med. 2000 Sept ; 48(5):312-26.
7. Tunér, J; Christensen, PH. Low level lasers in dentistry. Disponível em http://www.laser.nu/lllt/laser_therapy_%20in_dentistry.htm>. Acesso em 7 de Junho de 2003.
8. Goldin, JR. Pesquisa em saúde: normas, leis e diretrizes. 2. ed. Porto Alegre: HCPA, 1995.
9. Strobel, S; Miller; HRP; Ferguson, A. Human intestinal mucosal mastcells: evaluation of fixation and staining techniques. J ClinPathol. 1981 Aug; 34(8):851-8.
10. Silveira, JC; Lopes, EE. Alguns aspectos do comportamento do mastócito sob ação do raio laser de GaAs – 904 nm (Estudo experimental em cobaias –Caviaporcellus). Arq. Cent. Estud. Curso Odontol., Belo Horizonte. 1991 jan/dez; 28(1-2):73-96.
11. Gundersen, HJG et al. Some new, simple and efficient stereological methods and their use in pathological research and diagnosis. Apmis. 1988 May; 96(5):379-94.
12. Basford, JR. Low intensity laser therapy: still not an established clinical tool. Lasers Surg Med 1995;16(4):331-42.
13. El Sayed, SO; Dyson, M. Effect of laser pulse repetition rate and pulse durationon mast cell number and degranulation. Lasers Surg Med. 1996; 19(4):433-7.
14. Belkin, M; Schwartz, M. New biological phenomena associated with laser radiation. Health Phys. 1989; 56(5):687-90. Kolárová, H; Ditrichová, D; Wagner, J. Penetration of laser light into the skin in vitro.Lasers Surg Med. 1999 May; 24(5):231-5.
15. Rochkind, S et al. Systemic effects of low-power laser irradiation on the peripheral and central nervous system, cutaneous wounds, and burns. Lasers Surg Med. 1989 Feb; 9(2):174-82.
16. Tsyganova, NV. Changes in mast cells in the loose subcutaneous connectivetissue after laser irradiation. Bull ExpBiol Med. 1974 Jun; 76(12):1047-9.
17. Karu, TI. Photobiology of low-power laser effects. Health Phys. 1989 May; 56(5):691-701.
 Endereço para correspondência:
Endereço para correspondência:
Prof. Dr. Otacílio Luiz Chagas Júnior
Departamento de Cirurgia, Traumatologia e
Prótese Buco-Maxilo-Facial
Universidade Federal de Pelotas – Faculdade de
Odontologia
Rua Gonçalves Chaves, 457 - 3º andar –
Pelotas - RS/Brasil
CEP: 96015-570
e-mail: otaciliochagasjr@gmail.com













