Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Revista de Cirurgia e Traumatologia Buco-maxilo-facial
versão On-line ISSN 1808-5210
Rev. cir. traumatol. buco-maxilo-fac. vol.13 no.4 Camaragibe Out./Dez. 2013
Expressão da metaloproteinase 9 no carcinoma de células escamosas oral
Expression of matrix metalloproteinase 9 in oral squamous cell carcinoma
Lianne D'Oleron Lima VasconcelosI; Nathalia Vieitez Rodrigues MoreiraI; Leorik Pereira da SilvaII; Ana Paula Veras SobralIII
I Graduada em Odontologia, FOP/UPE.
II Aluno de Graduação em Odontologia, FOP/UPE.
III Professora Associada de Patologia Bucal da FOP/UPE.
RESUMO
A metaloproteinase-9 (MMP-9) ou gelatinase B pertence à família das metaloproteinases da matriz, enzimas que degradam componentes da matriz extracelular (MEC) e da membrana basal e estão implicadas no processo de carcinogênese, contribuindo para a progressão tumoral, invasão e metástase. Neste trabalho, a MMP-9 foi utilizada como marcador imuno-histoquímico, a fim de correlacionar sua expressão com a gradação histológica de 28 casos de carcinoma de células escamosas oral (CCEO) obtidos do Laboratório de Patologia Bucal da Faculdade de Odontologia de Pernambuco (FOP/UPE). As amostras foram classificadas quanto ao grau de malignidade em carcinoma in situ, baixo grau, grau moderado e alto grau de malignidade. A técnica imuno-histoquímica foi realizada através do método estreptavidina-biotina, utilizando o anticorpo anti-MMP9. Na análise estatística, foi utilizado o teste Exato de Fischer, com nível de significância de p=0.05. Verificou-se que a MMP-9 apresentou positividade em 24 casos (85.7%) de CCEO, sendo observada correlação estatisticamente significativa entre a expressão da MMP-9 e o grau de malignidade (p=0.002). Os resultados indicam que a expressão da MMP-9 pode ser sugerida como fator preditivo de comportamento biológico agressivo no CCEO.
Descritores: Carcinoma de células escamosas. Neoplasias bucais. Imuno-histoquímica. Metaloproteinase 9 da Matriz.
ABSTRACT
The metalloproteinase-9 (MMP-9) or gelatinase B belongs to the family of matrix metalloproteinases, enzymes which degrade extracellular matrix (ECM) and basement membrane components and are implicated in the carcinogenesis process, contributing to tumor progression, invasion and metastasis. In this work, MMP-9 was used as an immunohistochemical marker in order to correlate its expression with histological grading of 28 cases of oral squamous cell carcinoma (OSCC) obtained from the Laboratory of Oral Pathology, School of Dentistry of Pernambuco (FOP / UPE). The samples were classified according to the malignancy grade as in situ carcinoma, low grade, intermediate grade and high grade of malignancy. The immunohistochemistry technique was performed by the streptavidin-biotin method using the antibody anti-MMP9. The statistical analysis used the Fisher's exact test, with a significance level of p=0.05. It was verified that MMP-9 expression was positive in 24 OSCC cases (85.7%). Significant statistical correlation was observed between the expression of MMP-9 and the degree of malignancy (p=0.002). The results indicate that expression of MMP-9 may be suggested as a predictor of aggressive biological behavior in OSCC.
Descriptors: Carcinoma, Squamous Cell. Mouth Neoplasms. Immunohistochemistry. Matrix Metalloproteinase 9.
INTRODUÇÃO
A determinação do potencial de crescimento, invasão e metástase é de extrema importância na conduta clínica, no tratamento e no prognóstico do carcinoma de células escamosas (CCE)1,2. O estroma tumoral tem uma relação direta com o comportamento biológico das neoplasias, contribuindo significativamente para a progressão do CCE3. Para que aconteçam as etapas da carcinogênese (organização primária, progressão, angiogênese, invasão local e desenvolvimento de metástases), a célula neoplásica necessita da degradação proteolítica da matriz extracelular (MEC)4. Dentre as enzimas degradadoras da MEC, destaca-se a família das metaloproteinases da matriz (MMPs), diante da sua extensa capacidade de degradar, processar, ativar ou inativar praticamente todos os componentes da MEC2,5.
As MMPs são uma família de enzimas proteolíticas, do tipo endopeptidases, zinco- e cálcio-dependentes, que atuam desorganizando e degradando componentes da MEC e da membrana basal, através de processos que alteram as interações célula-célula e célula-matriz2,5. Embora desempenhem várias funções fisiológicas, há grande interesse no potencial das MMPs, livre de mecanismos regulatórios, na propagação do câncer6,4. Essas ações podem ser diretas, através da degradação da MEC e da membrana basal, promovendo proliferação de células neoplásicas e disseminação metastática, e indiretas, quando promovem angiogênese, necessária para nutrição e disseminação do tumor4. O aumento na produção dessas enzimas associa-se ao fenótipo metastático e invasivo em muitos tumores7,1,3.
Diferentes tipos de MMPs interagem entre si e participam de diversos estágios do desenvolvimento do câncer8. Durante a invasão neoplásica, o maior papel das MMPs consiste não apenas na quebra da barreira da MEC, mas no rearranjo dos seus componentes para facilitar a migração celular por entre este microambiente9,4.
A MMP-9 é a gelatinase B do grupo das gelatinases, assim conhecidas por degradarem os vários tipos de colágenos desnaturados (gelatinas), além de contribuírem para a digestão do colágeno tipo IV e outros componente da membrana basal2,5.
As MMPs estão implicadas numa variedade de papéis que podem ajudar a iniciação do tumor, crescimento, migração, angiogênese, a seleção de subpopulações resistentes a apoptose, e na invasão e metástase. Portanto, não podem mais ser pensadas apenas como destruidoras da MEC, mas como parte de um distinto sistema de comunicação através do qual o tumor interage com o estroma10.
Diante do exposto, o objetivo deste trabalho é analisar, através da técnica imuno-histoquímica, a expressão da MMP-9 em carcinomas de células escamosas orais (CCEOs) na tentativa de entender sua correlação com o grau histológico de malignidade destas lesões.
METODOLOGIA
Foram obtidas vinte e oito (28) amostras de CCEOs bucais emblocadas em parafina, bem como as fichas de biópsia, no Laboratório de Patologia Bucal da FOP (UPE). Este trabalho foi aprovado pelo Comitê de Ética em Pesquisa desta instituição através do registro 083/10.
A gradação dos tumores foi realizada utilizandose a classificação histopatológica de malignidade proposta pela Organização Mundial de Saúde (OMS, 2005)11, que se baseia no grau de diferenciação celular. Os tumores foram classificados em baixo, moderado e alto grau de malignidade. Considerou-se, ainda, carcinoma in situ quando não houve invasão da membrana basal.
A técnica imuno-histoquímica foi realizada pelo método da estreptavidina-biotina peroxidase, otimizado com o sistema de amplificação LSAB (Labeled Streptavidin-Biotin for mouse primary antibody, DAKO). A recuperação antigênica foi feita em panela de pressão elétrica durante 1' em Citrato pH 6.0; procedeu-se a incubação do anticorpo primário monoclonal anti-MMP9 (DBS), numa diluição de 1:125, sendo a 3,3-diaminobenzidina (Sigma Chemical CO, St. Louis, USA) o cromógeno; os cortes foram contra-corados com Hematoxilina de Harris.
A imunomarcação foi analisada à microscopia de luz, e o padrão de imunoexpressão da MMP-9 foi classificado quanto à presença (+) ou ausência (-), e para os casos positivos em: fraca (+), moderada (++) e intensa (+++), de acordo com a intensidade de marcação.
Foram utilizados o Software STATA/SE 9.0 e o Excel 2007 para realizar a análise estatística. O Teste Exato de Fisher verificou a associação entre as variáveis categóricas, sendo aplicado com 95% de confiança, considerando-se estatisticamente significativo quando p<0,05.
RESULTADOS
Dos 28 casos de CCEOs estudados, observouse maior prevalência dos casos de alto grau (n=14; 50%) em relação aos de baixo grau (n=10; 35.7%). Observamos ainda 2 casos de grau moderado e 2 de carcinoma in situ, correspondendo a 7.1% cada.
A análise da imunomarcação da MMP-9 revelou que, dos 28 casos, 24 foram positivos (85.7%); destes, 18 (75%) foram positivos no parênquima, com intensidade fraca em 5 (27.8%), moderada em 9 (50%) e forte em 4 (22.2%). Em 1 caso, foi observada marcação positiva moderada em células do parênquima no front de invasão tumoral. No estroma, 13 casos foram positivos (54.2%), sendo a intensidade fraca em 2 (15.4%), moderada em 7 (53.8%) e forte em 4 (30.8%). A Figura 1 mostra a expressão da MMP-9 em CCEOs investigados.
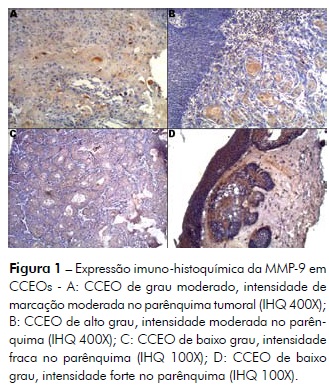
Todos os casos de alto grau de malignidade (n=14) foram positivos para a MMP-9, observandose associação estatisticamente significativa entre a marcação da MMP-9 e a gradação histológica (p=0.002) (Tabela 1).

DISCUSSÃO
Estimativas do INCA (2012)12 sugerem aproximadamente 518.510 novos casos de câncer no Brasil para os anos de 2012 e 2013. Para o câncer bucal, são estimados 14.170 novos casos, sendo 9.990 casos em homens e 4.180 em mulheres. Esses elevados valores têm impulsionado estudos que visam um melhor entendimento do processo da carcinogênese, assim como a descoberta de mecanismos que predizem o comportamento biológico destes tumores para que sejam desenvolvidos tratamentos mais efetivos.
Analisando casos de CCEOs, Nascimento (2010)5 verificou que os de alto grau de malignidade foram mais frequentes (n=41; 58%) que os de baixo grau (n=30; 42%). Nosso estudo concordou com este resultado, observando-se maior prevalência dos casos de alto grau (50%) em relação aos de baixo grau, grau moderado e carcinoma in situ (35.7%, 7.1% e 7.1%, respectivamente).
A determinação da capacidade de invasão e metástase do CCEO é de extrema importância na conduta clínica, no tratamento e no prognóstico. Para que ocorra essa invasão, são necessárias alterações nas interações entre células neoplásicas e a MEC, ocorrendo um aumento na secreção de enzimas degradadoras da MEC, em especial as MMPs2.
Tem-se verificado que, em cânceres humanos, a desregulação da expressão das MMPs ocorre tanto nas células malignas do tumor quanto nas células do estroma13,5. No presente estudo, houve expressão da MMP-9 em ambos, sendo maior no parênquima (75%) do que no estroma (54.2%), enquanto Nascimento (2010)5 encontrou maior expressão no estroma (76%) do que no parênquima (52%).
O-Charoenrat et al. (2001, 2002)14,15 relataram a expressão das MMPs e de seus inibidores (TIMPs) em CCEs de cabeça e pescoço, verificando que as MMPs-2, -7, -9 e -11 exerceram um importante papel na progressão e desenvolvimento de metástase nos tumores estudados. Hong et al. (2000)1, comparando a expressão das MMPs-2 e –9 em CCEOs, relataram um maior papel da MMP-9 no desenvolvimento de metástase, afirmando ser sua expressão um bom marcador como fator prognóstico.
Recentes pesquisas16-19 também tem demonstrado elevada expressão da MMP-9 nos CCEs de cabeça e pescoço, e enfatizado seu importante papel na progressão tumoral, especialmente devido à degradação do colágeno IV, principal componente da membrana basal. Corroborando a literatura citada, o presente estudo obteve expressão significativa da MMP-9 nos CCEOs (85.7%). Além disso, ao correlacionar a marcação da MMP-9 com o grau de malignidade dos casos investigados, verificou-se significância estatística de p=0.002, o que indica uma maior ação proteolítica desta MMP nos tumores com alto grau de malignidade, e consequente aumento no potencial de invasão e metástase, à semelhança do achado de De Vicente et al. (2005)20. Porém, Hong et al. (2000)1 não verificaram correlação entre a gradação histológica do CCEO e a expressão da MMP-9.
Com base nesses resultados, concluímos que a expressão da MMP-9 pode ser sugerida como fator preditivo de comportamento biológico agressivo no CCEO.
REFERÊNCIAS
1. Hong SD, Hong SP, Lee JI, Lim CY. Expression of matrix metalloproteinase-2 and -9 in oral squamous cell carcinomas with regard to the metastatic potential. Oral Oncol. Oral Oncol. 2000;36(2):207-13. [ Links ]
2. Pereira AC, Carmo ED, Silveira VA, Amadei SU, Rosa LEB. O papel das MMP-2 e -9 no desenvolvimento do carcinoma epidermóide. Rev bras cancerol. 2006;52(3):257-262.
3. Pereira ALA, Veras SSL, Silveira EJD, Seabra FRG, Pinto LP, Souza LB, Freitas RA. O papel das proteínas da matriz extracelular e das metaloproteinases em carcinomas de cabeça e pescoço: uma atualização bibliográfica. Rev. Bras. Otorrinolaringol. 2005;71(1):81-6.
4. Cavalheiro BG. Expressão das metaloproteinases MMP-2, MT1-MMP e TIMP-2 e aspectos climicopatológicos no cardinoma medular da glândula tireóide: implicações prognósticas [tese]. São Paulo: Universidade de São Paulo, 2006.
5. Nascimento GJF. Associação entre polimorfismos funcionais nos genes da MMP-7 e MMP-9 e o perfil clinicopatológico do carcinoma epidermóide de língua [tese]. Natal: Universidade Federal do Rio Grande do Norte, 2010.
6. Yoon SO, Park SJ, Yun CH, Chung AS. Roles of matrix metalloproteinases in tumor metastasis and angiogenesis. J Biochem Mol Biol. 2003;36(1):128-37.
7. Thomas GT, Lewis MP, Speight PM. Matrix metalloproteinases and oral cancer. Oral Oncology. 1999;35(3):227-33.
8. Vihinen P, Kähäri VM. Matrix metalloproteinases in cancer: prognostic markers and therapeutic targets. Int J Cancer. 2002;99(2):157-66.
9. Nabeshima K, Inoue T, Shimao Y, Sameshima T. Matrix metalloproteinases in tumor invasion: role for cell migration. Pathol Int. 2002;52(4):255-64.
10. Lynch CC, Matrisian LM. Matrix metalloproteinases in tumor-host cell communication. Differentiation. 2002;70(9-10):561-73.
11. Barnes L, Eveson JW, Reichart P, Sidransky D. World Health Organization classification of tumours: pathology and genetics of head and neck tumours. Lyon: IARCPress; 2005. p. 168-9.
12. Brasil. Ministério da Saúde. Estimativa 2012: Incidência de Câncer no Brasil. Rio de Janeiro: INCA; 2011.
13. Stamenkovic I. Matrix metalloproteinases in tumor invasion and metastasis. Semin Cancer Biol. 2000;10(6):415-33.
14. O-Charoenrat P, Rhys-Evans PH, Eccles SA. Expression of matrix metalloproteinases and their inhibitors correlates with invasion and metastasis in squamous cell carcinoma of the head and neck. Arch Otolaryngol Head Neck Surg. 2001;127(7):813-20.
15. O-Charoenrat P, Rhys-Evansa PH, Archera DJ, Eccles SA. C-erbB receptors in squamous cell carcinomas of the head and neck: clinical significance and correlation with matrix metalloproteinases and vascular endothelial growth factors. Oral Oncol. 2002;38(1):73-80.
16. Barros SS, Henriques ÁC, Pereira KM, de Medeiros AM, Galvão HC, Freitas Rde A. Immunohistochemical expression of matrix metalloproteinases in squamous cell carcinoma of the tongue and lower lip. Arch Oral Biol. 2011;56(8):752-60.
17. Freitas VS, de Andrade Santos PP, de Almeida Freitas R, Pereira Pinto L, de Souza LB. Mast cells and matrix metalloproteinase 9 expression in actinic cheilitis and lip squamous cell carcinoma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2011;112(3):342-8.
18. Henriques AC, de Matos FR, Galvão HC, Freitas RA. Immunohistochemical expression of MMP-9 and VEGF in squamous cell carcinoma of the tongue. J Oral Sci. 2012;54(1):105-11.
19. Virós D, Camacho M, Zarraonandia I, García J, Quer M, Vila L, León X. Prognostic role of MMP-9 expression in head and neck carcinoma patients treated with radiotherapy or chemoradiotherapy. Oral Oncol. 2012 Oct 31. pii: S1368-8375(12)00324-7. doi: 10.1016/j. oraloncology.2012.10.005. [Epub ahead of print]
20. de Vicente JC, Fresno MF, Villalain L, Vega JA, Hernández VG. Expression and clinical significance of matrix metalloproteinase-2 and matrix metalloproteinase-9 in oral squamous cell carcinoma. Oral Oncol. 2005;41(3):283-93.
 Endereço para correspondência:
Endereço para correspondência:
Ana Paula Veras Sobral
Rua Monte Alverne, 107/05,
Hipódromo – Recife – PE,
CEP: 52.041-610
e-mail: anapvsobral@hotmail.com