Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RGO.Revista Gaúcha de Odontologia (Online)
versão On-line ISSN 1981-8637
RGO, Rev. gaúch. odontol. (Online) vol.58 no.4 Porto Alegre Dez. 2010
ORIGINAL ORIGINAL
Análise histológica da lesão óssea de mandíbula de coelho após aplicação local de cloreto de estrôncio
Histological analysis of surgically injured rabbit mandibles treated topically with strontium chloride
Márcio Antonio FariaI,*; Nelson VillaII; Adriana Aparecida Ferraz CarbonelI; Ricardo Santos SimõesIII; Soraia HadadI; Fátima Neves FaracoIV
IUniversidade Federal de São Paulo, Escola Paulista de Medicina, Departamento de Morfologia e Genética. Rua Botucatu, 740, Vila Clementino, 04023- 900, São Paulo, SP, Brasil
IIUniversidade de São Paulo, Faculdade de Medicina, Departamento de Histologia e Embriologia. São Paulo, SP, Brasil
IIIUniversidade de São Paulo, Faculdade de Medicina, Departamento de Ginecologia e Obstetrícia. São Paulo, SP, Brasil
IVUniversidade Paulista, Faculdade de Odontologia. São Paulo, SP, Brasil
RESUMO
OBJETIVO: Avaliar, pela histologia, o efeito da aplicação tópica do cloreto de estrôncio em defeitos ósseos provocados na mandíbula de coelho.
MÉTODOS: Foram utilizados 12 coelhos (New Zealand), nos quais se produziram dois defeitos cirúrgicos nas regiões laterais da mandíbula, bilateralmente. Logo após, os defeitos cirúrgicos do lado direito foram preenchidos com esponja de colágeno embebida em soro fisiológico (Controle) e os do lado esquerdo preenchidos com o mesmo material embebido em solução de cloreto de estrôncio a 2 Molar (Experimento). Os animais foram divididos em dois grupos e eutanasiados após 28 e 56 dias. O material coletado foi incluído para processamento histológico de rotina e as lâminas coradas pela hematoxilina e eosina (H.E.).
RESULTADOS: A aplicação tópica de cloreto de estrôncio estimulou e acelerou a neoformação óssea nos defeitos cirúrgicos, tratados com cloreto de estrôncio (28 dias) quando se fez comparação entre os dois grupos. Aos 28 dias o osso neoformado foi predominantemente primário. Aos 56 dias a neoformação óssea preencheu totalmente os defeitos cirúrgicos, tanto do grupo onde se utilizou a solução fisiológica quanto do tratado com cloreto de estrôncio. No entanto, notou-se que nos coelhos tratados com estrôncio o tecido ósseo neoformado se apresentou mais desenvolvido, mostrando a presença de sistemas de Havers.
CONCLUSÃO: A aplicação tópica de cloreto de estrôncio estimula e acelera a reparação óssea em lesão, provocada artificialmente em mandíbula de coelho quando se compararam os dois grupos (controle x experimento).
Termos de indexação: Coelhos. Estrôncio. Mandíbula. Regeneração óssea.
ABSTRACT
OBJECTIVE: This study histologically assessed the effect of applying strontium chloride topically to surgically-induced bone defects in rabbit mandibles.
METHODS: Small holes were made surgically on both sides of the lateral region of the mandible of 12 New Zealand rabbits. The holes on the right side were then filled with a collagen sponge soaked in saline (control) and the holes on the left were filled with a collagen sponge soaked in a 2 molar solution of strontium chloride. The animals were divided into two groups: the control group or GI was killed 28 days later and the experimental group or GII was killed 56 days later. The material was included for routine histological processing and the slices were stained with hematoxylin and eosin (HE).
RESULTS: At 28 days, the topical application of strontium chloride had stimulated and accelerated new bone formation in the surgically-induced bone defects. At this time, the newly formed bone was mostly primary. At 56 days, newly formed bone had completely filled both the holes treated with saline and strontium chloride. However, the newly formed bone in the holes treated with strontium chloride was more developed, presenting several Haversian systems.
CONCLUSION: Topical application of strontium chloride stimulates and accelerates the repair of surgically-induced bone defects in rabbit mandibles.
Indexing terms: Rabbits. Strontium. Mandible. Bone regeneration.
INTRODUÇÃO
Inúmeras substâncias têm sido estudadas na tentativa de melhorar a qualidade do tecido ósseo, diminuindo os processos de reabsorção e estimulando a deposição. Entre estas, o estrôncio tem demonstrado resultados promissores, alterando o balanço fisiológico do tecido ósseo, no sentido de bloquear a ação dos osteoclastos e estimular a ação e diferenciação dos osteoblastos1-5.
O estrôncio tem sido amplamente estudado na forma de cloreto ou de ranelato de estrôncio, sendo este último o mais utilizado, por via sistêmica, na prevenção da osteoporose. É descrito que o ranelato de estrôncio in vitro aumenta a síntese do colágeno e proteínas não colágenas pelos osteoblastos6 ou in vivo, pela inibição da reabsorção óssea (inibição e bloqueio da diferenciação dos osteoclastos), assim estimulando o aumento da deposição óssea6-8.
Raros são os trabalhos que utilizaram estrôncio localmente. No entanto, quando assim usado no tecido ósseo, esta substância demonstrou ser efetiva na melhoria da arquitetura óssea, com resultados semelhantes ao do uso sistêmico9. Desta forma, resolvemos avaliar a morfologia da reparação óssea na mandíbula de coelhos após aplicação tópica do cloreto de estrôncio.
MÉTODOS
Foram utilizados 12 coelhos New Zealand, fêmeas, adultas, com peso entre 4 e 5 kg, idade entre 10 e 12 meses, provenientes do biotério da Universidade de Santo Amaro. Os animais foram inicialmente anestesiados com quetamina (10 mg/kg), midazolam (0,5 mg/kg) e atropina (10 mg/kg) de peso corporal, por via intramuscular. Após tricotomia, foi realizada incisão retilínea de retalho cutâneo total na região látero-inferior em ambos os lados da mandíbula. Após o afastamento do periósteo, foram provocados dois defeitos via cirurgia (um de cada lado) com o uso de motor e contra-ângulo redutor 16:1, valendo-se de uma broca trefina de 5 mm de diâmetro por 5 mm de profundidade na região lateral da mandíbula. Esses defeitos cirúrgicos foram preenchidos por esponjas de colágeno (Hemospon®, Technew Com. e Ind. Ltda., Campo Grande, Brasil) e recobertas com uma membrana de colágeno reabsorvível (Genderme®, Baumer S.A., Mogi Mirim, Brasil) a qual foi fixada no tecido ósseo com auxílio de parafusos de titânio.
Os defeitos cirúrgicos do lado direito serviram como controle, recebendo esponjas de colágeno embebidas em soro fisiológico. Já os defeitos ósseos do lado esquerdo, receberam esponjas embebidas em solução de cloreto de estrôncio 2 Molar (solução gelatinosa). Em seguida, procedeu-se a sutura das feridas cirúrgicas em dois planos. Após os procedimentos cirúrgicos, os animais foram mantidos em biotério, em gaiolas plásticas individuais, com temperatura e iluminação controladas, ração balanceada e água ad libitum. Após 28 e 56 dias da cirurgia, os animais foram novamente anestesiados e sacrificados. Os animais então foram divididos em dois grupos: GI - animais sacrificados aos 28 dias e GII - animais sacrificados aos 56 dias. Os fragmentos das mandíbulas contendo os defeitos cirúrgicos foram retirados e fixados em formol a 10% em tampão fosfato por 24 horas. Em seguida foram descalcificados em solução de ácido etilenodiamino tetra-acético a 10% (EDTA), pH 7,0, por 30 dias. Os fragmentos foram submetidos à técnica histológica de rotina para inclusão em parafina. Após o processamento histológico, o material foi incluído de tal maneira que se pudesse observar todo o comprimento do defeito (da superfície à profundidade). Cortes semi-seriados de 5,0µm de espessura foram feitos seguindo o longo eixo (longitudinal) dos defeitos cirúrgicos, ou seja, da cortical para a base dos mesmos, sendo então corados pela Hematoxilina e Eosina (H.E.) e analisados pela microscopia de luz.
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da Universidade de Santo Amaro de acordo com o parecer número 071/2006, registro n. 024/06. Este trabalho foi realizado de acordo com os Princípios Éticos de Experimentação Animal, elaborado pelo Colégio Brasileiro de Experimentação Animal, entidade filiada ao Internacional Council of Laboratory Animal Science.
RESULTADOS
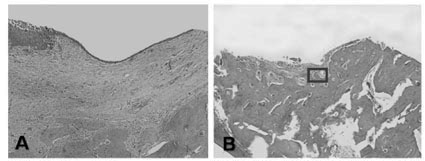
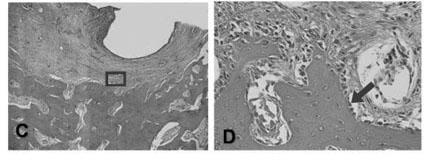
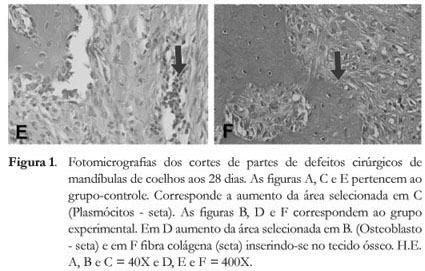
Nas lesões de 28 dias, após aplicação de solução salina, notou-se pequeno crescimento ósseo na porção mais profunda do defeito cirúrgico, representado por tecido ósseo tipicamente primário. O resto do defeito cirúrgico apresentou-se preenchido por tecido conjuntivo, contendo infiltrado de células inflamatórias (linfócitos e plasmócitos), fibroblastos e vasos sanguíneos (Figuras 1A, 1C e 1E). Já 28 dias após aplicação de cloreto de estrôncio, o local do defeito cirúrgico apresentou-se praticamente preenchido por tecido ósseo com características típicas de tecido ósseo primário, estando as cavidades medulares preenchidas por tecido conjuntivo frouxo, rico em fibroblastos e vasos sanguíneos de luz ampla (Figuras 1B e 1D). Na porção superficial (cortical) do defeito cirúrgico foi encontrada uma pequena reminiscência de tecido conjuntivo altamente vascularizado, onde se observaram grupos de células em processo de diferenciação, dando origem a grupos de osteoblastos recém diferenciados e secretores (Figura 1D).
Foi possível observar o grande número de osteoblastos nos defeitos tratados com estrôncio (28 dias), assim como a grande quantidade de feixes de fibras colágenas sendo anexadas pelo osteoide recém sintetizado, demonstrando a grande atividade destas células (Figura 1F).
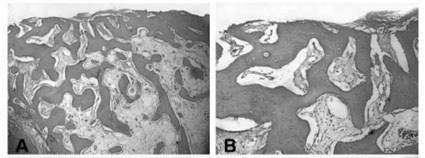
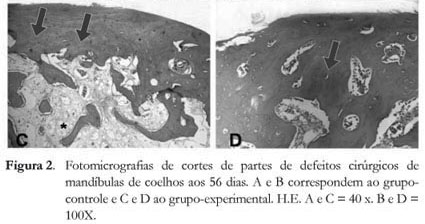
Notou-se, nos grupos de 56 dias (controle e experimental), que os defeitos cirúrgicos se encontravam totalmente preenchidos por tecido ósseo. No grupo-controle este tecido ósseo foi predominantemente primário (Figuras 2A e 2B). No grupo experimental, entretanto, foi encontrado sistemas de Havers bem típicos) e medula óssea contendo células adiposas (Figuras 2C e 2 D).
DISCUSSÃO
O cloreto de estrôncio apresenta ação antirreabsortiva e osteoestimuladora no tecido ósseo, quimicamente análogo ao cálcio e interagindo com este, sendo que sua absorção é gastrintestinal, através de difusão passiva, ou seja, transporte paracelular. Deve ser mencionado que a sua atividade não interfere com o metabolismo do cálcio. Ao contrário, quando a ingestão de estrôncio é intensificada, ocorre reposição de cálcio e sua deposição nas áreas de remodelação óssea ativa10-14.
Foi estudada a qualidade dose-dependente do sal de estrôncio, demonstrando que doses excessivas podem causar distúrbios no metabolismo do cálcio. No entanto, em doses fisiológicas ou até quatro vezes maiores são seguras14-17. No presente estudo, não foi detectado qualquer distúrbio na estrutura do osso neoformado que pudesse ser relacionada à dose administrada de cloreto de estrôncio tópica em concentração a 2 Molar. O osso neoformado nas regiões dos defeitos cirúrgicos aparentou uma estrutura normal, com trabéculas bem formadas e células de aspecto típico de síntese óssea. Deve ser salientado que o estrôncio acelerou o processo de ossificação no local do defeito, visto que 28 dias após aplicação deste sal a lesão estava praticamente preenchida por tecido ósseo.
O estrôncio apresenta a capacidade de penetrar nas células, via canais de cálcio e, subsequentemente, unir-se a determinados sítios de ligação intracelulares, tais como o retículo endoplasmático, afetando assim a homeostasia intracelular do cálcio e os processos de mineralização óssea11.
Pelo nosso estudo, notou-se que o estrôncio apresentou efeito benéfico na reparação do defeito ósseo na mandíbula. De acordo com inúmeros autores, o cloreto de estrôncio, em baixas doses, não causa nenhum distúrbio no metabolismo ósseo, mas aumenta o número de osteoblastos e diminui o número e atividade de osteoclastos1-4,18.
A literatura relata que o uso sistêmico do estrôncio em animais e em pacientes na forma de ranelato, mostra-se efetivo na melhoria da qualidade do tecido ósseo (geometria e microarquitetura), aumentando a força de resistência do osso e reduzindo o risco de fraturas em pacientes com osteoporose pós-menopausa4,7-8. Isto parece vir de acordo com nossos resultados, uma vez que foi notável a maior produção de matriz óssea, a maior quantidade de trabéculas ósseas e sua maior espessura em nosso grupo teste de 28 dias.
Foi utilizado neste experimento um protocolo de trabalho semelhante ao de Ferraro et al.9 que estudaram o efeito do cloreto de estrôncio sobre o osso alveolar de ratos, administrando este íon através de um veículo de esponja de colágeno (Gelfoam®, Pharmacia & Upjohn Co, Kalamazoo, Michigan, EUA) localmente, onde as esponjas de colágeno foram embebidas em solução de cloreto de estrôncio a 2 Molar para os grupos teste e embebidas em solução fisiológica para os grupos controle. As esponjas foram implantadas sub e supra periostealmente, porém não foram criados defeitos ósseos. Desta forma, o cloreto de estrôncio foi utilizado localmente e os resultados dos autores sugerem que a osteo-gênese pode ser estimulada pela presença local deste íon.
A grande quantidade de tecido conjuntivo frouxo nos defeitos tratados com solução salina, o que não se observou na mesma proporção no grupo teste, permite crer que a utilização do cloreto de estrôncio, segundo a metodologia da presente pesquisa acelerou a produção de tecido ósseo nos defeitos cirúrgicos criados. Na análise de 56 dias, as diferenças histomorfológicas entre os grupos teste e controle foram discretas, uma vez que ambos os defeitos se mostraram totalmente preenchidos por tecido ósseo trabecular.
Ressalta-se que, nos defeitos cirúrgicos dos grupos teste e experimental aos 28 dias, o tecido encontrado entre as trabéculas ósseas é do tipo conjuntivo frouxo. Já nas lesões de 56 dias, notou-se a presença de inúmeras células adiposas e vasos sanguíneos, sugerindo a existência de medula óssea madura, que se mostrou mais evidente nos defeitos tratados com cloreto de estrôncio. Esta observação foi reiterada pela avaliação do tecido ósseo encontrado nestas amostras, uma vez que foi possível observar a constituição de sistemas de Havers.
CONCLUSÃO
Conclui-se que a aplicação tópica de gel de cloreto de estrôncio a 2 Molar acelerou a reparação óssea de defeitos criados em mandíbulas de coelhos.
Colaboradores
MA FARIA executou a maior parte do trabalho, pois foi tema de sua tese de mestrado. N VILLA co-orientou a pesquisa. AAF CARBONEL realizou juntamente com o autor a documentação fotográfica. RS SIMÕES colaborou na parte experimental, como aluno nas cirurgias dos animais. S HADAD realizou juntamente com o autor o preparo do material e a leitura das lâminas. FN FARACO orientou a pesquisa.
REFERÊNCIAS
1. Buehler J, Chappuis P, Saffar JL, Tsouderos Y, Vignery A. Strontium ranelate inhibits bone resorption while maintaining bone formation in alveolar bone in monkeys. Bone. 2001;29(2):176-9. [ Links ]
2. Dahl SG, Allain P, Marie PJ, Mauras Y, Boivin G, Ammann P, et al. Incorporation and distribution of strontium in bone. Bone. 2001;28(4):446-53. [ Links ]
3. Fonseca JE. Rebalancing bone turnover in favor of formation with strontium ranelate: implications for born strength. Reumathology. 2008;47(1):17-9. [ Links ]
4. Marie PJ, Ammann P, Boivin G, Rey, C. Mechanisms of action and therapeutic potencial os strontium in bone. Calcif Tissue Int. 2001;69(2):121-9. [ Links ]
5. Farlay D, Boivin G, Panczer G, Lalande A, Meunier PJ. Long-term strontium ranelate administration in monkeys preserves characteristics of bone mineral crystals and degree of mineralization of bone. J Bone Miner Res. 2005;20(9):1569-78. [ Links ]
6. Reginster JY. Strontium ranelate in osteoporosis. Curr Pharm Des. 2002;8(21):1907-16. [ Links ]
7. Ammann P, Shen V, Robin B, MaurasY, Bonjour JP, Rizzoli R. Strontium ranelate improves bone resistance by increasing bone mass and improving architecture in intact female rats. J Bone Miner Res. 2004;19(12):2012-201. [ Links ]
8. Marie PJ. Strontium ranelate: a novel mode of action optimizing bone formation and resorption. Osteoporos Int. 2005;16(1):7-10. [ Links ]
9. Ferraro EF, Glass RT. The effect of strontium chloride upon alveolar bone. J Periodontol. 1980;51(6):345-7. [ Links ]
10. Brandi ML. New treatment strategies: ipriflavone, strontium, vitamin D metabolites and analogs. Am J Med. 1993;95(5):69-73. [ Links ]
11. Cabrera WE, Schrooten I, De Broe ME, D'haese PC. Strontium and bone. J Bone Miner Res. 1999;14(5):661-8. [ Links ]
12. Kollenkirchen V. Measurement of bone resorption by strontium excretion in prelabelled rats. Bone. 1995;17(4):455-60. [ Links ]
13. Matsumoto A. Effect of strontium chloride on bone resorption induced by prostaglandin E2 in cultured bone. Arch Toxicol. 1988;62(2):240-1. [ Links ]
14. Boivin G, Meunier PJ. The mineralization of bone tissue: a forgotten dimension in osteoporosis research. Osteoporos Int. 2003;14(3):19-24. [ Links ]
15. Brown EM. Is the calcium receptor a molecular target for the actions of strontium on bone?. Osteoporos Int. 2003;14(3):25-34. [ Links ]
16. Coulombe J, Faure H, Robin B, Ruat M. In vitro effects of strontium ranelate on the extracellular calcium-sensing receptor. Biochem Biophys Res Commun. 2004;323(4):1184-90. [ Links ]
17. Morohashi T, Sano T, Yamada S. Effects of strontium on calcium metabolism in rats. I. A distinction between the pharmacological and toxic doses. Jpn J Pharmacol. 1994;64(3):155-62. [ Links ]
18. Manette C, Collete J, Sarlet N, Tancredi A. Comprehensive therapy in osteoporosis using a single drug: from ADFR to strontium ranelate. Curr Med Chem. 2006;13(13):1585-90. [ Links ]
Recebido em: 28/5/2009
Versão final reapresentada em: 17/9/2009
Aprovado em: 5/10/2009
* Correspondência para / Correspondence to: MA FARIA. E-mail: <marcio.unifesp@hotmail.com>