Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RGO.Revista Gaúcha de Odontologia (Online)
versão On-line ISSN 1981-8637
RGO, Rev. gaúch. odontol. (Online) vol.59 no.2 Porto Alegre Abr./Jun. 2011
ARTIGO ORIGINAL / ORIGINAL ARTICLE
Ação dos agentes desproteinizantes e antioxidantes sobre a resistência de união à microtração de sistemas adesivos convencionais I
Action of deproteinizing and antioxidant agents on the microtensile bond strength of conventional adhesives
Ana Isabella Arruda Meira RIBEIRO II; Darlene Cristina Ramos Eloy DANTAS II; Gymenna Maria Tenório GUÊNES III; Raphaela Karla Pimentel de ARAÚJO IV; Clara Cavalcanti CYRILLO IV; Rodivan BRAZ IV
I Artigo elaborado a partir da dissertação de AIAM RIBEIRO, intitulada "Influência dos agentes desproteinizantes, antioxidantes e dos sistemas adesivos sobre a resistência de união à microtração". Universidade de Pernambuco; 2007
II Universidade Estadual da Paraíba, Centro de Ciências Biológicas e da Saúde, Departamento de Odontologia
III Universidade Federal da Paraíba, Faculdade de Odontologia, Departamento de Dentística
IV Universidade de Pernambuco, Faculdade de Odontologia, Departmento de Odontologia Restauradora
RESUMO
Objetivo
Avaliar o efeito dos agentes desproteinizantes e antioxidantes na resistência de união à dentina de sistemas adesivos convencionais.
Métodos
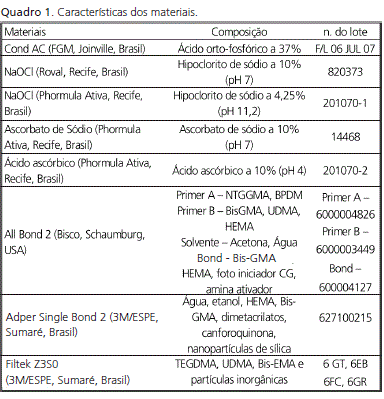
Após a remoção da porção oclusal de esmalte e polimento da dentina, foram utilizados 28 molares humanos hígidos desmineralizados com ácido fosfórico a 37% por 15 segundos e subdivididos aleatoriamente em: G1=NaOCl 10,00% por 60 segundos, All Bond 2 - AB2 (Bisco, Schaumburg, USA); G2=NaOCl 10,00%, Ascorbato de sódio a 10,00% 10min, AB2; G3=NaOCl 10,00%, Ácido ascórbico por 10min e AB2; G4=NaOCl 4,25% por 45s e AB2; G5=NaOCl 4,25%, AS, AB2; G6=NaOCl 4,25%, AA, AB2; G7=AB2; G8=NaOCl 10,00%, Adper Single Bond 2 - ASB2 (3M/ESPE, Sumaré, Brasil); G9=NaOCl 10,00%, AS, ASB2; G10=NaOCl 10,00%, AA, ASB2; G11=NaOCl 4,25% e ASB2; G12=NaOCl 4,25%, AS, ASB2; G13=NaOCl 4,25%, AA, ASB2; G14=ASB2. Os espécimes foram restaurados com compósito FiltekTM Z350 (3M/ESPE, Sumaré, Brasil), armazenados por 24h a 37ºC, seccionados com disco diamantado (Buehler, Lake Bluff, USA), para obtenção de palitos com 0,7 ± 0,2mm2 e submetidos ao teste de resistência de união à microtração em uma Máquina de Testes Universal (KRATOS, São Paulo, Brasil)(0,5mm/min).
Resultados
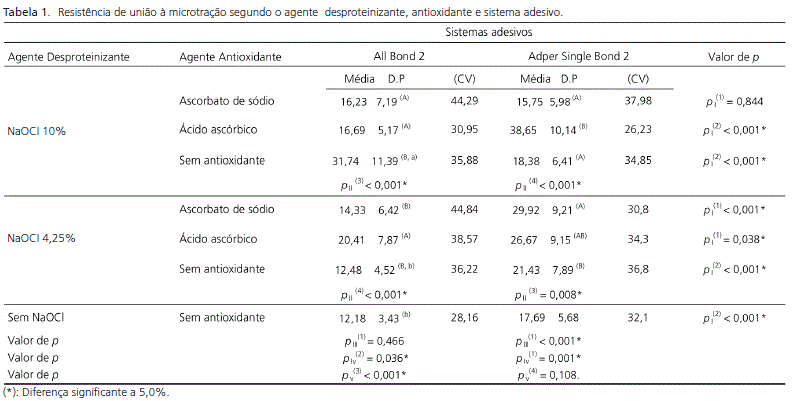
A ANOVA e teste de Tukey (p<0,05) indicaram que as médias de resistência de união variaram de 12,18 a 38,65 MPa, sendo mais elevadas para G10 (38,65), G1 (31,74) e G12 (29,92).
Conclusão
A desproteinização sem antioxidante melhorou a resistência de união do AB2; o ASB2 obteve melhor comportamento quando utilizado em associação com NaOCl 10,00% e AA; o uso de NaOCl a 10,00% por 60s apresentou os maiores valores, o agente antioxidante que obteve melhor desempenho foi o AA.
Termos de indexação: Adesivos dentinários. Antioxidantes. Hipoclorito de sódio.
ABSTRACT
Objective
This study assessed the effects of the deproteinizing and antioxidant agents of conventional adhesives on dentin bond strength.
Methods
Twenty-eight healthy human molars were used. The enamel and dentin surfaces were ground, polished and etched with a 37% phosphoric acid solution for 15s and divided randomly into: G1 = 10% NaOCl for 60s, All Bond 2 (Bisco-AB2, Schaumburg, USA), G2 = 10% NaOCl, 10% sodium ascorbate (AS) 10 min, AB2; G3 = 10% NaOCl, 10% ascorbic acid (AA) for 10 min and AB2, G4 = 4.25% NaOCl for 45s and AB2; G5 = 4.25% NaOCl, AS, AB2; G6 = 4.25% NaOCl, AA, AB2, G7 = AB2, G8 = 10% NaOCl, Adper Single Bond 2 (ASB2 - 3M/ESPE); G9 = 10% NaOCl, AS, ASB2; G10 = 10% NaOCl, AA, ASB2; G11 = 4.25% NaOCl and ASB2; G12 = 4.25% NaOCl, AS, ASB2; G13 = 4.25% NaOCl, AA, ASB2; G14 = ASB2. The specimens were restored with FiltekTM Z350 composite (3M/ESPE, Sumaré, Brazil), stored for 24hs at 37 ºC and cut with a diamond disk (Buehler, Lake Bluff, USA) to obtain 1 mm² sticks. The microtensile bond test was done by a Universal testing machine (KRATOS, São Paulo, Brazil) (0.5 mm/min).
Results
The ANOVA and Tukey test (p <0.05) indicated that the average strengths ranged from 12.18 to 38.65 MPa, and were higher for the G10 (38.65), G1 (31.74) and G12 (29.92).
Conclusion
Antioxidant-free deproteination resulted in better AB2 bond strength. ASB2 resulted in the best behavior when associated with 10% NaOCl and AA. The use of 10% NaOCl for 60s resulted in the highest values. AA was the antioxidant agent with the best performance.
Indexing terms: Dentin-bonding agents. Antioxidants. Sodium hypochlorite.
INTRODUÇÃO
Dentre as estratégias de união à dentina, a mais usual, é o procedimento de desmineralização com o emprego de soluções ácidas, removendo a smear layer, abrindo os túbulos dentinários e expondo a matriz colágena para penetração de monômeros monômeros hidrofílicos, que interpenetram a teia de fibras colágenas expostas, formando uma estrutura mista com fibrilas envolvidas por resina e cristais de hidroxiapatita, denominada camada híbrida1. Para isso, a maioria dos sistemas de união utiliza o ácido fosfórico, que promove também mudanças na conformação do colágeno, frequentemente, associadas ao seu processo de desnaturação e fragmentação, o que pode determinar uma brusca redução da permeabilidade dentinária, através do colapso destas fibrilas, comprometendo a infiltração dos monômeros resinosos e, subsequente, formação desta camada2.
Em virtude disto, o papel das fibrilas colágenas têm sido questionado3, tanto com relação à adesão dentinária, como na eficiência de selamento marginal, sugerindo não ser necessária a formação desta camada para se obter elevados valores de resistência de união, pois a presença de longos tags de resina no interior dos túbulos dentinários pode representar o poder de penetração de uma resina, mas não responde pela efetiva retenção do sistema adesivo4.
Diante das dificuldades clínicas presentes nos passos relativos ao procedimento adesivo, têm sido propostas alternativas para diminuir a sensibilidade da técnica de condicionamento total com o procedimento da desproteinização.
Acredita-se que o uso do hipoclorito de sódio (NaOCl) seja uma das possíveis estratégias para o aprimoramento da adesão dentinária, pois a remoção das fibrilas colágenas poderia elevar a força de união, devido ao aumento da capacidade de molhamento, resultando numa superfície hidrofílica, já que a hidroxiapatita é um substrato com elevada energia de superfície, enquanto que o colágeno tem baixa energia de superfície5.
A aplicação do agente desproteinizante altera a ultra-morfologia da superfície de dentina condicionada, deixando-a mais irregular, aumentando sua área, expondo uma rede secundária de canais e alargando a abertura dos túbulos dentinários6. Estas múltiplas irregularidades na dentina intertubular favorecem a permeabilidade dentinária, proporcionando, assim, uma boa retenção mecânica do monômero resinoso ao substrato dentinário modificado.
Contudo, uma possível desvantagem da desproteinização pode estar relacionada à presença de radicais livres residuais do NaOCl na dentina, proporcionando uma polimerização incompleta devido à finalização prematura da cadeia polimérica7. Entretanto, a ação de um agente antioxidante, poderia ajudar a neutralizar e reverter estes efeitos adversos.
Os agentes antioxidantes são substâncias que atuam como depuradoras de radicais livres. A vitamina C (ácido ascórbico), ou, em sua forma de sal, o ascorbato de sódio, tem sido utilizados para reverter os valores de resistência de união de dentes submetidos à desproteinização7 ou ao clareamento8.
Diante do exposto, foram avaliados os efeitos do NaOCl, ascorbato de sódio e ácido ascórbico sobre a resistência de união dos sistemas adesivos convencionais (3 e 2 passos) à dentina humana através do teste de resistência de união à microtração.
MÉTODOS
O estudo foi realizado no Núcleo de Pesquisas em Biomateriais da Faculdade de Odontologia de Pernambuco, Universidade de Pernambuco. Vinte e oito terceiros molares humanos hígidos foram utilizados nesta pesquisa após aprovação pelo Comitê de Ética em Pesquisa da Faculdade de Odontologia da Universidade de Pernambuco, CAAE - 0153.0.097.000-06.
Seguida a desinfecção em solução aquosa de timol a 0,2% (Phytofármaco, Campina Grande, Brasil)9 por 24 horas e realização de profilaxia, os dentes tiveram suas raízes embutidas em resina acrílica. O esmalte oclusal foi totalmente removido a partir de um corte perpendicular ao longo eixo do dente, utilizando um disco diamantado (Buehler - 111190/100109240 Ltd., Lake Bluff. IL, USA) girando em alta velocidade (500rpm) com constante irrigação, para a exposição da dentina superficial.
Com auxìlio de uma politriz DP 10 (Panambra, São Paulo, Brasil), a superfície dentinária foi abrasionada com lixas de carboneto de silício de granulações decrescentes 180 - 240 - 320, respectivamente, sob refrigeração à água, com o objetivo de produzir uma lama dentinária padronizada. Após o polimento, as superfícies dentinárias foram visualizadas através de uma lupa estereoscópica (Coleman, São Paulo, Brasil), com 40X de aumento, para ser certificado de que nenhum remanescente de esmalte estava presente sobre esta superfície.
A caracterização dos materiais utilizados para realização deste estudo, bem como as suas composições podem ser vistas no Quadro 1. Os espécimes foram subdivididos (Quadro 2).
Após os tratamentos de superfície e realização da técnica adesiva, seguindo as recomendações dos fabricantes, iniciou-se a confecção de blocos de resina composta FiltekTM Z350 (3M ESPE, São Paulo, Brasil) com altura de 4mm. Cada incremento foi fotopolimerizado por 20s, sob intensidade de luz halógena de 600 mW/cm2 (Ultralux EL, Dabi Atlante, São Paulo, Brasil), mensurada por um radiômetro (Gnatus, São Paulo, Brasil). Posteriormente, todo o esmalte periférico foi removido utilizando pontas diamantadas tronco-cônicas 3216 (SS White, Rio de Janeiro, Brasil) em alta rotação, sob refrigeração.
Em seguida, os espécimes foram armazenados por 24 horas a 37°C e fixados à cortadeira de precisão Elsaw (Elquip, São Paulo, Brasil). Utilizando um disco diamantado (Buehler 111190/100493107 Ltd., Lake Bluff. IL, USA) a 200 rpm, com constante irrigação, foram feitos cortes seriados paralelos ao longo eixo do espécime, com espessura de 1mm, nos sentidos mésio-distal e vestíbulolingual. Então, a base do dente foi seccionada perpendicularmente ao seu longo eixo, e foram obtidos vários corpos-de-prova em forma de "palitos", com área transversal de aproximadamente de 0,7 ± 0,2mm2, perfazendo um total de 308 palitos, pois 107 palitos foram desprezados. Utilizando um paquímetro de leitura digital (Digimess, São Paulo, Brasil), a largura e espessura de cada corpo-de-prova foram mensuradas e calculadas a área adesiva em mm2, tendo uma média de 0,695mm2.
Para realização do ensaio de microtração, os corpos- de-prova foram fixados ao dispositivo metálico, com gel adesivo à base de cianoacrilato (Loctite - Superbond, São Paulo, Brasil) e submetidos ao ensaio a uma velocidade de 0,5mm/min na máquina universal de testes (Kratos K2000 - Equip. Ind. Ltda. /N. M98D301, São Paulo, Brasil). Cada grupo foi composto de 22 palitos e os que não resistiram ao corte foram desconsiderados.
Os resultados foram obtidos em Kgf, transformados em MPa e submetidos à análise de variância - ANOVA. O nível de significância utilizado na decisão dos testes estatísticos foi de 5% (0,05). Os dados foram digitados na planilha Excel e o software utilizado para a obtenção dos cálculos estatísticos foi o Statistical Package for the Social Sciences (SPSS) na versão 13.0.

RESULTADOS
Para análise dos dados, foram obtidas as medidas estatísticas: média, desvio- padrão e coeficiente de variação e utilizados os testes t-Student com variâncias iguais ou desiguais, teste F (ANOVA) com comparações pareadas de Tukey ou de Tamhane's.
Na Tabela 1, apresentaram-se estatísticas da resistência à microtração, segundo os agentes desproteinizante, antioxidante e sistemas adesivos convencionais.
DISCUSSÃO
A nanoinfiltração é um fenômeno que pode permitir a penetração de toxinas, produtos bacterianos e água entre restaurações adesivas e estrutura dentária, causada possivelmente pelo colapso da rede de colágeno superficial10.
As fibrilas colágenas desorganizadas podem se degradar com o passar do tempo, e as intactas que foram desmineralizadas, se desestabilizarem devido à pobre infiltração da resina ou perda da proteção da camada híbrida a longo prazo, reduzindo a resistência de união11. Entretanto, esta alteração da rede de colágeno poderia ser evitada com o auxílio da técnica da desproteinização, através do condicionamento proteolítico com hipoclorito de sódio12.
Dependendo da concentração, tempo e forma de aplicação, o hipoclorito poderá remover quantidades diferentes de colágeno, proporcionando o aparecimento de diferentes valores de resistência de união, podendo ser indiferente13, elevado14 ou diminuído15, o que afeta a durabilidade clínica das restaurações adesivas.
Uma das justificativas para este aumento seria o emprego de adesivos contendo acetona como solvente orgânico3-4, o qual está presente no All Bond 2 (Bisco, Schaumburg, USA), por proporcionar uma maior difusão, ser mais volátil, devido à baixa temperatura de ebulição (56,5ºC), tendo uma evaporação três vezes maior que a do álcool, o que contribui para o deslocamento da água16, já que possui maior vapor de pressão, não permitindo que o oxigênio livre residual permaneça no substrato, o que impediria a polimerização completa do monômero resinoso7. Estes fatores poderiam ter melhorado o contato do monômero com a estrutura irregular da dentina intertubular tratada com NaOCl, favorecendo o contato do adesivo com os cristais de hidroxiapatita, devido ao aumento da permeabilidade tubular15.
Neste estudo foram comparadas diferentes concentrações, tempos e valores de pH do NaOCl, evidenciando diferença estatística significativa entre estas variações. A literatura reportou que o tempo ideal seria de NaOCl a 10% por 60s17, o que corroborou com os resultados deste estudo, pois o emprego do NaOCl nesta concentração também elevou os valores de resistência de união, principalmente, quando foi utilizado o sistema adesivo de dois passos Adper Single Bond 2 (3M/ESPE, Sumaré, Brasil), embora tenha sido relatado que a cinética de citotoxicidade desta substância siga uma tendência dependente da concentração18.
Estes resultados talvez se justifiquem por o hipoclorito de sódio ser um agente proteolítico não-específico, que tem a capacidade de remover o material orgânico à temperatura ambiente, podendo até chegar a alterações no conteúdo mineral, através da obtenção de um substrato dentinário diferenciado, alto conteúdo de apatita, promovendo um contato íntimo entre o adesivo e a dentina19.
No entanto, a ausência da camada híbrida em substrato desproteinizado poderia colocar duas superfícies rígidas em contato, o que comprometeria a união com o passar do tempo17. Porém, deve ser levado em consideração, que mesmo se empregando a técnica de desmineralização, as propriedades mecânicas da dentina são alteradas e que o sistema adesivo não possui a capacidade de recuperar estas propriedades20. Existem evidências clínicas da degradação da união entre sistemas adesivos e dentina a longo prazo, e foi sugerido que a superfície dentinária desproteinizada, com camada híbrida reduzida ou ausente, permitiria um melhor comportamento quando avaliada após diferentes tempos de armazenamento21.
A desproteinização poderia proporcionar uma redução de 75% do módulo de elasticidade e dureza da dentina, sendo esta mais uma justificativa para o emprego desta técnica, fazendo com que esta adquira características semelhantes ao esmalte22, pois produz uma maior porosidade na superfície dentinária desmineralizada, pelo aumento na abertura dos túbulos, favorecendo uma melhor difusão dos monômeros pelo aumento da sua permeabilidade, rugosidade, molhabilidade e exposição dos cristais de hidroxiapatita, o que poderia resultar numa interface mais estável a longo prazo por ser essencialmente mineral23.
Entretanto, diferentes autores argumentaram também que o efeito da desproteinização diminuiria os valores da resistência de união resina-dentina9, devido à redução das propriedades mecânicas da resina infiltrada7. Considerando este ponto de vista, a qualidade marginal da interface resina/esmalte seria pior que a da resina/dentina, pois não existe formação de camada híbrida nesta interface e seu módulo de elasticidade de Young é superior ao da dentina12. Além disso, têm sido encontradas evidências clínicas de que restaurações executadas com adesivos a base de acetona se beneficiariam da técnica da remoção de colágeno13, assim como, verificado o sucesso clínico da desproteinização em pacientes com amelogênese imperfeita hipocalcificante24.
Outro fator relevante ao utilizar esta técnica é que a presença de radicais livres residuais reativos comprometeria a foto-ativação do adesivo, resultando em falha prematura da cadeia de terminação e incompleta polimerização25. Porém, estes valores poderiam ser revertidos através da aplicação dos agentes antioxidantes ascorbato de sódio ou do ácido ascórbico a 10%26.
Neste estudo, comparando o emprego destes antioxidantes, houve uma diferença significativa quando o ácido ascórbico interagiu com o NaOCl a 10% empregando o sistema adesivo de dois passos Adper Single Bond 2 (3M/ESPE, Sumaré, Brasil), mas apresentou um comportamento semelhante ao ascorbato de sódio, quando este foi empregado em associação como NaOCl a 4,25% com o mesmo sistema adesivo.
Quanto ao sistema adesivo All Bond 2 (3M/ESPE, Sumaré, Brasil), na concentração do NaOCl a 4,25% foi mais indicada com emprego do ácido ascórbico, já na concentração a 10%, sem a utilização de agentes antioxidantes, pois uma das justificativas para este aumento dos valores de resistência de união seria o emprego de primers contendo acetona como solvente3,12,21.
Em contrapartida, a elevada volatilidade deste solvente poderia ser uma desvantagem, uma vez que, à medida que o adesivo vai sendo utilizado, parte do solvente do frasco evapora, alterando a relação monômero/solvente, favorecendo uma maior perda potencial de massa dos produtos que contém acetona, seguido, em ordem decrescente, dos produtos que combinam acetona com outros solventes, etanol e etanol associado à água, por isso que a acetona não poderia prevenir as consequências do colapso das fibras colágenas se houver uma secagem excessiva da dentina16.
Os resultados deste estudo proporcionaram maiores valores de resistência de união quando da utilização do sistema adesivo Adper Single Bond 2 (3M/ESPE, Sumaré, Brasil), fato este que pôde ter ocorrido devido à mudança das características deste adesivo, que apesar de ter o etanol e água como solvente possui cargas nanoparticuladas, o que pôde ter favorecido a um melhor embricamento do sistema adesivo ao substrato desproteinizado, já que este proporciona um alargamento dos túbulos dentinários, e um aumento da difusibilidade deste monômero resinoso. Todavia, não houve uma melhora significativa para os grupos controle negativo dos sistemas adesivos All Bond 2 (Bisco, Schaumburg, USA) e Adper Single Bond 2 (3M/ESPE, Sumaré, Brasil), pois foi verificado na literatura que só há uma completa dissolução do colágeno após 45 minutos de tratamento com NaOCl27.
Estes resultados foram discordantes dos autores supracitados, devido a uma provável competitividade no mecanismo de união entre os agentes antioxidantes e as moléculas dos monômeros funcionais NTGGMA e BPDM, impedindo que o sistema adesivo All Bond 2 (Bisco, Schaumburg, USA) interaja com o substrato dentinário desproteinizado. O ácido ascórbico, precursor do ascorbato de sódio, aparentemente sofre uma redução gradual na atividade com o tempo, sua estabilidade parece ser melhor em associação com álcool e HEMA, do que em água, Bis-GMA e TEGDMA28.
A presença de uma interação química entre o substrato dentinário e compostos químicos presentes no sistema adesivo deve ser avaliada e levada em consideração também para o sistema adesivo Adper Single Bond 2 (3M/ ESPE, Sumaré, Brasil), pois no caso do monômero MDP presente em alguns sistemas adesivos auto-condicionantes, já se estabeleceu uma significante interação deste com os cristais de hidroxiapatita presentes no substrato dentinário29. Entretanto, tem sido relatado que só poderia haver uma interação química de sistemas adesivos convencionais com os íons de cálcio da dentina na dependência da presença do ácido polialcenóico, o qual não faz parte dos adesivos dentinários avaliados neste estudo30.
A desproteinização pode gerar a formação de uma ‘'camada híbrida reversa'', responsável pela micro-retenção da resina, justificando os achados deste estudo, que evidenciaram uma elevada magnitude dos valores de resistência de união, mesmo empregando o NaOCl com concentração e tempo de aplicação reduzidos, por criar um superfície mais reativa, sendo rica em hidroxiapatita, com características semelhante ao esmalte5.
Considerando que a técnica de desmineralização tem sido bastante questionável, em virtude da degradação combinada da resina e do colágeno dentinário, que pode aumentar o conteúdo de água na interface adesiva, levando ao comprometimento da longevidade de união6, novas estratégias de união deveriam ser estudadas e este trabalho indicou um provável caminho a ser investigado com maior profundidade.
CONCLUSÃO
De acordo com os resultados analisados e discutidos, pôde-se concluir que a desproteinização sem a associação com antioxidante melhorou a resistência de união do sistema adesivo All Bond 2 (Bisco, Schaumburg, USA) . Já o sistema adesivo Adper Single Bond 2 (3M/ESPE, Sumaré, Brasil), obteve melhor comportamento, quando utilizado em associação com hipoclorito de sódio a 10% e ácido ascórbico.
Com relação à influência da concentração e do tempo de aplicação do agente desproteinizante sobre a resistência de união, pôde ser verificado que foi mais indicada sua aplicação a 10% por 60 segundos e o agente antioxidante que obteve melhor desempenho foi o ácido ascórbico.
Colaboradores
AIAM RIBEIRO, GMT GUÊNES, RKP ARAÚJO, DCRE DANTAS, CC CYRILLO e R BRAZ participaram de todas as etapas do artigo.
REFERÊNCIAS
1. Martins GC, Franco APGO, Godoy EP, Maluf DR, Gomes JC, Gomes OMM. Adesivos dentinários. RGO - Rev Gaúcha Odontol. 2008;56(4):429-36. [ Links ]
2. Monticelli F, Toledano M, Silva AS, Osorio E, Osorio R. Sealing effectiveness of etchi-and-rinse vs self-etching adhesives after water aging: influence of acid etching and NaOCl pretreatment. J Adhes Dent. 2008;10(3):183-8.
3. Cederlund A, Jonsson B, Blomlöf J. Do intact collagen fibers increase dentin bond strength? Swed Dent J. 2002;26(4):159-66.
4. Duarte PBPG, Silva EM. Nanoleakage phenomenon on desproteinized human dentin. J Appl Oral Sci. 2007;15(4):285-91.
5. Montes MAJR, Goes M, Ambrosano GMB, Duarte RM, Sobrinho LC. Effect of collagen removal and use of low-viscosity resin liner on marginal adaptation of composite resin restorations with marginals in dentin. Oper Dent. 2003;28(4):378-87.
6. Breschi L, Mazzoni A, Ruggeri A, Cadenaro M, Di Lenarda R, De Stefano Dorigo E. Dental adhesion review: aging and stability of the bonded interface. Dent Mater. 2008;24(1):90-101.
7. Lai SCN, Mak YF, Cheung GSP, Osorio R, Toledano M, Carvalho RM, et al. Reversal of compromised bonding to oxidized etched dentin. J Dent Res. 2001;80(10):1919-24.
8. Türkün M, Kaya AD. Effect of 10% sodium ascorbate on the shear bond strength of composite resin to bleached bovine enamel. J Oral Rehabil. 2004;31(12):1184-91.
9. Fuentes V, Ceballos L, Osorio R, Toledano M, Carvalho RM, Pashley DH. Tensile strength and microhardness of treated human dentin. Dent Mater. 2004;20(6):522-9.
10. Sano H. Microtensile testing, nanoleakage, and biodegradation of resin-dentin bonds. J Dent Res. 2006;85(1):11-4.
11. Yang B, Adelung R, Ludwig K, Böbmann K, Pashley DH, Kern M. Effect of structural change of collagen fibrils on the durability of dentin bonding. Biomaterials. 2005;26(24):5021-31.
12. Saboia VPA, Pimenta LAF, Ambrosano GMB. Effect of collagen removal on microleakage of resin composite restorations. Oper Dent. 2002;27(1):38-43.
13. Saboia VPA, Almeida PC, Ritter AV, Swift Jr EJ, Pimenta LAF. 2-year clinical evaluation of sodium hypochlorite treatment in the restoration of non-carious cervical lesions: a pilot study. Oper Dent. 2006;31(5):530-5.
14. Salim DA, Andia-Merlin RY, Arana-Chavez VE. Micromorphological analysis of the interaction between a onebottle adhesive and mineralized primary dentine after superficial deproteination. Biomaterials. 2004;25(19):4521-7.
15. Saboia VPA, Nato F, Mazzoni A, Orsini G, Putignano A, Giannini M, et al. Adhesion of a two-step etch-and-rinse adhesive on collagen-depleted dentin. J Adhes Dent. 2008;10(6):419-22.
16. Abate PF, Rodriguez VI, Macchi RL. Evaporation of solvent in one-bottle adhesives. J Dent. 2000;28(6):437-40.
17. Montes MAJR, De Goes MF, Sinhoreti MAC. The in vitro morphological effects of some current pre-treatments on dentin surface: a SEM evaluation. Oper Dent. 2005;30(2):201-12.
18. Fidalgo TKS, Barcelos R, Petrópolis DB, Azevedo BR, Primo LG, Silva Filho FC. Citotoxicidade de diferentes concentrações de hipoclorito de sódio sobre osteoblastos humanos. RGO - Rev Gaúcha Odontol. 2009;57(3):317-21.
19. Maior JRS, Figueira MAS, Netto ABAB, Souza FB, Silva CHV, Tredwin CJ. The importance of dentin collagen fibrils on the marginal sealing of adhesive restorations. Oper Dent. 2007;32(3):261-5.
20. Toledano M, Osorio R, Osorio E, Prati C, Carvalho RM. Microhardness of acid-treated and resin infiltrated human dentine. J Dent. 2005;33(4):349-54.
21. Arias VG, Berdran-De–Castro AKB, Pimenta LAF. Effects of sodium hypochlorite gel and sodium hypochlorite solution on dentin bond strength. Inc J Biomed Mater Res B Appl Biomater. 2005;72(2):339-44.
22. Marshall Jr GW, Yücel N, Balooch M, Kinney JH, Habelitz S, Marshall SJ. Sodium hypochlorite alterations of dentin and dentin collagen. Surf Sci. 2001;491:444-55.
23. Correr GM, Alonso RCB, Grando MF, Borges AFS, Puppin- Rontani RM. Effect of sodium hypochlorite on primary dentin: a scanning electron microscopy (SEM) evaluation. J Dent. 2006;34(7):454-9.
24. Sonmez IS, Aras S, Tunç ES, Kuçukesmen C. Sucesso clínico da desproteinização no tratamento da amelogênese imperfeita hipocalcificante. Quintessence Int. 2009;40:113-8.
25. Yiu CKY, García-Godoy F, Tay FR, Pashley DH, Imazato S, King NM, et al. A nanoleakage perspective on bonding to oxidized dentin. J Dent Res. 2002;81(9):628-32.
26. Nagpal R, Tewari S, Gupta R. Effect of various surface treatments on the microleakage and ultrastructure of resin-tooth interface. Oper Dent. 2007;32(1):16-23.
27. Sauro S, Mannocci F, Tay FR, Pashley DH, Cook R, Carpenter GH, et al. Deproteinization effects of NaOCl on acid-etched dentin in clinically-relevant vs prolonged periods of application: a confocal and environmental scanning electron microscopy study. Oper Dent. 2009;34(2):166-73.
28. Antonucci JM, Grams CL, Termini DJ. New initiation systems for dental resin based on ascorbic acid. J Dent Res. 1979;58(9):1887- 99.
29. Fugekawa D, Hayakawa S, Yoshida Y, Suzuki K, Osaka A, Van Meerbeek B. Chemical interaction of phosphoric acid ester with hydroxyapatite. J Dent Res. 2006;85(10):941-4.
30. Abo T, Asmussen E, Uno S, Tagami J. Short- and long-term in vitro study of the bonding of eight commercial adhesives to normal and deproteinized dentin. Acta Odontol Scand. 2006;64(4):237-43.
 Endereço para correspondência:
Endereço para correspondência:
AIAM RIBEIRO
Universidade Estadual da Paraíba,
Centro de Ciências Biológicas e da Saúde,
Departamento de Odontologia.
Rua Juvêncio Arruda, s/n., Campus Universitário
Bodocangó, 58429-600, Campina Grande, PB, Brasil.
e-mail: isaro_jesus@hotmail.com
Recebido: 3/7/2009
Aceito: 23/2/2010













