Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RGO.Revista Gaúcha de Odontologia (Online)
versão On-line ISSN 1981-8637
RGO, Rev. gaúch. odontol. (Online) vol.59 no.3 Porto Alegre Jul./Set. 2011
ARTIGO REVISÃO / REVIEW ARTICLE
Uso de proteínas recombinantes na reconstrução de maxilares
Use of recombinant proteins for maxillary reconstruction
Eder Magno Ferreira de OLIVEIRAI,II; Nauber de Souza VITORINOI; Paulo Henrique Luiz de FREITASI;Thomaz WASSALII;Marcelo Henrique NAPIMOGAII
IHospital Municipal Dr. Mário Gatti, Departamento de Cirurgia e Traumatologia Bucomaxilofacial.
IIFaculdade São Leopoldo Mandic, Curso de Odontologia.
RESUMO
Reconstrução óssea dos maxilares após ressecções tumorais, avulsões traumáticas ou mesmo reabsorção por desuso é uma das tarefas mais difíceis na clínica do implantodontista e do cirurgião bucomaxilofacial. As propriedades osteogênicas, osteoindutoras, osteocondutoras e não-antigênicas do osso autógeno o colocam como o padrão-ouro para a solução de problemas de disponibilidade óssea. Entretanto, a necessidade de um segundo sítio cirúrgico para a coleta do enxerto, aumenta significativamente o custo e a morbidade associados ao procedimento reconstrutivo. A enxertia óssea ganhou uma excelente ferramenta com a descoberta das proteínas ósseas morfogenéticas (conhecidas como BMP, do inglês bone morphogenetic proteins) na década de 60. O benefício da obtenção de matriz óssea verdadeira e funcional sem a necessidade de um segundo sítio cirúrgico parece ser a grande vantagem do uso das proteínas ósseas morfogenéticas. No entanto, aspectos importantes da utilização de proteínas recombinantes humanas tais como controle da taxa de liberação da proteína ao longo do processo de reparo ósseo, ainda necessitam de estudos aprofundados para que parâmetros clínicos de utilização possam ser estabelecidos. Além disso, estudos clínicos de longa duração avaliando as características biomecânicas do osso neoformado após administração de proteínas ósseas morfogenéticas ainda são escassos. Embora promissora, a utilização das proteínas morfogenéticas ósseas na clínica implantodôntica e bucomaxilofacial ainda necessita de maior respaldo científico.
Termos de indexação: Engenharia tecidual. Proteínas recombinantes. Transplante ósseo.
ABSTRACT
Jaw bone reconstruction after tumour resection, traumatic avulsion or even atrophy due to disuse is one of the most challenging clinical tasks for implantologists and maxillofacial surgeons. Autogenous bone, with its osteogenic, osteoinductive and non-antigenic properties, has been considered the gold standard in the resolution of bone availability problems. However, the need for a second surgical site in order to harvest the bone graft significantly increases both the cost and the morbidity related to reconstructive procedures. Bone grafting gained an important tool with the discovery of bone morphogenetic proteins (BMPs) in the 1960s. Obtaining a true, functional bone matrix without bone harvesting may be the greatest benefit from BMP usage. Nevertheless, fundamental aspects of BMP application such as the control of protein release throughout the process of bone repair are yet to be fully understood, with clinical guidelines for usage of the protein remaining uncertain. Moreover, long-term clinical studies assessing the biomechanical properties of bone formed after BMP application are sporadic. Although promising, the widespread use of bone morphogenetic proteins by implantologists and maxillofacial surgeons demands greater scientific support.
Termos de indexação: Tissue engineering. Recombinant proteins. Bone transplantation.
INTRODUÇÃO
Reconstruir a maxila ou a mandíbula em casos de perdas após ressecção de tumores, avulsões traumáticas ou mesmo reabsorção por desuso, é uma das tarefas mais difíceis na clínica do cirurgião bucomaxilofacial. Para que o paciente tenha a função e a estética restituída, é importante que a reconstrução promova volume e distribuição óssea adequada - o que por vezes pode ser virtualmente impossível. É fundamental, portanto, analisar o tipo de defeito que se deseja reconstruir antes de tomar qualquer decisão sobre sequência de tratamento ou de materiais de enxertia.
Embasada em achados científicos, a experiência clínica há muito elegeu o osso autógeno como material de eleição para a reconstrução de defeitos ósseos dos maxilares. Suas propriedades osteogênicas, osteoindutoras, osteocondutoras e nãoantigênicas o asseguram como o material ideal para a resolução clínica de problemas de disponibilidade de tecido ósseo1. Talvez a única, mas não menos importante desvantagem da utilização do osso autógeno, é a necessidade de um segundo sítio cirúrgico para a coleta do material, o que aumenta significativamente o custo e a morbidade associada ao procedimento. É comum observar certa rejeição por parte dos pacientes à menção da necessidade de colheita e enxertia óssea, e muitos acabam optando por opções restauradoras alternativas ou aquém do ideal pura e simplesmente em função da necessidade desta etapa adicional. A fim de minimizar este problema, substitutos ósseos estão disponíveis para a tarefa de auxiliar na reconstrução dos maxilares conforme sumarizado na Tabela 1.

A promessa da engenharia tecidual
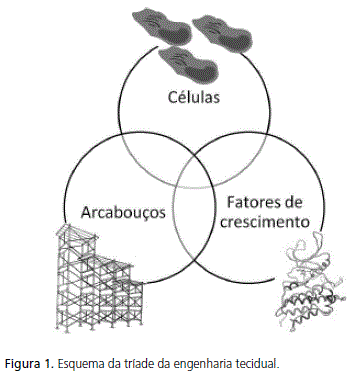
O conceito de engenharia tecidual vem causando forte repercussão nos meios científicos ao aventar a ideia da criação extracorpórea de tecidos para a recuperação de pacientes que tenham sofrido algum tipo de injúria tecidual irreparável pelos meios cicatriciais usuais. A chamada tríade da engenharia tecidual (Figure 1) reúne os componentes essenciais para que a criação ex vivo de tecidos seja possível. São eles: a) células: idealmente células-tronco mesenquimais pluripotenciais, que permitiriam a diferenciação e surgimento de células formadoras dos diversos tipos teciduais existentes; b) fatores de diferenciação: moléculas naturalmente existentes nos tecidos vivos que, se administradas com propriedade, facilitariam os processos de proliferação e diferenciação celular na direção do tipo tecidual desejado e c) arcabouços ou armações: estruturas físico-químicas que viabilizariam a proliferação e diferenciação celular, além de promover a organização espacial do tecido que se busca reconstruir.
No que tange à recuperação de tecidos ósseos, particularmente de defeitos de continuidade ou de volume, o primeiro componente invariavelmente estará presente, uma vez que o próprio organismo hospedeiro proporcionará células nas mais diversas etapas da cadeia de diferenciação. Os pontos de questionamento giram em torno da identificação e utilização criteriosa de fatores de diferenciação, apropriados para a regeneração óssea e do desenvolvimento de arcabouços que possibilitem a organização da matriz extracelular óssea.
Proteínas ósseas morfogenéticas e seu potencial biológico
Um grande avanço nas possibilidades de enxertia óssea ocorreu com a descoberta das proteínas ósseas morfogenéticas (conhecidas como BMP, do inglês bone morphogenetic proteins), cujo estudo foi iniciado por Marshall Urist em 19653. Embora tecnicamente seja considerado um enxerto, este material tem como efeito principal a indução da formação óssea4. Classificadas como um subgrupo da super-família dos fatores de crescimento transformadores beta (TGF-β, do inglês transforming growth factor-β), as BMP são polipeptídeos multifuncionais que desempenham importante papel em uma gama de funções e processos celulares como a embriogênese, o crescimento e a diferenciação celular, e a cicatrização óssea e reparo de fraturas5-7. Previamente foi observado que a diferenciação de células pluripotentes em osteoblastos é possível, abrindo caminho para o estudo de substâncias com potencial osteoindutor4. Tal observação desencadeou uma série de investigações com o objetivo de identificar, no osso desmineralizado, as possíveis substâncias responsáveis pelo fenômeno. Assim, foi identificada uma glicoproteína de baixo peso molecular (na ocasião já denominada polipeptídeo morfogenético do osso) que promovia a formação óssea ectópica8. O próximo grande avanço foi a purificação de três BMP a partir de osso bovino, as quais foram posteriormente denominadas BMP 1, 2 e 39. No final dos anos 1980, a tecnologia do DNA recombinante foi utilizada para gerar clones complementares do DNA das moléculas de BMP humano, sendo estes inseridos em células de mamíferos e de outros animais para a produção de BMP recombinantes humanas, atualmente conhecidos como rhBMP10. Desde então, cerca de 20 BMP foram isoladas e relatadas na literatura. Em 2003, um estudo in vitro comparou a atividade de formação óssea de 14 diferentes tipos de BMP recombinantes11. A atividade de fosfatase alcalina, um importante marcador de formação óssea, estava consistentemente aumentada após o tratamento das células com BMP-2, BMP-6 e BMP- 9. Concluiu-se que estas três BMP são as mais potentes na promoção da diferenciação celular rumo à linhagem osteoblástica.
Como a BMP age localmente, a proteína deve ser implantada no sítio a ser reconstruído por meio de uma matriz que previna a eliminação imediata da mesma. Idealmente, a matriz promove uma taxa de liberação previsível e contínua, estendendo-se por um período maior. Procede-se uma "liberação como dose de ataque" (burst release), para recrutar células indiferenciadas para o sítio de implantação, seguida de liberação gradual que promove a diferenciação de células osteoprogenitoras para osteoblastos12. As três matrizes aprovadas atualmente, incluem a esponja absorvível de colágeno tipo I (ACS), matriz de colágeno tipo I derivada de osso e uma combinação de rhBMP7 em matriz de colágeno particulado combinado com carboximetilcelulose13.
Após aplicação de concentrações apropriadas da BMP (especificamente da BMP-2 humana sintetizada através de tecnologia recombinante, ou rhBMP-2) em esponja de colágeno absorvível e implantação no organismo hospedeiro, este é capaz de induzir a formação de tecido ósseo no sítio de implantação13. O primeiro passo na formação óssea induzida pelo implante de rhBMP-2/ colágeno absorvível é a atração de células osteogênicas, como já demonstrado em estudos in vitro14. Em seguida, há um aumento da proliferação de células multipotentes15-19. Uma vez aumentada a população de células precursoras, a rhBMP-2 é capaz de promover a diferenciação destas em direção à linhagem osteogênica19-23. O que se segue é a formação e o remodelamento de um tecido que, quando avaliado radiográfica, biomecânica e histologicamente, se comporta como o osso nativo13.
Aplicabilidade clínica e resultados do uso das BMP
O uso clínico das BMP vem sendo divulgado positivamente na literatura pertinente às disciplinas de Implantodontia e Cirurgia bucomaxilofacial24-25. Em estudo prévio em canídeos, foi avaliado o efeito da BMP- 2 na formação óssea em defeitos de continuidade na mandíbula. Os autores observaram que, entre os 3 e 6 meses pós-operatórios, a resistência mecânica dos defeitos reconstruídos aumentou consideravelmente, de forma compatível com o grau de mineralização e espessura óssea26.
Em outro trabalho, foi observado resultados semelhantes ao utilizar a BMP-2 na reconstrução de defeitos hemi-mandibulares em primatas não humanos, reafirmando as propriedades da proteína como potente osteoindutora em defeitos segmentares da mandíbula27. Semelhante conclusão foi obtida quando este autor avaliou a eficácia da mesma molécula na reconstrução de fendas palatinas em macacos28. Assim, concluiu-se que a BMP-2 é um bom substituto para o osso medular autógeno particulado na reconstrução de defeitos congênitos dos maxilares. Posteriormente, foi avaliada a funcionalidade em longo prazo do osso regenerado por BMP-2 em grandes defeitos segmentares da mandíbula29, com a comparação entre os resultados obtidos pela instalação de implantes cônicos em osso regenerado por BMP e em osso reconstruído por auto-enxerto. Enquanto todos os implantes instalados no osso regenerado por BMP se osteointegraram, metade daqueles instalados em osso enxertado falharam. Os resultados histológicos obtidos no grupo em que a BMP foi utilizada, apontaram excelente regeneração óssea em termos da porcentagem da superfície osso-implante preenchida por matriz óssea calcificada. Segundo estes autores, o aumento e a manutenção da densidade óssea, além do bom padrão de remodelação na interface entre o osso-implante cônico indicam a estabilidade em longo prazo do osso regenerado por rhBMP-228.
Em estudo com humanos (80 indivíduos), foi avaliada a eficácia na indução óssea obtida com diferentes concentrações de rhBMP-2 associado a ACS em alvéolos pós-exodontia para posterior instalação de implantes dentários. Quando comparado ao grupo controle (apenas ACS, sem a proteína), as duas concentrações de rhBMP-2 empregadas (0,75 e 1,5mg/ml) foram capazes de aumentar a largura média do alvéolo após 6 meses de cicatrização, sendo que a maior concentração obteve os melhores resultados. Durante a fase de instalação dos implantes, o grupo que recebeu a concentração de 1,5mg/ml necessitou de menos procedimentos adicionais para ganho ósseo quando comparado aos demais grupos. Segundo os autores, estes resultados comprovaram a eficácia deste material na obtenção de um rebordo alveolar mais apropriado para suportar implantes dentários25.
A eficácia do rhBMP-2/ACS no levantamento de seio maxilar e instalação de implantes dentários em 160 pacientes foi avaliada e comparada àquela do enxerto autógeno. Os autores deste estudo avaliaram a formação óssea, osteointegração e a funcionalidade dos implantes aos seis meses e aos dois anos pós-instalação. No que tange altura óssea obtida com o procedimento, nenhuma diferença foi encontrada entre os dois grupos aos seis meses pós-enxertia. Neste período, uma maior densidade óssea foi encontrada no grupo com enxerto autógeno. Todavia, esta superioridade não se manteve, uma vez que seis meses após a instalação do componente protético o osso formado na presença de BMP foi considerado mais denso. No entanto, a perda de altura óssea na crista alveolar pós-instalação dos implantes e a taxa de sucesso destes em longo prazo foi a mesma para os dois grupos. Portanto, a possibilidade de se tratar o defeito ósseo com um biomaterial, o qual apresenta o mesmo sucesso de quando se utiliza osso obtido em um segundo sítio cirúrgico suporta a indicação para a BMP30.
O uso de outra proteína recombinante (rhBMP-7) foi avaliado em 14 pacientes a fim de testar sua aplicabilidade ne reconstrução de defeitos mandibulares que variavam de 4 a 8 cm, em seu maior diâmetro. Tais defeitos tiveram como etiologia fibroma ossificante juvenil agressivo, osteomielite crônica associada a uso prévio de bisfosfonatos ou ameloblastoma. Todos os pacientes apresentaram evidência radiográfica de formação óssea aos 3 e 4 meses pós-operatórios. Dois pacientes tiveram implantes colocados entre 6 e 8 meses de pós-operatório. Segundo os autores, o uso de materiais osteoindutores está se tornando uma alternativa ao enxerto autógeno tradicional da mandíbula, podendo modificar o conceito da abordagem cirúrgica de deficiências e defeitos ósseos na região maxilofacial24.
Perspectivas
O benefício da obtenção de matriz óssea verdadeira e funcional sem a necessidade de um segundo sítio cirúrgico parece ser a grande vantagem do uso das proteínas ósseas morfogenéticas. Um grande número de ensaios laboratoriais suportam o uso da rhBMP na formação de osso de novo2-3,7,11-12,15,22 o que torna este material uma grande promessa para o tratamento de defeitos e deficiências ósseas crânio-maxilo-faciais. Entretanto, ainda é relativamente pequeno o número de trabalhos controlados em pacientes25. Não obstante, estes poucos apontam resultados animadores, que uma vez levados a termo, consolidarão o papel das citocinas osteoindutoras no arsenal terapêutico de periodontistas, implantodontistas e cirurgiões bucomaxilofaciais.
As evidências de aumento na densidade do osso neoformado após o início da função são uma vantagem adicional das BMP, em comparação com o enxerto de osso autógeno30. Todavia, o custo financeiro desta modalidade de tratamento ainda é um empecilho para o desenvolvimento de pesquisas e a popularização de seu uso na clínica odontológica. Entretanto, a relação custo-benefício da modalidade para a sociedade como um todo pode ser positiva. Foi demonstrado que, se equacionados os custos diretos (recursos materiais e humanos) e indiretos (prejuízos advindos da demora na recuperação do paciente e sua reintegração às atividades econômicas) no tratamento de fraturas tibiais grau III com rhBMP-2 versus os custos da terapia convencional, a primeira significa economia de recursos em uma perspectiva nacional, em comparação com a segunda25. Extrapolações para a cirurgia maxilofacial devem ser realizadas com cuidado, mas não pode se negar que a informação disponível na literatura ortopédica abre a mesma perspectiva para o futuro na Odontologia.
CONSIDERAÇÕES FINAIS
Apesar do aqui exposto, aspectos importantes da utilização de proteínas recombinantes humanas (ex. rhBMP-2 ou rhBMP-7) como o controle da taxa de liberação da citocina ao longo do processo de reparo ósseo, ainda necessitam de estudos adicionais para que parâmetros clínicos e prospectivos de utilização possam ser efetivamente determinados. Além disso, estudos clínicos de longa duração avaliando as características biomecânicas do osso neoformado após administração de BMP ainda são escassos, o que é particularmente importante quando a reconstrução do osso alveolar para uma futura reabilitação com implantes é considerada. É importante que o leitor considere a proteína morfogenética óssea como mais uma ferramenta disponível para a resolução de casos difíceis que envolvam a reconstrução das perdas de substância óssea do esqueleto maxilofacial, e não como terapia única que supera em eficácia todas as outras disponíveis até o presente. Faz-se necessária, ainda, a realização de testes clínicos de longa duração e livres de vieses de qualquer natureza antes que as proteínas morfogenéticas ósseas sejam utilizadas de forma mais ampla na clínica odontológica e maxilofacial.
ColaboradoresEMF OLIVEIRA, NS VITORINO, PHL FREITAS, T WASSAL e MH NAPIMOGA participaram de todos os processos para elaboração do artigo.
REFERÊNCIAS
1. Ehrenfeld M, Hagenmaier C. Autogenous bone grafts in maxillofacial reconstruction. In: Greenberg AM, Prein J. Craniomaxillofacial reconstructive and corrective bone surgery: principles of internal fixation using the AO/ASIF technique. New York: Springer-Verlag; 2002. p. 295-309. [ Links ]
2. Deatherage J. Bone materials available for alveolar grafting. Oral Maxillofac Surg Clin North Am. 2010;22(3):347-52.
3. Urist MR. Bone: formation by autoinduction. Science. 1965;150(698):893-9.
4. Wilk RM. Bony reconstruction of the jaws. In: Miloro M. Peterson's principles of oral and maxillofacial surgery. 2nd ed. New York: B C Decker Inc; 2004. p. 783-802.
5. Ai-Aql ZS, Alagl AS, Graves DT, Gerstenfeld LC, Einhorn TA. Molecular mechanisms controlling bone formation during fracture healing and distraction osteogenesis. J Dent Res. 2008;87(2):107-18.
6. Canalis E, Economides AN, Gazzerro E. Bone morphogenetic proteins, their antagonists, and the skeleton. Endocr Rev. 2003;24(2):218-35.
7. Song B, Estrada KD, Lyons KM. Smad signaling in skeletal development and regeneration. Cytokine Growth Factor Rev. 2009;20(5-6):379-88.
8. Urist MR, Nogami H, Mikulski A. A bone morphogenetic polypeptide. Calcif Tissue Res. 1976;21(1):81-7.
9. Ripamonti U. Soluble and insoluble signals sculpt osteogenesis in angiogenesis. World J Biol Chem. 2010;26;1(5):109-32.
10. Wozney JM, Rosen V, Celeste AJ, Mitsock LM, Whitters MJ, Kriz RW, et al. Novel regulators of bone formation: molecular clones and activities. Science. 1988;242(4885):1528-34.
11. Cheng H, Jiang W, Phillips FM, Haydon RC, Peng Y, Zhou L, et al. Osteogenic activity of the fourteen types of human bone morphogenetic proteins (BMPs). J Bone Joint Surg Am. 2003;85(4):1544-52.
12. Ghodadra N, Singh K. Recombinant human bone morphogenetic protein-2 in the treatment of bone fractures. Biologics. 2008;2(3):345-54.
13. U.S. Food and Drug Administration. Summary of safety and effectiveness data for INFUSE® bone graft. 2007 [cited 2010 Out 4]. Available from: <http://www.accessdata.fda.gov/cdrh_ docs/pdf5/P050053b.pdf>.
14. Singh A, Morris RJ. The Yin and Yang of bone morphogenetic proteins in cancer. Cytokine Growth Factor Rev. 2010;21(4):299- 313.
15. Jäger M, Fischer J, Dohrn W, Li X, Ayers DC, Czibere A, et al. Dexamethasone modulates BMP-2 effects on mesenchymal stem cells in vitro. J Orthop Res. 2008;26(11):1440-8.
16. Graham TR, Agrawal KC, Abdel-Mageed AB. Independent and cooperative roles of tumor necrosis factor-alpha, nuclear factor-kappaB, and bone morphogenetic protein-2 in regulation of metastasis and osteomimicry of prostate cancer cells and differentiation and mineralization of MC3T3-E1 osteoblast-like cells. Cancer Sci. 2010;101(1):103-11.
17. Jeong BC, Lee YS, Park YY, Bae IH, Kim DK, Koo SH, et al. The orphan nuclear receptor estrogen receptor-related receptor gamma negatively regulates BMP2-induced osteoblast differentiation and bone formation. J Biol Chem. 2009;284(21):14211-8.
18. Kuh SU, Zhu Y, Li J, Tsai KJ, Fei Q, Hutton WC, Yoon ST. Can TGFbeta1 and rhBMP-2 act in synergy to transform bone marrow stem cells to discogenic-type cells? Acta Neurochir (Wien). 2008;150(10):1073-9
19. Yamaguchi A, Katagiri T, Ikeda T, Wozney JM, Rosen V, Wang EA, et al. Recombinant human bone morphogenetic protein-2 stimulates osteoblastic maturation and inhibits myogenic differentiation in vitro. J Cell Biol. 1991;113(3):681-7.
20. Arpornmaeklong P, Kochel M, Depprich R, Kubler NR, Wurzler KK. Influence of platelet-rich plasma (PRP) on osteogenic differentiation of rat bone marrow stromal cells. An in vitro study. Int J Oral Maxillofac Surg. 2004;33(1):60-70.
21. Osyczka AM, Damek-Poprawa M, Wojtowicz A, Akintoye SO. Age and skeletal sites affect BMP-2 responsiveness of human bone marrow stromal cells. Connect Tissue Res. 2009;50(4):270- 7.
22. E LL, Xu LL, Wu X, Wang DS, Lv Y, Wang JZ, Liu HC. The interactions between rat-adipose-derived stromal cells, recombinant human bone morphogenetic protein-2, and beta-tricalcium phosphate play an important role in bone tissue engineering. Tissue Eng Part A. 2010;16(9):2927-40.
23. Togashi AY, Cirano FR, Marques MM, Pustiglioni FE, Lang NP, Lima LA. Effect of recombinant human bone morphogenetic protein-7 (rhBMP-7) on the viability, proliferation and differentiation of osteoblast-like cells cultured on a chemically modified titanium surface. Clin Oral Implants Res. 2009;20(5):452-7.
24. Herford AS, Boyne PJ. Reconstruction of mandibular continuity defects with bone morphogenetic protein-2 (rhBMP-2). J Oral Maxillofac Surg. 2008;66(4):616-24.
25. Triplett RG, Nevins M, Marx RE, Spagnoli DB, Oates TW, Moy PK, et al. Pivotal, randomized, parallel evaluation of recombinant human bone morphogenetic protein-2/absorbable collagen sponge and autogenous bone graft for maxillary sinus floor augmentation. J Oral Maxillofac Surg. 2009;67(9):1947-60.
26. Toriumi DM, Kotler HS, Luxenberg DP, Holtrop ME, Wang EA. Mandibular reconstruction with a recombinant bone-inducing factor. Functional, histologic, and biomechanical evaluation. Arch Otolaryngol Head Neck Surg. 1991;117(10):1101-12.
27. Boyne PJ. Animal studies of application of rhBMP-2 in maxillofacial reconstruction. Bone. 1996;19(Suppl. 1):83S-92S.
28. Boyne PJ, Nath R, Nakamura A. Human recombinant BMP-2 in osseous reconstruction of simulated cleft palate defects. Br J Oral Maxillofac Surg. 1998;36(2):84-90.
29. Boyne PJ, Nakamura A, Shabahang S. Evaluation of the long-term effect of function on rhBMP-2 regenerated hemimandibulectomy defects. Br J Oral Maxillofac Surg. 1999;36(2):344-52.
30. Alt V, Donell ST, Chhabra A, Bentley A, Eicher A, Schnettler R. A health economic analysis of the use of rhBMP-2 in Gustilo- Anderson grade III open tibial fractures for the UK, Germany, and France. Injury. 2009;40(12):1269-75.
 Endereço para correspondência:
Endereço para correspondência:
MH NAPIMOGA
Faculdade São Leopoldo Mandic,
Curso de Odontologia.
Rua José Rocha Junqueira, 13,
Swift, 13045-755, Campinas,
SP, Brasil.
e-mail: napimogamh@yahoo.com
Recebido: 2/3/2011
Aceito: 18/5/2011













