Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RGO.Revista Gaúcha de Odontologia (Online)
versão On-line ISSN 1981-8637
RGO, Rev. gaúch. odontol. (Online) vol.59 supl.1 Porto Alegre Jan./Jun. 2011
ARTIGO REVISÃO / REVIEW ARTICLE
Câncer bucal e a terapia fotodinâmica como modalidade terapêutica
Oral cancer and photodynamic therapy as a treatment
João Paulo Figueiró LONGOI; Silene Paulino LOZZII;CRicardo Bentes AZEVEDOI
IUniversidade de Brasília, Instituto de Ciências Biológicas, Departamento de Genética e Morfologia
RESUMO
O câncer de boca é um dos tipos mais prevalentes dentro da população. Dados epidemiológicos indicam que sejam diagnosticados 10 mil novos casos de câncer de boca por ano. Atualmente, seu tratamento é feito através de cirurgia, radioterapia, quimioterapia ou uma associação destas três modalidades terapêuticas. Por promoverem graves efeitos adversos aos pacientes, constantes esforços são tomados no intuito de desenvolver novos protocolos terapêuticos que possam substituir ou auxiliar os tratamentos convencionais disponíveis atualmente. A terapia fotodinâmica, uma técnica que combina a utilização de fármacos fotossensíveis e irradiação com luz, tem demonstrado ser uma alternativa com sucesso clinicamente demonstrado para o tratamento de tumores superficiais, como os tumores de boca, com efeitos colaterais mínimos. O presente artigo descreve o cenário atual do câncer de boca e suas opções de tratamento, e apresenta a terapia fotodinâmica como uma opção viável de tratamento para este tipo de câncer.
Termos de indexação: Fotoquimioterapia. Neoplasias bucais. Terapêutica.
ABSTRACT
Oral cancer is one of the most prevalent types of cancer. Actually, surgery, chemotherapy, radiotherapy or a combination of these three methods are common treatments for oral cancer. Although these protocols have demonstrated some effectiveness in oral cancer therapy, they can promote a series of side effects for patients during treatment. Alternatively for these traditional treatments, photodynamic therapy has been used clinically for oral cancer and precancerous lesions treatment. This paper presents the photodynamic therapy as an option treatment for oral cancer.
Indexing terms: Photochemotherapy. Mouth neoplasms. Therapeutics.
INTRODUÇÃO
Câncer
O câncer é hoje um dos principais problemas de saúde pública mundial. Dados epidemiológicos apontam as neoplasias malignas como terceira maior causa de morte do mundo, sendo a segunda entre as doenças1. Estes dados promoveram uma espécie de corrida mundial para a "cura" do câncer. Grande parte dos atuais conhecimentos em biologia celular foi desenvolvida a partir de projetos com interesse em terapêutica para os tumores malignos.
O câncer é uma terminologia mundialmente conhecida para uma série de doenças que possuem em comum a hiperproliferação de populações celulares específicas, com potencial de invasão de tecidos próximos e/ou distantes. Em termos patológicos, o câncer é classificado como uma neoplasia maligna, ou seja, é o desenvolvimento de novos clones celulares com atividade proliferativa superior às das células vizinhas e com caráter de invasão e destruição tecidual adjacente acentuada2.
Alguns autores descrevem o desenvolvimento do câncer como um processo micro evolutivo em escala celular, sendo uma entre os bilhões de células do organismo humano que desenvolve algum tipo de nova característica que permite uma atividade proliferativa superior às das células vizinhas frente às pressões contraproliferativas do organismo. A regulação do número de células dentro dos tecidos é for-temente realizada tanto por mecanismos intracelulares, re-presentados pelos mecanismos de indução de apoptose e re-paração de DNA quanto por fatores de controle extracelular, como a supressão tumoral pelo sistema imune. A ocorrência de proliferações desordenadas como no caso do câncer ocorre pela falha na regulação de algum destes mecanismos, ou pelo desenvolvimento de clones malignos que conseguem "escapar" destes mecanismos de regulação3.
As causas para o desenvolvimento de tumores malignos sempre estão correlacionadas com algum grau de instabilidade genética. Essa instabilidade pode decorrer de algum tipo de desordem genômica hereditária ou de alguma alteração promovida por causas e fatores ambientais. Os fatores ambientais que desencadeiam o processo de carcinogênese são denominados carcinógenos. Por sua vez, os carcinógenos são elementos químicos, físicos ou biológicos, os quais expõem o indivíduo a riscos aumentados de desenvolvimento cancerígeno4-5.
O processo de carcinogênese foi classicamente dividido em três fases: a) iniciação; b) promoção e c) progressão da doença. Na fase de iniciação, as células são expostas aos carcinógenos, que podem promover algum tipo de alteração ou instabilidade genética. A fase de promoção é caracterizada pela seleção e proliferação de clones iniciados, através da expressão aumentada de genes relacionada ao aumento da capacidade proliferativa. A fase promotora é marcada pela alteração das marcações genotípicas, ocorridas na iniciação, para uma caracterização fenotípica, com a presença de algumas marcações morfológicas das células. Na progressão tumoral, células pré-neoplásicas se desenvolvem em tumores por um processo de expansão clonal facilitado pelo aumento progressivo da instabilidade genética dessas células6.
Obesidade
Lesões cancerígenas, localizadas nos tecidos bucais, que incluem lábio, mucosa bucal, gengivas, palato duro, língua e assoalho da boca, estão entre as mais prevalentes formas de câncer na população brasileira e mundial. No Brasil, este tipo de neoplasia é a quarta mais prevalente entre os homens e sétima mais prevalente entre as mulheres1. Relatórios do Instituto Nacional do Câncer1 indicam que este tipo de câncer terá aproximadamente 10 mil novos casos diagnosticados por ano no País.
Acredita-se que as diferenças de incidência de tumores nos tecidos bucais nas diferentes populações estão diretamente relacionadas aos diferentes graus de exposição de fatores de risco nesses grupos. A maior prevalência de homens com tumores bucais em relação às mulheres deriva de sua maior exposição a fatores de risco para o câncer bucal, como tabaco, álcool e radiação ultravioleta proveniente dos raios solares7.
Os fatores de risco para o desenvolvimento de câncer bucal estão bem estabelecidos na literatura, sendo apontado o consumo excessivo de álcool e tabaco como os principais fatores etiológicos para o desenvolvimento dos tumores de mucosa e a exposição à radiação ultravioleta do sol para as neoplasias de lábio. Outros fatores como composição da dieta, infecções virais e fatores hereditários são também apresentados na literatura como potenciais fatores de risco4,8-9.
Aproximadamente 90% das lesões malignas localizadas nos tecidos bucais são carcinomas, tumores de origem epitelial, que podem ser identificados e tratados com maior facilidade em suas fases iniciais de desenvolvimento. O carcinoma epidermóide é o principal tipo de câncer bucal e decorre da proliferação descontrolada de células epiteliais estratificadas da mucosa bucal10-11.
Tratamento para o câncer bucal
O tratamento básico para os vários tipos de câncer bucal consiste na eliminação dos tecidos neoplásicos através de cirurgia, radioterapia, quimioterapia ou uma associação destas três modalidades terapêuticas. A decisão na escolha da modalidade terapêutica depende da extensão, estadiamento tumoral, relação com estruturas anatômicas anexas, envolvimento de cadeia linfática, idade e cooperação do paciente, além do subtipo histológico de lesão12. Sannomiya & Furukawa13 apresentaram a casuística do tratamento de mais de 1 mil pacientes, no período de 1993 a 2002, atendidos com o diagnóstico de alguma modalidade de neoplasia maligna de cabeça e pescoço. A partir disso, os autores concluíram que: a) o tratamento cirúrgico é a opção de escolha para os casos de carcinoma epidermóide nos seus estágios iniciais, sendo que em estágios mais avançados destas lesões é recomendada a utilização adjuvante de quimioterapia ou radioterapia; b) a recorrência dos tumores tratados depende principalmente do envolvimento de cadeia linfática e da extensão da lesão.
Apesar de apresentar bons resultados, essas terapias apresentam várias complicações pós-tratamento. Mesmo com procedimentos de reconstrução cirúrgica, uma das consequências após os tratamentos é a ocorrência de algum grau de desfiguração facial, promovendo graves defeitos estéticos e funcionais. Nesses casos, a qualidade de vida dos pacientes tratados é fortemente comprometida, gerando alterações psicológicas e emocionais fortes, afetando o seu grau de recuperação. Muitas vezes os pacientes tratados necessitam do acompanhamento de equipes multidisciplinares para a recuperação completa e retorno a vida cotidiana normal14-15.
Em uma visão fisiológica, um largo espectro de efeitos adversos ao complexo maxilo-mandibular e estruturas anexas são detectados após os tratamentos tradicionais para câncer bucal. As manifestações ou complicações mais frequentes da radioterapia são: mucosite, candidose, hipossalivação, cárie de radiação, disfagia (dificuldade de deglutir), perda do paladar, trismo muscular, alterações vasculares e osteorradionecrose, como complicação mais grave35. Uma exacerbação de infecções como as doenças periapical e periodontal17, e a mucosite severa podem, ocasionalmente, levar à necessidade de um ajuste do tratamento ou mesmo da interrupção da radioterapia ou quimioterapia, demonstrando que as complicações bucais devem ser prevenidas ou reduzidasao mínimo.
Pela exigência de internações hospitalares e mobilização de grandes equipes multidisciplinares de apoio à saúde, o custo operacional para o tratamento de câncer bucal tem despertado interesse por parte dos pesquisadores e gestores em saúde. Menzin et al.18revisaram os aspectos econômicos da execução dos procedimentos para tratamento de câncer de cabeça e pescoço, que segue os mesmos padrões dos tratamentos do câncer de boca. Nesse estudo, os autores confirmam que o custo operacional para o tratamento do câncer de boca é diretamente proporcional à complexidade dos casos e ao tempo de internação necessário para a conclusão das terapias.
Terapia fotodinâmica
Tendo como base o cenário atual das possibilidades terapêuticas para o tratamento das neoplasias bucais, diversos estudos têm demonstrado a utilização da terapia fotodinâmica como alternativa para o tratamento de lesões neoplásicas dos tecidos bucais19-20. A grande vantagem na utilização desta terapia é a diminuição dos efeitos colaterais observados pós-tratamento em comparação com as outras modalidades terapêuticas. Além dos fatores biológicos favoráveis a esta terapia, a aplicação da terapia fotodinâmica na perspectiva de saúde coletiva tem despertado grande interesse pelo seu custo operacional inferior, quando comparado com o de tratamentos tradicionalmente utilizados como a cirurgia e quimioterapia, pois pode ser realizada em ambiente ambulatorial, dispensando em alguns casos as internações hospitalares21.
Mecanismos de ação fotoquímicos
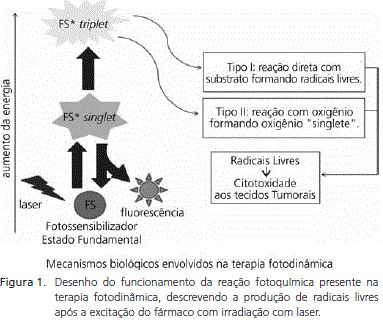
O princípio básico da terapia fotodinâmica é a geração de agentes citotóxicos através da interação dinâmica entre um fármaco fotossensibilizador excitado por luz em comprimentos de onda específicos. A absorção de fótons pelos fármacos fotossensibilizadores gera a ativação destes fármacos, levando estas moléculas a situações de grande instabilidade química, com a mudança do padrão de organização eletrônica normal. A tendência natural de toda molécula com algum grau de excitação eletrônica é o retorno ao seu estado fundamental, pois este estado é energeticamente o mais favorável a qualquer molécula. O retorno da molécula à estabilidade é realizado pela emissão de energia na mesma intensidade da energia de absorção do fóton pelo fármaco fotossensibilizador22.
A Figura 1 descreve como a absorção de fótons emitidos por irradiação a laser pode levar a transformação do fármaco fotossensibilizador do seu estado fundamental a um estado excitado chamado de estado singlet. A partir desta transformação inicial, o fármaco fotossensibilizador pode retornar ao seu estado fundamental liberando a energia de excitação em forma de fluorescência ou calor, ou passar a outro estado de excitação menos instável denominado de estado triplet. Para a destruição tumoral, a forma triplet do fármaco fotossensibilizador gerada na reação pode interagir com qualquer biomolécula presentes no meio (reação Tipo I), que se torna excitada e pode reagir com o oxigênio do meio, formando íons peróxidos, superóxidos e radicais hidroxilas, gerando uma cascata de espécies reativas de oxigênio. Na reação tipo II, o fármaco fotossensibilizador excitado transfere sua energia diretamente para o oxigênio em seu estado fundamental, tornando-o excitado, o oxigênio "singlete", também uma espécie reativa de oxigênio22.
As espécies reativas de oxigênio são radicais livres com alta energia que podem reagir com praticamente qualquer molécula, levando a modificações químicas que impedem seu funcionamento normal. A geração de uma cascata de espécies reativas após a aplicação da terapia fotodinâmica é o fator fundamental para a citotoxicidade causada pela terapia devido a sua alta capacidade de interações com diferentes biomoléculas23.
Dolmans et al.24 descreveram que a geração das espécies reativas de oxigênio leva à destruição tumoral por três mecanismos biológicos principais: a) destruição direta da massa tumoral pela ação das espécies reativas de oxigênio; b) alteração da vascularização tumoral, gerando áreas de hipóxia nas massas tumorais e c) a ativação do sistema imunológico pela necrose e/ou apoptose que atuaria em uma fase secundária na redução da massa tumoral.
As espécies reativas de oxigênio formadas após a aplicação da terapia fotodinâmica são moléculas iônicas com alta atividade química e com potencial para reagir com qualquer biomolécula, visando à estabilização química destas espécies. Devido a pouca difusibilidade das espécies reativas de oxigênio através dos compartimentos celulares, os sítios celulares afetados pela terapia fotodinâmica serão aqueles onde houve o acúmulo seletivo das drogas fotossensibilizadoras. Por sua vez, os sítios celulares onde há o acúmulo dos fármacos estão ligados às características físico-químicas de cada classe de drogas25.
O grande aporte de espécies reativas de oxigênio, após a terapia fotodinâmica, promove uma série de alterações nas células tumorais. A morte celular dos clones tumorais pode derivar de mecanismos de apoptose e/ou necrose, dependendo das regiões subcelulares afetadas, além da intensidade do estímulo agressor26.
A morte celular caracterizada por necrose, em geral, está relacionada à presença de um agente agressor de alta intensidade. Nessas situações, os mecanismos básicos de defesa e escape celulares da morte são ineficientes devido à grande intensidade do estímulo agressor como o promovido pela formação de espécies reativas de oxigênio após a aplicação da terapia fotodinâmica. Uma das características marcantes da necrose são as alterações funcionais em diferentes regiões subcelulares, com especial atenção às membranas biológicas que provocam a liberação dos conteúdos celulares e consequente perda de viabilidade. Associada à destruição das membranas celulares, ocorre a liberação de fosfolipídios de membrana e, consequentemente, a geração de intenso processo inflamatório decorrente dos produtos gerados na via da lipooxigenase27.
A apoptose é uma modalidade de morte celular que ocorre tanto em eventos fisiológicos quanto patológicos. Os eventos morfológicos observados em células em apoptose são a compactação nuclear, o empacotamento e liberação de fragmentos citoplasmáticos e de organelas em microvesículas envoltas em membrana plasmática, os corpos apoptóticos. A liberação dessas vesículas contendo material celular são fagocitadas pelas células vizinhas, desencadeando processos inflamatórios em menor intensidade quando comparados aos processos relacionados à necrose. A ocorrência de processos inflamatórios em menor proporção se refere a não-liberação de fosfolipídios de membrana. Na terapia fotodinâmica esse processo de via de morte celular ocorre em menor escala nos tecidos neoplásicos28.
Assim, diversos estudos histológicos e em culturas celulares29-31 têm demonstrado que a aplicação da terapia fotodinâmica promove a morte das células tumorais tanto por mecanismos de necrose quanto por mecanismos de apoptose. A caracterização destas duas modalidades de morte celular pode ser obtida a partir de análises morfológicas ou bioquímicas. Muitos trabalhos discutem as vantagens e desvantagens da ocorrência da morte celular tumoral preferencialmente por necrose ou por apoptose. Essa discussão se basearia na estimulação ou não do sistema imunológico. A morte celular por necrose estimularia mais a resposta imune, que os eventos apoptóticos. O estímulo imunológico poderia gerar reações inflamatórias clinicamente desfavoráveis aos pacientes, porém, estimularia o desenvolvimento de respostas imunes específicas contra os tumores tratados e promoveria a regulação do volume tumoral pela pressão imunológica contra os tumores22.
O segundo mecanismo de controle tumoral pós-terapia fotodinâmica consiste nas alterações vasculares observadas nas áreas do tumor promovidas pela terapia. Dentre os principais eventos descritos na literatura, citam-se a trombose e oclusão na microvasculatura tumoral. Esses eventos, em geral, promovem a diminuição e colapso do fluxo sanguíneo e consequente hipóxia tecidual das áreas tumorais supridas por estes vasos32. A presença de lesão do endotélio vascular, agregação plaquetária, aporte de células inflamatórias e necrose local são alguns dos fatores que potencializam o desenvolvimento dos eventos de trombose vascular após a aplicação da terapia fotodinâmica33.
O terceiro mecanismo envolvido na destruição das massas tumorais é representado pela ação do sistema imunológico contra as células cancerígenas. Contrariamente às demais terapias contra o câncer, a terapia fotodinâmica possui um efeito imunoestimulante. O desenvolvimento de respostas imunológicas contra as células tumorais se encerra no aumento da apresentação antigênica promovida pela alta atividade das células imunológicas nos tumores tratados com a terapia fotodinâmica. Alguns autores descrevem ainda um efeito de proteção antitumoral sistêmico quando há a utilização da terapia fotodinâmica, advindo da seleção de linfócitos de memória contra os clones tumorais tratados no sítio primário do câncer22.
Fármacos fotossensibilizadores
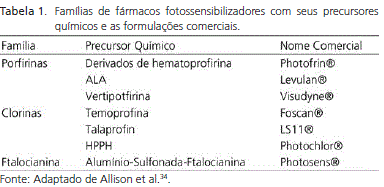
Os fármacos fotossensibilizadores são os elementos principais na execução da terapia fotodinâmica. Estas estruturas realizam a transferência de energia luminosa para gerar reações que culminam com a formação de uma série de espécies químicas altamente reativas, que por sua vez promovem a destruição das células-alvo. Diversos fármacos fotossensibilizadores têm sido desenvolvidos e testados clinicamente para serem utilizados na terapia fotodinâmica. Classicamente, a literatura tem separado os grupos de fármacos fotossensibilizadores em gerações de fármacos de acordo com o período cronológico de desenvolvimento. Nessa lógica, podem-se citar os fármacos de primeira geração, desenvolvidos no final da década de setenta e início de oitenta; de segunda geração, desenvolvidos na década de noventa; e ainda fármacos fotossensibilizadores de terceira geração que seria referente a associações terapêuticas aos fármacos fotossensibilizadores, como imunoterapia ou radiofototerapia25.
Contrários a essa lógica cronológica de classificação, alguns autores têm classificado os fármacos fotossensibilizadores de acordo com semelhanças químicas entre os fármacos, classificando-os em famílias de fármacos fotossensibilizadores33. A justificativa para esta nova classificação é a falsa impressão de efetividade que a classificação em gerações poderia gerar. Na antiga classificação existia a impressão de que os fármacos de segunda geração seriam mais eficazes na terapia fotodinâmica do que os de primeira geração, o que nem sempre é verdadeiro.
Seguindo esta nova lógica, os fármacos fotossensibilizadores foram classificados em três grandes famílias. Na descrição da Tabela 1, apenas alguns representantes de cada família são apresentados.
A escolha de um fármaco fotossensibilizador para a utilização na terapia fotodinâmica envolve uma complexa análise de características até que se possa determinar qual a melhor opção para a execução da terapia fotodinâmica. Dentre os pontos a serem analisados, pode-se citar: a toxicidade e carcinogenicidade dos fármacos; a seletividade pelas células alvo; possíveis afeitos adversos decorrentes de exposição à luz branca, via de administração, custos, capacidade de eliminação das drogas, comprimento de onda para ativação e efetividade clínica. A análise de todos estes fatores muitas vezes se torna complexa, porém estes valores devem ser pesados e um fator de efetividade calculado subjetivamente para justificar a escolha de um fármaco fotossensibilizador entre as várias opções terapêuticas23.
Aplicação clínica da terapia fotodinâmica em tumores bucais
A terapia fotodinâmica já está aprovada para uso clínico nos Estados Unidos, Canadá, Rússia, Japão e alguns países da União Europeia. No Brasil, está terapia está liberada para utilização em regime de pesquisa clínica. Para os tumores de boca, os fármacos fotossensibilizadores mais utilizados na literatura são os derivados de porfirinas Photofrin® e ALA, e o fármaco Foscan®. Estão disponíveis mais de 1500 casos relatados no tratamento de tumores de cabeça e pescoço utilizando estes três protocolos para terapia fotodinâmica, tendo sido acompanhados casos de 1990 a 200619.
Biel19 relata, em artigo de metanálise, que de 518 pacientes tratados com tumores iniciais (T1 ou T2) de cabeça e pescoço, 462 (89,1%) apresentaram remissão clínica completa após um único tratamento com a terapia fotodinâmica. No mesmo trabalho, o autor relata o acompanhamento por 16 anos de 171 pacientes tratados com terapia fotodinâmica para tumores de laringe, com completa remissão e ausência de recorrências. Estes resultados apresentam um cenário extremamente animador para a utilização da terapia fotodinâmica no tratamento do câncer de boca, porém, estudos de seguimento dos pacientes tratados ainda são necessários para estabelecer completamente a efetividade desta terapia.
Como foi descrito anteriormente, a terapia fotodinâmica possui como vantagens a diminuição dos efeitos colaterais comumente descritos a terapias tradicionais para o câncer. Clinicamente, a terapia tem se mostrada efetiva principalmente nos casos de tumores iniciais e nos casos de lesões cancerizáveis20. Ainda assim, alguns efeitos colaterais são observados durante o tratamento com a terapia fotodinâmica, que estão principalmente relacionados a diferentes padrões de fototoxicidade de pele35.
CONSIDERAÇÕES FINAIS
Tendo como base o cenário atual das modalidades terapêuticas para o tratamento do câncer boca, representado principalmente pela cirurgia, radioterapia, quimioterapia ou uma associação destas três modalidades terapêuticas, a terapia fotodinâmica tem despertado grande interesse para a sua aplicação clínica. Os efeitos adversos minimizados e a forma de tratamento mais conservador são os pontos fortes para a terapia fotodinâmica. Como ressalva, estudos de longa duração ainda são necessários para comprovar a real eficiência deste protocolo terapêutico.
Colaboradores
JPF LONGO foi responsável pela pesquisa bibliográfica e pela redação do artigo. SP LOZZI e RB AZEVEDO foram responsáveis pela revisão do artigo quanto a forma, conteúdo e sequência de tópicos a serem abordados.
REFERÊNCIAS
1. Brasil. Ministério da Saúde. Instituto Nacional do Câncer. Estimativas da incidência e mortalidade por câncer. Rio de Janeiro: INCA; 2008. [ Links ]
2. Knowles M, Selby P. Introduction to the cellular and molecular biology of cancer. Oxford: Bioscience; 2005. 3. Merlo LMF, Pepper JW, Reid BJ, Maley CC. Cancer as an evolutionary and ecological process. Nat Rev Cancer. 2006;6:924-35.
4. Scully C, Field JK, Tanzawa H. Genetic aberrations in oral or head neck squamous cell carcinoma (SCHN): 1. Carcinogen metabolism, DNA repair and cell cycle control. Oral Oncol. 2000;36(5):256-63.
5. Todd R, Donoff RB, Wongd TW. The molecular biology of oral carcinogenesis: toward a tumor progression model. J Oral Maxillofac Surg. 1997;55(6):613-23.
6. Hursting SD, Slaga TJ, Fischer SM, Digiovanni J, Phang JM. Mechanism-based cancer prevention approaches: targets, examples, and the use of transgenic mice. J Natl Cancer Inst. 1999;91(3):215-25.
7. Liu L, Kumar SK, Sedghizadeh PP, Jayakar AN, Shuler SF. Oral squamous cell carcinoma incidence by subsite among diverse racial and ethnic populations in california. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008;105(4):470-80.
8. Sciubba JJ. Oral cancer and its detection. J Am Dent Assoc. 2001;132(Suppl):12S-18S.
9. Kojima A, Maeda H, Sugita Y, Tanaka S, Kameyama Y. Human papillomavirus type 38 infection in oral squamous cell carcinomas. Oral Oncol. 2002;38(6):591-6.
10. Silverman Jr S. Demographics and ocurrence of oral and pharyngeal cancers. J Am Dent Assoc. 2001;132:7-11.
11. Pereira MC, Oliveira DT, Landman G, Kowalski LP. Histologic subtypes of oral squamous cell carcinoma: prognostic relevance. J Can Dent Assoc. 2007;73(4):38-44.
12. Lung T, Tascau OC, Almasan HA, Muresan O. Head and neck cancer, treatment, evolution and post therapeutic survival - part 2: a decade's results 1993-2002. J Craniomaxillofac Surg. 2007;35(2):126-31.
13. Sannomiya EK, Furukawa S. Diferentes métodos de tratamento radioterápico em tumores da cavidade bucal e suas complicações. Rev Bras Odontol. 2000;57:336-8.
14. Chandu A, Smith ACH, Rogers SN. Health-related quality of life in oral cancer: a review. J Oral Maxillofac Surg. 2006;64(3):485-502.
15. Almeida MEL, Silva MGC, Souza ECF. Anos potenciais de vida perdidos devido à mortalidade por câncer de boca e faringe. RGO - Rev Gaúcha Odontol. 2002;50(1):21-4.
16. Ord RA, Blanchaert RH. Current management of oral cancer. J Am Dent Assoc. 2001;132:19-23.
17. Ferraz FC, Simões W, Rapaport A, Bozzo RO. O uso de localizador apical endodôntico em pacientes irradiados. RGO - Rev Gaúcha Odontol. 2004;52(3):157-60.
18. Menzin J, Lines LM, Manning LM. The economics of squamous cell carcinoma of the head and neck. Curr Opin Otolaryngol Head Neck Surg. 2006;15(2):68-73.
19. Biel MA. Photodynamic therapy treatment of early oral and laryngeal cancers. Photochem Photobiol. 2007;83(5):1063-8.
20. Chen HM, Chen CT, Yang H, Lee MI, Kuo MY, Kuo YS, et al. Successful treatment of an extensive verrucous carcinoma with topical 5-aminolevulinic acid-mediated photodynamic therapy. J Oral Pathol Med. 2005;34(4):253-6.
21. Hopper C, Niziol C, Shidhu M. The cost-effectiveness of foscan mediated photodynamic therapy (foscan-pdt) compared with extensive palliative surgery and palliative chemotherapy for patients with advanced head and neck cancer in the UK. Oral Oncol. 2004;40(4):372-82.
22. Luksiene Z. Photodynamic Therapy: mechanisms of action and ways to improve the efficiency of treatment. Medicina. 2003;39(12):1137-49.
23. Castano AP, Mroz P, Hamblin MR. Photodynamic therapy and anti-tumour immunity. Nat Rev Cancer. 2006;6(7):535-45.
24. Dolmans DE, Fukumura D, Jain RK. Photodynamic therapy for cancer. Nat Rev Cancer. 2003;3(5):380-7.
25. Dougherty TJ, Gomer CJ, Henderson BW, Jori G, Kessel D, Koberlik M, et al. Photodynamic therapy. J Natl Cancer Inst. 1998;90(12):889-905.
26. Rello S, Stockert JC, Moreno V, G'amez A, Pacheco M, Juarranz A, et al. Morphological criteria to distinguish cell death induced by apoptotic and necrotic treatments. Apoptosis. 2005;10(1):201-8.
27. Rich T, Allen RL, Wyllie AH. Defying death after DNA damage. Nature. 2000;407(6805):777-83.
28. Buytaert E, Dewaele M, Agostinis P. Molecular effectors of multiple cell death pathways initiated by photodynamic therapy. Biochim Biophys Acta. 2007;1776(1):86-107.
29. Longo JPF, Lozzi SP, Simioni AR, Morais PC, Tedesco AC, Azevedo RB. Photodynamic Therapy with aluminum-chloro-phtalocyanine induces necrosis and vascular damage in mice tongue tumors. J Photochem Photobiol B. 2009;94(2):143-6.
30. Tapajós ECC, Longo JPF, Simioni AR, Lacava ZGM, Santos MFMA, Morais PC, et al. In vitro photodynamic therapy on human oral keratinocytes using chloroaluminum-phthalocyanine. Oral Oncol. 2008;44(11):1073-9.
31. Kaneko T, Chiba H, Yasuda T, Kusama K. Detection of photodynamic therapy-induced early apoptosis in human salivary gland tumor cells in vitro and in a mouse tumor model. Oral Oncol. 2004;40(8):787-92.
32. Krammer B. Vascular effects of photodynamic therapy. Anticancer Res. 2001;21(6b):4271-7.
33. Bobrov N, Cavarga I, Longauer F, Rybárová S, Fedoročko P, Brezáni P, et al. Histomorphological changes in murine fibrosarcoma after hypericin-based photodynamic therapy. Phytomedicine. 2007;14(2-3):172-8.
34. Allison RR, Downie GH, Cuenca R, Hu XH, Childs CJH, Sibata CH. Photosensitizers in clinical PDT. Photodiagnosis Photodyn Ther. 2004;1(1):27-42.
35. Tsoukas MM, Lin GC, Lee MS, Anderson RR, Kollias N. Predictive dosimetry for threshold phototoxicity in photodynamic therapy on normal skin: red wavelengths produce more extensive damage than blue at equal threshold doses. J Invest Dermatol. 1997;108(4):501-5.
 Endereço para correspondência:
Endereço para correspondência:
JPF LONGO
Universidade de Brasília,
Instituto de Ciências Biológicas,
Departamento de Genética e Morfologia.
Campus Universitário Darcy Ribeiro,
70910-900, Brasília, DF, Brasil.
e-mail: jplongo@uol.com.br
Recebido: 10/6/2009
Aceito: 13/12/2009













